一种同时检测3种人畜共患病病原菌的多重IMS-荧光RPA检测方法与流程
本发明涉及一种同时检测多种病原菌的方法,具体涉及一种同时检测3种人畜共患病病原菌的多重ims-荧光rpa检测方法。
背景技术:
畜牧业的迅猛发展,电商、各类网淘平台的崛起,给人民带来实惠的同时,互通有无的物流业增加了多种病原菌混合感染的风险。沙门氏菌、大肠杆菌o157:h7、布氏杆菌属于人畜共患病的病原菌,其中布氏杆菌属二类动物病原微生物,沙门氏菌、大肠杆菌o157:h7属三类动物病原微生物。沙门氏菌、大肠杆菌o157:h7和布氏杆菌均为具有高致病性的人畜共患致病菌,且普遍存在于环境中,如在食品、水、空气、纺织品和土壤中这三种菌均能长期生存、繁殖,并可在人群中广泛传播,造成严重疫情。目前我国对这三种病原菌的检测仍采用经典的传统分离培养、生化鉴定、血清学方法,为解决传统方法的检测周期长,步骤繁琐、大批量检测工作量大及成本高等问题,快速分子方法如荧光定量pcr、lamp、rpa技术不断得到发展与完善,近年,多重分子技术的研究已成为行业专家关注的热点。
免疫磁珠分离(immunomagneticseparation,ims)技术是一种具有高效、特异的样品预处理方法,其原理是利用磁珠表面的活性基团与目标菌抗体进行偶联,制成特异性免疫磁珠,然后在液相中与目标菌发生抗原抗体结合,经外磁场作用,将带目标菌的磁珠从复杂的样品基质中特异分离。该技术利用抗原抗体之间的特异结合,高效富集目标菌,并保留目标菌原有生物活性,利于下游的检测鉴别,是一种理想的样品预处理方法,被广泛应用于致病菌检测的样品预处理。
重组酶聚合酶等温扩增(recombinaseploymeraseamplification,rpa)技术被称为是可以替代pcr的核酸检测技术(由英国公司twistdxinc开发),首先,体系中重组酶和引物37℃条件下形成酶和引物的聚合体并在模板dna上寻找完全互补的序列;定位后启动dna合成;在扩增体系中加入一个荧光标记的探针,通过收集荧光即可实现检测过程实时监测。
目前,国内外还没有采用ims技术结合rpa技术同时针对沙门氏菌、大肠杆菌o157:h7、布氏杆菌3种人畜共患病鉴定的有关研究报道。本发明结合ims、rpa两种技术优势,同时用3种特异性免疫磁珠分离基质中沙门氏菌、大肠杆菌o157:h7和布氏杆菌,磁珠分离液可直接提取dna,同时用3种特异性引物及探针,实现对沙门氏菌、大肠杆菌o157:h7和布氏杆菌的同时检测,达到微生物致病菌的快速、高效、高通量检测的目的。
技术实现要素:
针对现有技术的不足,本发明提供了一种同时检测3种人畜共患病病原菌的多重ims-荧光rpa检测方法,达到快速、高效、高通量检测的效果。具体技术方案如下:
一种同时检测3种人畜共患病病原菌的多重ims-荧光rpa检测方法,包括以下步骤:
步骤一、引物与探针设计:
选择沙门氏菌fimy位点、大肠杆菌o157:h7mannosyltransferase位点、布氏杆菌omp31位点为靶基设计引物和探针,表1所示;
表1多重荧光rpa扩增用特异引物及探针序列
步骤二、免疫磁珠的制备:
取0.1ml磁珠液于盛有1.0mlpbst缓冲液的离心管中,混匀,3000r/min离心2min,弃液体;重复上述步骤清洗3次,加入1.0mlpbst缓冲液使磁珠重悬其中;向上述重悬液中加入0.1ml沙门氏菌属免疫血清,放摇床,室温轻缓旋转振荡3h;用1.0ml1×洗液清洗5次后,加入0.5ml重悬液,于4℃保存备用;重复以上操作制备大肠杆菌o157:h7和布氏杆菌免疫磁珠液;
步骤三、免疫磁珠分离:
无菌操作取20g检样至装有200ml蛋白胨水的带滤网无菌均质袋内,轻缓振荡30min;过滤检样上清液转移于离心管,5000r/min离心20min,弃上清液体,沉淀重悬于1.0mlpbst缓冲液中;取全部检样悬液于装有0.1ml免疫磁珠悬液的小管中,室温轻缓旋转振荡30min;小心移出管中液体,加入1.0ml洗液混匀,3min后移出洗液,重复清洗5次,加入0.5ml重悬液使吸附目标菌的磁珠重悬其中;带有目标菌的磁珠重悬液可直接用于细菌基因组dna提取;
步骤四、模板提取:
取步骤二所得全部带有目标菌的磁珠重悬液10000r/min离心1min,弃上清;按细菌基因组dna提取试剂盒提供的操作手册提取dna;得到的核酸用nanodrop1000分光光度计测定其浓度和纯度;
步骤五、三重荧光rpa:
三重荧光rpa的反应体系为50μl,包括rehydrationbuffer29.5μl,ddh2o3.3μl,primerf(10μm)、primerr(10μm)各1.5μl,twistampnexonprobe(10μm)0.5μl,基因组dna各1μl,最后加入mgac(280mm)2.5μl;向含有冻干酶粉的0.2mltwistampexorpa反应管中依次加入上述反应体系各成分,充分混匀后2000r/min离心10sec,将反应试管放在rpa荧光定量pcr仪7500fast中进行实时荧光扩增,37℃恒温反应40min;
步骤六、结果判定:
rpa反应设置三个荧光通道(fam、hex、cy5),反应过程实时收集荧光,反应结束后能收集到荧光信号,并有明显扩增曲线,方可判定为阳性。
本发明中用到的设备和材料如下:
1实验菌株及样品
所用菌株共32株,具体信息如表2。
表2本实验所用菌株信息
实验所用皮张、毛皮、纺织品样品1-60号购自郑州各大购物市场,其余60份属课题组收集样品,主要来自酒店、衣服出租店、医院、火车卧铺、皮张加工厂等公共场所。
2主要试剂
蛋白胨水(购自陆桥公司);沙门氏菌属、大肠杆菌o157:h7和布氏杆菌免疫血清(デソカ生研株式会社产品);磁珠液dynabeadsm-280sheepanti_rabbitigg(dynal公司产品);pbst缓冲液(dynal公司产品);10×洗液(dynal公司产品);重悬液(dynal公司产品);细菌基因组dna提取试剂盒(购自陆桥公司);rpa荧光检测试剂盒(twistampdnaamplificationexokits)(英国twistdx公司产品)。
3主要仪器
磁力架,英国matrixpathatrix公司;离心机,德国eppendorf公司;微量分光光度计nanodrop,美国赛默飞公司;荧光定量pcr仪7500fast,美国abi(appliedbiosystem)公司;
4引物与探针
将设计好的设计引物和探针序列发南京金斯瑞生物科技有限公司合成。
本发明通过沙门氏菌fimy基因、大肠杆菌o157:h7mannosyltransferase基因、布氏杆菌omp31基因的分析,设计特异性的引物与探针,建立3种病原菌多重ims-荧光rpa检测体系。本方法采用了三重荧光方法,目前已有报道建立了针对细菌rpa检测方法,未见有针对人畜共患病病原菌的三重荧光rpa方法,三重荧光引物、探针设计复杂,反应条件不易优化,方法建立人员必须有较高的分子生物学理论基础,较强的实验能力。结果表明,多重荧光定量rpa特异性很好,且不同浓度的dna检测中3种基因扩增效率基本相同,3种荧光信号的收集不会相互干扰,且检测限可达3.0cfu/ml、4.5cfu/ml、8.7cfu/ml。本发明在免疫磁珠分离的基础上,尝试磁珠分离液直接提取dna,利用实时荧光rpa同时进行3种人畜共患病病原菌鉴定。ims技术直接从检样中捕获靶细菌,去除部分dna扩增干扰物质;同时由于荧光rpa特异性扩增,使方法本身叠加了特异性,专一性更高、结果更准确;同时解决了传统检测中布氏杆菌生长较慢,从样品中分离布氏杆菌难度较大的问题。
本发明提供的同时检测3种人畜共患病病原菌的多重ims-荧光rpa检测方法,与现有技术相比具有以下有益效果:
(1)本方法能够同时检测三种人畜共患病病原菌,沙门氏菌、大肠杆菌o157:h7和布氏杆菌均为具有高致病性的人畜共患致病菌,且普遍存在于环境中,如在食品、水、空气、纺织品和土壤中这三种菌均能长期生存、繁殖,并可在人群中广泛传播,造成严重疫情。三种菌都能引起人全身性炎症,出现发热,严重可引起败血症,临床诊断不易区分。三种菌鉴定多用传统方法,传统方法步骤繁杂,耗时长,所用试剂也多。布氏杆菌生长较慢,不易培养,临床上,细菌感染大多都是混合感染,布氏杆菌培养困难,往往容易出现假阴性,造成误诊;本发明提供的多重ims-荧光rpa方法可同时检测三种病原菌,时间缩短至2h,节约人力、耗材、试剂,解决了临床混合感染不易诊断问题。
(2)本方法在引物、探针设计方面的创新:rpa反应本身对引物的设计要求较高,三重荧光反应对引物、探针设计要求更高,且没有专一的设计软件,要求长度在30~35bp之间,gc含量控制在30%~70%之间,对5’端和3’端附近核苷酸有严格要求,5’端附近应避免有连续的g,3’端附近是g和c,引物中间不能出现较长的单一核苷酸重复或者反复重复序列,设计时还应考虑到避免引物自身和引物之间形成二级结构;探针的长度在46~52bp之间,是扩增子(amplicon)的同源寡聚核苷酸,其间嵌有一个‘dspacer’代替序列中的一个碱基,thf的两侧分别标记荧光基团(dt-fluorophore)和猝灭基团(dt-quencher),这两个dt碱基之间的距离小于6bp。
(3)本方法简便快速,特异性好,敏感度高,抗干扰性强,适用范围广,检测成本低,适合基层推广应用。
附图说明
图1为沙门氏菌单一rpa特异性结果,其中1、salmonellasp.(atcc12325),2、salmonellasp.(atcc14028),3、salmonellasp.(cmcc50353),4、salmonellasp.(混合菌液),5、salmonellasp.(cicc21482),6salmonellasp.(cicc21493),7、salmonellasp.(atcc13076),8、salmonellasp.(cicc21493)。
图2为大肠杆菌o157:h7单一rpa特异性结果,其中1、ecoilo157:h7(atcc700028),2、ecoilo157:h7(atcc35150),3、ecoilo157:h7(cicc21530),4、ecoilo157:h7(atcc43888),5、ecoilo157:h7(nctc12900),6、ecoilo157:h7(混合菌液)。
图3为布氏杆菌单一rpa特异性结果,其中1、brucella(混合菌液),2、brucella(m5),3、brucella(ret.1)。
图4为沙门氏菌单一rpa灵敏性结果,其中菌液浓度依次为1、3000.00cfu/ml,2、300.00cfu/ml,3、30.00cfu/ml,4、3.00cfu/ml,5、0.30cfu/ml。
图5为大肠杆菌o157:h7单一rpa灵敏性结果,其中菌液浓度依次为1、4500.00cfu/ml,2、450.00cfu/ml,3、45.00cfu/ml,4、4.50cfu/ml,5、0.45cfu/ml。
图6为布氏杆菌单一rpa灵敏性结果,其中菌液浓度依次为1、8700.00cfu/ml,2、870.00cfu/ml,3、87.00cfu/ml,4、8.70cfu/ml,5、0.87cfu/ml。
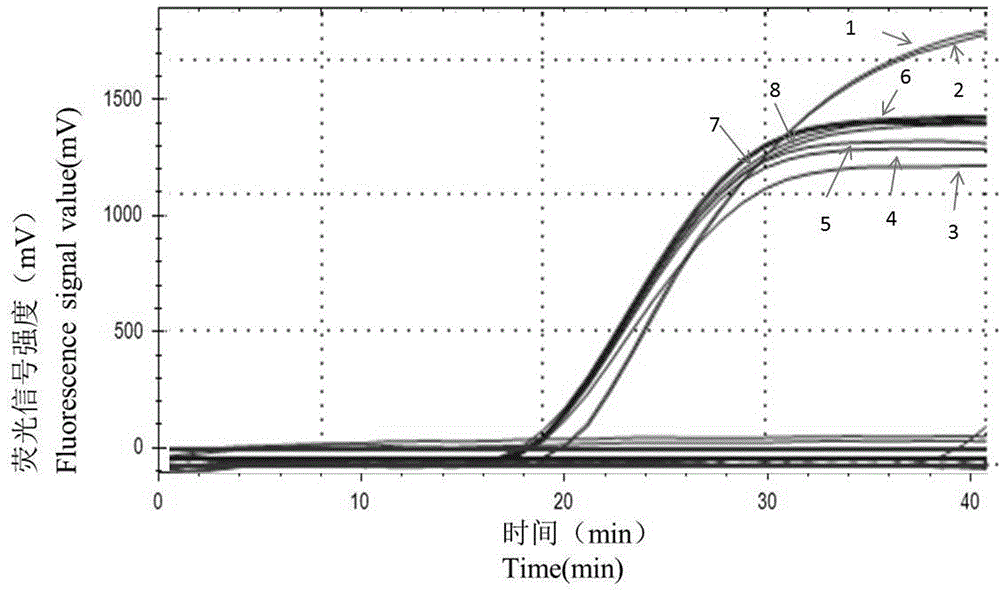
图7为多重ims-荧光rpa检测沙门氏菌、大肠杆菌o157:h7和布氏杆菌体系特异性结果。
图8为多重ims-荧光rpa检测沙门氏菌、大肠杆菌o157:h7和布氏杆菌体系灵敏度结果,其中菌液稀释度依次为1、106cfu/ml,2、105cfu/ml;3、104cfu/ml;4、103cfu/ml;5、102cfu/ml;6、10cfu/ml。
图9为人工感染样品测试结果。
图10为收集样品测试结果。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合本发明的优选实施例,并配合附图进行详细描述。
实施例1
一种同时检测3种人畜共患病病原菌的多重ims-荧光rpa检测方法,包括以下步骤:
步骤一、引物与探针设计:
选择沙门氏菌fimy位点、大肠杆菌o157:h7mannosyltransferase位点、布氏杆菌omp31位点为靶基设计引物和探针,表1所示;
表1多重荧光rpa扩增用特异引物及探针序列
步骤二、免疫磁珠的制备:
取0.1ml磁珠液于盛有1.0mlpbst缓冲液的离心管中,混匀,3000r/min离心2min,弃液体;重复上述步骤清洗3次,加入1.0mlpbst缓冲液使磁珠重悬其中;向上述重悬液中加入0.1ml沙门氏菌属免疫血清,放摇床,室温轻缓旋转振荡3h;用1.0ml1×洗液清洗5次后,加入0.5ml重悬液,于4℃保存备用;重复以上操作制备大肠杆菌o157:h7和布氏杆菌免疫磁珠液;
步骤三、免疫磁珠分离:
无菌操作取20g检样至装有200ml蛋白胨水的带滤网无菌均质袋内,轻缓振荡30min;过滤检样上清液转移于离心管,5000r/min离心20min,弃上清液体,沉淀重悬于1.0mlpbst缓冲液中;取全部检样悬液于装有0.1ml免疫磁珠悬液的小管中,室温轻缓旋转振荡30min;小心移出管中液体,加入1.0ml洗液混匀,3min后移出洗液,重复清洗5次,加入0.5ml重悬液使吸附目标菌的磁珠重悬其中;带有目标菌的磁珠重悬液可直接用于细菌基因组dna提取;
步骤四、模板提取:
取步骤二所得全部带有目标菌的磁珠重悬液10000r/min离心1min,弃上清;按细菌基因组dna提取试剂盒提供的操作手册提取dna;得到的核酸用nanodrop1000分光光度计测定其浓度和纯度;
步骤五、三重荧光rpa:
三重荧光rpa的反应体系为50μl,包括rehydrationbuffer29.5μl,ddh2o3.3μl,primerf(10μm)、primerr(10μm)各1.5μl,twistampnexonprobe(10μm)0.5μl,基因组dna各1μl,最后加入mgac(280mm)2.5μl;向含有冻干酶粉的0.2mltwistampexorpa反应管中依次加入上述反应体系各成分,充分混匀后2000r/min离心10sec,将反应试管放在rpa荧光定量pcr仪7500fast中进行实时荧光扩增,37℃恒温反应40min;
步骤六、结果判定:
rpa反应设置三个荧光通道(fam、hex、cy5),反应过程实时收集荧光,反应结束后能收集到荧光信号,并有明显扩增曲线,方可判定为阳性。
方法测试
1)单一rpa特异性验证
设置3组实验。取表2中32株标准菌株菌悬液,10倍梯度稀释,选取稀释至10000倍浓度菌液,各取10ml制成混合菌液,平均分成三份,每一份和表2中32株标准菌株菌悬液组合为1组实验,共3组实验,分别用沙门氏菌属、大肠杆菌o157:h7和布氏杆菌免疫磁珠分离3种菌株。具体操作:取菌液2ml加入到装有一种免疫磁珠的离心管中,室温结合30min,置磁力架磁分离30min,弃悬浮液,加2ml2×pbs洗涤磁珠-细菌复合物3次,加入1ml重悬液使磁珠充分分散。分别取100μl重悬液提取dna,以微量分光光度计nanodrop测试dna浓度,并按照实施例1中步骤四的方法,反应体系调整ddh2o13.5μl,分别以混合菌液和表2中32株菌悬液提取基因组dna为模板,用3种致病菌各自引物进行单一rpa扩增,其它条件不变,灭菌水做空白对照,结果见图1、图2、图3。混合菌液经过磁珠分离、提取dna、rpa扩增,结果单一的沙门氏菌、大肠杆菌o157:h7、布氏杆菌扩增曲线明显,其它基因组dna为模板均未扩增,证明三种目标菌引物互为特异;表2中32种菌液dna扩增后,结果和预期一致,证明三种目标菌引物相对其他干扰菌具有较好特异性。
2)单一rpa灵敏度验证
分别取试验1)中沙门氏菌、大肠杆菌o157:h7和布氏杆菌磁珠悬液200μl,100μl涂布平板计数,得出浓度后将菌液稀释到106~10cfu/ml,调整至200ml体系中。取调整后105~10cfu/ml各稀释度100μl提取基因组dna,并按照实施例1中步骤四的方法,按1)中调整后的条件对单一荧光rpa灵敏性进行检测,灭菌水做空白对照。
接种倍比稀释的沙门氏菌、大肠杆菌o157:h7和布氏杆菌,200ml体系中沙门氏菌、大肠杆菌o157:h7、布氏杆菌的终浓度为0.30–3000.00cfu/ml、0.45–4500.00cfu/ml、0.87–8700.00cfu/ml。按上述条件进行rpa扩增后,本实验有明显扩增曲线的最低浓度沙门氏菌3.0cfu/ml、大肠杆菌o157:h74.5cfu/ml、布氏杆菌8.7cfu/ml,因此沙门氏菌、大肠杆菌o157:h7、布氏杆菌检测限分别达到3.0、4.5和8.7cfu/ml。其中沙门氏菌0.3cfu/ml、大肠杆菌o157:h70.45cfu/ml浓度时也收集到了较弱的荧光信号,呈现弱阳性,布氏杆菌0.87cfu/ml浓度未收集到荧光信号。而如图4、图5、图6。
3)多重rpa特异性验证
取1)中提取的混合菌液和32株菌株dna,按照实施例1中步骤四的方法进行三重荧光rpa检测多重方法特异性,灭菌水做空白对照。
结果见图7,由图7可知3种致病菌均有明显扩增曲线,其它基因组dna模板均未扩增。说明实验建立的多重ims-荧光rpa检测体系具有良好的特异性。
4)多重rpa灵敏度验证
根据单一rpa灵敏度结果,多重时取试验2)中106~10cfu/ml稀释度菌液,调整至200ml体系中。提取调整后各稀释度3种致病菌dna模板,按照上述步骤四、三重荧光rpa方法,同一反应体系中加入3种不同稀释度病原菌dna模板,6个稀释梯度同时检测,每个梯度设1个空白对照,进行方法灵敏度验证。
多重rpa灵敏度的验证是在单一灵敏度验证的基础上进行的,单一灵敏度结果显示,当菌液稀释至10cfu/ml,调整至200ml体系中时,三种病原菌单一灵敏度检测时荧光信号较弱或收集不到荧光信号,因此验证多重灵敏度时考虑反应体系复杂,或受引物二聚体会影响,选择了6个稀释度菌液进行实验。从沙门氏菌、大肠杆菌o157:h7和布氏杆菌多重ims-荧光rpa实验结果显示,在原来单一体系中加入另外两种病原菌引物和探针,和单一体系灵敏度实验相比,灵敏性受到一定程度的影响,单一体系实验最低检出限虽仍能检出,但荧光信号强度均比单一检测时低,呈现弱阳性。但在不同浓度的菌液检测中fimy基因、mannosyltransferase基因、omp31基因扩增效率基本相同,表明3种荧光信号的收集不会相互影响。见图8。
5)实际样品的检测
取市购的1-60号样品,无菌操作每个样品取20g至无菌袋内;取沙门氏菌、大肠杆菌o157:h7和布氏杆菌菌悬液,做10倍梯度稀释,按照试验2)估计,选试验1)中100倍稀释度菌液,分别取50μl,一一对应加入上述制作好的1-60号样品中(每种菌污染20份),隔夜放置备用;另取60份公共场所收集样品同样检测。
生物安全柜内检测人工污染样品,直接取200ml蛋白胨水加入各污染样品中,按实施例1中步骤二、步骤三、步骤四操作,实验设置无菌离子水作为阴性对照。无菌条件下按实施例1中步骤二操作取样,按实施例1中步骤三、步骤四操作检测60份公共场所收集样品。
使用新建多重ims-荧光rpa方法对人工感染1-60号样品的dna样本进行扩增,结果显示与预期结果一致,并无非特异性产物扩增(见图9);用多重ims-荧光rpa体系对60份公共场所收集的样本dna检测,结果显示有2个样本沙门氏菌阳性、1个样本大肠杆菌o157:h7阳性(见图10),3份阳性样品送测序,测序结果与genebank沙门氏菌、大肠杆菌o157:h7dna序列一致。
本发明结合两种技术优点,ims技术分离样品中病原菌、rpa技术鉴定,针对性强;而且相对于常规的单重检测,多重检测是在同一反应体系下进行,大大节约时间,3种病原菌的鉴定可在2h内完成,快速、高效;实验操作程序更加精简、便捷,3种病原菌鉴定简单地分为2步:ims富集和rpa鉴定;同时节约试剂、耗材,实验成本低廉,整个实验过程只需一台便携式小型实时荧光检测仪(只需几百元就能购置)即可,该方法适宜基层推广应用,甚至可进行现场检测,有望成为卫生防疫及卫生监督部门技术支撑。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,本领域普通技术人员对本发明的技术方案所做的其他修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!