特异结合DDX24解旋酶的多肽及其应用的制作方法
本发明涉及生物医学领域,具体涉及一系列特异性结合DDX24解旋酶的多肽及其应用。
背景技术:
DDX24是一种ATP依赖的RNA 解旋酶,由DDX24基因所编辑,它属于DDX蛋白家族。该家族的蛋白涉及RNA二级结构改变的细胞过程,如蛋白翻译启动,线粒体RNA的剪切,以及核糖体和剪接体的组装过程 (Staley and Guthrie 1998, Cell 92: 315-325; Berthelot, Muldoon et al, 2004 Molecular Microbiology 51(4): 987-1001; Linder 2006,Gene & Development 19: 2122-2137)。DDX24在人类多种癌细胞中过表达。还有文章指出DDX24与多脏器静脉、淋巴管畸形的联系,提示DDX24在内皮细胞中的重要作用,参与血管畸形的形成 (Pang, Hu et al, 2019, Hepatology 69(2): 803-816)。因此,找出特异性结合DDX24解旋酶的探针对于了解DDX24在疾病发生发展过程中的作用,进而应用于疾病的早期检测、分子成像、药物的靶向输送具有重要意义。
目前研究表明, DDX24可能是抑癌基因p53的一种负调控分子(Shi, Dai et al,2016, Oncogene 35(4): 528-536)。DDX24通过抑制p300介导的p53乙酰化,进而促进p53介导的转录靶点p21,上调凋亡调节剂(PUMA)的激活。,DDX24在人类乳腺癌细胞中过表达,如果以RNA干扰导致DDX24蛋白水平降低,会使细胞周期阻滞和衰老,而且这种作用呈p53依赖性 (Shi, Dai et al, 2016, Oncogene 35(4): 528-536)。这些结果表明,DDX24和p53在病变细胞中可能有密切的相互作用,并且这种相互作用对疾病的发生发展有重要影响。根据以上的一些背景,我们设计了具有高度特异性结合DDX24解旋酶的系列多肽。本专利首次发现衍生于p53转录活性区域的多肽 (Kussie, Gorina et al. 1996, Science 274: 948-953)可以在体外直接结合重组的DDX24蛋白。此外,我们首次发现磷酸化修饰的基于p53的多肽 (Feng, Jenkins et al. 2009, Structure 17(2): 202-210) 也可以可以用来特异性识别DDX24解旋酶。另外我们首次测试发现由噬菌体展示实验针对Mdm2/Mdmx-p53 筛选出的多肽(Hu, Gilkes et al. 2007, Cancer Res 67(18): 8810-8817)可以用来特异性识别DDX24解旋酶。。
技术实现要素:
本发明的目的在于:提供一种具有高度特异性结合DDX24解旋酶的多肽及其应用,该多肽能特异性识别DDX24解旋酶。
特异性识别DDX24解旋酶的多肽,所述多肽的氨基酸序列包括如下所示的特征序列部分:
1.氮端-SQETFSDLWKLLPEN-羧基端,其中英文字母代表常规天然氨基酸;
2.氮端-S(p)QET(p)FSDLWKLLPEN-羧基端,其中英文字母代表常规天然氨基酸,(p)代表S或者T的羟基被磷酸化修饰;
3.氮端-LTFEHYWAQLTS-羧基端,其中英文字母代表常规天然氨基酸;
4.氮端-SGQHSHGYDDCWHQP-羧基端,其中英文字母代表常规天然氨基酸,这一序列的多肽具有和上述1-3相同长度, 在实验中做为阴性对照。
进一步的,所述肿瘤细胞选自DDX24 高表达的SMMC-7721肝癌细胞株。
所述p53多肽衍生于p53蛋白转录活性区域,通过常规多肽化学合成或者特异化学修饰得到。所述p53多肽可以结合、封闭、拮抗DDX24解旋酶。所述p53多肽经过化学发光、荧光、核素等标记,应用于制备DDX24解旋酶相关的药物或检测试剂中。
本发明的有益效果在于:本发明的多肽能特异性识别DDX24解旋酶,对于了解DDX24在疾病发生发展过程中的作用,进而应用于疾病的早期检测、分子成像、药物的靶向输送具有重要意义。
本发明还包括将上述p53多肽应用于设计、制备与DDX24相关疾病的药物或检测试剂中。
附图说明
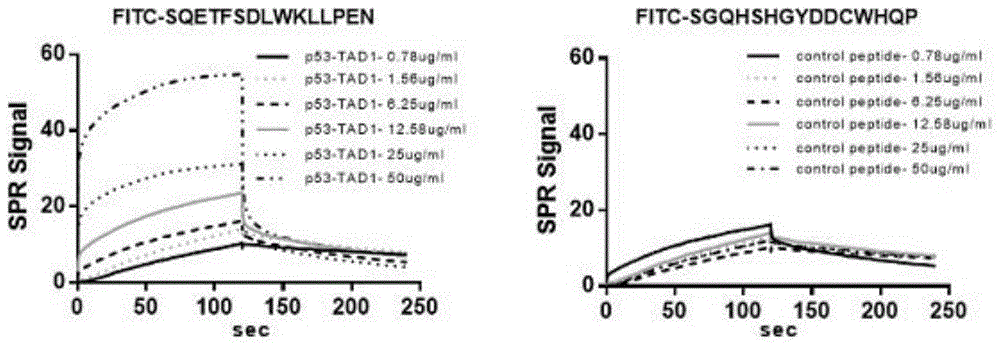
图1:对上述荧光标记多肽序列以SPR表面等离子共振分析技术测定体外与DDX24的结合力。测试条件:pH:10 mM Acetate 5.5,流速:10μl/min,流速:30μl/min, 多肽浓度:0.78125/1.5625/6.25/12.5/25/50μg/ml,结合时间:120 s,解离时间:120 s。结果显示:多肽1的Kd = 7.15 + 3.6μM,多肽2的Kd = 1.83 + 0.2μM,多肽3的Kd= 0.069 + 0.03μM,而对比多肽4无可测量的结合活性。
图2:2A图中1-3多肽及对照多肽4标绿色FITC荧光。在96黑色荧光孔板内接种SMCC-7721细胞(标记为DDX24H)97L细胞(标记为DDX24L)。用细胞培养液将实验多肽1-3与对照多肽4稀释至终浓度10 μM,孵育及洗脱后荧光检测仪读取细胞内特异结合多肽的信号(EM:528, EX:485)。结果显示,1-3多肽与对照多肽4对比,活细胞内摄取1-3多肽的量明显多于对照多肽4。DDX24高表达的SMMC-7721细胞与DDX24低表达的97L细胞对比,DDX24高表达的SMMC-7721细胞内摄取的1-3多肽明显多于DDX24低表达的97L细胞。2B、2C图中对96孔板内细胞冰上孵育30 min,再次读数荧光信号以观察和37℃孵育结合情况下的区别。读数后,细胞重新放回37℃孵育2个小时,再次读取荧光信号。 结果显示,SMMC-7721细胞(DDX24H)的荧光强度变化较97L细胞(DDX24L)更为明显,表现在低温环境时荧光强度增高,而恢复37℃时荧光强度又降低。
图3:在SMCC-7721细胞选择标上绿色荧光(FITC)多肽3,加入40μM(终浓度)所述多肽3的培养液中,于37ºC孵育 4 h,0.1%BSA/PBS洗板三次,每次5分钟,后分别在37ºC或者4ºC固定(4%多聚甲醛)30分钟。然后洗板,室温封闭(3%BSA、PBS)30分钟,孵育DDX24抗体(ThermoFisher, PA5-51721),及红色荧光二抗(ThermoFisher, A21428),室温避光孵育1小时,并DAPI染核。最后荧光显微镜下观察并采集图像。结果显示:多肽3与细胞内DDX24结合后显示的相转移现象(黄色箭头表示的核内或者胞内颗粒状聚集在4ºC更加明显)与用DDX24特异性抗体染色结果完全一致。
具体实施方式
为详细说明本发明的技术内容、构造特征、所实现目的及效果,以下结合实施方式详细予以说明。
本发明实施例为:一种可以特异性结合DDX24解旋酶的p53多肽及其应用,所述p53多肽的序列包括:
1.氮端-SQETFSDLWKLLPEN-羧基端,其中英文字母代表常规天然氨基酸;
2.氮端-S(p)QET(p)FSDLWKLLPEN-羧基端,其中英文字母代表常规天然氨基酸,(p)代表S或者T的羟基被磷酸化修饰;
3.氮端-LTFEHYWAQLTS-羧基端,其中英文字母代表常规天然氨基酸;
4.氮端-SGQHSHGYDDCWHQP-羧基端,其中英文字母代表常规天然氨基酸,这一序列的多肽具有和上述1-3相同长度, 在实验中做为阴性对照。
具体实施方式1:多肽直接结合DDX24重组蛋白 (SPR 体外结合实验)。
DDX24蛋白的纯化:为了体外获得重组的DDX24蛋白,装有DDX24基因(28-859aa, 基于57062 Pubmed 序列文库号)经Bamh I和Hind III酶切位点连接到pSumo载体,在DH5α菌获得重组质粒,经测序验证无误,转入表达菌:BL21(DE3)进行蛋白纯化。将质粒转化至BL21(DE3),37度200转摇至吸光度0.6-0.8,加入终浓度0.1mM IPTG(索莱宝,SBJ-F2160),16度诱导表达,4度/5000g/15分钟收菌,每升培养基用30毫升A液重悬。高压低温破碎仪(JNBIO,JN-mini)破菌,14000g/35分钟/4度收菌,取上清液用镍柱(南京森贝伽生物科技有限公司,SBJ-FL2160)纯化,B液洗脱。洗脱蛋白加ulp1酶切16小时/4度,C液透析(索莱宝,ya1043透析袋)过夜。透析蛋白反挂镍柱(南京森贝伽生物科技有限公司,货号SBJ-FL2160),收集流穿, 流穿液超滤浓缩(Millipore,货号UFC903096)后过HiLoad 16/600 superdex 200 prep grade柱子(GE,货号28-9920-17AC),D液洗脱,收集目的蛋白,浓缩后冻干(冻干设备厂家:广州智祥生物科技有限公司,型号:TF-LFD-1)。其中溶液A: 50 mM Tris-HCl pH8.0, 500 mM NaCl, 20 mM Imidazole;B: 50 mM Tris-HCl pH8.0, 500mM NaCl, 300 mM Imidazole; C: 50 mM Tris-HCl pH8.0, 150mM NaCl;D: PBS。最后,通常情况下抽提蛋白的产率为10升表达菌液,可以获得90%纯度DDX24蛋白0.1mg。
对上述荧光标记多肽序列以SPR表面等离子共振分析技术测定体外与DDX24的结合力。SPR结合分析:在Biacore T200仪器上测定DDX24与多肽的离解常数(Kd)。利用生物素(Pierce)对靶肽进行生物素化处理。传感器芯片SA表面结合链霉亲和素,进行条件调节,然后将生物素化的多肽固定在表面。将DDX24注入传感器芯片。然后根据蛋白浓度绘制平衡结合条件下的最大响应,以确定Kd值。测试条件:pH:10 mM Acetate 5.5,流速:10 μl/min,流速:30 μl/min, 多肽浓度:0.78125/1.5625/6.25/12.5/25/50μg/ml,结合时间:120 s,解离时间:120 s。结果为图1所示,多肽1的Kd= 7.15 + 3.6μM,多肽2的Kd= 1.83 + 0.2μM,多肽3的Kd= 0.069 + 0.03μM,而对比多肽4无可测量的结合。结果表明,多肽1-3在体外能特异性结合DDX24。
具体实施方式2:多肽与DDX24高表达活细胞选择性结合 (活细胞荧光结合实验)。
为了进一步验证所列多肽能够在活细胞结合胞内DDX24,所述1-3多肽及对照多肽4标上绿色FITC荧光(上海波泰公司合成)。在96孔黑色荧光板内(Corning公司,354640)接种每孔相同数量(1×105)的DDX24 高表达的SMCC-7721细胞(标记为DDX24H),和DDX24 低表达97L细胞(标记为DDX24L)。用细胞培养液将实验多肽1-3与对照多肽4稀释至相同终浓度(10 μM),每个相同浓度重复2孔,加样后荧光读取机(Synergy HTX公司)测量各孔总荧光强度(EM:528, EX:485)确定每孔总荧光信号持平,记录后,放入37ºC培养箱孵育12小时。然后吸去含多肽的培养液,用不含多肽的新鲜培养液轻轻浸洗细胞2次,每次5min,最后荧光检测仪读取细胞内特异结合多肽的信号(EM:528, EX:485)。实验结果如图2A所示,1-3多肽与对照多肽4对比,活细胞内摄取1-3多肽的量明显多于对照多肽4。DDX24高表达的SMMC-7721细胞与DDX24低表达的97L细胞对比,DDX24高表达的SMMC-7721细胞内摄取的1-3多肽明显多于DDX24低表达的97L细胞。
为了进一步验证DDX24家族蛋白易产生的胞内相转移,且低温促进其相转移现象的特性 (Nott, Petsalaki et al. 2015, Mol Cell 57(5): 936-947), 对96孔板内细胞冰上孵育30 分钟,再次读数荧光信号以观察和37℃孵育结合情况下的区别。读完数据后,细胞重新放回37℃孵育2个小时,再次读取荧光信号。 实验结果如图 2 B,C 所示, SMMC-7721细胞(DDX24H)的荧光强度变化较97L细胞(DDX24L)更为明显,表现在低温环境时荧光强度增高,而恢复37℃时荧光强度又降低。提示特异结合的多肽1-3示踪的荧光信号可以准确反映细胞内的DDX24在低温时易于出现相转移的独特生物物理性质。
具体实施方式3:多肽与DDX24高表达细胞选择性结合(免疫荧光)。
为了进一步验证上述多肽能否特异结合活细胞内DDX24,利用DDX24高表达的肝癌细胞进行多肽细胞结合实验。在所述多肽标上绿色荧光(FITC),取DDX24 高表达SMCC 7721细胞 (1×105/well, 8孔腔室玻片(ThermoFisher,154941),加入40μM终浓度所述多肽3的培养液中,然后用0.1%BSA/PBS 溶液洗脱 3 次,每次 5分钟。然后加入4%多聚甲醛于37ºC 或者4ºC 固定30 分钟。洗脱后用3% BSA/PBS溶液封闭30分钟。滴加DDX24抗体(ThermoFisher, PA5-51721),4℃湿盒内孵育过夜。洗脱后滴加红色荧光二抗(ThermoFisher, A21428),室温避光孵育1小时。洗脱后向玻片上滴加DAPI,避光孵育5分钟。在荧光显微镜下观察并采集图像。 如图3所示,通过观察发现本发明多肽3(本实施例用多肽3, 但本发明实施不仅限于多肽3)与细胞内DDX24结合后显示的相转移现象(黄色箭头表示的核内或者胞内颗粒状聚集在4ºC更加明显)与用DDX24特异性抗体染色结果完全一致。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人rna解旋酶9.13和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人核糖核酸解旋酶48.4和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶13和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶9和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶12和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人rna解旋酶105和编码这种多肽的多核苷酸的制作方法
- Hcv ns-3丝氨酸蛋白酶抑制剂的制作方法
- 丙型肝炎病毒ns3解旋酶atp结合位点单克隆抗体识别表位的制作方法
- 一个编码冰缘植物冷诱导蛋白的基因及其在抗寒转基因烟草中的应用的制作方法