一种提高乙醇产率的酿酒酵母定点饱和突变基因spt15-N及其应用的制作方法
本发明涉及是生物质发酵生产乙醇的技术,特别是一种提高乙醇产率的酿酒酵母spt15定点饱和基因突变方法
背景技术:
传统的生物乙醇生产主要以粮食发酵为主,世界粮食紧缺现象严重限制了原料来源。木质纤维素是世界上最为丰富的生物质资源,量最大、价最廉,每年的总产量约占所有生物质资源的50%[1],但目前大多数此类的物质没有得到高效利用。以生物质为原料制取的工业乙醇,作为一种清洁的可再生能源,是替代石油等化石燃料的必然趋势,已被纳入许多国家的发展战略规划。
酿酒酵母(s.cerevisiae)是真核微生物,细胞壁厚、固醇含量高,对乙醇及木质纤维素水解物中毒性因子的耐受性较高[3];能在低ph、严格厌氧条件下快速发酵葡萄糖生产乙醇,副产物少;不易被细菌和病毒污染,且相关工业技术成熟。酿酒酵母全基因组测序已完成[4],是迄今为止研究最透彻的真核微生物,可利用生物信息学的方法和手段,以及日趋完善的分子生物学技术,对其进行基因操作和代谢网络的重构。是乙醇发酵的研究重点和首要目标微生物。酵母菌的乙醇耐受性与多个基因有关,因而通过传统的单基因敲除或过量表达很难达到提高酵母菌乙醇耐性和提高乙醇产率的目的。2006年alper等报道了通过gtme的方法提高酵母菌乙醇产率和耐性的开创性研究,为酵母菌乙醇产率和耐性代谢工程操作提供了新的思路。
转录水平调控是基因表达调控中效率最高的一个环节。全局转录机制工程(globaltranscriptionmachineryengineering,gtme)是一种通过基因转录重排来优化细胞表型的技术[6],它通过分子生物学方法,如易错pcr、dna改组等,建立起始转录因子突变库,改造全局转录调控因子,针对目的产品或目标表型进行定向筛选,使整个转录调控过程发生变化从而改变或提高目标基因的转录及表达,获得目的代谢流增强或特定表型增强的菌种。转录是由rna聚合酶执行的,在真核生物中rna聚合酶ⅱ负责转录产生大部分功能基因的mrna,而rna聚合酶ⅱ转录效率是由起始转录因子和启动子结合能力决定的。酿酒酵母中起始转录因子之一的spt15属于转录起始复合物部分,,是一种tata结合蛋白[7],参与转录起始复合物的形成,控制基因表达效率。它与相关基因启动子区域tata结合能力的改变,影响相关基因表达效率,从而引起菌种的表型变化。它的突变使相关基因过量表达,在表型上提高了酵母对乙醇耐受能力。
中国专利:一种突变的酿酒酵母起始转录因子及其编码基因与应用(zl200810024036.8)它利用随机突变技术突变转录因子spt15基因,经过筛选获得spt15的一个突变体spt15-6;另一个中国专利:突变的酿酒酵母起始转录因子基因及其表达载体和应用(zl201310008539.7)也是利用随机突变技术突变转录因子spt15基因,经过筛选获得spt15的一个突变体spt15-10。它们与原酿酒酵母spt15基因序列的比对有明显的变化。将它们利用基因工程技术构建重组酿酒酵母,发酵检测乙醇产率都有变化,但对工程应用来说,都不理想,即乙醇产率还应进一步提高。
本发明从野生型酵母菌株中扩增得到起始转录调控因子基因spt15,用定点饱和突变法获得突变基因,并构建到pyes2ntc载体,通过醋酸锂法转化到酿酒酵母invsc1中表达,对获得的重组酵母菌乙醇产量进行测定。经筛选得到2个点突变spt15基因。突变后重组的重组酿酒酵母的代谢特性大大提高,也就是大大提高了其乙醇产率。
参考文献
[1]liuhm,xul,yanm,etal.gtmeforconstructionofrecombinantyeastco-fermentingxyloseandglucose.chinjbiotech,2008,24(6):16.
刘红梅,许琳,严明,等.gtme构建共发酵木糖和葡萄糖的重组酿酒酵母.生物工程学报,2008,24(6):16.
[2]hala,gregorys.globaltranscriptionmachineryengineering:anewapproachforimprovingcellularphenotype.metabeng,2007,9:258267.
技术实现要素:
本发明提出一种利用基因工程手段对酿酒酵母的spt15定点饱和基因突变,提高乙醇产率的方法。
本发明是这样实现的。一种提高乙醇产率的酿酒酵母spt15定点饱和基因突变的方法,其步骤为:
1、酿酒酵母s.cerevisiaeinvsc1spt15基因的扩增及重组质粒构建
a)运用基因组提取试剂盒,提取s.cerevisiaeinvsc1基因组。以s.cerevisiae总dna为模板,使用spt15_forward和spt15_reverse引物pcr扩增酿酒酵母起始转录因子spt15基因。pcr循环参数为:94℃,5min;94℃1min,56℃1min,72℃2min,30个循环。用胶回收试剂盒(takara公司)对扩增出的基因进行纯化回收。
其中引物:spt15_forward5'-atggccgatgaggaacgtttaaaggagttta-3'
spt15_reverse5'-tcacatttttctaaattcacttagcacagggtatatag-3'
原始spt15基因序列见序列表seqidno.1
b)回收后的spt15基因与pmd18-t(takara公司)载体连接,氯化钙法将连接载体转化到大肠杆菌dh5α感受态细胞,提取单克隆重组质粒pmd18-spt15,经测序得到基因序列spt15正确。接着使用spt15_yes2ntf和spt15_yes2ntr引物pcr扩增pmd18-spt15质粒上的spt15基因。pcr循环参数为:94℃,5min;94℃1min,56℃1min,72℃2min,30个循环。经notⅰ,bamhⅰ双酶切后用胶回收试剂盒(takara公司)对扩增出的基因进行纯化回收。
其中引物:spt15_yes2ntf5'-ggatccgccgatgaggaacgttta-3'
spt15_yes2ntr5'-gcggccgctcacatttttctaaattcac-3'
c)回收后的spt15基因与经notⅰ,bamhⅰ双酶切并回收后的pyes2ntc线性载体连接,氯化钙法将连接载体转化到大肠杆菌dh5α感受态细胞,提取单克隆重组质粒pyes2ntc-spt15,经测序得到基因序列spt15正确。
2、定点饱和突变基因库及重组酿酒酵母的获得
a)通过spt15序列的同源比对和三维结构分析,发现lys127位点位于对称结构的中间结合部位,此位点的突变可能影响spt15与spt3的结合,因此选定该位点为突变位点。
b)根据反向重叠延伸pcr(overlapextensionpcr)原理,设计一对突变引物spt15_mutf和spt15_mutr,其中小写划线字母部分即为突变位点,对应127位氨基酸密码子。
首先,以重组质粒pyes2ntc-spt15为模板,使用引物spt15_mutf和spt15_mutr进行质粒扩增,pcr扩增循环参数为94℃50sec,62℃45sec,72℃7min,30个循环,最后,72℃延伸10min,反向扩增得到包含载体序列和基因序列的线性片段,经过dpnⅰ酶消化模板后,胶回收,自连接,转化大肠杆菌dh5α,卡那霉素抗性平板筛选转化子,测序鉴定是否为突变基因。突变基因序列与原酿酒酵母spt15基因序列[10]的比对结果显示,共获得在第127位赖氨酸的12个不同的点突变,其他位点未发生突变。12个点突变结果见表1。
其中引物:spt15_mutf5'-atggttgttaccggtgcannkagtgaggatgactca-3'
spt15_mutr5'-tgcaccggtaacaaccattttccctgaggcaaaaattaaagc-3'
c)将含有突变的和未突变的spt15基因重组质粒,利用醋酸锂法[9]转化入酿酒酵母invsc1。使用sx筛选培养基筛选转化子,得到含有spt15突变基因的一系列重组酿酒酵母(共12个),按突变基因序号分别命名为系列重组酿酒酵母invsc1-spt15-x,其中x为f、v、r、m、l、g、t、s、q、d、n、i(见表1)。
表1定点饱和突变位点密码子和氨基酸
3、重组酿酒酵母invsc1-spt15-x发酵实验、结果分析及筛选。
将上述得到的12个重组酿酒酵母和对照组分别接种于50ml种子培养基中,30℃、200r/min培养24h,以10%(v/v)接种于含100ml发酵培养基的500ml三角瓶中,将菌液适当稀释后在600nm下测定吸光度值,选择在对数生长期的菌株分别接种到100ml发酵培养基中30℃、200r/min厌氧发酵培养。测定乙醇含量和残糖量。发酵液样品经0.45μm醋酸纤维滤膜过滤,采用sba-40c型生物传感分析仪及试剂(山东省科学院生物研究所)进行乙醇浓度和葡萄糖浓度的检测。经测定分析和筛选,重组菌重组酿酒酵母invsc1-spt15-m,invsc1-spt15-n,利用葡萄糖产乙醇产率有大幅度提高,在葡萄糖培养基中的乙醇产率分别为43.0±0.9g/l和43.7±0.2g/l。分别比对照菌株增加17.8%和19.7%。
优选的spt15-m突变基因序列见seqidno.2,该突变基因在127位由赖氨酸突变为甲硫氨酸。
优选的spt15-n突变基因序列见seqidno.3,该突变基因在127位分别由赖氨酸突变为天冬酰胺。
本发明的原理是这样的。细胞的表型是由众多基因综合决定的,构建一个理想表型的菌株需要同时进行多基因的修饰,然而引入这些修饰的能力通常是很有限的。基因表达调控发生在遗传信息传递的各个水平上,而转录调控是基因表达调控中最重要的一个环节。全局转录机制工程方法允许改变许多末端基因的表达。即通过对于转录蛋白应答的变更,使得整个转录子产生大的扰动。通过改造起始转录调控因子spt15,利用特定筛选条件得到优化的目标表型,就是通过起始转录因子的改变来实现多基因的同时改变从而调节整个的代谢网络。
本发明选定lys127位点作为突变点进行定点饱和突变,取得明显的技术效果。
本发明具有明显的优点。本发明方法简单,操作容易,乙醇产率提高效果明显。具有很好的经济效益和社会效益。
附图说明
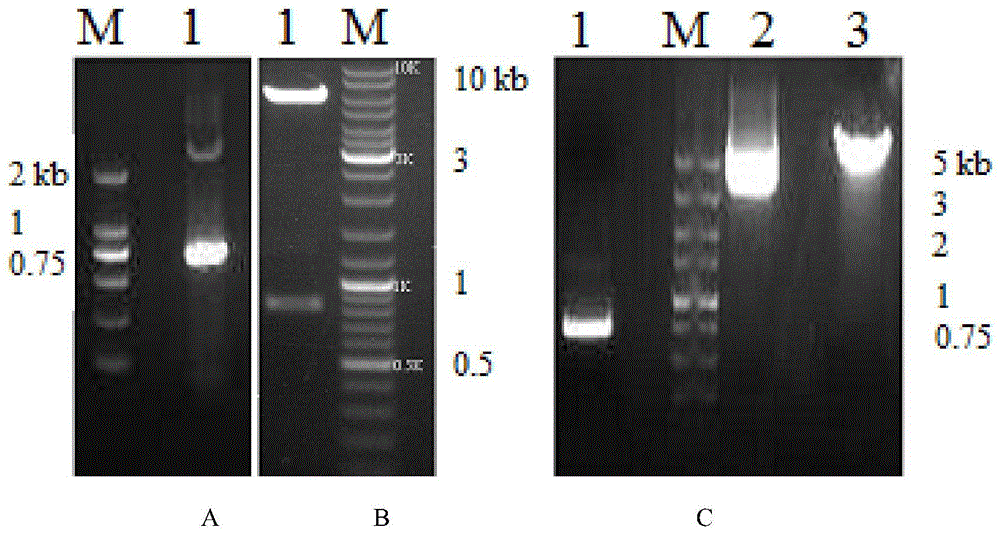
图1.spt15基因的克隆及pyes2ntc-spt15重组质粒的电泳检测验证
其中(a)1:spt15的pcr产物;m:dnamarkerdl2000
(b)1:pmd18-spt15质粒的双酶切验证;m:dnamarkerdl10000
(c)1:pyes2ntc-spt15质粒的pcr验证;2:pyes2ntc-spt15质粒;
3:pyes2ntc-spt15单酶切产物;m:dnamarkerdl5000
图2突变基因重组酵母invsc1-spt15-x的糖利用情况
图3突变基因重组酵母invsc1-spt15-x与对照菌株的乙醇产率
图4突变基因重组酵母菌株invsc1-spt15-m,invsc1-spt15-n和对照菌株重组菌invsc1-neo的乙醇产量和葡萄糖利用曲线;
图5野生型酵母菌株中起始转录调控因子基因spt15的三维结构及突变位点;
具体实施方式
下面以实例对本发明进一步说明:
实施例1:spt15基因的克隆及其重组质粒的构建
以s.cerevisiaeinvsc1的基因组dna为模板,利用设计的引物进行pcr反应,pcr产物电泳检测在0.75kb左右有一明显条带(图1)。将pcr产物经纯化回收后和克隆载体pmd18-t连接,连接产物转化大肠杆菌e.colidh5α,利用蓝白斑筛选出阳性转化子pmd18-spt15,质粒测序结果表明得到的spt15序列正确,和基因库中基因序列同源性100%(genbank基因编号m29459.1,蛋白质编号aaa34458.1)。
在质粒pmd18-spt15上经pcr扩增,经notⅰ,bamhⅰ双酶切,琼脂糖凝胶电泳回收纯化。回收后的spt15基因与经notⅰ,bamhⅰ双酶切并回收后的pyes2ntc线性载体连接,经过pcr和酶切验证获得重组质粒pyes2ntc-spt15,经测序得到基因序列spt15。
实施例2定点饱和突变基因库及重组酿酒酵母的获得
以实施例1获得的重组质粒pyes2ntc-spt15为模板,进行反向重叠延伸pcr,经过dpnⅰ酶消化、回收后自连接,转化大肠杆菌dh5α,卡那霉素抗性平板筛选转化子,测序鉴定是否为突变基因。突变基因序列与原酿酒酵母spt15基因序列[10]的比对结果显示,共获得在第127位赖氨酸的12个不同的点突变,其他位点未发生突变。12个点突变结果见表1。
实施例3突变基因重组酿酒酵母筛选
将含有突变的和未突变的spt15基因重组质粒,利用醋酸锂法[9]转化入酿酒酵母invsc1。使用缺少尿嘧啶的筛选培养基筛选转化子,得到含有spt15突变基因的一系列重组酿酒酵母。按突变基因序号分别命名为系列重组酿酒酵母invsc1-spt15-x,其中x为k、f、v、r、m、l、g、t、s、q、d、n、i(见表1)。其中k为未突变。
实施例4invsc1-spt15-x突变基因重组酵母的糖利用情况
大部分基因都显示葡萄糖消耗速率有不同程度的降低。尤其是spt15-n,spt15-k。但对照菌株与突变基因重组菌株均在12小时内葡萄糖即消耗完全,表明葡萄糖消耗速率并不影响其乙醇产量。(见图3)
实施例5突变基因重组酵母菌invsc1-spt15-x厌氧发酵乙醇产量的检测
对照菌株invsc1-neo和重组菌株invsc1-spt15-x在100g/l的葡萄糖培养基中,30℃、200r/min的条件下发酵48h后得到的乙醇产量如表2所示。
与对照菌invsc1-neo相比,invsc1-spt15-l,invsc1-spt15-g,invsc1-spt15-k,invsc1-spt15-i,invsc1-spt15-s乙醇产量基本没有变化,最高峰都在24h。而invsc1-spt15-t,invsc1-spt3,invsc1-spt15-q,invsc1-spt15-f,invsc1-spt15-v,invsc1-spt15-d乙醇产率明显下降,乙醇产率在25-29g/l左右。是对照菌株的68.5%-79.5%。而spt15-r的虽然最高乙醇产率与对照菌相比变化不大,但乙醇达到最高产量的时间从24h推迟到48h。
重组酵母菌invsc1-spt15-m,invsc1-spt15-n,利用葡萄糖产乙醇产率有大幅度提高,在葡萄糖培养基中的乙醇产率分别为43.0±0.9g/l和43.7±0.2g/l。分别比对照菌株增加17.8%和19.7%。该结果初步揭示出起始转录因子spt15基因的有效突变使酿酒酵母的代谢途径和代谢流发生了重大变化。
表2重组菌与对照菌株相同条件下的产乙醇比较
本发明使用的材料说明。
大肠杆菌escherichiacolidh5、酿酒酵母宿主菌株为saccharomycescerevisiaeinvsc1、酵母表达载体pyes2ntc均可以购买。
实验所用基因组dna提取试剂盒购自上海华舜生物工程有限公司,限制性内切酶notⅰ,bamhⅰ购自neb公司,pmd18-tvector、胶回收试剂盒为大连宝生物工程有限公司(takara)生产,引物合成,质粒提取试剂盒,taq聚合酶、dntpmixture氨苄抗生素为上海生工生物工程公司生产,transtaqdnapolymerasehighfidelity高保真pcr聚合酶为全式金公司生产,基因序列的测定由英骏(invitrogen)生物有限公司完成。其他试剂为分析纯。
培养基
大肠杆菌用lb培养基培养,添加50μg/ml氨苄青霉素。酿酒酵母用ypad培养基培养。
基本培养基(ypad)(g/l):酵母粉10,蛋白胨20,葡萄糖20,腺嘌呤硫酸盐0.075。
筛选培养基(sx)(g/l):不含氨基酸酵母氮源(ynb)6.7,必需氨基酸混合物(缺尿嘧啶)1.3,葡萄糖20,琼脂粉20。
种子培养基(g/l):酵母粉10,蛋白胨20,葡萄糖20。
发酵培养基(g/l):酵母粉10,蛋白胨20,葡萄糖100。
序列表
<110>南阳师范学院
<120>一种提高乙醇产率的酿酒酵母定点饱和突变基因spt15-n及其应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>723
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggccgatgaggaacgtttaaaggagtttaaagaggcaaacaagatagtgtttgatcca60
aataccagacaagtatgggaaaaccagaatcgagatggtacaaaaccagcaactactttc120
cagagtgaagaggacataaaaagagctgccccagaatctgaaaaagacacctccgccaca180
tcaggtattgttccaacactacaaaacattgtggcaactgtgactttggggtgcaggtta240
gatctgaaaacagttgcgctacatgcccgtaatgcagaatataaccccaagcgttttgct300
gctgtcatcatgcgtattagagagccaaaaactacagctttaatttttgcctcagggaaa360
atggttgttaccggtgcaaaaagtgaggatgactcaaagctggccagtagaaaatatgca420
agaattatccaaaaaatcgggtttgctgctaaattcacagacttcaaaatacaaaatatt480
gtcggttcgtgtgacgttaaattccctatacgtctagaagggttagcattcagtcatggt540
actttctcctcctatgagccagaattgtttcctggtttgatctatagaatggtgaagccg600
aaaattgtgttgttaatttttgtttcaggaaagattgttcttactggtgcaaagcaaagg660
gaagaaatttaccaagcttttgaagctatataccctgtgctaagtgaatttagaaaaatg720
tga723
<210>2
<211>723
<212>dna
<213>人工序列(artificialsequence)
<400>2
atggccgatgaggaacgtttaaaggagtttaaagaggcaaacaagatagtgtttgatcca60
aataccagacaagtatgggaaaaccagaatcgagatggtacaaaaccagcaactactttc120
cagagtgaagaggacataaaaagagctgccccagaatctgaaaaagacacctccgccaca180
tcaggtattgttccaacactacaaaacattgtggcaactgtgactttggggtgcaggtta240
gatctgaaaacagttgcgctacatgcccgtaatgcagaatataaccccaagcgttttgct300
gctgtcatcatgcgtattagagagccaaaaactacagctttaatttttgcctcagggaaa360
atggttgttaccggtgcaatgagtgaggatgactcaaagctggccagtagaaaatatgca420
agaattatccaaaaaatcgggtttgctgctaaattcacagacttcaaaatacaaaatatt480
gtcggttcgtgtgacgttaaattccctatacgtctagaagggttagcattcagtcatggt540
actttctcctcctatgagccagaattgtttcctggtttgatctatagaatggtgaagccg600
aaaattgtgttgttaatttttgtttcaggaaagattgttcttactggtgcaaagcaaagg660
gaagaaatttaccaagcttttgaagctatataccctgtgctaagtgaatttagaaaaatg720
tga723
<210>3
<211>723
<212>dna
<213>人工序列(artificialsequence)
<400>3
atggccgatgaggaacgtttaaaggagtttaaagaggcaaacaagatagtgtttgatcca60
aataccagacaagtatgggaaaaccagaatcgagatggtacaaaaccagcaactactttc120
cagagtgaagaggacataaaaagagctgccccagaatctgaaaaagacacctccgccaca180
tcaggtattgttccaacactacaaaacattgtggcaactgtgactttggggtgcaggtta240
gatctgaaaacagttgcgctacatgcccgtaatgcagaatataaccccaagcgttttgct300
gctgtcatcatgcgtattagagagccaaaaactacagctttaatttttgcctcagggaaa360
atggttgttaccggtgcaaatagtgaggatgactcaaagctggccagtagaaaatatgca420
agaattatccaaaaaatcgggtttgctgctaaattcacagacttcaaaatacaaaatatt480
gtcggttcgtgtgacgttaaattccctatacgtctagaagggttagcattcagtcatggt540
actttctcctcctatgagccagaattgtttcctggtttgatctatagaatggtgaagccg600
aaaattgtgttgttaatttttgtttcaggaaagattgttcttactggtgcaaagcaaagg660
gaagaaatttaccaagcttttgaagctatataccctgtgctaagtgaatttagaaaaatg720
tga723
- 还没有人留言评论。精彩留言会获得点赞!