一种合成手性烯丙基仲醇的方法与流程
本发明涉及手性醇的合成,具体涉及通过动力学拆分合成手性烯丙基仲醇的方法,属于有机化学中的不对称合成领域。
背景技术:
手性烯丙基仲醇的不对称合成方法主要分为两种方式:对消旋体烯丙基仲醇动力学拆分和直接不对称合成。通过手性反应试剂进行动力学拆分消旋体烯丙基仲醇是一种常用方法,化学家已经发展了大量通过酶催化或非酶催化方法,利用反应试剂与醇羟基发生反应速率的不同,从而实现消旋体烯丙基仲醇的动力学拆分。
目前通过烯丙基仲醇自身异构化反应,实现烯丙基仲醇动力学拆分的方法研究尚不充分。采用分子内氢转移实现异构化反应,作为具有原子经济性的代表型反应,异构化过程中不仅避免了使用额外的氧化剂和还原剂,同时也减少了反应过程中副产物产生,大大提高了反应的效率、选择性和原子经济性,且得到的饱和羰基化合物为有机合成中常见的反应中间体,在天然产物和药物合成中具有广泛的应用。
因此,进一步深入研究通过不对称烯丙基仲醇自身异构化反应,从而实现其动力学拆分获取手性烯丙基仲醇仍是非常必要的。
技术实现要素:
为了克服上述缺陷,本发明采用消旋烯丙基仲醇(±)-1为原料,在手性联萘酚钾盐催化剂作用下,反应得到手性烯丙基仲醇类化合物。该方法为合成手性烯丙基仲醇类化合物提供了一种简便、廉价、高效的途径。
本发明提供的动力学拆分合成手性烯丙基仲醇的方法,其特征在于,包括如下步骤:以消旋烯丙基仲醇(±)-1为原料,在手性联萘酚钾盐催化作用下,有机溶剂中反应得到手性烯丙基仲醇2。反应方程式如下:
其中,r1为芳香基、杂芳香基或烷基;r2芳基、杂芳香基或烷基;r3为氢、烷基或卤素;r4为氢、烷基或芳香基。
具体而言,r1代表下列基团中的一种:芳香族取代基且芳香族取代基上有给电子基团,例如:苯基、间甲基苯基、对异丙基苯基、2-萘基等;芳香族取代基且芳香族取代基上有吸电子基团如邻位、对位氟苯基,对氯苯基;r1取代基为呋喃或者噻吩环;r1取代基为烷基取代,例如:异丙基,叔丁基,环丙基,庚烷基,壬烷基。r1代表下列基团中的一种:芳香族取代基且芳香族取代基上有基团f、cl、br、甲氧基;r2取代基为者噻吩基或烷基取代。
进一步地,在上述技术方案中,所述有机溶剂选自二氯甲烷、乙酸乙酯、环戊基甲醚、苯甲醚、二正丁基醚、甲基叔丁基醚、乙醚或邻二甲苯。优选反应溶剂为二正丁基醚。
进一步地,在上述技术方案中,反应温度为0-30℃;优选反应温度为室温。
进一步地,在上述技术方案中,消旋体(±)-1合成方法如下:采用化合物4发生反应得到酯5,接着羟基tbs保护得到6,随后被还原成醛7,然后和叶立德8发生wittig反应生成烯烃9,最后在强酸条件下脱去tbs保护生成(±)-1。参考:massad,s.k.;hawkins,l.d.;baker,d.c.j.org.chem.1983,48,5180-5182。
反应方程式表示如下:
进一步地,在上述技术方案中,消旋化烯丙基仲醇(±)-1与手性联萘酚钾盐摩尔比为1:0.05-0.15。
进一步地,在上述技术方案中,手性联萘酚钾盐催化剂优选以下结构:
进一步地,在上述技术方案中,手性联萘酚钾盐制备如下:手性开环冠醚联萘酚与碱性钾反应生成手性联萘酚钾盐。碱性钾选自氢氧化钾、碳酸钾、碳酸氢钾、磷酸钾或氢化钾。优选氢氧化钾或氢化钾,加入当量优选为两者等当量。以采用氢氧化钾为碱,合成催化剂c6为例:
发明有益效果:
本发明使用开环冠醚催化剂衍生得到手性联萘酚钾盐作为手性布朗斯特碱催化剂,催化剂中醚链的引入稳定了钾正离子,使生成的联萘酚钾盐催化剂具有很好稳定性,对水和空气不敏感,室温下可以长时间存在(放置3个月)而不变质。
采用该催化剂,对消旋烯丙基仲醇不对称异构化反应实现了烯丙基仲醇的动力学拆分,得到了系列手性烯丙基仲醇类化合物。该合成方法,反应原料易得,产物结构丰富,产物立体选择性高,反应后得到手性烯丙基仲醇类化合物收率中等至优秀。
说明书附图:
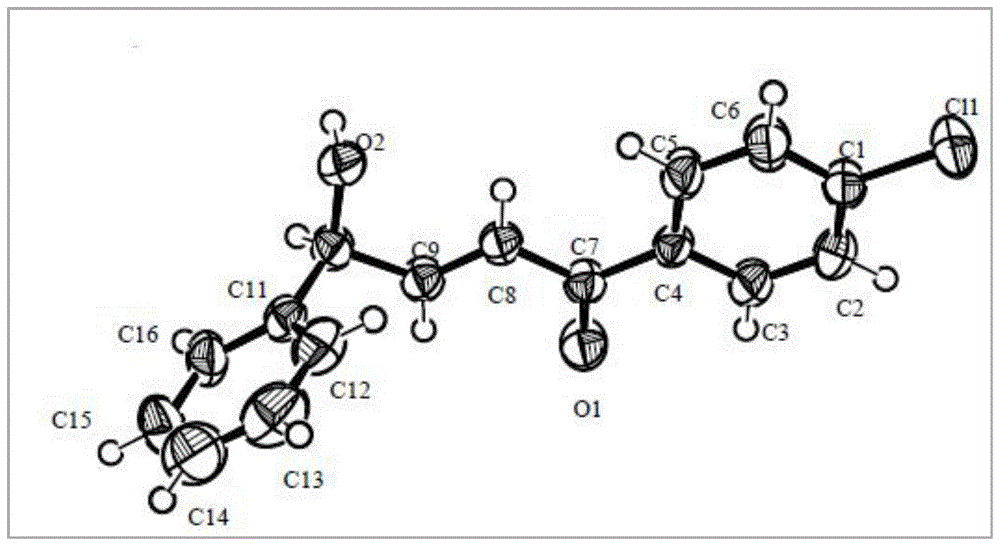
图1为实施例4中化合物(s)-2g单晶结构图;
具体实施方式
实施例1
以消旋烯丙基仲醇(±)-1a为原料,在手性联萘酚钾盐催化作用下,有机溶剂中反应得到手性烯丙基仲醇2a。反应方程式和反应条件优化结果如下:
反应条件:(±)-1a(0.1mmol),催化剂(0.01mmol)在溶剂(1.0ml)中室温反应3小时;bee值通过hplc手性柱测定;c转化率采用1hnmr确定;ds值采用fiaud方法计算:s=ln[(1-conv.)(1-ee)]/ln[(1-conv.)(1+ee)].s均为重复三次的结果;e12小时;f1.5ml二正丁醚;g5mol%催化剂;h1mol%催化剂。
在反应条件筛选过程中,首先考察了不同类型手性联萘酚钾盐催化剂对反应的影响(标号1-7)。同时通过对照不同催化剂对反应的影响,确定了催化剂c6最佳催化剂。
典型催化剂的合成:以c6催化剂为例,经过六步反应后得到,合成路线反应方程式如下:
中间体s1的合成
取250毫升圆底烧瓶,放置磁力搅拌子,氢化钠(60%dispersioninmineraloil,2.8g,70.05mmol,3.0equiv.)加入圆底烧瓶中,然后加入无水四氢呋喃(100ml)。将反应体系放入冰水浴中降温至0℃,将(s,s)-氢化苯偶姻(5.0g,23.35mmol,1.0equiv.)溶解于四氢呋喃(50ml)然后缓慢滴加进入氢化钠的悬浮溶液,待反应停止产生气泡之后,在反应体系上加一个回流冷凝管,然后加入烯丙基溴(7.05ml,81.72mmol,3.5equiv.)。反应回流2小时,然后冷却至室温,然后加水(50ml)淬灭反应。然后向反应混合物中加入乙醚萃取(3x50ml),有机相使用饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干,得到淡黄色油状化合物。硅胶柱层析(pe/et2o,9:1)纯化得到目标产物为无色油状液体(6.6g,96%yield)。
中间体s2的合成
二烯烃化合物s1(6.6g,22.4mmol)使用甲醇(68ml)溶解于250ml圆底烧瓶中,将反应体系冷却至-78℃,通臭氧2.5小时,直到反应体系显示出淡蓝色,反应体系中过量的臭氧通过通氮气10分钟排除,然后将反应体系升温至0℃,硼氢化钠(0.85g,22.4mmol)分多次缓慢加入反应体系,加入完毕反应体系继续搅拌2小时。然后将反应体系使用2n的hcl(23ml)淬灭,将反应体系中的溶剂旋干,然后加入热的氯仿(3×55ml)萃取。有机相使用无水硫酸镁干燥,过滤,旋干得到粗品,硅胶柱层析(eluent:etoac),得到s2为无色油状液体(4.8g,71%yield)。
中间体s3的合成
将s2(4.8g,15.9mmol,1.0equiv.)溶解于二氯甲烷(150ml),向该溶液中加入对甲苯磺酰氯(7.58g,2.5equiv.),三乙胺(4.85ml,2.2equiv.),dmap(194.3mg,0.1equiv.)。该反应体系在室温下搅拌48小时,然后使用饱和的氯化铵(100ml)淬灭反应。向水相中加入二氯甲烷(3×50ml),合并有机相,然后使用饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干得到棕色油状液体。硅胶柱层析(petroleumether/etoac,4:1)纯化得到s3为无色油状液体(8.93g,92%yield)。参考:aspinall,h.c.;greeves,n.;mciver,e.g.tetrahedron2003,59,10453-10463.
中间体s4的合成
将单mom保护3,3’碘取代(r)构型联萘酚(2.4g,4.12mmol,2.0equiv.)溶解于dmf(25ml)中,将研磨成粉状的氢氧化钾(276.9mg,4.94mmol,2.4equiv.)加入反应体系中,然后在室温下搅拌2小时。待氢氧化钾完全溶解后,使用注射泵向反应体系中滴加s3(1.259g,2.06mmol,1.0equiv.)的dmf(5ml)溶液,80℃下2小时滴加完毕。反应过夜,然后冷却至室温,向反应立体中加入饱和氯化铵溶液淬灭反应,然后使用二氯甲烷萃取,合并有机相,然后使用无水硫酸钠干燥,过滤,旋干。粗品使用硅胶柱层析(pe/acetone12:1)得到s4为白色固体(2.5g,85%yield)。参考:yan,h.;jang,h.b.;lee,j.-w.;kim,h.k.;lee,s.w.;yang,j.w.;song,c.e.angew.chem.,int.ed.2010,49,8915-8917.
中间体s5的合成
将s4(1.39g,0.97mmol)溶解于二氯甲烷(23ml)和甲醇(2.3ml)的混合溶液中,向反应体系中加入12nhcl(30ml)。反应体系搅拌过夜,然后使用水和乙酸乙酯的混合溶液稀释。分离有机相然后使用饱和碳酸氢钠洗涤,之后使用饱和食盐水洗涤,使用无水硫酸钠干燥。过滤,旋干得到粗品,硅胶柱层析(petroleumether/etoac,10:1)得到s5为白色固体(1.2g,92%yield)。
4h),7.23–7.19(m,2h),7.09(d,j=8.5hz,2h),7.04-6.98(m,4h),6.90(t,j=7.4hz,4h),6.48(d,j=7.4hz,4h),5.65(s,2h),4.09(s,2h),3.68–3.64(m,2h),3.63-3.58(m,2h),3.39–3.34(m,2h),3.19–3.15(m,2h).13cnmr(150mhz,cdcl3):δ154.18,149.47,140.42,139.52,137.62,133.47,133.45,132.45,130.30,127.82,127.43,127.39,127.25,127.17,127.04,126.96,125.93,125.30,125.02,124.28,122.85,115.42,93.30,87.12,85.15,72.60,68.21.hrms(esi)m/zcalcdfor[c58h42i4nao6,m+na]+:1364.9052,found:1364.9056.
催化剂c6的合成
在干燥的schlenk管中加入s5(200.0mg,0.15mmol)和氢氧化钾(8.4mg,0.15mmol)。乙酸乙酯(4.0ml)在室温下注入schlenk管中。该反应体系搅拌12小时后,过滤旋干,然后真空干燥得到催化剂c6为黄色固体(98%,203.0mg)。该催化剂室温敞口放置3个月,外观、旋光等理化数据没有变化,催化活性与新制备结果一致。
7.5hz,2h),7.24–7.12(m,4h),7.08–6.91(m,8h),6.78–6.69(m,2h),6.52–6.41(m,4h),3.98–3.89(m,2h),3.73–3.62(m,4h),3.25–3.10(m,4h).
13cnmr(100mhz,dmso-d6):δ153.91,140.04,138.79,138.63,137.81,133.93,133.86,133.70,133.68,132.30,128.45,127.56,127.15,126.97,126.90,126.75,126.48,125.35,125.24,123.65,123.61,114.01,93.94,84.29,71.95,67.58.
hrms(esi)m/zcalcdfor[c58h42i4ko6,m+h]+:1380.8792,found:1380.8725.
opticalrotation:
physicalproperties:lightyellowsolid.yield:98%,203.0mg.
反应条件的考察:在10ml真空管中,加入消旋烯丙基醇(±)-1a(0.01mmol),c6(10mol%),然后加入1.0ml溶剂二正丁醚,密封反应管,将反应管置于常温下,磁力搅拌反应12小时。用tlc跟踪反应,终止反应后,真空浓缩反应液,然后经柱层析获得目标化合物(s)-2a,转化率54%,98%ee,s=50。
在其它条件固定的情况下,仅考察溶剂用量对反应的影响,以1a和2a反应生成3a为例:1.0ml二正丁醚,转化率52%,98%ee;1.5ml二正丁醚,转化率50%,95%ee;
在其它条件固定的情况下,仅考察催化剂用量对反应的影响,以1a和2a反应生成3a为例,1%mol手性催化剂c6,转化率11%,12%ee;5%mmol手性催化剂c6,转化率49%,95%ee;10%mmol手性催化剂c6,转化率54%,98%ee。
实施例2:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1c(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。反应体系室温搅拌11.5小时,旋干溶剂,然后硅胶柱层析(石油醚/乙酸乙酯/丙酮=10:1:1)纯化得到手性的烯丙基醇(s)-2c和1,4-二酮化合物3c。1hnmr(400mhz,cdcl3):7.89(d,j=8.2hz,2h),7.40–7.28(m,7h),7.28-7.22(m,1h),7.10(dd,j=15.3,4.5hz,1h),5.45(s,1h),3.01–2.90(m,1h),2.64(s,1h),1.26(d,j=6.9hz,6h).
13cnmr(100mhz,cdcl3):190.21,154.52,148.09,141.04,135.40,128.92,128.82,128.30,126.66,123.73,73.95,34.22,23.63.
hrms(esi)m/zcalcdfor[c19h20nao2,m+na]+:303.1356,found:303.1360.
opticalrotation:
yield:47%,13.2mg.reactiontime:11.5h.
hplcanalysis:chiralceloj-h(hexane/i-proh=85:15,flowrate=1.0ml/min,wavelength=254nm),tr=11.339min(minor),tr=12.278min(major).
实施例3:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1e(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系搅拌室温下搅拌5.5小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性的烯丙基醇(s)-2e和1,4-二酮化合物3e。
1hnmr(400mhz,cdcl3):7.70(t,j=7.4hz,1h),7.51–7.44(m,1h),7.40–7.25(m,5h),7.19(t,j=7.5hz,1h),7.15–6.99(m,3h),5.41(s,1h),2.72(s,1h).
13cnmr(100mhz,cdcl3):189.41(d,jc-f=2.1hz),161.12(d,jc-f=252.5hz),148.80,140.80,134.00(d,jc-f=8.8hz),130.82(d,jc-f=2.2hz),128.78,128.29,127.23(d,jc-f=6.1hz),126.62,126.52,124.37(d,jc-f=3.4hz),116.46(d,jc-f=22.8hz),73.73.
hrms(esi)m/zcalcdfor[c16h13fnao2,m+na]+:279.0792,found:279.0798.
opticalrotation:
yield:44%,11.3mg.reactiontime:5.5h.
hplcanalysis:chiralcelod-h(hexane/i-proh=85:15,flowrate=1.0ml/min,wavelength=254nm),tr=10.768min(minor),tr=12.861min(major).
实施例4:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1g(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌4.5小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性的烯丙基醇(s)-2g(单晶结构见附图1)和1,4-二酮化合物3g。
1hnmr(400mhz,cdcl3):7.90(d,j=8.4hz,2h),7.43(d,j=8.4hz,2h),7.40-7.28(m,5h),7.27–7.22(m,1h),7.13(dd,j=15.3,4.1hz,1h),5.47(s,1h),2.48–2.42(m,1h).
13cnmr(100mhz,cdcl3):189.24,148.99,140.81,139.42,135.91,130.03,128.93,128.90,128.49,126.64,123.05,73.93.
hrms(esi)m/zcalcdfor[c16h13clnao2,m+na]+:295.0496,found:295.0500.
opticalrotation:
yield:43%,11.7mg.reactiontime:4.5h.
hplcanalysis:chiralceloj-h(hexane/i-proh=85:15,flowrate=1.0ml/min,wavelength=254nm),tr=13.619min(major),tr=16.253min(minor).
实施例5:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1h(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌12小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2h和1,4-二酮化合物3h。
1hnmr(400mhz,cdcl3):7.89(d,j=7.4hz,2h),7.50(t,j=7.3hz,1h),7.38(t,j=7.6hz,2h),7.26–7.18(m,3h),7.07(dd,j=15.3,4.4hz,1h),6.80(d,j=8.6hz,2h),5.32(s,1h),3.97(s,1h),3.70(s,3h).
13cnmr(100mhz,cdcl3):190.75,159.46,148.96,137.50,133.02,132.90,128.58,128.51,128.05,123.24,114.11,73.37,55.22.
hrms(esi)m/zcalcdfor[c17h16nao3,m+na]+:291.0992,found:291.0996.
opticalrotation:
yield:48%,12.9mg.reactiontime:12h.
hplcanalysis:chiralceloj-h(hexane/i-proh=80:20,flowrate=1.0ml/min,wavelength=254nm),tr=21.272min(major),tr=23.824min(minor).
实施例6:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1j(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌1.0小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2j和1,4-二酮化合物3j。
1hnmr(400mhz,cdcl3):7.93(d,j=7.4hz,2h),7.56(t,j=7.4hz,1h),7.45(t,j=7.6hz,2h),7.38(s,1h),7.30–7.22(m,4h),7.06(dd,j=15.3,4.6hz,1h),5.43(s,1h),2.86(s,1h).
13cnmr(100mhz,cdcl3):190.54,147.79,142.94,137.39,134.70,133.10,130.09,128.63,128.61,128.41,126.71,124.69,123.98,73.23.
hrms(esi)m/zcalcdfor[c16h13clnao2,m+na]+:295.0496,found:295.0500.
opticalrotation:
yield:47%,12.8mg.reactiontime:1.0h.
hplcanalysis:chiralceloj-h(hexane/i-proh=85:15,flowrate=1.0ml/min,wavelength=254nm),tr=13.065min(major),tr=15.736min(minor).
实施例7:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1l(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌3.0小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2l和1,4-二酮化合物3l。
1hnmr(400mhz,cdcl3):7.57(s,1h),7.38–7.21(m,6h),7.17(dd,j=15.4,3.8hz,1h),7.11(d,j=15.5hz,1h),6.54–6.46(m,1h),5.40(d,j=3.7hz,1h),3.47(s,broad,1h).
13cnmr(100mhz,cdcl3):177.92,153.11,147.93,146.90,140.79,128.84,128.37,126.64,122.64,118.26,112.46,73.82.
hrms(esi)m/zcalcdfor[c14h12nao3,m+na]+:251.0679,found:251.0683.
opticalrotation:
yield:42%,9.6mg.reactiontime:3.0h.
hplcanalysis:chiralceloj-h(hexane/i-proh=70:30,flowrate=1.0ml/min,wavelength=254nm),tr=11.039min(major),tr=16.610min(minor).
实施例8:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1n(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌48小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性的烯丙基醇(s)-2n和1,4-二酮化合物3n。
1hnmr(400mhz,cdcl3):7.42–7.27(m,5h),6.92(dd,j=15.7,4.7hz,1h),6.50(d,j=15.7hz,1h),5.35(s,1h),2.88–2.77(m,1h),2.72(s,1h),1.10(d,j=6.9hz,6h).
13cnmr(100mhz,cdcl3):204.11,146.32,140.97,128.78,128.27,126.52,125.96,73.66,39.03,18.24.
hrms(esi)m/zcalcdfor[c13h16nao2,m+na]+:227.1043,found:227.1047.
opticalrotation:
yield:42%,8.6mg.reactiontime:48h.
hplcanalysis:chiralcelod-h(hexane/i-proh=95:5,flowrate=1.0ml/min,wavelength=254nm),tr=25.583min(minor),tr=27.000min(major).
实施例9:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1r(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌15小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性的烯丙基醇(s)-2r和1,4-二酮化合物3r。
1hnmr(400mhz,cdcl3):7.40–7.21(m,7h),7.16(t,j=7.8hz,3h),6.84(dd,j=15.9,4.7hz,1h),6.38(d,j=15.9hz,1h),5.30(s,1h),2.88(dq,j=11.6,6.3hz,4h),2.70(d,j=2.2hz,1h).
13cnmr(100mhz,cdcl3):δ199.57,146.61,140.96,140.86,128.83,128.42,128.35,128.29,127.86,126.47,126.05,73.59,42.13,29.84.
hrms(esi)m/zcalcdfor[c18h18nao2,m+na]+:289.1199,found:289.1205.
opticalrotation:
yield:45%,12.0mg.reactiontime:15h.
hplcanalysis:chiralceloj-h(hexane/i-proh=70:30,flowrate=1.0ml/min,wavelength=254nm),tr=12.149min(major),tr=14.695min(minor).
实施例10:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1u(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌23小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2u和1,4-二酮化合物3u。
1hnmr(400mhz,cdcl3):7.41-7.27(m,5h),6.86(dd,j=15.8,4.8hz,1h),6.38(d,j=15.8hz,1h),5.33(s,1h),2.84(d,j=3.0hz,1h),2.52(t,j=7.4hz,2h),1.57(s,2h),1.25(s,12h),0.87(t,j=6.5hz,3h).
13cnmr(100mhz,cdcl3):201.03,146.30,141.01,128.76,128.24,127.93,126.48,73.58,40.63,31.80,29.37,29.35,29.20,29.18,24.01,22.60,14.05.
hrms(esi)m/zcalcdfor[c19h28nao2,m+na]+:311.1982,found:311.1985.
opticalrotation:
yield:48%,13.8mg.reactiontime:23h.
hplcanalysis:chiralceloj-h(hexane/i-proh=95:5,flowrate=1.0ml/min,wavelength=254nm),tr=12.967min(major),tr=14.963min(minor).
实施例11:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1v(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌38小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2v和1,4-二酮化合物3v。
1hnmr(400mhz,cdcl3):7.43-7.27(m,5h),6.97(dd,j=15.2,4.0hz,1h),6.90(d,j=15.3hz,1h),5.36(s,1h),2.48(s,1h),2.05(s,3h),1.82(s,6h),1.79-1.66(m,6h).
13cnmr(100mhz,cdcl3):204.07,146.51,141.12,128.76,128.22,126.59,121.74,73.90,45.45,37.75,36.49,27.82.
hrms(esi)m/zcalcdfor[c20h24nao2,m+na]+:319.1669,found:319.1662.
opticalrotation:
yield:45%,13.3mg.reactiontime:38h.
hplcanalysis:chiralcelod-h(hexane/i-proh=90:10,flowrate=1.0ml/min,wavelength=254nm),tr=10.718min(minor),tr=12.614min(major).
实施例12:
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1w(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下38小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2w和1,4-二酮化合物3w。
1hnmr(400mhz,cdcl3):7.46(s,1h),7.38–7.25(m,5h),6.91(dd,j=15.8,5.0hz,1h),6.42(d,j=17.1hz,1h),5.36(s,1h),3.99(s,2h),3.94(s,3h),3.53(s,3h),3.28(d,j=3.2hz,1h),2.62(s,2h),1.67(s,4h).
13cnmr(100mhz,cdcl3):200.36,155.14,151.34,148.61,146.63,141.41,141.13,128.69,128.12,127.98,126.48,107.54,73.52,40.77,39.86,33.50,29.62,27.31,21.30.
hrms(esi)m/zcalcdfor[c21h24n4nao4,m+na]+:419.1690,found:419.1697.
opticalrotation:
yield:43%,17.0mg.reactiontime:38h.
hplcanalysis:chiralceloj-h(hexane/i-proh=50:50,flowrate=2.0ml/min,wavelength=254nm),tr=20.834min(major),tr=25.547min(minor).
实施例13
在干燥schlenk管中,加入消旋烯丙基仲醇(±)-1x(0.10mmol)和催化剂c6(6.9mg,0.005mmol),随后加入二正丁醚(1.5ml)。该反应体系室温下搅拌反应3.0小时,旋干溶剂,然后硅胶柱层析(pe/etoac/acetone,10:1:1)纯化得到手性烯丙基醇(s)-2x和1,4-二酮化合物3x。
1hnmr(400mhz,cdcl3):7.88(d,j=7.9hz,2h),7.50(t,j=7.2hz,1h),7.38(t,j=7.5hz,2h),7.27–7.18(m,2h),7.11(dd,j=15.3,4.1hz,1h),6.95(s,1h),6.92–6.86(m,1h),5.64(s,1h),4.24(s,1h).
13cnmr(100mhz,cdcl3):δ190.97,147.85,144.40,137.06,132.97,128.52,128.40,126.76,125.60,124.94,123.78,68.92.
hrms(esi)m/zcalcdfor[c14h12nao2s,m+na]+:267.0450,found:267.0455.
opticalrotation:
yield:42%,10.3mg.reactiontime:3.0h.
hplcanalysis:chiralcelod-h(hexane/i-proh=75:25,flowrate=1.0ml/min,wavelength=254nm),tr=7.145min(minor),tr=8.119min(major).
以上实施例描述了本发明的基本原理、主要特征及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!