作为隐花色素调节剂的含有咔唑的酰胺类、氨基甲酸酯类和脲类的制作方法
相关申请
本申请要求2014年4月7日提交的美国临时专利申请61/976,350的优先权,所述申请的整体内容通过引用并入本文。
本文公开的主题尤其涉及含有咔唑的酰胺、氨基甲酸酯和脲衍生物、含有这些化合物的药物组合物、其用于治疗隐花色素介导的疾病或病症的方法及其生产方法。还提供诊断、检测或监测接受本文公开的化合物和组合物的对象的隐花色素依赖性疾病的进展的方法。
发明背景
昼夜节律时钟是一种控制许多生理过程的每日节律的内在计时机制,所述生理过程诸如睡眠/唤醒行为、体温、激素分泌和代谢(takahashi,j.s.等人,nat.rev.genet.2008,9,764;green,c.b.等人,cell,2008,134,728;zhang,e.e.等人,nat.rev.mol.cell.biol.2010,11,764)。昼夜节律以细胞自主性方式通过时钟基因的转录调节网产生。在核心反馈环中,转录因子clock和bmal1激活period(per1和per2)和隐花色素(cry1和cry2)基因的表达。在翻译和核定位后,per和cry蛋白抑制clock-bmal1的功能,导致持续的节律基因表达。许多生理途径在昼夜节律时钟的控制下(panda,s.等人,cell,2002,109,307),包括许多肝过程的直接调节(rey,g.等人,plosbiol.2011,9,e1000595;bugge,a.等人,genesdev.2012,26,657)。
昼夜节律去同步化与胰岛素敏感性受损(spiegel,k.等人,j.appl.physiol.2005,99,2008;spiegel,k.等人,lancet,1999,354,1435)、瘦素水平降低有关并导致高血糖症、高胰岛素血症和相当于前驱糖尿病状态的葡萄糖反应的餐后葡萄糖反应(scheer,f.a.等人,proc.natl.acad.sci.usa,2009,106,4453)。数个全基因组关联研究发现,cry2在哺乳动物葡萄糖水平的调节中可能是重要的(dupuis,j.等人,nat.genet.2010,42,105;liu,c.等人,plosone,2011,6,e21464;barker,a.等人,diabetes,2011,60,1805)。
由于内分泌性胰腺的胰岛素敏感性和胰岛素分泌能力的改变,血液中的葡萄糖浓度是高度节律性的(polonsky,k.s.等人,n.engl.j.med.1988,318,1231)。clockδ19突变型小鼠发生年龄依赖性高血糖症,并且这些动物还发生对饮食诱发的肥胖易感,具有不适当低的胰岛素浓度(turek,f.w.等人,science,2005,308,1043),并且血糖在响应于用胰岛素治疗时显示更急剧的下降,这表明这些动物的胰岛素敏感性提高,由此掩蔽了其β-细胞缺乏(marcheva,b.等人,nature,2010,466,627)。小鼠中bmal1的肝特异性缺失导致葡萄糖耐量受损和胰岛素敏感性提高(lamia,k.a.等人,proc.natl.acad.sci.usa,2008,105,15172)。患有2型糖尿病的个体,甚至他们的尚未患有该疾病的直系亲属,都显示葡萄糖耐量的节律性发生改变(boden,g.等人,diabetes,1999,48,2182)。此外,与无2型糖尿病的人相比,在患有该疾病的人中,per2、per3和cry2表达显著较低(stamenkovich,j.a.等人,metabolism,2012,61,978)。糖异生基因烯醇丙酮酸磷酸羧激酶(pck1)和葡萄糖6-磷酸酶(g6pc)受cry和bmal1基因调节物rev-erb控制(zhang,e.e.等人,nat.med.2010,16,1152;lamia,k.a.等人,nature,2011,480,552;yin,l.等人,science,2007,318,1786)。糖异生受多个信号转导机制的严密控制,此外,小鼠中的研究显示cry1和cry2的调节可干扰糖异生并调节血糖水平(zhang,e.e.等人,nat.med.2010,16,1152)。
在单一疗法或组合疗法情况下,新的和已确立的口服抗糖尿病药具有不一致且有限的有效性。口服抗糖尿病疗法遭受血糖控制差或有限,或由不可接受的副作用(诸如水肿、体重增加或甚至更严重的并发症如低血糖症)导致的患者顺应性差。二甲双胍,一种取代的双胍,可引起腹泻和胃肠不适。最后,水肿、体重增加以及在一些情况下的肝脏毒性和心脏毒性,与给药一些噻唑烷-2,4-二酮抗糖尿病药(例如罗格列酮和吡格列酮)有关。使用上述药剂中的两种或更多种的组合疗法是普遍的,但通常仅导致血糖控制逐渐增加的改善。
cry1和cry2还与糖皮质激素受体(gr)相互作用以全面改变对糖皮质激素类的转录反应(lamia,k.a.等人,nature,2011,480,552)。cry1和/或cry2的丧失导致葡萄糖耐受不良和组成型高水平的循环皮质酮,这表明了与肝中糖皮质激素反式激活增加偶联的下丘脑–垂体–肾上腺轴抑制的降低。在基因组上,cry1和cry2以激素依赖性方式与pck1启动子中的糖皮质激素反应元件缔合,并且地塞米松诱导的pck1基因转录在隐花色素缺陷型肝中显著增加。这表明用于抑制炎症的糖皮质激素的不期望的代谢副作用(例如高血糖症、胰岛素抵抗和肾上腺功能抑制)可通过将其与可稳定cry1和/或cry2的药剂组合来减轻。
概述
本文的主题涉及隐花色素(cry)调节化合物、含有cry调节化合物的药物组合物和通过给药cry调节化合物治疗cry相关疾病或病症(例如,糖尿病、肥胖症、代谢综合征、库欣综合征(cushing’ssyndrome)和青光眼)的方法。
在一个方面,本文公开的主题涉及式i的化合物或其药学上可接受的盐或水合物:
其中:
a、d、e、g、j、l、m和q各自独立地是n或c;
当a、d、e、g、j、l、m和q是c时,r1和r2各自独立地选自h、卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、羟基、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-o-(c=o)-r8、-nr8(c=o)-r10、-(c=o)-nr8r9、-nr8r9、-nr8or9、-s(o)cnr8r9、-s(o)d(c1-c8)烷基、-o-so2-r8、nr8-s(o)c、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-(cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
r3和r5各自独立地选自h、氰基、-cf3、-chf2、-ch2f、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-(c=o)-nr8r9、-s(o)cnr8r9、-s(o)d(c1-c8)烷基、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-(cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
其中r3基团的每一个任选彼此连接作为4-12元单环或二环;
其中r5基团的每一个任选彼此连接作为4-12元单环或二环;
r4是h、-cf3、-chf2、-ch2f、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-(c=o)-nr8r9、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
其中r6和r7彼此连接作为4-12元单环或二环;
r8、r9和r10各自独立地选自h、(c1-c6)烷基、-(cr11r12)e(3-10)元环烷基、-(cr11r12)g(c6-c10)芳基和-(cr11r12)g(4-10)元杂环基;
前述r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16的(c1-c6)烷基、(3-10)元环烷基、(c6-c10)芳基和(4-10)元杂环基的任何碳原子独立地被1-3个各自独立地选自以下的r14取代基任选取代:卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、羟基、-o-r15、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-r15、-(c=o)-o-r11、-(c=o)-o-r15、-o-(c=o)-r11、-o-(c=o)-r15、-nr11(c=o)-r13、-(c=o)-nr11r12、-(c=o)-nr11r15、-nr11r12、-nr11r15、-nr11or12、-nr11or15、-s(o)cnr11r12、-s(o)cnr11r15、-s(o)d(c1-c6)烷基、-s(o)dr15、-o-so2-r11、-o-so2-r15、-nr11-s(o)c、-nr15-s(o)c、-(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基、-(cr11r12)e(4-10)元杂环基、-(cr11r12)f(c=o)(cr11r12)e(c6-c10)芳基、-(cr11r12)f(c=o)(cr11r12)e(4-10)元杂环基、-(cr11r12)eo(cr11r12)f(c6-c10)芳基、-(cr11r12)eo(cr11r12)f(4-10)元杂环基、-(cr11r12)fs(o)d(cr11r12)e(c6-c10)芳基和-(cr11r12)fs(o)d(cr11r12)e(4-10)元杂环基;
前述r14的(c1-c6)烷基、(3-10)元环烷基、(c6-c10)芳基和(4-10)元杂环基的任何碳原子独立地被1-3个各自独立地选自以下的r16取代基任选取代:卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、(ch2)eoh、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-r15、-(c=o)-o-r11、-(c=o)-o-r15、-o-(c=o)-r11、-o-(c=o)-r15、-nr11(c=o)-r13、-(c=o)-nr11r12、-nr11r12和–nr11r15;
前述r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r14和r15的(4-10)元杂环基的任何氮原子独立地被以下任选取代:(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-o-r11、-(c=o)-nr11r12、-(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基、-(cr11r12)e(4-10)元杂环基、-(cr11r12)f(c=o)(cr11r12)e(c6-c10)芳基或-(cr11r12)f(c=o)(cr11r12)e(4-10)元杂环基;
r11、r12和r13各自独立地是h或(c1-c6)烷基;
r15是–(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基或–(cr11r12)e(4-10)元杂环基;
a和b各自独立地是1、2、3或4;
c是1或2;
d是0、1或2;且
e、f和g各自独立地是0、1、2、3、4或5。
在一些实施方案中,a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环酰胺环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在其它实施方案中,a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环脲环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在一些实施方案中,式i化合物是在c-3处携带(r)-构型的单一对映异构体,其中a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环酰胺环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在本文公开的主题的其它实施方案中,式i化合物是在c-3处携带(r)-构型的单一对映异构体,其中a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环脲环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
本文描述的主题的其它实施方案是选自以下的化合物或其药学上可接受的盐或水合物:
1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3-氟吡咯烷-2-酮;
2-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-2-氮杂双环[2.2.1]庚-3-酮;
1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)咪唑烷-2-酮;
(1r,4s)-2-((r)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-2-氮杂双环[2.2.1]庚-3-酮;
(r)-1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)咪唑烷-2-酮;
(r)-1-((r)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3-氟吡咯烷-2-酮;
(s)-1-((s)-3-(9h-咔唑-9-基)-2-羟基-2-甲基丙基)-3-氟吡咯烷-2-酮;
(r)-1-((r)-3-(9h-咔唑-9-基)-2-羟基丙基)-4-甲基咪唑烷-2-酮。
在另一个方面,本文所述的化合物调节cry1或cry2。cry1或cry2的调节包括以下中的任一种:与cry1或cry2结合;抑制cry1或cry2的修饰;改变cry1或cry2定位;提高或降低cry1或cry2稳定性;提高或降低cry1或cry2与目标之间的结合;提高或降低cry1或cry2活性;和提高或降低cry1或cry2目标的活性。cry1和/或cry2的目标包括但不限于per1、per2、糖皮质激素受体(gr)、clock、bmal1或clock-bmal1启动子序列。
在另一个方面,本文所述的主题提供包含式i化合物或其药学上可接受的盐或水合物和药学上可接受的载体、佐剂或稀释剂的药物组合物。在一些实施方案中,药物组合物进一步包含一种或多种额外治疗剂。额外治疗剂的实例包括,但不限于,dpp-iv抑制剂诸如西他列汀、阿格列汀、维格列汀、沙格列汀和利格列汀;glp-1激动剂诸如艾塞那肽、利拉鲁肽和阿必鲁肽;sglt2抑制剂诸如坎格列净、埃格列净和达格列净);二甲双胍和磺脲类诸如格列本脲。额外治疗剂的其它实例包括signifor®、酮康唑、甲吡酮、米托坦、依托咪酯、korlym®、表皮生长因子抑制剂、醛固酮合酶/11β-羟化酶抑制剂lci699和酮夫康唑(cor-003)。
在其它方面,提供通过向对象给药治疗有效量的本文所述的药物组合物而治疗对象中的cry介导的疾病或病症的方法。在一个进一步方面,本发明提供用于向对象给药治疗有效量的本文所述的药物组合物而减轻对象中的cry介导的疾病或病症的症状的方法。所述疾病或病症可选自糖尿病,糖尿病性并发症诸如糖尿病性神经病,糖尿病性视网膜病,糖尿病性肾病,白内障形成,青光眼,糖尿病性血管病,动脉粥样硬化;非酒精性脂肪性肝炎(nash);非酒精性脂肪性肝病(nafld);哮喘;慢性阻塞性肺病(copd);代谢综合征;胰岛素抵抗综合征;肥胖症;青光眼;库欣综合征;精神病性抑郁症;阿尔茨海默氏病(alzheimer’sdisease);神经性疼痛;药物滥用;骨质疏松症;癌症;黄斑变性;和肌病。
本文所述的任何方法还可以涉及将一种或多种额外治疗剂给药至所述对象。额外治疗剂的实例包括,但不限于,dpp-iv抑制剂诸如西他列汀、阿格列汀、维格列汀、沙格列汀和利格列汀;glp-1激动剂诸如艾塞那肽、利拉鲁肽和阿必鲁肽;sglt2抑制剂诸如坎格列净、埃格列净和达格列净);二甲双胍;磺脲类,诸如格列本脲;signifor®;酮康唑;甲吡酮;米托坦;依托咪酯;korlym®;表皮生长因子抑制剂;醛固酮合酶/11β-羟化酶抑制剂lci699;和酮夫康唑(cor-003)。
在另一个方面,提供监测对象中的cry介导的疾病或病症的进展或预后的方法,其涉及测量在第一时间段来自对象的第一样品中一种或多种隐花色素或隐花色素调节的基因的有效量;测量在第二时间段来自对象的第二样品中一种或多种隐花色素或隐花色素调节的基因的有效量;且将第一样品中检测的一种或多种隐花色素或隐花色素调节的基因的量与第二样品中检测的一种或多种隐花色素或隐花色素调节的基因的量或与参考值进行比较。隐花色素调节的基因的实例包括在其启动子中含有e-盒序列的基因。此类基因包括,但不限于,dbp、rev-erbα、rev-erbβ、rorα、rorβ、rorγ、per1、per2、per3、cry1、cry2、pck1、g6pc、avp、vip、cck、sp(物质p)、aa-nat、pk2(前移动结合蛋白2(prokinectin2))、c-myc、myod和nampt。
在一些实施方案中,所述监测包括评价对象中发生cry介导的疾病或病症的风险的变化。
用于人中给药的最佳时间预期为晚上,这对应于人cry表达的峰值和活性(白天)期的结束。
所述对象可包括针对cry介导的疾病或病症先前已进行治疗的对象、针对cry介导的疾病或病症先前未进行治疗的对象或先前未诊断患有cry介导的疾病或病症的对象。所述样品可以是全血、血清、血浆、血细胞、内皮细胞、组织活检样品、淋巴液、腹水液、间质液、骨髓、脑脊液(csf)、精液、唾液、粘液、痰、汗或尿液。
在一些实施方案中,第一样品在针对cry介导的疾病或病症进行治疗之前从对象获取,且第二样品在针对cry介导的疾病或病症进行治疗之后从对象获取。在其它实施方案中,所述对象用含有本文公开的式i化合物的药物组合物治疗。在某些实施方案中,所述监测进一步包括为对象选择治疗和/或监测针对cry介导的疾病或病症进行治疗的有效性,其中针对cry介导的疾病或病症的治疗包括手术干预、单独或与一种或多种额外治疗剂组合给药本文定义的药物组合物、在给药本文提供的药物组合物或与一种或多种额外治疗剂组合之后或之前进行手术干预,或不采取进一步行动。
在其它实施方案中,参考值包括指数值、衍生自一种或多种cry介导的疾病或病症风险预测算法的值、衍生自未患有cry介导的疾病或病症的对象的值或衍生自诊断患有cry介导的疾病或病症的对象的值。在一些实施方案中,所述测量包括检测一种或多种隐花色素的存在或不存在、定量一种或多种隐花色素的量、定性一种或多种隐花色素的类型并评价一种或多种隐花色素结合目标的能力。所述目标可以是per1、per2或clock-bmal1启动子序列。
如本文所公开,cry介导的疾病或病症可选自糖尿病,糖尿病性并发症诸如糖尿病性神经病,糖尿病性视网膜病,糖尿病性肾病,白内障形成,青光眼,糖尿病性血管病,动脉粥样硬化;非酒精性脂肪性肝炎(nash);非酒精性脂肪性肝病(nafld);哮喘;慢性阻塞性肺病(copd);代谢综合征;胰岛素抵抗综合征;肥胖症;青光眼;库欣综合征;精神病性抑郁症;阿尔茨海默氏病;神经性疼痛;药物滥用;骨质疏松症;癌症;黄斑变性;和肌病。
在一个实施方案中,在本文公开的式i化合物中,a、d、e、g、j、l、m和q是碳。在另一个实施方案中,在式i化合物中,r1和r2是氢。在还有其它实施方案中,在式i化合物中,r1和r2是氟,且a和b是1。在进一步实施方案中,在式i化合物中,r3和r5是氢。在另一个实施方案中,在式i化合物中,r3、r4和r5是氢。在一些实施方案中,在式i化合物中,r6和r7连接以形成任选取代的单环。
在其它实施方案中,在式i化合物中,r6和r7连接以形成任选取代的稠合二环、任选取代的桥连二环、任选取代的螺二环、任选取代的吡咯烷酮环、任选取代的咪唑烷酮环、任选取代的哌啶酮环和/或任选取代的嘧啶酮环。同样地,在这些实施方案的任一个中,由r6和r7形成的环可以仅仅被氟、甲基、乙基、异丙基、c3-6环烷烃或苯基取代。
除非另有定义,否则本文所使用的所有技术和科学术语具有本发明所属领域普通技术人员通常理解的相同含义。尽管类似于或等同于本文描述的方法与材料的那些方法与材料可用于本发明的实践,但下面描述了合适的方法与材料。本文提及的所有出版物、专利申请、专利和其它参考文献均通过引用以其整体明确并入。在冲突的情况下,以本说明书(包括定义)为准。此外,本文描述的材料、方法和实施例只是说明性的,并不意欲是限制性的。
本发明的其它特征和优势从以下详述和权利要求将是显而易见的。
附图简述
图1a-h是显示给药化合物72之后小鼠中的核心时钟基因表达的一系列图。在用媒介物(h2o)或化合物72处理的c57bl/6jdio(a、c、e、g)或balb/c(b、d、f、h)小鼠的肝脏中经24小时以六小时时间间隔测量核心时钟基因per2(a和b)、bmal1(c和d)、cry1(e和f)和cry2(g和h)的mrna表达。通过rt-qpcr测定转录物水平,并将其与媒介物在zt8处比较,其中黑暗周期加阴影。通过t-检验将来自每个时间点的化合物72处理者的mrna水平与媒介物进行比较:*<0.05,**<0.01,***<0.001,****<0.0001。
图2a-d是显示给药化合物72之后小鼠中的糖异生基因表达的一系列图。在用媒介物(h2o)或化合物72处理的c57bl/6jdio(a和c)或balb/c(b和d)小鼠的肝脏中经24小时以六小时时间间隔的糖异生基因pck1(pepck;a和b),g6pc(葡萄糖6-磷酸酶催化亚基;c和d)的mrna表达。通过rt-qpcr测定转录物水平,并将其与媒介物在zt8处比较,其中黑暗周期加阴影。通过t-检验将来自每个时间点的化合物72处理者的mrna水平与媒介物进行比较:*<0.05,**<0.01,***<0.001,****<0.0001。
图3a-c是显示给药化合物72、化合物48、化合物9或化合物57之后icr小鼠的肝脏中的核心时钟基因表达的一系列图。在用化合物72、化合物48、化合物9、化合物57或媒介物处理4天的icr小鼠的肝脏中测量核心时钟基因per2(a)、bmal1(b)和cry2(c)的mrna表达。通过rt-qpcr对最后zt0剂量之后在zt6获取的样品测定mrna的水平。通过t-检验将来自每个时间点的化合物72处理者的mrna水平与媒介物进行比较:*<0.05,**<0.01,***<0.001,****<0.0001。
图4是显示在cry1表达的峰值的化合物72的每日三次剂量之后dbp基因表达的图。在每日三次剂量的100mg/kg化合物72之后在来自db/db小鼠的全血中在zt7.5测量dbpmrna的表达。通过rt-qpcr测定转录物水平,并将其与来自在zt7.5媒介物(10%kolliphor)处理的小鼠的血液进行比较。通过t-检验将来自每次化合物处理的mrna水平与媒介物进行比较(***;p≤0.001)。
图5a-d是显示在cry1表达的峰值或最低点的单剂量的化合物72之后的核心时钟基因表达的一系列图。在单剂量的100mg/kg化合物72之后来自c57bl/6jdio小鼠的肝脏中在zt7.5(cry1表达的峰值)或zt17.5(cry1表达的最低点)测量核心时钟基因per2(a)、bmal1(b)、cry1(c)和cry2(d)的mrna表达。通过rt-qpcr测定转录物水平,并将其与来自媒介物(10%kolliphor)处理者的肝脏进行比较。通过t-检验将来自每个时间点的化合物72处理者的mrna水平与媒介物进行比较:*<0.05,**<0.01,***<0.001,****<0.0001。
图6是显示化合物72对db/db小鼠中的口服葡萄糖耐量测试(ogtt)的影响的一系列图。在cry1和bmal1基因表达的峰值(zt0)(a)或最低点(zt10)(b)作为单剂量给药化合物72(50mg/kg,po)或10%kolliphor(对照)。
图7是显示化合物72对db/db小鼠中的葡萄糖曲线下面积(auc)的影响的图。在cry1和bmal1基因表达的峰值(zt0)作为单剂量给药化合物72(50mg/kg,po)或10%kolliphor(对照)。
图8a-c是显示给药7天的化合物72对db/db小鼠中的葡萄糖代谢的影响的一系列图。将化合物72(50mg/kg,po)或10%kolliphor(对照)给药7天。a)空腹血糖水平;b)口服葡萄糖耐量测试(ogtt);c)葡萄糖auc。
图9a-b是显示给药7天的化合物72对db/db小鼠中的胰岛素水平的影响的一系列图。给药化合物72(50mg/kg,po)或10%kolliphor(对照)。a)葡萄糖负载之前(在0h)和之后(在2h)的胰岛素水平;b)稳态模型估计评估的胰岛素抵抗(homa-ir)。
图10是显示在给药最后剂量(50mg/kg,po)后约8小时血浆和肝脏中测量的化合物72的化合物水平的图。在图上通过虚线指定per2测定中化合物72的ec50浓度。
图11a-c是显示递增剂量的化合物72(10mg/kg,50mg/kg和100mg/kg)对db/db小鼠中的葡萄糖代谢的影响的一系列图。10%kolliphor用作媒介物对照。a)空腹血糖水平;b)ogtt;c)葡萄糖auc。
图12a-b是显示递增剂量的化合物72(10mg/kg,50mg/kg和100mg/kg)对db/db小鼠中的胰岛素水平的影响的一系列图。10%kolliphor用作媒介物对照。a)葡萄糖负载之前(在0h)和之后(在2h)的胰岛素水平;b)稳态模型估计评估的胰岛素抵抗(homa-ir)。
图13是显示在以递增剂量(10mg/kg,50mg/kg和100mg/kg)给药最后剂量之后约8小时血浆和肝脏中测量的化合物72的化合物水平的图。在图上通过虚线指定per2测定中化合物72的ec50浓度。
图14a-c是显示递增剂量的化合物9(30mg/kg,100mg/kg和300mg/kg)对db/db小鼠中的葡萄糖代谢的影响的一系列图。10%kolliphor用作对照。a)空腹血糖水平;b)ogtt;c)葡萄糖auc。
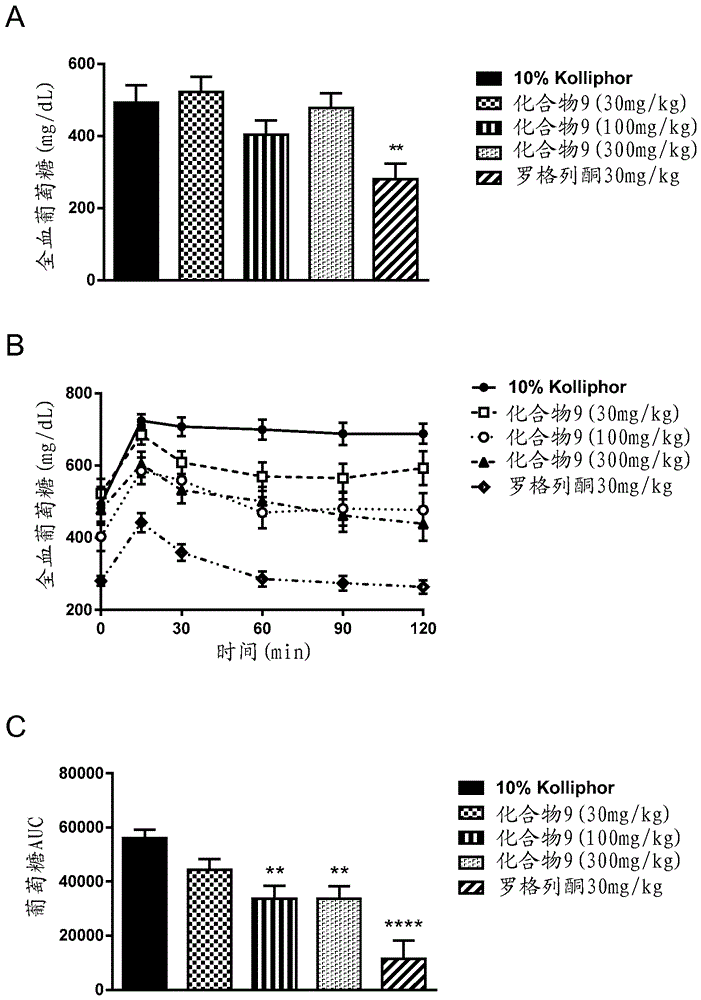
图15a-b是显示不同剂量的化合物9(30mg/kg,100mg/kg和300mg/kg)对db/db小鼠中的胰岛素水平的影响的一系列图。10%kolliphor用作对照。a)葡萄糖负载之前(在0h)和之后(在2h)的胰岛素水平;b)稳态模型估计评估的胰岛素抵抗(homa-ir)。
图16是显示在以递增剂量(30mg/kg,100mg/kg和300mg/kg)给药最后剂量之后约8小时血浆和肝脏中的化合物9的化合物水平的图。在图上通过虚线指定per2测定中化合物9的ec50浓度。
图17a-c是显示化合物72对c57/bl6jdio小鼠中的葡萄糖代谢的影响的图。将化合物72(100mg/kg,po)、10%kolliphor(对照)或罗格列酮(30mg/kg)给药7天。a)空腹血糖水平;b)ogtt;c)葡萄糖auc。
图18a-b是显示化合物72对c57/bl6jdio小鼠中的胰岛素水平的影响的一系列图。将化合物72(100mg/kg,po)、10%kolliphor(对照)或罗格列酮(30mg/kg)给药7天。a)葡萄糖负载之前(在0h)和之后(在2h)的胰岛素水平;b)稳态模型估计评估的胰岛素抵抗(homa-ir)。
图19是显示化合物72对皮质酮诱导的胰岛素抵抗的大鼠模型的影响的一系列图。将皮质酮(30mg/kg,sc)与媒介物、化合物72(50mg/kg,po)或米非司酮(30mg/kg,po)一起给药7天。(a)空腹血浆葡萄糖水平和(b)空腹血浆胰岛素水平。
图20是显示给药7天的化合物72(50mg/kg,po)对皮质酮诱导的胰岛素抵抗的大鼠模型中的homa-ir的影响的图。将皮质酮(30mg/kg,sc)与媒介物、化合物72(50mg/kg,po)或米非司酮(30mg/kg,po)一起给药7天。
图21是显示化合物72对cry1fad结合结构域的体外热稳定性的影响的图。用化合物72处理纯化的cry1fad结合结构域引起蛋白熔化温度的剂量依赖性增加,如通过差示扫描荧光测定(‘热偏移’)测定法所测定。
图22a-c是显示递增剂量的化合物72(10mg/kg,30mg/kg和100mg/kg)对dio小鼠中的葡萄糖代谢的影响的一系列图。将化合物72(100mg/kg,po)、10%kolliphor(对照)或罗格列酮(30mg/kg)给药7天。a)空腹血糖水平;b)ogtt;c)葡萄糖auc。
详述
本文中引用的每个申请和专利以及每个申请和专利中引用的每个文献或参考文献(包括在各已公开专利的审查期间;“申请引用的文献”),以及对应于和/或要求这些申请和专利中任一个的优先权的各个美国和外国的申请或专利,以及所述各个申请引用的文献中引用或参考的各个文献,都通过引用明确并入本文。更一般而言,在本文中(在权利要求书前的参考文献列表中或在文本本身中)引用了文献或参考文献;并且这些文献或参考文献(“本文引用的参考文献”)的每一个,以及本文引用的参考文献中引用的每个文献或参考文献(包括任何制造商说明书、用法说明等),均通过引用明确并入本文。通过引用并入本文的文献可用于本发明的实践中。整个本说明书中描述的特征、结构或特性可在一个或多个实施方案中以任何合适的方式组合。例如,整个本说明书中,短语“示例性实施方案”、“实例性实施方案”、“一些实施方案”或其它类似用语的使用是指结合一个实施方案描述的具体特征、结构或特性可包括在本文所述的至少一个实施方案中的事实。因此,整个本说明书中,短语“示例性实施方案”、“实例性实施方案”、“在一些实施方案中”、“在其它实施方案中”或其它类似用语的出现,不必都是指实施方案的相同组别,并且所述特征、结构或特性可在一个或多个实施方案中以任何合适的方式组合。
为了便于理解本公开内容,下面定义了许多术语。本文定义的术语具有本文所述主题相关领域普通技术人员通常理解的含义。术语例如“一个/种(a)”、“一个/种(an)”和“该(the)”并非是仅仅是指单数实体,而是包括可用于举例说明的具体实例的一般类别。除如权利要求中所概述以外,本文术语用于描述本文所述主题的具体实施方案,但它们的使用并不为该主题划定界限。
如本文所使用的术语“包含”、“包括”或“具有”以其开放式、非限制性意义使用。
除非另有说明,否则如本文所使用的术语“卤素”意指氟、氯、溴或碘。
除非另有说明,否则如本文所使用的术语“烷基”包括具有直链或支链部分的饱和一价烃基。
除非另有说明,否则如本文所使用的术语“烯基”表示含有一个或多个碳-碳双键的2-6个碳的一价直链或支链基团,并且其实例为乙烯基、1-丙烯基、2-丙烯基、2-甲基-1-丙烯基、1-丁烯基、2-丁烯基等。
如本文所使用的术语“炔基”表示含有碳-碳三键的2-6个碳原子的一价直链或支链基团,并且其实例为乙炔基、1-丙炔基等。
除非另有说明,否则如本文所使用的术语“烷氧基”包括o-烷基,其中烷基如上文定义。
术语“me”意指甲基,且“et”意指乙基。
除非另有说明,否则如本文所使用的术语“环烷基”是指本文所指的含有总共3-10个碳原子的非芳族的、饱和或部分饱和的单环或稠合、螺环或未稠合的二环或三环烃。环烷基的说明性实例衍生自,但不限于,以下:
除非另有说明,否则如本文所使用的术语“芳基”包括通过去除一个氢而衍生自芳族烃的有机基团,诸如苯基或萘基。
除非另有说明,否则如本文所使用的术语“(4-12)元杂环基”包括含有1-4个各自选自o、s和n的杂原子的芳族和非芳族杂环基,其中每个杂环基团在其环体系中具有4-12个原子,且前提条件是所述基团的环不含2个邻接的o或s原子。非芳族杂环基团包括在其环体系中只有3个原子的基团,但是芳族杂环基在其环体系中必须具有至少5个原子。杂环基团包括苯并稠合环体系。3元杂环基团的实例为氮杂环丙烷,4元环杂环基团的实例为氮杂环丁烷基(衍生自氮杂环丁烷)。5元杂环基团的实例为噻唑基,7元环的实例为氮杂
如本文所使用的术语“取代的”意指指定原子上的任一个或多个氢原子被来自所示基团的选定基团置换,条件是不超过指定原子的常价,且该取代导致产生稳定的化合物。当取代基为酮(即=o)时,则该原子上的2个氢原子被置换。酮取代基不存在于芳族部分上。如本文所使用,环双键是两个相邻的环原子之间形成的双键(例如c=c、c=n或n=n)。此类基团的非限制性实例包括而不限于h、ch3、no2、so2n(ch3)2、so2n((ch3)so2)、cooh、cooch3、co(n(ch3))、烷基、烯基、炔基、芳基、芳烷基、环烷基、杂环基、烷基芳基、杂芳基、杂环烷基、烷氧基(即甲氧基、乙氧基等)、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸酯基、烷基羰基、烷基氨基羰基、芳烷基氨基羰基、烯基氨基羰基、烷基羰基、芳基羰基、芳烷基羰基、烯基羰基、烷氧基羰基、氨基羰基、烷基硫基羰基、三氟甲基、五氟乙基、卤素(即氯、氟、溴、碘)、氰基、硫基、酰氨基、醚、酯、羟基、羟基烷基、饱和或不饱和脂肪酸、叠氮基、膦酰基氨基(phosphonamido)、磺酰胺基、内酰胺、磷酸酯基、膦酸酯基(phosphonato)、亚膦酸酯基(phosphinato)、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰基氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、胍基、巯基、烷基硫基、芳基硫基、硫代羧酸酯基、硫酸酯基、烷基亚硫酰基、磺酸酯基(sulfonato)、氨基磺酰基、磺酰胺基、硝基、氰基、叠氮基等。
本文公开的主题提供调节一种或多种隐花色素分子的含有咔唑的磺酰胺化合物。这些化合物具有下式i中所示的通用结构:
或其药学上可接受的盐或水合物,其中
a、d、e、g、j、l、m和q各自独立地是n或c;
当a、d、e、g、j、l、m和q是c时,r1和r2各自独立地选自h、卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、羟基、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-o-(c=o)-r8、-nr8(c=o)-r10、-(c=o)-nr8r9、-nr8r9、-nr8or9、-s(o)cnr8r9、-s(o)d(c1-c8)烷基、-o-so2-r8、nr8-s(o)c、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-(cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
r3和r5各自独立地选自h、氰基、-cf3、-chf2、-ch2f、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-(c=o)-nr8r9、-s(o)cnr8r9、-s(o)d(c1-c8)烷基、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-(cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
r3基团的每一个任选彼此连接作为4-12元单环或二环;
r5基团的每一个任选彼此连接作为4-12元单环或二环;
r4是h、-cf3、-chf2、-ch2f、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r8、-(c=o)-o-r8、-(c=o)-nr8r9、-(cr8r9)d(3-10)元环烷基、-(cr8r9)e(c6-c10)芳基、-(cr8r9)e(4-10)元杂环基、-(cr8r9)f(c=o)(cr8r9)e(c6-c10)芳基、-(cr8r9)f(c=o)(cr8r9)e(4-10)元杂环基、-(cr8r9)eo(cr8r9)f(c6-c10)芳基、-(cr8r9)eo(cr8r9)f(4-10)元杂环基、-cr8r9)fs(o)d(cr8r9)e(c6-c10)芳基和–(cr8r9)fs(o)d(cr8r9)e(4-10)元杂环基;
其中r6和r7彼此连接作为4-12元单环或二环;
r8、r9和r10各自独立地选自h、(c1-c6)烷基、-(cr11r12)e(3-10)元环烷基、-(cr11r12)g(c6-c10)芳基和-(cr11r12)g(4-10)元杂环基;
前述r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15和r16的(c1-c6)烷基、(3-10)元环烷基、(c6-c10)芳基和(4-10)元杂环基的任何碳原子独立地被1-3个各自独立地选自以下的r14取代基任选取代:卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、羟基、-o-r15、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-r15、-(c=o)-o-r11、-(c=o)-o-r15、-o-(c=o)-r11、-o-(c=o)-r15、-nr11(c=o)-r13、-(c=o)-nr11r12、-(c=o)-nr11r15、-nr11r12、-nr11r15、-nr11or12、-nr11or15、-s(o)cnr11r12、-s(o)cnr11r15、-s(o)d(c1-c6)烷基、-s(o)dr15、-o-so2-r11、-o-so2-r15、-nr11-s(o)c、-nr15-s(o)c、-(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基、-(cr11r12)e(4-10)元杂环基、-(cr11r12)f(c=o)(cr11r12)e(c6-c10)芳基、-(cr11r12)f(c=o)(cr11r12)e(4-10)元杂环基、-(cr11r12)eo(cr11r12)f(c6-c10)芳基、-(cr11r12)eo(cr11r12)f(4-10)元杂环基、-(cr11r12)fs(o)d(cr11r12)e(c6-c10)芳基和-(cr11r12)fs(o)d(cr11r12)e(4-10)元杂环基;
前述r14的(c1-c6)烷基、(3-10)元环烷基、(c6-c10)芳基和(4-10)元杂环基的任何碳原子独立地被1-3个各自独立地选自以下的r16取代基任选取代:卤素、氰基、硝基、-cf3、-chf2、-ch2f、三氟甲氧基、叠氮基、(ch2)eoh、(c1-c6)烷氧基、(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-r15、-(c=o)-o-r11、-(c=o)-o-r15、-o-(c=o)-r11、-o-(c=o)-r15、-nr11(c=o)-r13、-(c=o)-nr11r12、-nr11r12和–nr11r15;
前述r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r14和r15的(4-10)元杂环基的任何氮原子独立地被以下任选取代:(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、-(c=o)-r11、-(c=o)-o-r11、-(c=o)-nr11r12、-(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基、-(cr11r12)e(4-10)元杂环基、-(cr11r12)f(c=o)(cr11r12)e(c6-c10)芳基或-(cr11r12)f(c=o)(cr11r12)e(4-10)元杂环基;
r11、r12和r13各自独立地是h或(c1-c6)烷基;
r15是–(cr11r12)e(3-10)元环烷基、-(cr11r12)e(c6-c10)芳基或–(cr11r12)e(4-10)元杂环基;
a和b各自独立地是1、2、3或4;
c是1或2;
d是0、1或2;且
e、f和g各自独立地为0、1、2、3、4或5。
在式i化合物的示例性实施方案中,a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环酰胺环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在一些实施方案中,a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环脲环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在本文公开的主题的一些实施方案中,式i化合物是在c-3处携带(r)-构型的单一对映异构体,其中a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环酰胺环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在其它实施方案中,式i化合物是在c-3处携带(s)-构型的单一对映异构体,其中a、d、e、g、j、l、m和q各自为c;r1和r2各自独立地选自h或卤素;r4是h或(c1-c6)烷基;r3和r5是h;r6和r7彼此连接作为4-12元单环或二环脲环;r8、r9、r10、r11、r12、r13、r14、r15、r16、a、b、c、d、e和f如本文所定义。
在某些实施方案中,化合物可选自:
1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3-氟吡咯烷-2-酮;
2-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-2-氮杂双环[2.2.1]庚-3-酮;
1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)咪唑烷-2-酮;
(1r,4s)-2-((r)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-2-氮杂双环[2.2.1]庚-3-酮;
(r)-1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)咪唑烷-2-酮;
(r)-1-((r)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3-氟吡咯烷-2-酮;
(s)-1-((s)-3-(9h-咔唑-9-基)-2-羟基-2-甲基丙基)-3-氟吡咯烷-2-酮;
(r)-1-((r)-3-(9h-咔唑-9-基)-2-羟基丙基)-4-甲基咪唑烷-2-酮;或其药学上可接受的盐或水合物。
如本文所使用的术语“药学上可接受的”是指材料,诸如载体或稀释剂等,其不消除本文所述化合物的生物活性或性质,并且是相对无毒的,即所述材料可给药至个体而不引起不良的生物作用或以有害方式与含有其的组合物的任何组分相互作用。
如本文所使用的术语“药学上可接受的盐”是指保留指定化合物的游离酸和碱的生物有效性并且不是在生物学上或其它方面不期望的盐。式i化合物的药学上可接受的盐包括其酸加成盐和碱盐。合适的酸加成盐由形成无毒盐的酸形成。实例包括乙酸盐、己二酸盐、阿半乳聚糖磺酸盐、抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、硼酸盐、樟脑磺酸盐、胆酸盐、柠檬酸盐、乙二磺酸盐、依托酸盐、乙磺酸盐、甲酸盐、富马酸盐、半乳糖醛酸盐、葡庚糖酸盐、葡糖酸盐、葡萄糖醛酸盐、谷氨酸盐、六氟磷酸盐、海苯酸盐、马尿酸盐、盐酸盐/氯化物、氢溴酸盐/溴化物、氢碘酸盐/碘化物、3-羟基-2-萘甲酸盐、1-羟基-2-萘甲酸盐、依西酸盐、乳酸盐、乳糖酸盐、苹果酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、甲基硫酸盐、粘酸盐、萘二磺酸盐、萘二甲酸盐(naphthalate)、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、乳清酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、磷酸盐/磷酸氢盐/磷酸二氢盐、糖二酸盐、水杨酸盐、硬脂酸盐、琥珀酸盐、磺基水杨酸盐、酒石酸盐、甲苯磺酸盐、三氟乙酸盐和色氨酸盐。
合适的碱盐由形成无毒盐的碱形成。实例包括腺嘌呤、铝、2-氨基-2-甲基丙-1-醇、精氨酸、苯乙苄胺、苄星(benzathine)、钙、胆碱、胞嘧啶、二乙胺、二乙醇胺、吡咯乙醇、特丁胺、乙二胺、氨基葡萄糖、甘氨酸、胍、鸟嘌呤、海巴明(hydrabamine)、赖氨酸、镁、葡甲胺、吗啉、烟酰胺、乙醇胺、鸟氨酸、哌嗪、钾、普鲁卡因、脯氨酸、吡哆醇、丝氨酸、银、钠、三乙醇胺、氨丁三醇、酪氨酸、缬氨酸和锌盐。关于合适盐的综述,参见“handbookofpharmaceuticalsalts:properties,selection,anduse”,stahl和wermuth(wiley-vch,weinheim,germany,2002)。
适当时,可通过将式i化合物的溶液和期望的酸或碱混合在一起,容易地制备式i化合物的药学上可接受的盐。盐可从溶液中沉淀,并通过过滤收集或可通过蒸发溶剂来回收。盐中的电离度可从完全电离到几乎非电离而变化。
式i化合物还可以各种晶型存在,称为多晶型物。多晶型物包括相同元素组成的化合物的不同晶格堆积排列。多晶型物可具有不同的x射线衍射图案、红外光谱、熔点、密度、硬度、晶形、光学和电学性质、稳定性、溶剂合物和溶解度。各种因素诸如重结晶溶剂、结晶速率和储存温度可引起单一晶型占主导。
“溶剂合物”意指指定化合物的药学上可接受的溶剂合物,其保留此类化合物的生物有效性。溶剂合物的实例包括本发明的化合物与水、异丙醇、乙醇、甲醇、二甲亚砜、乙酸乙酯、乙酸或乙醇胺的组合。术语“水合物”是指其中所述溶剂是水的溶剂合物。术语“醇化物”是指其中所述溶剂是醇的溶剂合物。水合物由一个或多个水分子与一个物质分子的组合而形成,其中水保留其作为h2o的分子状态。水合物的非限制性实例包括一水合物、二水合物等。
本发明的化合物包括如本文所定义的式i化合物、其多晶型物、前药和异构体(包括光学、几何和互变异构体)以及同位素标记的式i化合物。
本发明的化合物可作为前药给药。因此当给药至机体中或机体上时,式i化合物的某些衍生物(其本身可能几乎没有或没有药理活性)可例如通过水解裂解转化为具有期望活性的式i化合物。此类衍生物称为“前药”。关于前药使用的更多信息可见于“pro-drugsasnoveldeliverysystems,第14卷,acssymposiumseries(t.higuchi和w.stella)和“bioreversiblecarriersindrugdesign”,pergamonpress,1987(编辑e.b.roche,americanpharmaceuticalassociation)。可如例如h.bundgaard的“designofprodrugs”(elsevier,1985)中所述,可例如通过用本领域技术人员已知为‘前药部分’的某些部分置换存在于式i化合物中的合适官能团来产生前药。
此类前药的一些实例包括其中式i化合物含有羧酸官能团(-co2h)、其酯(例如氢被(c1-c8)烷基置换);其中式i化合物含有醇官能团(-oh)、其醚(例如氢被(c1-c8)烷酰基氧基甲基置换);且其中式i化合物含有仲氨基官能团(-nhr,其中r不是h)、其酰胺(例如一个氢被(c1-c10)烷酰基置换)。根据前述实例和其它前药类型的实例的置换基团的其它实例是本领域普通技术人员已知的。
式i化合物含有一个或多个不对称碳原子。应理解,对应于式i化合物的所有对映异构体和/或非对映异构体可通过类似方法制备。式i化合物的所有旋光异构体和立体异构体及其混合物都被视为在本发明的范围内。就式i化合物而言,本发明包括外消旋体、一种或多种对映异构体形式、一种或多种非对映异构体形式或其混合物的使用。式i化合物还可作为互变异构体存在。本发明涉及所有此类互变异构体及其混合物的使用。
本发明的化合物内含有的某些官能团可取代为生物等排基团,即,具有与母体基团类似的空间或电子要求,但展现不同或改进的物理化学或其它性质的基团。合适的实例是本领域技术人员众所周知的,并且包括但不限于描述于以下中描述的部分:patini等人,chemrev.1996,96,3147-3176和其中引用的参考文献。
请求保护的式i化合物的范围内包括药学上可接受的酸加成盐或碱盐,其中抗衡离子是旋光性的(例如d-乳酸盐或l-赖氨酸),或外消旋的(例如dl-酒石酸盐或dl-精氨酸)。可通过本领域技术人员众所周知的常规技术(例如色谱法和分级结晶)来分离顺/反异构体。用于制备/分离各个对映异构体的常规技术包括由合适的旋光纯的前体手性合成或使用例如手性高压液相色谱法(hplc)拆分外消旋体(或盐或衍生物的外消旋体)。
或者,外消旋体(或外消旋体前体)可与合适的旋光化合物(例如醇)反应或在其中式i化合物含有酸性或碱性部分的情况下,与酸或碱(诸如酒石酸或1-苯乙胺)反应。所得非对映异构体混合物可通过色谱法和/或分级结晶分离,并且非对映异构体通过技术人员众所周知的方法转化为相应的纯的对映异构体和/或非对映异构体。可使用色谱法(通常为hplc),在不对称树脂上,用由含有0-50%异丙醇(通常2-20%)和0-5%烷基胺(通常0.1%二乙胺)的烃(通常为庚烷或己烷)组成的流动相,获得对映异构体富集形式和/或非对映异构体富集形式的本发明的手性化合物(及其手性前体)。洗脱液的浓缩提供富集的混合物。对映异构体和/或非对映异构体的混合物可通过本领域技术人员已知的常规技术分离。参见例如e.l.eliel的“stereochemistryoforganiccompounds”(wiley,newyork,1994)。
式i化合物可以是同位素标记的,其中一个或多个原子被具有相同原子序数、但原子质量或质量数不同于通常存在于自然界中的原子质量或质量数的原子置换。适于包含入本发明化合物的同位素的实例包括氢的同位素,诸如2h和3h;碳,诸如11c、13c和14c;氯,诸如36cl;氟,诸如18f;碘,诸如123i和125i;氮,诸如13n和15n,氧,诸如15o、17o和18o;磷,诸如32p;以及硫,诸如35s。某些同位素标记的式i化合物,例如并入放射性同位素的式i化合物,可用于药物和/或底物(substrate)组织分布研究。放射性同位素氚(即3h)和碳-14(即14c)鉴于其容易并入和检测方法即用,特别可用于该目的。用较重同位素诸如氘(即2h)取代,可提供由较大代谢稳定性导致的某些治疗优势,例如体内半衰期延长或剂量要求降低,因此在一些情况下可能是优选的。用正电子发射同位素(诸如11c、18f、15o和13n)的取代,可用于正电子发射成像术(pet)研究用于检查底物受体占据。通常可通过本领域技术人员已知的常规技术或通过类似于随附实施例和制备例中描述的方法,使用适当的同位素标记的试剂替换先前采用的未标记的试剂,来制备同位素标记的式i化合物。
本发明的化合物调节cry1和/或cry2。如本文所使用,“调节”是指提高、降低或改变cry1和cry2功能、活性或内在特征。cry1或cry2的调节包括以下的任一种:与cry1或cry2结合;抑制cry1或cry2的修饰;改变cry1或cry2定位;提高或降低cry1或cry2稳定性;提高或降低cry1或cry2与目标之间的结合;提高或降低cry1或cry2活性;和提高或降低cry1或cry2目标的活性。
cry1和cry2的调节包括本发明的化合物通过直接相互作用或间接相互作用与cry1和/或cry2的结合。在一些方面,本发明的化合物可结合含有cry1和/或cry2的复合物。用于检测小分子和蛋白之间的相互作用的方法是本领域已知的,例如免疫沉淀技术、色谱法和各种阵列形式。
cry1和cry2的内在特性,诸如翻译后修饰、稳定性或定位可被本发明的化合物改变。cry1和cry2的翻译后修饰可在测定cry1和cry2的活性、稳定性或细胞定位中起关键作用。一些研究已显示,磷酸化可改变cry1和cry2稳定性。本发明的化合物可阻止或增加cry1和cry2的翻译后修饰,例如磷酸化、泛素化、乙酰化、糖基化、核糖基化或苏素化。
本领域技术人员可容易地进行用于检测cry1或cry2的翻译后修饰的方法。此类检测方法包括western印迹和放射免疫测定法。在特定条件下,例如在与per1和per2异源二聚化后,cry1和cry2定位至核。一旦在核内,cry1和cry2就在以下中起作用:破坏核clock-bmal1复合物免于起始转录,由此下调负反馈环中的昼夜节律基因,所述负反馈环对维持昼夜摆动是决定性的。本领域人员可通过例如免疫荧光、亚细胞分级分离和western印迹测定法容易地确定蛋白的定位。cry1和cry2的下调对于昼夜摆动也是决定性的,并在转录和蛋白水平上受介导。cry1和cry2稳定性可通过本领域已知的方法以及实施例5-8中呈现的方法来测量。
如本文所使用,cry1和cry2活性,包括cry1或cry2与目标之间的结合和下游cry1或cry2目标的活性。本发明的化合物可提高或降低cry1或cry2与目标之间的结合。与cry1和/或cry2结合的目标是本领域已知的,并且包括per1、per2、糖皮质激素受体、clock-bmal1启动子序列和vegf启动子序列。其它目标包括其表达受cry1或cry2调节的基因,包括在其启动子中含有e-盒序列的基因。此类基因包括而不限于dbp、rev-erbα、rev-erbβ、rorα、rorβ、rorγ、per1、per2、per3、cry1、cry2、pck1、g6pc、avp、vip、cck、sp(物质p)、aa-nat、pk2(前移动结合蛋白2(prokinectin2))、c-myc、myod和nampt。本文提及的cry1和cry2目标还包括尚待鉴定中的那些目标。
可通过例如免疫沉淀法、酵母双杂交、亲和色谱法来测定cry1或cry2和目标之间的结合。cry1或cry2目标的下游活性包括clock-bmal1介导的转录、cry1或cry2与clock-bmal-1启动子的结合、cry1或cry2与vegf启动子的结合、per1或per2定位或稳定性、clock-bmal1二聚化、clock-bmal1目标基因诸如cry1、cry2、per1、per2、rev-erbα和β、rora、tim蛋白和vegf的表达。可通过染色质免疫沉淀法、电泳迁移率变动分析或如实施例3和4中所述的启动子-荧光素酶测定法,来确定用于检测启动子活性的方法。用于测定目标基因的表达的方法包括本领域普通技术人员可容易地进行的基因表达分析和微阵列。
在一些实施方案中,用于确定推定效力的方法或测定法可用于鉴定适用于治疗或缓解cry介导的疾病或病症的症状的本文所述的那些的具体化合物。在一个方面,可以在测量化合物对核心时钟基因表达的影响的体外测定法中测定化合物诱导在指定暴露时间之后基线和最大值之间一半反应的浓度(在本文中称为ec50值或浓度)。将与核心时钟基因启动子序列(即,per1、per2、cry1、cry2或bmal1)可操作连接的荧光素酶报道子(reporter)引入细胞(即,转染、转导、感染),所述细胞用本发明的化合物处理,并随时间测量发光(或时钟基因驱动的表达)。具体地,确定相比于与昼夜节律相关的预期表达的发光的周期、幅度和相位。可以使用本领域技术人员容易获得的方法计算化合物的ec50值。此类测定的一个实例在本文中描述于实施例3中。ec50值可用于评价本发明化合物的效力。
在其它方面,可以通过体内测定法来测定具有增加效力的本发明化合物。将所述化合物给药至对象(即,小鼠模型)一段时间。从对象分离生物样品,并测量生物样品中存在的化合物的浓度水平。所述生物样品是,例如,全血或其任何级分(即,血清或血浆),或组织,诸如受cry介导的疾病或病症影响的组织。将处理的对象的样品中检测的浓度与相同化合物的ec50浓度值进行比较,如在相关的体外测定法中所测试(如上文和实施例3中所述)。测量的体内化合物浓度大于测定的ec50值的化合物是本发明优选的化合物。这些优选的化合物可以表明用于治疗或缓解cry介导的疾病或病症的症状的增加效力。
在本文公开的主题的其它方面,提供包含根据式i的化合物和药学上可接受的载体、佐剂或稀释剂的药物组合物。制备具有特定量的活性化合物的各种药物组合物的方法是本领域技术人员已知或显而易见的。此外,本领域普通技术人员熟悉配制和给药技术。此类专题讨论于例如goodman和gilman的“thepharmaceuticalbasisoftherapeutics”,现行版,pergamonpress;以及“remington’spharmaceuticalsciences”,现行版,mackpublishing,co.,easton,pa。这些技术可应用于本文所述的方法和组合物的适当方面和实施方案中。药物组合物优选在gmp条件下制备。提供下列实施例仅用于说明性目的,不意在充当本发明的限制。
因为本文所述的化合物意欲用于药物组合物中,所以容易理解它们优选各自以基本纯的形式提供,例如纯度至少50%、纯度至少55%、纯度至少60%、纯度至少65%、纯度至少70%、纯度至少75%、纯度至少80%、纯度至少85%、至少90%、纯度至少95%、纯度至少96%、纯度至少97%、纯度至少98%或纯度至少99%。如本文提供的百分比基于重量对重量。化合物的不纯制备物可用于制备用于药物组合物中的更纯的形式;这些不太纯的化合物的制备物应含有至少1%、更合适至少5%,例如10-49%的式i化合物。
式i化合物可以合适的局部、经口、经鼻、经眼、粘膜、直肠、阴道和胃肠外药物制剂提供用于治疗cry介导的疾病。可作为片剂或胶囊剂、作为油性或水性混悬剂、锭剂、糖锭剂、散剂、颗粒剂、乳剂、糖浆剂或酏剂经口给药本发明的化合物。经口使用的组合物可包含用于调味、增甜、着色和保存的一种或多种试剂,以产生药学上精致和适口的制备物。片剂可含有药学上可接受的赋形剂、载体、稀释剂和佐剂作为制备此类片剂中的辅助手段。如本领域常规的,这些片剂可用药学上可接受的肠溶包衣(诸如单硬脂酸甘油酯或二硬脂酸甘油酯)进行包衣,以延迟在胃肠道的崩解和吸收,以便经较长时段提供持续作用。可通过使用喷雾干燥的分散体,诸如takeuchi,h.等人,j.pharm.pharmacol.1987,39,769-773描述的分散体,来增强水溶性差的化合物的溶解速率。
口服用制剂可为硬明胶胶囊剂的形式,其中将活性成分与惰性固体稀释剂(例如碳酸钙、磷酸钙或高岭土)混合。它们也可为软明胶胶囊剂的形式,其中将活性成分与水或油介质(诸如花生油、液体石蜡或橄榄油)混合。
水性混悬剂通常含有与适于制备水性混悬剂的赋形剂混合的活性成分。此类赋形剂可为助悬剂,诸如kolliphor、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、藻酸钠、聚乙烯吡咯烷酮、黄蓍胶和阿拉伯树胶(gumacacia);分散剂或润湿剂,其可为天然存在的磷脂(诸如卵磷脂)、环氧乙烷和长链脂肪酸的缩合产物(例如聚氧乙烯硬脂酸酯)、环氧乙烷和长链脂族醇的缩合产物(诸如十七碳亚乙基氧基十六醇)、环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物(例如聚氧乙烯山梨醇单油酸酯)或环氧乙烷脂肪酸己糖醇酐的缩合产物(诸如聚氧乙烯山梨醇酐单油酸酯)。
药物组合物可为无菌可注射水性或油性混悬剂的形式。该混悬剂可根据已知方法配制为水性等渗溶液剂或混悬剂,并且可由脂肪乳剂或混悬剂制备栓剂。组合物可进行灭菌和/或含有佐剂,诸如防腐剂、稳定剂、润湿剂或乳化剂、溶液促进剂、用于调节渗透压的盐和/或缓冲剂。此外,它们还可含有其它治疗上有价值的物质。无菌可注射制备物还可配制为无毒素胃肠外可接受的稀释剂或溶剂中的混悬剂,例如配制为1,3-丁二醇中的溶液剂。可采用的可接受的媒介物和溶剂为水、林格氏溶液和等渗氯化钠溶液。为了该目的,可采用任何温和的固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸(诸如油酸)可用于制备可注射剂。
对于药物的直肠给药,式i化合物还可以栓剂形式给药。这些组合物可通过将药物与合适的无刺激性的赋形剂混合来制备,所述赋形剂在约25℃下是固体,但在直肠温度下是液体,因此将在直肠中融化以释放药物。此类材料包括可可脂和其它甘油酯。
对于局部或经皮使用制备物,例如采用含有本发明化合物的乳膏剂、软膏剂、胶状剂、溶液剂或混悬剂。用于经皮给药的合适制剂包含有效量的本发明化合物与载体。载体可包括可吸收的药理学上可接受的溶剂以有助于穿过宿主的皮肤。例如,经皮装置为以下形式:包含衬垫件(backingmember)的绷带、含有化合物(任选与载体)的储库(reservoir)、任选速率控制屏障以便经延长时间段以受控和预定的速率将化合物递送至宿主皮肤以及将所述装置固定至皮肤的方式。还可使用基质经皮制剂和离子透入装置。用于局部应用于例如皮肤和眼的合适制剂优选为本领域众所周知的水性溶液剂、软膏剂、乳膏剂或凝胶剂。此类制剂可含有增溶剂、稳定剂、张度增强剂、缓冲剂和防腐剂。
活性化合物可与药学上可接受的载体一起制备,所述载体将保护化合物免于从机体快速清除,诸如控释制剂,包括植入剂和微囊化递送系统。可使用可生物降解、生物相容性聚合物,诸如乙烯乙酸乙烯酯、聚酐类、聚乙醇酸、胶原、聚原酸酯类和聚乳酸。用于制备此类制剂的方法将是本领域技术人员显而易见的。
还可以脂质体递送系统的形式(诸如小单层囊泡、大单层囊泡和多层囊泡)来制备式i化合物。脂质体可由多种磷脂类诸如胆固醇、硬脂酰胺或磷脂酰胆碱形成。
任一种活性药物成分或两者的合适的延时释放形式可以是基质片剂或胶囊组合物。合适的基质形成材料包括,例如,蜡类(例如,巴西棕榈蜡、蜂蜡、石蜡、地蜡、虫胶蜡、脂肪酸和脂肪醇)、油类、硬化油类或脂肪类(例如,硬化菜子油、蓖麻油、牛脂、棕榈油和大豆油)和聚合物类(例如,羟丙基纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素和聚乙二醇)。其它合适的基质压片材料为含其它载体和填料的微晶纤维素、粉状纤维素、羟丙基纤维素、乙基纤维素。片剂还可含有颗粒剂、包衣散剂或小丸剂。片剂还可以是多层的。当活性成分具有显著不同的药代动力学概况时,多层片剂是特别优选的。任选地,最终的片剂可以是包衣的或未包衣的。
包衣组合物通常含有不溶性基质聚合物(以包衣组合物的重量计约15-85%)和水溶性材料(例如以包衣组合物的重量计约15-85%)。任选地,可使用或包含肠溶聚合物(以包衣组合物的重量计约1-99%)。合适的水溶性材料包括聚合物诸如聚乙二醇、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇和单体材料诸如糖类(例如乳糖、蔗糖、果糖、甘露糖醇等)、盐类(例如氯化钠、氯化钾等)、有机酸(例如富马酸、琥珀酸、乳酸和酒石酸)及其混合物。合适的肠溶聚合物包括羟丙基甲基纤维素、醋酸琥珀酸酯(acetatesuccinate)、羟丙基甲基纤维素、邻苯二甲酸酯、聚醋酸乙烯邻苯二甲酸酯、醋酸邻苯二甲酸纤维素、醋酸偏苯三酸纤维素、虫胶、玉米醇溶蛋白和含有羧基的聚甲基丙烯酸酯。
可根据包衣共混物的性质(诸如主要组分或组分混合物的玻璃化转变温度)或用于给药包衣组合物的溶剂将包衣组合物增塑。合适的增塑剂可以包衣组合物的重量计的0-50%添加,并包括例如邻苯二甲酸二乙酯、柠檬酸酯类、聚乙二醇、甘油、乙酰化甘油酯类、乙酰化柠檬酸酯类、癸二酸二丁酯和蓖麻油。如果需要,包衣组合物可包含填料。基于包衣组合物的总重量,填料的量可为1重量%-约99重量%,并且可以是不溶性材料,诸如二氧化硅、二氧化钛、滑石、高岭土、氧化铝、淀粉、粉状纤维素、mcc或聚克立林钾(polacrilinpotassium)。包衣组合物可作为有机溶剂或水性溶剂或其混合物中的溶液或乳胶给药。如果应用溶液,则溶剂可以基于溶解的固体的总重量计大约25-99重量%的量存在。合适的溶剂为水、低级醇、低级氯化烃类、酮类或其混合物。如果应用乳胶,则溶剂以基于乳胶中聚合物材料的量计约25-97重量%的量存在。溶剂可主要为水。
本发明化合物的剂量水平为约0.5mg/kg体重-约100mg/kg体重的数量级或之间的任何增量。优选的剂量率为约30mg/kg体重-约100mg/kg体重之间。总日剂量可以单剂量或分剂量给药。式i化合物的合适治疗剂量的范围可为1微克(μg)-1000毫克(mg)/千克受体体重/天和之间的任何增量,诸如例如1、2、3、5、10、25、50、75、100、200、300、400、500、600、700、800、900或1000μg(1mg);2、3、5、10、25、50、75、100、200、300、400、500、600、700、800、900或1000mg。然而,应理解,对于任何特定患者的具体剂量水平将取决于多个因素,包括所给药的特定化合物的活性、年龄、体重、总体健康状况、性别、饮食、给药时间、给药途径、排泄速率、药物组合和经历治疗的特定疾病的严重程度。
可调节剂量方案以提供最佳期望反应。例如,可给药单次大剂量,可随时间推移给药数次分剂量或可如治疗情况的急迫性所指示成比例增加或降低剂量。特别有利的是以剂量单位形式配制胃肠外组合物以易于剂量的给药和一致性。如本文所使用的剂量单位形式是指适于作为用于待治疗的哺乳动物对象的单位剂量的物理分散单位;每个单位含有经计算与所需药物载体结合产生期望治疗效果的预定量的活性化合物。本发明的剂量单位形式的规格受制于和直接取决于(a)治疗剂的独特性质和待实现的特定治疗或预防效果,和(b)对于治疗的个体敏感性配制此类活性化合物的领域内的内在限制。因此,技术人员将理解,基于本文提供的公开内容,根据治疗领域众所周知的方法调节剂量和给药方案。也就是说,可容易地确立最大耐受剂量,并且还可确定向患者提供可检测的治疗益处的有效量,这可以是用于给药各药剂以便向患者提供可检测的治疗益处的临时要求。因此,尽管在本文中例举某些剂量和给药方案,但这些实例决不限制在实施本发明时可向患者提供的剂量和给药方案。
在一些实施方案中,大约在夜间的就寝时间或睡眠时间将本文所述的化合物和组合物给药至对象。优选地,在就寝时间之前或之后6小时、5小时、4小时、3小时、120分钟、90分钟、60分钟、45分钟、30分钟、25分钟、20分钟、15分钟、10分钟、5分钟之内或立即将本文所述的化合物和组合物给药至所述对象。优选地,在就寝时间之前2小时之内至立即将本发明的化合物和组合物给药至所述对象。如本文所使用,“就寝时间”是指对象以休息或睡着为目的而就寝的夜间时间。
在其它实施方案中,本文所述的化合物和组合物可以与食物或不与食物一起给药。当所述化合物或组合物与食物一起给药时,可以优选地在膳食(诸如早餐、午餐、晚餐或点心)之前或之后4小时内给药所述化合物或组合物。例如,在膳食之前或之后6小时内、5小时内、4小时内、3小时内、120分钟内、90分钟内、60分钟内、45分钟内、30分钟内、25分钟、20分钟内、15分钟内、10分钟内、5分钟内或立即给药本发明的化合物或组合物。优选地,在晚餐之后4小时内、3小时内、120分钟内、90分钟内或60分钟内将本发明的化合物和组合物给药至所述对象。
本文公开的主题的另一个方面,提供治疗cry介导的疾病或病症的方法,所述方法包括给药治疗有效量的本文中前述实施方案中任一个所描述的式i化合物。本发明的一个优选实施方案是治疗cry介导的疾病或病症的方法,其中特征在于cry水平异常的疾病或病症选自糖尿病、糖尿病相关的并发症、代谢综合征、胰岛素抵抗综合征、肥胖症、青光眼、库欣综合征、炎性病症、线粒体病症、弗里德利希共济失调、精神病性抑郁症、阿尔茨海默氏病、神经性疼痛、药物滥用、骨质疏松症、癌症、黄斑变性和肌病。通过本文公开的化合物治疗的特别优选的cry-介导的疾病或病症包括糖尿病,糖尿病性并发症诸如糖尿病性神经病,糖尿病性视网膜病,糖尿病性肾病,白内障形成,青光眼,糖尿病性血管病,动脉粥样硬化;非酒精性脂肪性肝炎(nash);非酒精性脂肪性肝病(nafld);哮喘;和慢性阻塞性肺病(copd)。
如本文所使用的术语“给药(administer)”、“给药(administering)”、“给药(administration)”等是指可用于使得能够将化合物或组合物递送至期望的生物作用部位的方法。这些方法包括但不限于口服、胃肠外、局部、粘膜、眼、经眼、阴道和直肠给药。本领域技术人员熟悉可与本文所述化合物和方法一起使用的给药技术,例如讨论于以下中的给药技术:goodman和gilman,thepharmacologicalbasisoftherapeutics,现行版;pergamon;以及remington's,pharmaceuticalsciences(现行版),mackpublishingco.,easton,pa。如本文所使用,药物组合物的“胃肠外给药”包括特征在于对象组织的物理破坏(physicalbreaching)和通过组织破坏给药药物组合物的任何给药途径。胃肠外给药因此包括但不限于通过注射组合物、通过经由外科切口应用组合物、通过经由组织穿透的非外科创伤应用组合物等给药药物组合物。具体而言,考虑胃肠外给药包括但不限于皮下、腹膜内、肌肉内和胸骨内注射以及肾透析输注技术。
“对象”在本发明的上下文中优选为哺乳动物。哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些实例。除人以外的哺乳动物可有利地用作代表cry介导的疾病或病症的动物模型(例如ob/ob小鼠)的对象。对象可为雄性或雌性。对象可以是已先前诊断或鉴定为患有cry介导的疾病或病症,并且任选针对所述疾病或病症已经历或正在经历治疗干预或治疗的对象。或者,对象也可以是先前未诊断为患有cry介导的疾病或病症的对象。例如,对象可以是展现cry介导的疾病或病症的一个或多个风险因子的对象,或不展现cry介导的疾病或病症的风险因子的对象,或对于cry介导的疾病或病症无症状的对象。对象还可以是患有cry介导的疾病或病症或处于发生cry介导的疾病或病症的风险中的对象,或者患有cry介导的疾病或病症复发或处于发生cry介导的疾病或病症复发的风险中的对象。对象还可以是已先前针对cry介导的疾病或病症进行治疗的对象,无论是通过单独或与其它治疗剂、手术还是前述的任何组合相组合来给药本文公开的化合物和组合物。如本文所使用的术语“对象”和“患者”可互换使用。
“cry介导的疾病或病症”可包括而不限于糖尿病(包括而不限于胰岛素依赖性“i型”糖尿病、非胰岛素依赖性“ii型”糖尿病、妊娠糖尿病和糖尿病相关并发症如糖尿病性神经病、糖尿病性视网膜病、糖尿病性心肌病、糖尿病性肾病、牙周病和糖尿病性酮症酸中毒)、代谢综合征、胰岛素抵抗综合征、肥胖症、青光眼、库欣综合征、精神病性抑郁症、阿尔茨海默氏病、神经性疼痛、药物滥用、骨质疏松症、癌症、黄斑变性和肌病。
如本文所使用的术语“治疗(treating)”、“治疗(treat)”或“治疗(treatment)”包括预防性(例如预防的)、缓解性、辅助性和治愈性治疗。例如,如本文所使用的2型糖尿病的治疗意指患有2型糖尿病或处于患有2型糖尿病的风险中的患者可根据本文所述的方法治疗。对于经历预防性治疗的患者,所得所预防性治疗的疾病状态的发生率的降低是预防性治疗的可测量的结果。
如本文所使用的术语“缓解(alleviating)”或“缓解(alleviate)”描述病症的体征或症状的严重程度由此减少、降低或抑制的过程。重要的是,症状可被缓解但不被消除。在一个优选实施方案中,给药本发明的药物组合物导致症状的消除,然而,消除不是必须的。预期本文所述的治疗有效量的化合物或药物组合物降低症状的严重程度。
如本文所使用的术语“症状”被定义为疾病、病症、损伤或机体中某些不适的指征。症状被经历所述症状的个体所感知或注意到,但其他人不容易注意到。其他人由卫生保健或临床专业人员定义。
如本文所使用的术语“代谢综合征”,除非另有说明,否则意指银屑病、糖尿病、伤口愈合、炎症、神经变性疾病、半乳糖血症、槭糖尿病、苯丙酮酸尿、高肌氨酸血症、胸腺嘧啶尿嘧啶尿症、硫化物血症(sulfinuria)、异戊酸血症、酵母氨酸尿症、4-羟基丁酸尿症、葡萄糖-6-磷酸脱氢酶缺乏症和丙酮酸脱氢酶缺乏症。
如本文所使用的术语“肥胖症”或“肥胖”通常是指比他/她的年龄、性别和身高的平均体重高至少约20-30%的个体。在技术上,“肥胖”对于男性被定义为其身体质量指数大于27.8kg/m2的个体,对于女性被定义为其身体质量指数大于27.3kg/m2的个体。本领域技术人员容易认识到本发明方法不限于落入上述标准内的那些。实际上,落入这些传统标准之外的个体,例如可能易于肥胖的个体,也可有利地实施本发明的方法。
如本文所使用的术语“炎性病症”是指病症,诸如哮喘、慢性阻塞性肺病(copd)、类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、银屑病、软骨钙质沉着病、痛风、炎性肠病、溃疡性结肠炎、克罗恩氏病(crohn’sdisease)、纤维肌痛和恶病质。
如本文所使用的术语“库欣综合征”是指一系列由长期暴露于升高水平的皮质醇导致的体征和症状。库欣综合征可由内源或外源性原因导致。内源性库欣综合征的原因包括垂体肿瘤(也称为库欣病)、肾上腺肿瘤和来自其它肿瘤(包括但不限于小细胞肺癌)的促肾上腺皮质激素(acth)和/或促肾上腺皮质激素释放激素(crh)的异位分泌。外源性(或医源性)库欣综合征由使用皮质类固醇用于治疗多种病症,包括炎性病症,包括但不限于哮喘、银屑病和类风湿性关节炎,所导致。
如本文所使用的术语“线粒体疾病”是指疾病诸如线粒体脑肌病,乳酸性酸中毒和中风样发作(melas),具有粗糙红色纤维的肌阵挛性癫痫(merrf),kearns-sayre综合征,慢性进行性外部眼肌麻痹,leber氏遗传性视神经病,leigh综合征,糖尿病,耳聋,神经源性肌无力,共济失调和色素性视网膜炎(narp)和肌源性胃肠道脑病。
如本文所使用的术语“癌症”是指特征在于不受控的细胞生长和/或增殖的病症和疾病,且包括良性和恶性癌症,过度增殖性病症和疾病,和癌转移。特别优选的癌症的实例为实体瘤癌症或上皮癌,包括但不限于:肺癌;脑癌;胰腺癌;头颈癌(例如鳞状细胞癌);乳腺癌;结肠直肠癌;肝癌;胃癌;肾癌;卵巢癌;前列腺癌或腺癌。其它癌症是vegf表达增加、血管生成增加的癌症或缺氧肿瘤。
如本文所使用的短语“治疗有效量”是指将引发研究人员、兽医、医生或其他人正在寻求的组织、系统、动物或人的生物或医学反应的药物或药剂的量。
如本文所使用的短语“有效降低血糖水平的量”是指足以提供足够高的循环浓度以实现期望作用的化合物的水平。此类浓度通常落入约10nm直至2μm的范围;其中范围为约100nm直至500nm的浓度是优选的。如前所示,由于落入如上所述的式i定义的不同化合物的活性可相当地变化,并且由于各个对象可呈现症状严重程度的广泛变化,因此确定对象对治疗的反应和相应地改变剂量取决于从业人员。
如本文所使用的短语“胰岛素抵抗”是指整个机体或各个组织(诸如骨骼肌组织、心肌组织、脂肪组织或肝组织)中对胰岛素作用的敏感性降低。胰岛素抵抗发生于患有或未患有糖尿病的许多个体中。
如本文所使用的短语“胰岛素抵抗综合征”是指包括胰岛素抵抗、高胰岛素血症、非胰岛素依赖性糖尿病(niddm)、动脉性高血压、向心性(内脏)肥胖和血脂异常的表现聚类。
本发明的化合物还可用于治疗与葡萄糖利用受损和胰岛素抵抗相关的其它代谢病症,包括niddm的主要晚期并发症,诸如糖尿病性血管病、动脉粥样硬化、非酒精性脂肪性肝炎(nash)、非酒精性脂肪性肝病(nafld)、糖尿病性肾病、糖尿病性神经病和糖尿病性眼并发症(诸如视网膜病、白内障形成和青光眼)以及与niddm有关的许多其它并发症,包括血脂异常、糖皮质激素诱发的胰岛素抵抗、多囊卵巢综合征、肥胖症、高血糖症、高脂血症、高胆固醇血症、高甘油三酯血症、高胰岛素血症和高血压。这些病况的简述可得自任何医学词典,例如“stedman’smedicaldictionary”(第x版)。
本文公开的化合物和组合物可以治疗有效量与本文定义的一种或多种其它治疗剂组合给药。例如,可与用于治疗cry介导的疾病或病症的其它物质一起产生协同效应。当本发明的化合物与其它疗法联合给药时,共同给药的化合物的剂量当然将根据采用的联合药物(co-drug)的类型、采用的具体药物、所治疗的病况等而变化。
如本文所使用的可互换使用的术语“组合治疗(combinationtreatment)”、“组合疗法(combinationtherapy)”、“组合治疗(combinedtreatment)”或“组合组合(combinatorialtreatment)”是指用至少两种不同的治疗剂治疗个体。如本文所利用的术语“共同给药”或“组合给药”等意指涵盖将选择的治疗剂给药至单个对象,并且意在包括其中不必通过相同的给药途径或在相同时间给药药剂的治疗方案。
本文所述的组合治疗意欲提供来自本文公开的化合物和组合物以及一种或多种额外治疗剂的共同作用的有益效果。所述组合的有益效果包括,但不限于,由本文公开的化合物和治疗剂的组合导致的药代动力学或药效动力学共同作用。这些治疗剂的组合给药通常经限定时间段(通常为数分钟、数小时、数天或数周,这取决于选择的组合)内实施。在一些实施方案中,本发明的化合物与一种或多种额外治疗剂以同时或依次方式组合给药。当同时给药时,本发明的化合物可以例如在与额外治疗剂相同的胶囊中给药。或者,本发明的化合物和额外治疗剂涵盖于待同时给药的分开组合物(即,胶囊)中。当依次给药时,本发明的化合物可以在给药额外治疗剂之前或之后给药。术语“药物组合”意指由混合或组合多于一种活性成分导致的产品,并且包括活性成分的固定或非固定的组合。“固定组合”意指将活性成分(例如如本文公开的化合物)和其它治疗剂两者以单一实体或剂量的形式同时给药至患者。“非固定组合”意指活性成分(例如本文公开的化合物)和其它治疗剂两者作为独立的实体无特定时限地同时、共同或依次给药至患者,其中此类给药在患者体内提供治疗有效水平的2种化合物。后者还适用于鸡尾酒(cocktail)疗法,例如给药3种或更多种活性成分。
用于治疗糖尿病、代谢综合征、肥胖症、胰岛素抵抗综合征、糖尿病并发症或癌症的治疗剂包括而不限于以下:胰岛素、降血糖剂、抗糖尿病药、抗炎药、降脂药、抗高血压药诸如钙通道阻断剂、β-肾上腺素能受体阻断剂、环氧合酶-2抑制剂、血管紧张素系统抑制剂、ace抑制剂、肾素抑制剂、化学治疗剂、放射疗法、激素调节剂、免疫调节剂、抗血管生成剂连同其它普通风险因子调节剂。
胰岛素包括快速起效形式,诸如赖脯胰岛素rdna来源:humalog(1.5ml,10ml,elilillyandcompany,indianapolis,ind.);胰岛素注射剂(常规胰岛素)形式牛和猪(常规iletini,elililly],人:rdna:humulinr(elililly)、novolinr(novonordisk)、半合成:velosulinhuman(novonordisk),rdnahuman,buffered:velosulinbr,猪:常规胰岛素(novonordisk),纯化猪:猪常规iletinii(elililly)、常规纯化的猪胰岛素(novonordisk),和常规(浓缩)iletiniiu-500(500单位/ml,elililly);中效形式诸如胰岛素锌混悬液,牛和猪:lenteiletingi(elililly),人,rdna:humulinl(elililly),novolinl(novonordisk),纯化的猪:lenteiletinii(elililly),低精蛋白锌胰岛素混悬液(nph):牛和猪:nphiletini(elililly),人,rdna:humulinn(elililly),novolinn(novonordisk),纯化的猪:猪nphiletinii(elililly),nph-n(novonordisk);和长效形式诸如胰岛素锌混悬液,长效(ultralente,elililly),人,rdna:humulinu(elililly)。
降血糖药包括而不限于磺脲类:醋磺己脲(dymelor)、氯磺丙脲(diabinese)、甲苯磺丁脲(orinase);二代磺脲类:格列吡嗪(glucotrol,glucotrolxl)、格列本脲(diabeta;micronase;glynase)、格列美脲(amaryl);双胍类:二甲双胍(glucophage);α-葡糖苷酶抑制剂:阿卡波糖(precose)、米格列醇(glyset);噻唑烷二酮类:罗格列酮(avandia)、吡格列酮(actos)、曲格列酮(rezulin);美格列奈类:瑞格列奈(prandin);和其它降血糖药诸如阿卡波糖;丁福明;盐酸布托沙明;卡格列波糖;环格列酮;恩格列酮钠;达格列酮钠;盐酸依托福明;格列胺脲;格列波脲;格列他尼;格列齐特钠;格列氟胺;胰高血糖素;格列己脲;格列嘧啶钠;格列辛脲;格列帕脲;利诺格列;富马酸利诺格列;帕莫酸甲酯;帕莫酸钠;酒石酸吡咯格列;人胰岛素原;醋酸司格列肽;妥拉磺脲;甲苯磺吡胺;唑泊司他。
抗炎药包括阿氯芬酸;二丙酸阿氯米松;阿孕苯奈德;α-淀粉酶;安西法尔;安西非特;氨芬酸钠;盐酸氨普立糖;阿那白滞素;阿尼罗酸;阿尼扎芬;阿扎丙宗;巴柳氮二钠;苄达酸;苯噁洛芬;盐酸苄达明;菠萝蛋白酶;溴哌莫;布地奈德;卡洛芬;环洛芬;辛喷他宗;克利洛芬;丙酸氯倍他索;丁氯倍他松;氯吡酸;丙酸氯硫卡松;醋酸可米松;可托多松;地夫可特;地奈德;去羟米松;二丙酸地塞米松;双氯芬酸钾;双氯芬酸钠;双醋二氟拉松;二氟米酮钠;二氟尼柳;二氟泼尼酯;地弗他酮;二甲亚砜;羟西奈德;恩甲羟松;恩莫单抗;依诺利康钠;依匹唑;依托度酸;依托芬那酯;联苯乙酸;非那莫;芬布芬;芬氯酸;苯克洛酸;芬度柳;苯吡帕酮;芬替酸;夫拉扎酮;氟扎可特;氟芬那酸;氟咪唑;醋酸氟尼缩松;氟尼辛;氟尼辛葡甲胺;氟可丁酯;醋酸氟米龙;氟喹宗;氟比洛芬;氟瑞托芬;丙酸氟替卡松;呋喃洛芬;呋罗布芬;哈西奈德;丙酸卤倍他索;醋酸卤泼尼松;异丁芬酸;布洛芬;布洛芬铝;布洛芬吡啶甲醇;伊洛达普;吲哚美辛;吲哚美辛钠;吲哚洛芬;吲哚克索;吲四唑;醋酸异氟泼尼松;伊索克酸;伊索昔康;酮洛芬;盐酸洛非咪唑;氯诺昔康;氯替泼诺依碳酸酯;甲氯芬那酸钠;甲氯芬那酸;二丁酸甲氯松;甲芬那酸;美沙拉秦;美西拉宗;磺庚甲泼尼龙;吗尼氟酯;萘丁美酮;奈普生;奈普生钠;萘普索;尼马宗;奥沙拉秦钠;奥古蛋白;奥帕诺辛;奥沙普秦;羟布宗;盐酸瑞尼托林;戊聚硫钠;保泰松甘油酸钠;吡非尼酮;吡罗昔康;肉桂酸吡罗昔康;吡罗昔康乙醇胺;吡洛芬;泼那扎特;普立非酮;普罗度酸;普罗喹宗;普罗沙唑;枸橼酸普罗沙唑;利美索龙;氯马扎利;柳胆来司;沙那西定;双水杨酯;水杨酸酯;血根氯铵;司克拉宗;丝美辛;舒多昔康;舒林酸;舒洛芬;他美辛;他尼氟酯;他洛柳酯;特丁非隆;替尼达普;替尼达普钠;替诺昔康;替昔康;替昔米德;四氢甲吲胺;硫平酸;替皮质酮匹伐酯;托美丁;托美丁钠;三氯奈德;三氟米酯;齐多美辛;糖皮质激素;佐美酸钠。一种重要的抗炎药是阿司匹林。
其它抗炎药是细胞因子抑制剂,包括细胞因子拮抗剂(例如il-6受体拮抗剂)、氮杂-烷基溶血磷脂类(aalp)和肿瘤坏死因子-α(tnf-α)抑制剂,诸如抗tnf-α抗体、可溶性tnf受体、tnf-α、反义核酸分子、多价脒基腙(cni-1493)、n-乙酰半胱氨酸、己酮可可碱(pentoxiphylline)、己酮可可碱(oxpentifylline)、碳环核苷类似物、小分子s9a、rp55778(一种tnf-α合成抑制剂)、地塞比诺(hu-211)、mdl201,449a(9-[(1r,3r)-反式-环戊-3-醇]腺嘌呤和trichodimerol(bms-182123)。其它tnf-α抑制剂包括依那西普(enbrel,immunex,seattle)和英利昔单抗(remicade,centocor,malvern,pa.)。
降脂药包括吉非贝齐、消胆胺、考来替泊、烟酸和hmg-coa还原酶抑制剂。可用于给药或与本发明的其它药剂共同给药的hmg-coa还原酶抑制剂包括但不限于辛伐他汀(美国专利号4,444,784)、洛伐他汀(美国专利号4,231,938)、普伐他汀钠(美国专利号4,346,227)、氟伐他汀(美国专利号4,739,073)、阿托伐他汀(美国专利号5,273,995)和西立伐他汀。
钙通道阻断剂包括二氢吡啶类,诸如硝苯地平;苯基烷基胺类,诸如维拉帕米;和苯并噻氮
β-肾上腺素能受体阻滞剂包括但不限于阿替洛尔、醋丁洛尔、阿普洛尔、苯呋洛尔、倍他洛尔、布尼洛尔、卡替洛尔、塞利洛尔、hedroxalol、茚诺洛尔、拉贝洛尔、左布诺洛尔、甲吲洛尔、美替洛尔、吲哚美辛(metindol)、美托洛尔、metrizoranolol、氧烯洛尔、吲哚洛尔、普萘洛尔、普拉洛尔、普拉洛尔、索他洛尔、纳多洛尔、替普洛尔、tomalolol、噻吗洛尔、布拉洛尔、喷布洛尔、三甲苯心安、2-(3-(1,1-二甲基乙基)-氨基-2-羟基丙氧基)-3-吡啶甲腈hcl、1-丁基氨基-3-(2,5-二氯苯氧基-)-2-丙醇、1-异丙基氨基-3-(4-(2-环丙基甲氧基乙基)苯氧基)-2-丙醇、3-异丙基氨基-1-(7-甲基茚满-4-基氧基)-2-丁醇、2-(3-叔丁基氨基-2-羟基-丙基硫基)-4-(5-氨基甲酰基-2-噻吩基)噻唑、7-(2-羟基-3-叔丁基氨基丙氧基)2-苯并[c]呋喃酮。上文鉴定的化合物可作为异构体混合物使用,或以其各自的左旋形式或右旋形式使用。
多种选择性cox-2抑制剂是本领域已知的,包括但不限于描述于以下中的cox-2抑制剂:美国专利号5,474,995;美国专利号5,521,213;美国专利号5,536,752;美国专利号5,550,142;美国专利号5,552,422;美国专利号5,604,253;美国专利号5,604,260;美国专利号5,639,780;美国专利号5,677,318;美国专利号5,691,374;美国专利号5,698,584;美国专利号5,710,140;美国专利号5,733,909;美国专利号5,789,413;美国专利号5,817,700;美国专利号5,849,943;美国专利号5,861,419;美国专利号5,922,742;美国专利号5,925,631和美国专利号5,643,933。多种上文鉴定的cox-2抑制剂是选择性cox-2抑制剂的前药,并包括描述于以下中的那些:wo95/00501、wo95/18799和1995年12月12日授权的美国专利号5,474,995。
血管紧张素ii拮抗剂的实例包括:肽类化合物(例如沙拉新,[(san1)(val5)(ala8)]血管紧张素-(1-8)八肽和相关类似物);n-取代的咪唑-2-酮(美国专利号5,087,634);咪唑乙酸盐衍生物包括2-n-丁基-4-氯-1-(2-氯偶苯酰)咪唑-5-乙酸(参见long等人,j.pharmacol.exp.ther.247(1),1-7(1988));4,5,6,7-四氢-1h-咪唑并[4,5-c]吡啶-6-甲酸和类似物衍生物(美国专利号4,816,463);n2-四唑β-葡糖苷酸类似物(美国专利号5,085,992);取代的吡咯类、吡唑类和三唑类(美国专利号5,081,127);酚和杂环衍生物诸如1,3-咪唑类(美国专利号5,073,566);咪唑并稠合的7元环杂环类(美国专利号5,064,825);肽类(例如美国专利号4,772,684);抗血管紧张素ii的抗体(例如美国专利号4,302,386);和芳烷基咪唑化合物诸如联苯基-甲基取代的咪唑类(例如ep253,310,1988年1月20日);es8891(n-吗啉代乙酰基-(-1-萘基)-l-丙氨酰基-(4-噻唑基)-l-丙氨酰基(35,45)-4-氨基-3-羟基-5-环-己戊酰基-n-己基酰胺,sankyocompany,ltd.,tokyo,japan);skf108566(e-α-2-[2-丁基-1-(羧基苯基)甲基]1h-咪唑-5-基[methylan-e]-2-噻吩丙酸,smithklinebeechampharmaceuticals,pa.);氯沙坦(dup753/mk954,dupontmerckpharmaceuticalcompany);瑞米吉仑(ro42-5892,f.hoffmanlarocheag);a2激动剂(marionmerrilldow)和某些非肽杂环(g.d.searleandcompany)。
血管紧张素转化酶(ace)抑制剂包括氨基酸类及其衍生物、肽类包括二肽类和三肽类和ace的抗体,所述抗体通过抑制ace活性、由此减少或消除升高血压的物质血管紧张素ii的形成来干扰肾素-血管紧张素系统。其它ace抑制剂包括酰基巯基和巯基烷酰基脯氨酸类诸如卡托普利(美国专利号4,105,776)和佐芬普利(美国专利号4,316,906),羧基烷基二肽类诸如依那普利(美国专利号4,374,829)、赖诺普利(美国专利号4,374,829)、喹那普利(美国专利号4,344,949)、雷米普利(美国专利号4,587,258)和培哚普利(美国专利号4,508,729),羧基烷基二肽模拟物类诸如西拉普利(美国专利号4,512,924)和贝那普利(美国专利号4,410,520),氧膦基烷酰基脯氨酸类诸如福辛普利(美国专利号4,337,201)和群多普利。
肾素抑制剂包括氨基酸类及其衍生物、肽类及其衍生物和肾素的抗体。其它肾素抑制剂包括肽类的脲衍生物(美国专利号5,116,835);由非肽键连接的氨基酸(美国专利号5,114,937);二肽和三肽衍生物(美国专利号5,106,835);氨基酸及其衍生物(美国专利号5,104,869和5,095,119);二醇磺酰胺类和亚磺酰类(美国专利号5,098,924);修饰的肽类(美国专利号5,095,006);肽基β-氨基酰基氨基二醇氨基甲酸酯(美国专利号5,089,471);吡咯咪唑酮类(美国专利号5,075,451);含有氟和氯施德丁(statine)或施德酮(statone)的肽(美国专利号5,066,643);肽基氨基二醇类(美国专利号5,063,208和4,845,079);n-吗啉代衍生物类(美国专利号5,055,466);抑胃酶肽衍生物类(美国专利号4,980,283);n-杂环醇类(美国专利号4,885,292);肾素的单克隆抗体(美国专利号4,780,401);及其各种其它肽和类似物(美国专利号5,071,837、5,064,965、5,063,207、5,036,054、5,036,053、5,034,512和4,894,437)。
可用于治疗糖尿病和相关病症的其它治疗剂包括但不限于脂肪酶抑制剂诸如西替司他(atl-962);合成的支链淀粉类似物诸如含或不含重组瘦素的symlin普兰林肽;钠-葡萄糖协同转运蛋白2(sglt2)抑制剂如sergliflozin(869682;kgt-1251)、ym543、卡格列净、埃格列净、达格列净、glaxosmithkline分子189075和sanofi-aventis分子ave2268;双重脂肪甘油三酯脂肪酶和pi3激酶活化剂如adyvia(id1101);神经肽y2、y4和y5受体拮抗剂如nastech分子pyy3-36、人激素的合成类似物pyy3-36和胰腺多肽(7tm分子tm30338);shionogi分子s-2367;大麻素cb1受体拮抗剂诸如利莫那班(acomplia)、泰伦那班、cp-945,598、solvay分子slv319、vernalis分子v24343;激素如油酰雌酮;5-羟色胺、多巴胺和去甲肾上腺素的抑制剂(本领域也称为三重单胺重摄取抑制剂)如替索芬辛(neurosearch分子ns2330);去甲肾上腺素和多巴胺重摄取抑制剂像contrave(丁氨苯丙酮加上阿片样物质拮抗剂纳曲酮)和excalia(丁氨苯丙酮加上抗惊厥药唑尼沙胺);11β-羟基类固醇脱氢酶1型(11b-hsd1)抑制剂如incyte分子incb13739;皮质醇合成抑制剂例如酮康唑(diobex分子dio-902);糖异生抑制剂诸如metabasis/daiichi分子cs-917;葡糖激酶活化剂如roche分子r1440;蛋白酪氨酸磷酸酶-1b反义抑制剂诸如isis113715;以及其它药剂如nicox分子ncx4016;促胃液素和表皮生长因子(egf)类似物的注射剂诸如isletneogenesistherapy(e1-i.n.t.);倍他司汀(obecure分子obe101);胆汁酸多价螯合剂(例如消胆胺和考来替泊)、维生素b3(也称为烟酸(nicotinicacid或niacin))、维生素b6(吡哆醇)、维生素b12(氰钴胺)、纤维酸衍生物(例如吉非贝齐、氯贝丁酯、非诺贝特和苯扎贝特)、普罗布考、硝酸甘油和胆固醇吸收抑制剂(例如β-谷甾醇和酰基coa-胆固醇酰基转移酶(acat)抑制剂诸如亚油甲苄胺(melinamide))、hmg-coa合酶抑制剂、角鲨烯环氧酶抑制剂和角鲨烯合成酶抑制剂。
用于治疗库欣综合征的药剂的实例包括但不限于神经调节剂(signifor®(帕瑞肽)、卡麦角林);肾上腺类固醇生成抑制剂(酮康唑、甲吡酮、米托坦、依托咪酯);和核受体调节剂(korlym®(米非司酮)、视黄酸)。其它药剂包括而不限于表皮生长因子受体抑制剂(例如,吉非替尼)、醛固酮合酶/11β-羟化酶抑制剂lci699和左酮康唑(cor-003)。
常用于治疗疼痛(包括神经性疼痛)的镇痛药的实例包括而不限于阿片样物质或非阿片样物质镇痛药。合适的阿片样物质镇痛药包括但不限于吗啡、海洛因、氢吗啡酮、氢可酮、羟吗啡酮、羟考酮、美托酮、阿扑吗啡、去甲吗啡、埃托啡、丁丙诺啡、麦啶、洛哌丁胺(lopermide)、阿尼利定、依索庚嗪、匹米诺定(piminidine)、倍他罗定、地芬诺酯、芬太尼(fentanil)、舒芬太尼、阿芬太尼、瑞芬太尼、左啡诺、右美沙芬、非那佐辛、喷他佐辛、环佐辛、美沙酮、异美沙酮和右丙氧芬。合适的非阿片样物质镇痛药包括但不限于阿司匹林、塞来考昔、罗非考昔、双氯芬酸(diclofinac)、二氟尼柳、依托度酸、非诺洛芬、氟比洛芬、布洛芬、酮洛芬、吲哚美辛、酮咯酸、甲氯芬那酸、甲芬那酸(mefanamicacid)、萘丁美酮、奈普生、吡罗昔康和舒林酸。
常用于治疗青光眼的治疗剂的实例包括胆碱能激动剂(例如匹罗卡品和卡巴胆碱)、胆碱酯酶抑制剂(例如毒扁豆碱、新斯的明、demacarium、碘依可酯和异氟磷)、碳酸酐酶抑制剂(例如乙酰唑胺、双氯非那胺、醋甲唑胺、依索唑胺和多佐胺)、非选择性肾上腺素能激动剂(例如肾上腺素和地匹福林)、α2-选择性肾上腺素能激动剂(例如阿可乐定和溴莫尼定)、β-阻断剂(例如噻吗洛尔、betazolol、左布诺洛尔、卡替洛尔和美替洛尔)、前列腺素类似物(例如拉坦前列素)和渗压性利尿药(例如甘油、甘露糖醇和异山梨醇);皮质甾类诸如倍氯米松、甲泼尼龙、倍他米松、泼尼松、泼尼松龙、地塞米松、氟替卡松和氢化皮质酮;及皮质甾类类似物诸如布地奈德。
常用于治疗阿尔茨海默氏病的治疗剂的实例包括β-分泌酶抑制剂或γ-分泌酶抑制剂;甘氨酸转运抑制剂,tau磷酸化抑制剂;aβ寡聚体形成阻断剂;p25/cdk5抑制剂;hmg-coa还原酶抑制剂;pparγ激动剂,诸如吡格列酮和罗格列酮;nk1/nk3受体拮抗剂;nsaid包括布洛芬;维生素e;抗淀粉样蛋白抗体,包括抗淀粉样蛋白人源化单克隆抗体;cox-2抑制剂;抗炎化合物,诸如(r)-氟比洛芬;cb-1受体拮抗剂或cb-1受体反激动剂;抗生素诸如多西环素和利福平;n-甲基-d-天冬氨酸盐(nmda)受体拮抗剂,诸如美金刚和奈拉美生;nr2b拮抗剂;雄激素受体调节剂;乙酰基胆碱酯酶抑制剂诸如加兰他敏、利凡斯的明、多奈哌齐和他克林;mglur5调节剂;生长激素促分泌素诸如依布莫仑、甲磺酸依布莫仑和卡莫瑞林;组胺h3拮抗剂;ampa激动剂;pdeiv抑制剂;gabaa反激动剂;gabaaα5受体配体;gabab受体配体;钾通道阻断剂;神经元烟酸激动剂;p-450抑制剂,诸如利托那韦。
常用于治疗情感障碍(诸如抑郁症)的治疗剂的实例包括而不限于阿米替林、氧阿米替林、地昔帕明、二苯西平、度硫平、多塞平、氯丙咪嗪、丙米嗪、去甲替林、米安色林、马普替林、曲米帕明、cp-122721、艾扎索南、pd-171729、mk-869、dov-216303、dov-21947、利卡西平、安非他酮、雷达法辛、维拉佐酮、gsk-679769、gw-597599、ns-2359、gsk-876008、普拉克索、度洛西汀、阿托西汀、ly-628535、地文拉法辛、依他普仑、lu-aa21004、沙瑞度坦、sr-58611、ssr-149415、ssr-146977、吗氯贝胺、r-673、r-1204、bms-469458、dpc-368、org-34517、org-34850、crh受体抑制剂、ono-2333ms、nbi-876008、aag-561、nbi-34041、dpc-368、pd-171729、ssr-125543、维洛沙秦、曲唑酮、萘法唑酮、米氮平、文拉法辛、瑞波西汀、反苯环丙胺、溴法罗明、吗氯贝胺、西酞普兰、依他普仑、帕罗西汀、氟西汀、氟伏沙明、舍曲林、hypericum(圣约翰草(st.john'swort))、阿普唑仑、氯硝西泮、地西泮、劳拉西泮、哈拉西泮、氯氮
常用于治疗成瘾和药物滥用的治疗剂的实例包括而不限于苯乙肼、苯基烷基肼(美国专利号4,786,653)、戒酒硫(“antabuse”)、2-亚氨基-5-苯基-4-噁唑烷酮、α-甲基-对酪氨酸或镰孢菌酸、哌嗪衍生物(美国专利号4,325,952)、与三环抗抑郁药物联合的可乐定(美国专利号4,788,189)、γ-吡喃酮类诸如麦芽酚或乙基麦芽酚(美国专利号4,276,890)、阿坎酸、加巴喷丁、氨己烯酸、巴氯芬、n-乙酰半胱氨酸、nocaine、莫达非尼(modanafil)、帕罗西汀、丁氨苯丙酮、米氮平、托吡酯、昂丹司琼、伐尼克兰、阿片样物质受体拮抗剂诸如纳曲酮、纳洛酮、那美芬(nalmephine)、antaxone、l-α-乙酰基地美庚醇、喷他佐辛、布托啡诺、纳布啡、丁丙诺啡和美沙酮。
常用于骨质疏松症治疗且可调节骨矿物含量的治疗剂的实例包括但不限于二膦酸盐类诸如阿伦膦酸盐(fosamax®)、利塞膦酸盐(actonel®)、依替膦酸盐(didronel®)、帕米膦酸盐、替鲁膦酸盐(skelid®)、氯膦酸盐(bonefos®;loron®)、奈立膦酸盐、奥帕膦酸盐、唑来膦酸盐(zometa®)和伊班膦酸盐(boniva®);选择性雌激素-受体调节剂(serm)诸如雷洛昔芬(evista®)、阿佐昔芬、氯米芬、巴多昔芬、拉索昔芬、奥美昔芬、他莫昔芬和托瑞米芬(toremifine);合成代谢疗法(anabolictherapies)诸如特立帕肽(forteo®;重组甲状旁腺激素)和雷奈酸锶;和甲状旁腺激素重组肽片段、雌激素/黄体酮置换疗法、单克隆抗体;核因子kb配体(rankl)的受体活化剂抑制剂诸如地舒单抗、护骨蛋白和抑胃酶肽a;组织蛋白酶k抑制剂诸如但不限于ost-4077(呋喃-2-甲酸-(1-{1-[4-氟-2-(2-氧代-吡咯烷-1-基)-苯基]-3-氧代-哌啶-3-基氨基甲酰基}-环己基)-酰胺)、亮抑酶肽、cbz-phe-ala-chn2、cbz-leu-leu-leu-甲醛、半胱氨酸蛋白酶抑制剂、不可逆半胱氨酸蛋白酶抑制剂如肽卤代甲基酮类、肽重氮基甲基酮类和环氧化物、静息的不可逆半胱氨酸蛋白酶抑制剂诸如酰氧基甲基酮类、氮杂肽、michael受体如肽乙烯基酯类、砜类和磺酸酯类、可逆半胱氨酸蛋白酶抑制剂诸如肽醛类、a-酮酯类和a-酮酰胺类、肽甲基酮类及其羟基、烷氧基、芳氧基、烷硫基和芳基硫基衍生物、1,3-双(酰基氨基)-2-丙酮类、1,3-双(酰基肼基)-羰基类、酰基氨基-吡唑啉酮类、哌啶酮类和thiazone-羰基-酰肼类、整联蛋白avb3(本领域也称为玻连蛋白)拮抗剂、解钙化合物(增加pth分泌的ca2+受体拮抗剂)、降钙素(miacalcinò);硝酸盐包括但不限于单硝酸异山梨酯(ismo)或硝酸甘油软膏(ntg);以及膳食补充剂诸如钙和维生素d,及其组合。
本发明的另一个实施方案是基于测量取自对象的样品中的时钟基因(例如cry1和cry2)表达水平来鉴定需要治疗的患者的方法(bjarnason,g.a.等人,am.j.pathol.2001,158,1793;akashi,m.等人,proc.natl.acad.sci.usa,2010,107,15643)。在来自对象的样品中测量的人时钟基因(包括cry1和cry2)的节律性mrna表达谱表明昼夜节律时钟存在于外周组织中(mohawk,j.a.等人,ann.rev.neurosci.2012,印刷前的电子出版物)。已证实这些样品中昼夜节律时钟相关基因的表达在一天期间变化。此外,在人中,外周血单核细胞中的时钟基因(例如cry1和cry2)表达模式由于疾病(诸如肥胖症)而变化(tahira,k.等人,arch.med.sci.2011,7,933)。外周单核血细胞中时钟基因(例如cry1和cry2)表达的改变可与血清瘦素、脂连蛋白、胰岛素和hscrp水平、血浆脂质、葡萄糖、褪黑激素和皮质醇水平相关,而在动物中,时钟基因(例如cry1和cry2)在组织(包括肝、脂肪、胰腺和骨骼肌)中表达。通过接触取自用式i化合物治疗的对象的样品,并测量节律性mrna或蛋白表达谱,可鉴定需要治疗的患者,并可评价药理活性。在其它实施方案中,可评价一种或多种隐花色素的活性,例如,隐花色素与目标诸如per1、per2、糖皮质激素受体(gr)或含有cry识别位点的启动子序列(诸如例如clock-bmal1启动子)结合的能力。
因此,本文公开的主题的一个方面涉及监测对象中的cry介导的疾病或病症的进展或预后的方法,其包括测量在第一时间段来自对象的第一样品中一种或多种隐花色素的有效量;测量在第二时间段来自对象的第二样品中一种或多种隐花色素的有效量;且将第一样品中检测的一种或多种隐花色素的量与第二样品中检测的一种或多种隐花色素的量或与参考值进行比较。
“诊断(diagnosis)”、“诊断(diagnose)”、“预后(prognose)”或“预后(prognosis)”不限于个体患有疾病的确定性或接近确定性的确定,而是还包括确定个体与健康个体或与普通人群相比具有增加的患有或发展疾病的可能性。
如本文所使用的“表达”和“表达水平”包括但不限于以下中的一种或多种:基因转录为前体mrna;前体mrna的剪接和其它加工以产生成熟mrna;mrna稳定性;成熟mrna翻译为蛋白(包括密码子使用和trna可用性);以及如果需要适当表达和功能的话,翻译产物的糖基化和/或其它修饰。
“公式”、“算法”或“模型”是采取一个或多个连续或分类输入(本文称为“参数”)并计算输出值(有时也称为“指数”或“指数值”)的任何数学方程、算法、分析或编程方法或统计技术。“算法”的非限制性实例包括求和、比率和回归运算符,诸如系数或指数、数值转化和归一化(包括而不限于基于临床参数(诸如性别、年龄、身体质量指数或种族)的那些归一化流程)、规则和准则、统计分类模型和以历史人群训练的神经网络。如本文定义的测量cry中特别有用的是线性和非线性方程和统计分类分析以使对象样品中检测的cry水平与对象发展cry介导的疾病或病症的风险之间的关系相关联。
“测量(measuring)”或“测量(measurement)”意指评价临床或对象来源的样品内给定物质的存在、不存在、数量或量(其可为有效量),包括此类物质的定性或定量浓度水平的推导,或以其它方式评估对象临床参数的值或分类。测量(measurement)或测量(measuring)还可涉及定性类型或鉴定物质。测量(measurement)或测量(measuring)还可涉及一种或多种cry与目标结合的能力,其中所述目标可以是周期基因或蛋白per1和per2、糖皮质激素受体(gr)或clock-bmal1基因的启动子区。cry的测量可用于诊断、检测或鉴定对象中的cry介导的疾病或病症,监测对象中的cry介导的疾病或病症的进展或预后,预测对象中的cry介导的疾病或病症的复发,或将对象分类为具有发展cry介导的疾病或病症或cry介导的疾病或病症复发的低风险或高风险。
“风险”在本发明的背景下涉及事件在特定时间段内将发生的概率,如同cry介导的疾病或病症的发展中一样,并且可意指对象的“绝对”风险或“相对”风险。可参考相关时间组群的测量后实际观察或参考从已追踪相关时间段的统计学上有效的历史组群产生的给定值,测量绝对风险。相对风险是指对象的绝对风险与低风险组群的绝对风险或平均人群风险相比的比率,其可因如何评价临床风险因子而变化。通常还采用未转化的给定检验结果的优势比(阳性事件与阴性事件的比例)(优势根据式p/(1-p),其中p为事件的概率,(1-p)为非事件的概率)。在本发明的背景下可评价的替代连续量度包括至发展cry介导的疾病或病症或进展至cry介导的疾病或病症的不同阶段(包括cry介导的疾病或病症的进展或发展)的时间和治疗转化风险降低率。
“风险评估”或“风险的评估”在本文公开的主题的背景下涵盖预测事件或疾病状态可能发生的概率、几率或似然性,事件发生或从一种疾病状态向另一种的转变(即从“正常”状况转变为处于发展cry介导的疾病或病症的风险的状况,或从风险状况转变为cry介导的疾病或病症,或发展复发性疾病或病症)的比率。风险评估还可包括在绝对或相对方面相对于先前测量的群体预测cry介导的疾病或病症的其它指数。本发明的方法可用于连续或分类测量转变成cry介导的疾病或病症的风险,因此诊断和定义被定义为处于发展疾病或病症的风险中的对象类别的风险范围。在分类情况下,本发明可用来区分正常和处于风险对象组群。在其它实施方案中,可使用本发明,以便将处于风险状况与疾病状况区分开,或将疾病状况与正常状况区分开。
如本文所使用的“样品”是从对象分离的生物样品,可包括,例如但不限于,全血、血清、血浆、血细胞、内皮细胞、组织活检样品、淋巴液、腹水液、间质液(也称为“细胞外液”并涵盖存在于细胞之间的空间中的流体,特别包括龈沟液)、骨髓、精液、脑脊液(csf)、唾液、粘液、痰液、汗液、尿液或任何其它分泌物、排泄物或其它体液。
“统计显著的”意味着变化大于可预期只是偶然发生的情况(其可能是“假阳性”)。统计显著性可通过本领域已知的任何方法测定。显著性的常用量度包括p-值,其代表获得至少与给定数据点一样极端的结果的概率,假设所述数据点只是偶然结果。在0.05或以下的p-值,结果经常被视为高度显著性的。
可通过测量样品(例如对象来源的样品)中一种或多种隐花色素的“有效量”,并将有效量与参考值进行比较,经常利用数学算法或公式以便将来自多个个体的结果的信息结合至单次测量中,来检测cry介导的疾病或病症的风险。任选可选择鉴定为具有cry介导的疾病或病症的增加风险的对象以接受治疗方案或治疗干预,诸如作为单一疗法或与一种或多种额外治疗剂组合给药如本文定义的式i化合物,或实施手术干预(其可在给药式i化合物之后或之前、单独或与额外治疗剂或其它疗法组合)。
用于检测样品中这些隐花色素的方法具有许多应用。例如,可测量一种或多种隐花色素以辅助cry介导的疾病或病症的诊断或预后。在另一个实例中,用于检测隐花色素的方法可用于监测对象对cry介导的疾病或病症的治疗的反应。在另一个实例中,该方法可用于测定并鉴定体内或体外调节隐花色素表达的化合物。
本发明可用于连续或分类测量转变成cry介导的疾病或病症的风险,因此诊断和定义被定义为处于发展所述疾病或病症的风险中的一类对象的风险范围。在分类情况下,本发明的方法可用于区分正常对象组群和处于风险对象组群。在其它实施方案中,可使用本发明,以便区分处于风险与疾病或将疾病与正常。此类区分用途可能需要各个组或概况、数学算法和/或截止点的不同组合,但经受用于预期用途的相同前述准确性测量值。
鉴定处于风险对象使得能够选择并开始不同的治疗干预或治疗方案,以延缓、减少或防止对象转变成cry介导的疾病或病症。有效量的隐花色素蛋白、核酸、多态性、代谢物或其它分析物的水平还允许监测治疗进程。在该方法中,可从经历cry介导的疾病或病症的治疗方案(例如治疗性治疗)的对象提供生物样品。此类治疗方案可包括但不限于手术干预和用用于诊断或鉴定患有cry介导的疾病或病症的对象的治疗剂(例如本文所述的式i化合物)治疗。如果需要,在治疗之前、期间或之后的不同时间点从对象获得生物样品。例如,通过将对象的隐花色素概况与参考隐花色素概况进行比较来确定疾病状态可重复多于一次,其中对象的概况可获自每次重复所述方法时所取的分开样品。可以定义的时间间隔(诸如,例如4小时、8小时、12小时、24小时、48小时、72小时或如本领域技术人员会进行的任何合适的时间间隔)从对象取样品。
对象的基因组成的差异可导致其代谢各种药物的相对能力的差异,所述药物可调节cry介导的疾病或病症的症状或风险因子。具有cry介导的疾病或病症或处于发展cry介导的疾病或病症的风险的对象可随年龄、种族和其它参数而变化。因此,测量单独和与药物代谢的已知遗传因子组合的有效量的一种或多种如上文定义的隐花色素,允许预定水平预测以下:在选择对象中待测试的推定治疗药或预防药将适用于治疗或预防对象中的cry介导的疾病或病症。
为了鉴定对特定对象适当的治疗剂或药物,来自对象的测试样品还可暴露于治疗剂或药物,并可测定隐花色素蛋白、核酸、多态性、剪接变体、代谢物或其它分析物中的一种或多种的水平或活性。还可测量受影响或与一种或多种隐花色素(例如per1、per2、gr、clock-bmal1启动子等)直接或间接结合的其它基因或蛋白。可将一种或多种隐花色素的水平与在针对cry介导的疾病或病症进行对象管理(例如治疗剂或药物的治疗或暴露)之前和之后源自对象的样品进行比较,或可与源于由于此类治疗或暴露已显示风险因子的改善的一个或多个对象的样品进行比较。
可以许多本领域技术人员已知的方式,例如提取方法,包括例如溶剂提取、亲和纯化和离心,从样品获得核酸。选择性沉淀也可纯化核酸。还可利用色谱方法,包括凝胶过滤、离子交换、选择性吸附或亲和结合。核酸可以是例如rna、dna,或可以合成为cdna。可使用本领域众所周知的微阵列技术,例如affymetrix阵列、随后多维缩放技术(multidimensionalscalingtechniques),来检测核酸。参见r.ekins,r.和chu,f.w.(1999)trendsbiotechnol.17:217-218;d.d.shoemaker等人(2001)nature409(6822):922-927和美国专利号5,750,015。
如果需要,可通过例如预分级分离,制备样品以增强一种或多种隐花色素的检测能力。预分级分离的方法包括例如cibacron蓝琼脂糖色谱法、大小排阻色谱法、离子交换色谱法、肝素色谱法、凝集素色谱法、亲和色谱法、单链dna亲和色谱法、依次提取、凝胶电泳和液相色谱法。还可在检测前修饰分析物。可通过除去大量存在的或可干扰样品中目标分子检测的蛋白,将样品预分级分离。例如,在血清样品中,血清白蛋白大量存在,并可掩盖一种或多种隐花色素的分析。因此,可使用例如包含特异性结合血清白蛋白的吸附剂的基质除去血清白蛋白,将血清样品预分级分离,可以使用亲和柱或抗血清白蛋白抗体。
在其它实施方案中,可通过高分辨电泳,例如一维或二维凝胶电泳,分离样品中的目标分子。可分离级分,并将其通过气相离子光谱法进一步分析。优选地,使用二维凝胶电泳以产生包括一种或多种隐花色素的各点的二维阵列。参见,例如,jungblut和thiede,(1997)massspectr.rev.16:145-162。二维凝胶电泳可采用本领域已知方法进行。参见,例如,deutscher编辑,methodsinenzymology,第182卷。通常,样品可通过例如等电聚焦分离,在等电聚焦期间,样品中的一种或多种隐花色素以ph梯度分离,直到它们达到其净电荷为零的点(即等电点)。该第一分离步骤导致产生一维阵列。使用通常不同于第一分离步骤的技术,进一步分离一维阵列中的分子。例如,在第二维度中,使用聚丙烯酰胺凝胶,诸如在十二烷基硫酸钠存在的情况下的聚丙烯酰胺凝胶电泳(sds-page),进一步分离通过等电聚焦分离的目标分子。sds-page凝胶允许基于分子量进一步分离。通常,二维凝胶电泳可分离复杂混合物内分子量范围为1000-200,000da的化学不同的目标分子。
二维阵列中的目标分子可使用本领域已知的任何合适方法检测。例如,凝胶中的目标分子可进行标记或染色(例如考马斯蓝或银染)。如果凝胶电泳产生对应于本发明的一种或多种隐花色素的分子量的点,则可切取该点,并将其通过例如气相离子光谱法、质谱法或高效液相色谱法进一步分析。或者,可通过施加电场将凝胶含有的目标分子转移至惰性膜。然后,可通过例如气相离子光谱法、质谱法或hplc,分析膜上的大致对应于目标分子的分子量的点。
任选地,在分析前,可修饰目标分子以改善其分辨率或测定其身份。例如,在分析前,样品可经受蛋白水解消化。可以使用任何蛋白酶。可能将蛋白切割成离散数目的片段的蛋白酶(诸如胰蛋白酶)是特别有用的。由消化导致的片段可充当目标分子的指纹,由此使得能够进行它们的间接检测。当存在具有相似分子量的目标分子(其可能与优选的分子即所述隐花色素混淆)时,这是特别有用的。此外,蛋白水解片段化可用于高分子量分子,因为通过质谱法更容易解析较小的分子。在另一个实例中,可以修饰分子以改善检测分辨率。例如,可使用神经氨酸酶从糖蛋白除去末端唾液酸残基以改善与阴离子吸附剂(例如阳离子交换阵列)的结合,并改善检测分辨率。在另一个实例中,可通过连接特异性结合其它分子实体的特定分子量的标签来修饰分子,进一步区分它们。任选地,在检测此类修饰的目标分子后,可通过匹配蛋白数据库(例如swissprot)中修饰版本的理化特征来进一步确定分子特征。
一旦捕获于基质(例如生物芯片或抗体)上,可使用任何合适的方法,诸如本文描述的方法以及本领域已知的其它方法,来测量样品中的一种或多种隐花色素。可使用本领域已知的任何方法来测量此类分子的水平或量的实际测量值。这些方法包括而不限于质谱法(例如激光解吸/电离质谱法)、荧光(例如夹心免疫沉淀法)、表面等离振子共振、椭圆光度法和原子力显微镜术。方法可进一步包括以下中的一种或多种:微阵列、pcr方法、质谱法(包括,例如,而不限于esi-ms、esi-ms/ms、esi-ms/(ms)n、基质辅助激光解吸/电离飞行时间质谱法(maldi-tof-ms)、表面增强激光解吸/电离飞行时间质谱法(seldi-tof-ms)、硅面解吸/电离(dios)、次级离子质谱法(sims)、四极飞行时间(q-tof)、大气压化学电离质谱法(apci-ms)、apci-ms/ms、apci-(ms)n、大气压光电离质谱法(appi-ms)、appi-ms/ms和appi-(ms)n、四极质谱法、傅里叶变换质谱法(ftms)、离子阱质谱法)、核酸芯片、northern印迹杂交、tma、sda、nasba、pcr、实时pcr、逆转录酶pcr、实时逆转录酶pcr、原位pcr、色谱分离质谱法联用、使用固定化抗体或通过传统免疫测定的蛋白捕获。参见例如美国专利号5,723,591、5,801,155和6,084,102以及higuchi,1992和1993。可在例如多孔板形式或芯片诸如biotroveopen阵列芯片(biotrove,woburn,ma)上进行pcr测定法。
例如,在例如northern印迹杂交分析或特异性(优选定量)扩增特定核酸序列的方法中,可使用对应于隐花色素类的序列数据库条目内的序列来构建用于检测rna序列的探针。作为另一个实例,可使用所述序列来构建引物,所述引物与隐花色素序列特异性或选择性杂交,并且使用所述引物在例如基于扩增的检测方法诸如逆转录聚合酶链式反应(rt-pcr),例如定量实时rt-pcr中,扩增此类序列。当基因表达中的改变与基因扩增、缺失、多态性和突变相关时,可通过比较对象和参考细胞群体中所检查的dna序列的相对量,来进行测试群体和参考群体中的序列比较。如本文所使用的术语“特异性(或选择性)杂交”当提及核酸时,是指测定异源核酸群体中核酸的存在的结合反应。因此,在指定的测定条件下,指定的核酸探针(包括抑制性核酸)可至少两倍于背景地与特定目标核酸结合或杂交,并且基本上不与样品中存在的其它核酸大量结合或杂交。
还可通过免疫测定法测定隐花色素类的水平。抗体可以是如本文详细讨论的单克隆、多克隆、嵌合抗体或前述抗体的片段,并且可用任何合适的免疫测定法进行检测反应产物的步骤。短语“特异性(或选择性)结合”抗体或“与…特异性(或选择性)免疫反应性”,当提及蛋白或肽时,是指测定异源蛋白和其它生物成分(biologies)群体中蛋白的存在的结合反应。因此,在指定的免疫测定条件下,指定抗体至少两倍于背景地与特定蛋白结合,并且基本上不与样品中存在的其它蛋白大量结合。在此类条件下与抗体的特异性结合可能需要针对其对特定蛋白的特异性选择的抗体。例如,可选择从特定物种(诸如大鼠、小鼠或人)中针对隐花色素产生的多克隆抗体,以获得仅与该隐花色素特异性免疫反应、而与其它蛋白(除了隐花色素的多态变体和等位基因)不特异性免疫反应的那些多克隆抗体。通过减去与来自其它物种的与隐花色素交叉反应的抗体来实现该选择。
根据本发明进行的免疫沉淀法可以是均质测定法或异质测定法。在均质测定法中,免疫反应通常涉及特异性抗体(例如,抗隐花色素蛋白抗体)、标记的分析物和目标样品。在抗体与标记的分析物结合后,从标记产生的信号被直接或间接地改变。免疫反应及其程度的检测两者可在均质溶液中进行。可采用的免疫化学标记包括自由基、放射性同位素、荧光染料、酶、噬菌体或辅酶。
在异质测定法中,试剂通常为样品、抗体和用于产生可检测信号的手段。可使用如上所述的样品。可将抗体固定在支持物(诸如珠粒(诸如蛋白a和蛋白g琼脂糖珠粒)、板或载片)上,并与液相中疑似含有抗原的样本接触。然后将支持物与液相分开,并且采用用于产生可检测信号的方式检查支持物相或液相的此类信号。信号与样品中分析物的存在相关。用于产生可检测信号的方式包括使用可检测标记。示例性的可检测标记包括根据已知技术的磁珠(例如dynabeads™)、荧光染料、酶(例如辣根过氧化酶、碱性磷酸酶和常用于elisa中的其它酶)、放射性标记(例如35s、125i、131i)和荧光标记(例如荧光素、alexa、绿色荧光蛋白、罗丹明)和比色标记诸如胶体金或有色玻璃或塑料珠粒。
或者,可使用间接测定法(其中例如使用第二标记抗体来检测结合的隐花色素特异性抗体)和/或在竞争或抑制测定法(其中例如将与隐花色素的不同表位结合的单克隆抗体与混合物同时培育)中,检测样品中的目标分子。例如,如果待检测的抗原含有第二结合部位,则在分离步骤之前,可将与该部位结合的抗体缀合至可检测基团并添加至液相反应溶液。固体支持物上可检测标记的存在表明测试样品中抗原的存在。用于测量抗体-抗原复合物的量或存在的方法包括,例如,荧光、发光、化学发光、吸光度、反射比、透射比、双折射或折射指数的检测(例如表面等离振子共振、椭圆光度法、共振镜方法、光栅耦合器波导方法或干涉量度法)。光学方法包括显微术(共焦和非共焦两者)、成像方法和非成像方法。电化学方法包括伏安法和电流测定法。射频方法包括多极共振波谱法。合适的免疫测定法的实例包括但不限于免疫印迹法(例如western印迹法、槽印迹测定法)、免疫沉淀法、免疫荧光方法、化学发光方法、电化学发光(ecl)或酶联免疫沉淀法,例如酶联免疫吸附测定法(elisa)和放射免疫沉淀法(ria)。通常参见e.maggio,enzyme-immunoassay,(1980)(crcpress,inc.,bocaraton,fla.);还参见美国专利号4,727,022、4,659,678、4,376,110、4,275,149、4,233,402和4,230,767。这些方法还描述于例如methodsincellbiology:antibodiesincellbiology,第37卷(asai编辑.1993);basicandclinicalimmunology(stites和terr编辑,第7版.1991);以及harlow和lane,同上。所有这些均通过引用并入本文。
可使用免疫测定法以测定样品中一种或多种隐花色素的存在或不存在以及样品中的量。可通过与标准品比较来测定抗体-标志物复合物的量。标准品可以是例如已知的化合物或已知存在于样品的另一种蛋白。如上所示,不必以绝对单位测量一种或多种隐花色素的测试量,只要测量单位可与对照比较。
蛋白通常以大量不同的形式存在于样品中,所述形式的特征在于可检测的不同质量。这些形式可由翻译前修饰和翻译后修饰的任一种或两种产生。翻译前修饰形式包括等位基因变体、剪接变体和rna编辑形式。翻译后修饰形式包括由蛋白水解切割(例如母体蛋白的片段)、糖基化、磷酸化、脂化、氧化、甲基化、胱氨酸化、磺化和乙酰化产生的形式。抗体还可用于检测蛋白、多肽、突变和多态性的翻译后修饰,诸如酪氨酸磷酸化、苏氨酸磷酸化、丝氨酸磷酸化、糖基化(例如o-glcnac)。此类抗体特异性检测一种或多种目标蛋白中的磷酸化氨基酸,并且可用于本文所述的免疫印迹法、免疫荧光和elisa测定法。这些抗体是本领域技术人员众所周知和市售的。还可在反射器基质辅助激光解吸电离时间飞行质谱法(maldi-tof)中使用亚稳离子来测定翻译后修饰(wirth,u.等人(2002)proteomics2(10):1445-51)。蛋白集合(包括特定蛋白及其全部修饰形式)在本文被称为“蛋白簇”。特定蛋白的所有修饰形式的集合(排除特定蛋白本身)在本文被称为“修饰的蛋白簇”。在本文公开的方法中,还可使用任何隐花色素的修饰形式本身。在某些情况下,与本文所述的特定形式相比,修饰形式在诊断中可展现更好的区分能力。可通过本发明已知的任何方法初步检测修饰形式。
或者,可测量隐花色素蛋白和核酸代谢物。术语“代谢物”包括代谢过程的任何化学或生物化学产物,诸如通过生物分子(例如蛋白、核酸、碳水化合物或脂质)的加工、切割或消耗产生的任何化合物。可以本领域技术人员已知的多种方式检测代谢物,所述方式包括折射指数光谱法(ri)、紫外线光谱法(uv)、荧光分析、放射化学分析、近红外光谱法(近ir)、核磁共振光谱法(nmr)、光散射分析(ls)、质谱法、热解质谱法、比浊法、弥散型拉曼光谱法、气相色谱法-质谱法联用、可与质谱法联用的液相色谱法(包括高效液相色谱法(hplc))、基质辅助激光解吸电离时间飞行(maldi-tof)-质谱法联用、离子喷雾光谱法-质谱法联用、毛细管电泳、离子迁移光谱法、表面增强激光解吸/电离(seldi)、光学方法、电化学方法、原子力显微术、射频方法、表面等离振子共振、椭圆光度法、nmr和ir检测。(参见国际申请公开号wo04/056456和wo04/088309,所述文献的每一个均通过引用以其整体并入本文)。在这方面,可使用上述检测方法或技术人员已知的其它方法,测量其它分析物。例如,可使用荧光染料诸如fluo系列,尤其fura-2a、rhod-2,检测样品中的循环钙离子(ca2+)。可使用特别设计或定制以检测此类代谢物的试剂类似地检测其它代谢物。
cry介导的疾病或病症可涉及一种或多种隐花色素的活性或一种或多种隐花色素与目标结合的能力的改变。尽管不希望受理论束缚,隐花色素蛋白据信与周期(period)蛋白per1和/或per2结合作为异二聚体,所述异二聚体然后与clock-bmal1基因的启动子区结合,以便在可对多个代谢过程影响的反馈环中促进转录抑制。因此,根据本发明的方法测量有效量的一种或多种隐花色素可涉及评价cry蛋白与per1和/或per2、与糖皮质激素受体(gr)或本领域技术人员已知的cry的任何其它结合目标结合的能力的提高或降低。可通过本领域已知的任何方法促进蛋白-蛋白相互作用的测量,所述方法包括免疫共沉淀法、酵母双杂交测定法、表面等离振子共振、双分子荧光互补、随机亲和纯化、噬菌体展示、荧光偏振/各向异性、双偏振干涉量度法、荧光相关光谱法、荧光共振能量转移等。
还可通过与dna序列(即clock-bmal1基因的启动子区)或含有被一种或多种隐花色素识别的结合部位的其它基因结合的能力的提高或降低来测量一种或多种隐花色素的活性。“启动子”、“启动子序列”或“启动子区”是指这样的dna序列,其能够结合细胞中的rna聚合酶,起始下游(3’方向)编码序列的转录,由此控制其表达。为了定义本发明的目的,启动子序列在其3'端通过转录起始位点结合,并延伸上游(5'方向)以包括以高出背景的可检测水平起始转录所必需的最小数目的碱基或元件。在启动子序列内将发现转录起始位点(通过例如用核酸酶s1作图便利地定义)以及负责rna聚合酶结合的蛋白结合结构域(共有序列)。启动子可以其整体源于天然基因,或由源于存在于自然界中的不同启动子的不同元件构成,或甚至包含合成的dna区段。在大多数情况下,没有完全定义调节序列的确切边界,不同长度的dna片段可具有相同的启动子活性。
clock-bmal1启动子(或含有cry的结合或识别位点的任何其它启动子区)可与报道子基因“可操作连接”。术语“可操作连接”是指单一核酸片段上核酸序列的缔合,使得一个的功能受另一个的影响。例如,当启动子能够影响编码序列的表达时,启动子与该编码序列可操作连接(即所述编码序列在启动子的转录控制下)。编码序列可以有义或反义取向与调节序列可操作连接。术语“报道子基因”意指编码基于报道子基因的作用而能够被鉴定的鉴定因子的核酸,其中所述作用用来追踪目标核酸的遗传,鉴定已遗传目标核酸的细胞或生物,和/或测量基因表达诱导或转录。本领域已知和使用的报道子基因的实例包括:荧光素酶(luc)、绿色荧光蛋白(gfp)、碱性磷酸酶(alp)、氯霉素乙酰基转移酶(cat)、β-半乳糖苷酶(lacz)、β-葡糖醛酸糖苷酶(gus)等。选择性标志物基因也可被认为是报道子基因。启动子-报道子基因构建体可包含于被转移或转染至细胞中的质粒或表达载体中。可通过测定基因产物的活性,例如在使用上文例举的报道子基因的情况下为酶活性,来检测报道子基因的表达。
术语“质粒”是指染色体外元件,其经常携带不是细胞中心代谢的部分的基因,并且通常为环状双链dna分子。此类元件可以是源于任何来源的自主复制序列、基因组整合序列、噬菌体或核苷酸序列、线性、环状或超螺旋的单链或双链dna或rna,其中多个核苷酸序列已被接合或重组为能够将启动子片段和所选基因产物的dna序列连同适当的3'非翻译序列引入细胞的独特构建体。术语“表达载体”意指经设计以使得能够在转化入宿主后表达插入的核酸序列的载体、质粒或媒介物。可通过本领域已知方法,例如转染、电穿孔、显微注射、转导、细胞融合、deae葡聚糖、磷酸钙沉淀、脂转染(溶酶体融合)、基因枪的使用或dna载体转运体,将载体引入期望的宿主细胞中。任何细胞都可用于进行报道子基因测定法,诸如原核细胞或真核细胞。优选地,所述细胞可为细菌细胞、真菌细胞、酵母细胞、线虫细胞、昆虫细胞、鱼细胞、植物细胞、鸟类细胞、动物细胞和哺乳动物细胞。所述细胞可以是原代细胞或可作为细胞系连续传代。示例性细胞和细胞系是本领域技术人员已知的。
测量一种或多种隐花色素与dna序列结合的活性或能力的其它方法包括染色质免疫沉淀测定法、电泳迁移率变动分析、dna拉下(pull-down)测定法、微量板捕获和检测等。
然后可测定有效量的隐花色素蛋白、核酸、多态性、代谢物或其它分析物的水平,或隐花色素蛋白或与隐花色素蛋白直接或间接结合的目标的活性,并与参考值(例如其疾病状态是已知的对照对象或群体)或指数值或基线值进行比较。参考样品或指数值或基线值可取自或源自一个或多个已暴露于治疗的对象,或可取自或源自一个或多个处于发展cry介导的疾病或病症的低风险中的对象,或可取自或源自已显示由于暴露于治疗而疾病风险因子改善的对象。或者,参考样品或指数值或基线值可取自或源自一个或多个未暴露于治疗的对象。例如,可从已接受针对cry介导的疾病或病症的初始治疗和针对所述疾病或病症的后续治疗以监测治疗进程的对象收集样品。在一些实施方案中,第一样品可在第一时间段(例如在用本文所定义的式i化合物单独或与一种或多种额外治疗剂组合治疗前)取自对象,随后如本文所述测量或检测一种或多种隐花色素(或隐花色素目标)。此后,第二样品可在第二时间段(例如在用本文所定义的式i化合物单独或与一种或多种额外治疗剂组合治疗后)取自对象,并测量一种或多种隐花色素或隐花色素目标。可以在整个疗程中以任何时间间隔获取多个样品以评价其有效性。
参考值也可包含源自来自群体研究的风险预测算法或计算指数的值,诸如本文所公开的那些。在该背景下的类似术语是“对照”,其可以是例如在正常对象中或在无疾病对象(诸如其中未检测到cry介导的疾病或病症)中的正常对象的相当样品中存在的隐花色素的平均或中值量。在与测量测试量相同或基本上相同的实验条件下,测量对照量。相关性可考虑测试样品中隐花色素存在或不存在和对照中相同分子的检测频率。相关性可考虑此类因素的两者以促进疾病状态的测定。
还可根据本文公开的方法制备未患有cry介导的疾病或病症并且预期不会发展cry介导的疾病或病症的那些对象的参考概况。还可使用一种或多种隐花色素的测量值以产生取自患有cry介导的疾病或病症的对象的“对象概况”。可将对象概况与参考概况进行比较以诊断或鉴定处于发展cry介导的疾病或病症的风险中的对象、监测疾病进程以及疾病进展的速度,并监测治疗方式或对象管理的有效性。
本发明的参考和受试概况者可含于机器可读介质中,所述机器可读介质诸如但不限于模拟磁带或数字磁带,尤其如通过vcr、cd-rom、dvd-rom、usb闪存介质可读取的那些。此类机器可读介质还可含有额外测试结果,诸如而不限于临床参数和传统实验室风险因子的测量值。可替代地或另外地,机器可读介质还可包含对象信息,诸如病史和任何相关家族史。机器可读介质还可含有涉及其它风险算法和计算指数的信息,诸如本文描述的那些。
在本文公开的方法中的任一种中,来自样品的数据可从检测装置直接传送至含有诊断算法的计算机中。或者,可用手或经由自动化装置将获得的数据传送至含有诊断算法的分开计算机中。因此,本发明的实施方案包括涉及将隐花色素的检测与cry介导的疾病或病症的可能诊断相关联的方法。相关性可考虑与对照量相比样品中一种或多种隐花色素的量(隐花色素的上调或下调)(例如在未检测到cry介导的疾病或病症的正常对象中)。相关性可考虑测试样品中隐花色素存在或不存在和对照中相同分子的检测频率。相关性可考虑此类因素两者以促进对象是否患有cry介导的疾病或病症的确定。
数据分析可包括测定检测的标志物的信号强度(例如峰高)和去除“离群值”(偏离预定统计分布的数据)的步骤。可将观察到的峰归一化,一种借此计算相对于某种参考的各峰高度的方法。例如,参考可以是由在标度中设置为零的仪器和化学品(例如能量吸收分子)产生的背景噪音。针对各个目标分子检测的信号强度可在期望标度(例如100)中以相对强度的形式展现。或者,样品可允许标准品(例如血清蛋白),使得来自标准品的峰可用作参考以计算针对检测的各个目标分子观察到的信号的相对强度。
所得数据可转化或转换成各种用于显示的形式。在称为“光谱视图(spectrumview)或滞留物图”的一种形式中,可显示标准光谱视图,其中所述视图描述每个特定分子量的分子到达检测器的量。在称为“峰图”的另一种形式中,只保留来自光谱视图的峰高和质量信息,得到更清晰的图像,并且使得能够更容易看到具有几乎相同分子量的目标分子。在称为“凝胶视图”的又另一种形式中,来自峰视图的每个质量可转化成基于各峰高度的灰度图像,导致产生类似于电泳凝胶上的条带的外观。在称为“3-d重叠图”的又另一种形式中,数个谱图可重叠以研究相对峰高的细微变化。在称为“差异图视图”的又另一种形式中,可比较两个或更多个谱图,便利地突出在样品之间上调或下调的独特的目标分子。可目视比较来自任何两个样品的概况(谱图)。在又另一种形式中,可使用spotfire散点图,其中检测到的目标分子在图中绘制为圆点,其中该图的一个轴表示检测到的隐花色素的表观分子量,另一个轴表示检测到的隐花色素的信号强度。对于每种样品,检测到的目标分子和样品中存在的分子的量可存入计算机可读介质中。然后可将该数据与对照或参考概况或参考值(例如,对照例如其中无法检测到cry介导的疾病或病症的对象中检测到的分子的概况或量)进行比较。
可使用使用分类模型的模式识别方法将本文公开的方法中产生的数据分类。在一些实施方案中,使用样品诸如“已知样品”产生的数据然后可用来“训练”分类模型。“已知样品”是预先分类(例如,疾病或无疾病)的样品。使用已知样品产生的数据然后可用于“训练”分类模型。“已知样品”是预先分类的样品。该数据可用来形成可称为“训练数据集”的分类模型。一旦训练,分类模型可识别使用未知样品产生的数据的模式。然后可使用该分类模型将未知样品分类至各类别。在例如预测特定生物样品是否与特定生物状况(例如患病与未患病)相关中,这可能是有用的。用来形成分类模型的训练数据集可包括原始数据或预处理数据。在一些实施方案中,原始数据可从飞行时间谱或质谱直接获得,然后可任选以任何合适的方式“预处理”。预处理步骤(诸如这些步骤)可用来减少用于训练分类模型的数据的量。
可使用任何合适的统计分类(或“学习”)方法形成分类模型,所述方法试图基于数据中存在的客观参数将数据体分为各类别。分类方法可为监督或非监督的。监督和非监督分类方法的实例描述于jain,“statisticalpatternrecognition:areview”,ieeetransactionsonpatternanalysisandmachineintelligence,第22卷,第1期,2000年1月,其通过引用以其整体并入本文。在监督分类中,将含有已知类别的实例的训练数据提供给学习机制,其学习定义每个已知类别的一组或多组关系。然后可将新的数据应用于学习机制,其然后利用学习的关系将新的数据分类。
监督分类方法的实例包括线性回归法(例如多元线性回归(mlr)、偏最小二乘(pls)回归和主组分回归(pcr))、二元决策树(例如递归划分法诸如cart-分类和回归树)、人工神经网络诸如反传网络、判别分析(例如贝叶斯分类器或fischer分析)、逻辑分类器和支持向量分类器(支持向量机)。优选的监督分类方法是递归划分法(美国专利申请公开号20020138208)。非监督分类试图基于训练数据集的相似性学习分类,而不预先分类训练数据集源自其中的谱图。非监督学习方法包括聚类分析。聚类分析试图将数据分成“聚类”或组群,所述聚类或组群理想地应当具有彼此非常相似并且非常不同于其它聚类的成员。然后使用某种距离量度测量相似性,所述距离量度测量数据项之间的距离,并将彼此更靠近的数据项聚类在一起。聚类技术包括macqueen的k平均值算法和kohonen的自组织映射算法。据称用于将生物信息分类的学习算法描述于例如国际申请公开号wo01/31580和美国专利申请公开号20020193950、20030004402和20030055615。另一种分类方法涉及多变量预测模型,其使用统一最大可分性分析(unifiedmaximumseparabilityanalysis,“usma”)分类器的非线性形式。usma分类器的详情描述于美国专利申请公开号20030055615。
其它分类算法和公式尤其包括但不限于主成分分析(pca)、互相关、因子旋转、逻辑回归(logreg)、线性判别分析(lda)、eigengene线性判别分析(elda)、随机森林(rf)、递归划分树(rpart)以及其它相关决策树分类技术、shrunkencentroids(sc)、stepaic、第k个最近邻法、boosting、决策树、神经网络、贝叶斯网络、支持向量机、leave-one-out(loo)、10倍交叉验证(10倍cv)和隐马尔科夫模型(hiddenmarkovmodel)。
一种或多种隐花色素的检测和关联还可使用任何合适的工具分析,所述工具包括软件包,例如appliedmaths、genexplore™、2-向聚类分析、主成分分析、判别分析、自组织映射;biodiscovery,inc.,losangeles,california(imagene™,专门的图像处理和数据提取软件,由matlab®驱动;genesight:层次聚类、人工神经网络(som)、主成分分析、时间序列;autogene™;clonetracker™);genedataag(basel,switzerland);mit’swhiteheadgenomecenter的分子模式识别网站;rosettainpharmatics,kirkland,washington。resolver™表达数据分析系统;scanalytics,inc.,fairfax,va。其microarray套件使得研究人员能够获取、显现、处理和分析基因表达微阵列数据;tigr(theinstituteforgenomeresearch)提供用于阵列分析的软件工具。例如,还参见eisen和brown,(1999)methodsenzymol.303:179-205。
在定性疾病状态的方法的某些实施方案中,所述方法进一步包括基于疾病或病症的状态管理或修改对象的临床治疗。例如,如果本发明方法的结果是非决定性的或有理由必需证实状态,则医生可命令更多测试(例如ct扫描、pet扫描、mri扫描、pet-ct扫描、x射线、活组织检查、血液测试)。或者,如果所述状态表明治疗是适当的,则医师可安排对象用于治疗。在其它情况下,对象可接受治疗性治疗(诸如,单独或与一种或多种额外治疗剂组合给药治疗剂(诸如例如本文定义的式i化合物))以替代手术,或除手术以外可接受所述治疗性治疗。进一步的行动可能不是合理的。此外,如果结果显示治疗是成功的,则维持疗法或无进一步管理可能是必需的。
本文公开的主题还提供此类方法,其中在对象临床治疗后再次测量隐花色素。在这些情况下,所述方法用来监测cry介导的疾病或病症的状态,例如对治疗的反应、疾病的消退或疾病的进程。可在对象接受每次治疗后重复所述方法,允许医生跟踪疗程的有效性。如果结果显示治疗是无效的,则可相应地改变疗程。
本发明提供用于定性疾病状态和/或检测或诊断疾病的试剂盒,其中试剂盒可用于检测一种或多种隐花色素。例如,所述试剂盒可用于检测本文所述的隐花色素的任一种或多种,所述一种或多种隐花色素差异性存在于疾病对象和正常对象的样品中。本发明的试剂盒具有许多应用。例如,所述试剂盒可用于本文所述的本发明方法的任一种,诸如特别用于区分对象是否患有cry介导的疾病或病症或具有阴性诊断,因此辅助诊断。在另一个实例中,所述试剂盒可通过使用cry介导的疾病或病症的体外或体内动物模型,用于鉴定调节一种或多种隐花色素的表达的化合物、调节一种或多种隐花色素的活性(即影响一种或多种隐花色素结合目标(诸如per1、per2、糖皮质激素受体(gr)或被隐花色素识别的启动子序列诸如clock-bmal1启动子或任何其它启动子序列)的能力)的化合物。在另一个实例中,所述试剂盒可用于鉴定如本文所述的一种或多种隐花色素蛋白的结合目标。
本发明的试剂盒可包括检测试剂,例如,通过具有同源核酸序列而特异性鉴定一种或多种隐花色素核酸的核酸,诸如与核酸的一部分互补的寡核苷酸序列、引物或适体,或由包装在一起的核酸编码的蛋白的抗体。寡核苷酸可以是基因的片段。寡核苷酸可以是单链或双链的。例如寡核苷酸的长度可为200、150、100、50、25、10或更少个核苷酸。或者,检测试剂可以是与一种或多种隐花色素蛋白或其目标特异性或选择性结合的一种或多种抗体。所述试剂盒可在分开的容器中含有核酸或抗体(已经与固体基质结合或用于使之与基质结合的试剂分开包装)、对照制剂(阳性和/或阴性)和/或可检测标记,尤其诸如荧光素、绿色荧光蛋白、罗丹明、花青染料、alexa染料、荧光素酶、放射性标记等。试剂盒中可包括用于进行测定和用于与疾病状态关联的说明书(例如书面、磁带、vcr、cd-rom等)。
例如,可将检测试剂固定于固体基质(诸如多孔带材)上以形成至少一个检测部位。多孔带材的测量或检测区可包括含有许多部位的核酸。测试带材还可含有用于阴性和/或阳性对照的部位。或者,对照部位可位于测试带材的各个带材上。任选地,不同的检测部位可含有不同量的固定的核酸,例如第一检测部位的较高量和随后部位的较少量。在添加测试样品后,展现可检测信号的部位数提供样品中存在的隐花色素的量的定量指示。检测部位可以任何合适的可检测形状配置,并用通常呈跨越测试带材宽度的条形或点的形状。基质阵列可在例如固体基质上,例如如描述于美国专利号5,744,305中的“芯片”。或者,基质阵列可为溶液阵列,例如xmap(luminex,austin,tx)、cyvera(illumina,sandiego,ca)、cellcard(vitrabioscience,mountainview,ca)和quantumdots’mosaic(invitrogen,carlsbad,ca)。所述试剂盒还可含有用于扩增或分离样品dna的试剂和/或酶。所述试剂盒可包括用于实时pcr的试剂(例如taqman探针和/或引物)和酶。
在一些实施方案中,所述试剂盒包含:(a)其上包含吸附剂的基质,其中所述吸附剂保留或以其它方式适于结合隐花色素,和(b)通过使样品与吸附剂接触,并检测由吸附剂保留的隐花色素,来检测隐花色素的说明书。在一些实施方案中,所述试剂盒可包含洗脱液(作为替代物或与说明书组合)或用于制备洗脱液的说明书,其中吸附剂和洗脱液的组合允许使用气相离子光谱法检测隐花色素。
在其它实施方案中,所述试剂盒可包含在其包含吸附剂的第一基质(例如用吸附剂官能化的颗粒)和第一基质可定位在其上以形成探针的第二基质,其可取出并插入机器(诸如例如气相离子光谱仪)中。在其它实施方案中,所述试剂盒可包含单一基质,呈为探针的形式,其中基质上的吸附剂可取出并插入机器中。在又另一个实施方案中,所述试剂盒可进一步包含预分级分离离心柱(例如cibacron蓝琼脂糖柱、抗hsa琼脂糖柱、k-30大小排阻柱、q-阴离子交换离心柱、单链dna柱、凝集素柱等)。在另一个实施方案中,所述试剂盒包含(a)与一种或多种隐花色素特异性结合的抗体;和(b)检测试剂。抗体可以是例如针对隐花色素基因的基因产物的抗体。
任选地,所述试剂盒可进一步包含标准品或对照信息,使得测试样品可与对照信息标准比较,以确定样品中检测到的一种或多种隐花色素的测试量是否是与cry介导的疾病或病症诊断一致的诊断量。
尽管上文详细描述了一些变型,但其它修改或添加是可能的。具体而言,除了本文记载的那些以外,可提供其它特征和/或变型。例如,上述实施可涉及公开的特征的各种组合和亚组合和/或上文公开的几个其它特征的组合和亚组合。此外,本文所述的逻辑流程不要求显示的特定顺序或相继顺序以达到所需结果。其它实施方案可在权利要求的范围内。
实施例
实施例1:化合物合成的反应方案
下面的反应方案,反应方案i、ii、iii、iv、v和vi,描述了用于合成式i化合物的方法。在用于制备式i化合物的通用方法中,变量r1、r2、r3、r4、r5、r6、r7、a和b如针对式i化合物的先前定义,除非另有说明。本文所述的反应方案意欲提供用于制备许多给定化合物的方法的概述。然而,从详述将显而易见的是,采用的制备模式比本文描述的通用方法进一步扩展。具体而言,注意到,可进一步修改根据所述方案制备的化合物,以提供本发明范围内的新的化合物。用于以下化合物中的试剂和中间体是市售的或可根据有机合成领域技术人员已知的标准文献方法制备。
下面的反应方案i描述了式i化合物的合成。在适当溶剂(诸如n,n-二甲基甲酰胺或n,n-二甲基乙酰胺)中,在约0℃至150℃的温度范围内,将适当取代的式iv的溴化物衍生物用适当的式v咔唑处理约5分钟至24小时的时段,提供相应的式iii的环氧乙烷(oxirane)化合物。用于使式iv的溴化物化合物与式v的咔唑反应以提供式iii化合物的优选条件包括在0℃至室温下在氢氧化钾存在的情况下,在n,n-二甲基甲酰胺中进行反应20至24小时,随后是萃取后处理。在适当溶剂(诸如n,n-二甲基甲酰胺、二甲亚砜或n,n-二甲基乙酰胺)中,在约室温至150℃的温度范围内,将式iii化合物用适当的式ii的酰胺或脲处理约5分钟至3天的时段,提供相应的式i的酰胺或脲化合物。用于使式iii的环氧乙烷化合物反应以提供式i化合物的优选条件包括在室温下在n,n-二甲基甲酰胺中与氢化钠进行反应20至24小时,随后是萃取后处理。或者,在具有适当碱(例如叔丁醇钾)的适当溶剂(例如二甲亚砜)中在室温下,式iii的环氧乙烷化合物可以与式ii的酰胺或脲反应3天,以提供式i化合物。
反应方案i
下面的反应方案ii描述了式i化合物的替代合成。在适当溶剂(诸如乙醇)中,在0℃至150℃的温度范围内,将适当取代的式iii的环氧乙烷衍生物用适当的式vii的二胺处理约5分钟至24小时的时段,提供相应的式vi的二胺化合物。用于使式iii的环氧乙烷化合物与式vii的二胺反应以提供式vi化合物的优选条件包括在40℃下在乙醇中进行反应20至24小时。在适当溶剂(诸如四氢呋喃)中在室温下,将式vi化合物用适当的羰基化试剂(诸如1,1'-羰基二咪唑)处理5分钟至24小时的时段,提供相应的式i化合物。
反应方案ii
下面的反应方案iii描述了式i化合物的替代合成。在适当溶剂(诸如四氢呋喃)中,在约0℃至65℃的温度范围内,将式ii的酰胺或脲化合物用适当取代的式ix的溴化物衍生物处理约5分钟至24小时的时段,提供相应的式iii的环氧乙烷化合物。用于使式ix的溴化物衍生物与式ii的酰胺或脲反应以提供式viii化合物的优选条件包括在0℃至室温下在氢化钠存在的情况下,在四氢呋喃中进行反应20至24小时,随后是萃取后处理。在适当溶剂(诸如n,n-二甲基甲酰胺)中,在0℃至70℃的温度范围内,将式viii化合物用适当的式v的咔唑处理约5分钟至24小时的时段,提供相应的式i化合物。用于使式viii的环氧乙烷化合物与式v的咔唑反应以提供式i化合物的优选条件包括在室温至70℃下在氢化钠存在的情况下,在n,n-二甲基甲酰胺中进行反应20至24小时,以提供式i化合物。
反应方案iii
下面的反应方案iv描述了式i化合物的替代合成。在约0℃至65℃的温度范围内,将式xiii的boc-保护的氨基酸化合物用氨、适当的偶联剂(诸如n,n,n′,n′-四甲基-o-(1h-苯并三唑-1-基)脲鎓六氟磷酸盐)、适当的碱(诸如n,n-二异丙基乙胺)和适当的溶剂(诸如二甲基甲酰胺)处理约5分钟至24小时的时段,提供相应的式xii的酰胺化合物。在适当的溶剂(诸如四氢呋喃)中在约0℃至100℃的温度范围内,将式xii的boc-保护的氨基酸化合物用适当的还原剂(诸如硼烷)处理约5分钟至24小时的时段,提供相应的式xi的boc-保护的二胺化合物。用于使式iii的环氧乙烷化合物与式xi的boc-保护的二胺反应以提供式x化合物的优选条件包括在70℃下在乙醇中进行反应16至24小时。在适当的溶剂(诸如四氢呋喃)中在约0℃至100℃的温度范围内,将式x化合物用适当的碱(诸如叔丁醇钾)处理约5分钟至24小时的时段,提供相应的式i化合物。
反应方案iv
下面的反应方案v描述了式i化合物的替代合成。在适当溶剂(诸如四氢呋喃)中在室温下,将式xvi的苄基保护的二胺化合物用适当的羰基化试剂(诸如1,1'-羰基二咪唑)处理5分钟至24小时的时段,提供相应的式xv化合物。用于使式iii的环氧乙烷化合物与式xv的苄基保护的脲反应以提供式xiv化合物的优选条件包括在室温至70℃下在氢化钠存在的情况下,在n,n-二甲基甲酰胺中进行反应16至24小时。在适当的溶剂(诸如四氢呋喃)中在约室温至100℃的温度范围内,在适当的催化剂(诸如碳载氢氧化钯)与适当的酸(诸如乙酸)存在的情况下,将式xiv的苄基保护的脲化合物用1至50psi氢气处理约5分钟至5天的时段,提供相应的式i化合物。
反应方案v
下面的反应方案vi描述了式i化合物的替代合成。在适当的溶剂(诸如n,n-二甲基甲酰胺或四氢呋喃)中,在0℃至150℃的温度范围内,将式xvii或xviii的适当取代的手性环氧乙烷衍生物用适当的式ii的酰胺或脲化合物、用适当的碱(诸如氢化钠)处理约5分钟至24小时的时段,提供相应的式i的手性酰胺或脲化合物。
反应方案vi
下面的反应方案vii描述了式i化合物的替代合成。在适当的溶剂(诸如乙醇)中,在0℃至150℃的温度范围内,将式xvii或xviii的适当取代的手性环氧乙烷衍生物用适当的式vii的二胺处理约5分钟至24小时的时段,提供相应的式vi的手性二胺化合物。用于使式xvii或xviii的环氧乙烷化合物与式vii的二胺反应以提供式vi化合物的优选条件包括在55℃下在乙醇中进行反应5至24小时。在适当溶剂(诸如四氢呋喃)中在室温下,将式vi化合物用适当的羰基化试剂(诸如1,1'-羰基二咪唑)处理5分钟至24小时的时段,提供相应的式i化合物。
反应方案vii
在本文所述的反应方案中,应当理解的是,根据需要,可以将用于制备式i化合物的中间体中的羟基用本领域技术人员已知的常规基团保护。例如,含有羟基的中间体可作为相应的叔丁基二甲基甲硅烷基醚进行保护,随后通过用四正丁基氟化铵处理来脱保护,以提供游离的羟基衍生物。“protectivegroupsinorganicsynthesis”,第3版,t.w.greene和p.g.m.wuts(wiley&sons,1999)中举例说明了合适的保护基及其去除方法。
1h核磁共振(nmr)谱在所有情况下都与提出的结构一致。特征性化学位移(δ)使用用于命名主峰的常规缩略语,以来自四甲基硅烷的百万分率低磁场(downfield)给出:例如s,单峰(singlet);d,双峰;t,三重峰;q,四重峰;m,多重峰;br,宽峰。质谱(m/z)使用电喷雾电离(esi)或大气压化学电离(apci)记录。当已使用薄层色谱法(tlc)时,其是指使用硅胶60f254板的硅胶tlc,rf是tlc板上化合物移动的距离除以溶剂前缘移动的距离。hplc是指高效液相色谱法。
包括下面的具体实施例用于说明性目的,不得解释为限制本公开内容。
中间体的制备
制备例1:2-氯-4-氟-n-(4-氟苯基)苯胺
将圆底烧瓶装入1-溴-4-氟苯(13.0g,74.3mmol)、2-氯-4-氟苯胺(11.354g,78.0mmol)、无水甲苯(200ml)和叔丁醇钾(10.003g,89.1mmol)。将混合物脱气,并用氮气反填充,然后添加三(二亚苄基丙酮)二钯(0)(2.041g,2.2mmol)和三-叔丁基膦(0.902g,4.5mmol),并将反应物在100℃在氮气下搅拌16小时。冷却之后,将混合物用6m盐酸水溶液处理成酸性ph,然后用固体碳酸钠调节回碱性ph。将混合物干燥(无水硫酸镁),过滤通过硅藻土(celite),并将滤饼用乙酸乙酯洗涤。将滤液浓缩,并将残余物通过硅胶色谱(0-20%乙酸乙酯/己烷)纯化,以提供淡黄色油(14g,79%)。1hnmr(300mhz,cdcl3):δ7.14(dd,1h,j=8.4,3.0hz),7.12-6.98(m,5h),6.88(td,1h,j=8.7,3.0hz),5.80(brs,1h)。
制备例2:3,6-二氟-9h-咔唑
将碳酸钾(26.528g,191.9mmol)、2-氯-4-氟-n-(4-氟苯基)苯胺(23.0g,96.0mmol)、三环己基鏻四氟硼酸盐(3.534g,9.6mmol)、二乙酸钯(1.077g,4.8mmol)和无水n,n-二甲基乙酰胺(200ml)的混合物在130℃在氮气下搅拌16小时。冷却之后,将混合物浓缩,并将残余物用乙酸乙酯处理,过滤通过硅藻土,并将滤饼用乙酸乙酯洗涤。将滤液浓缩,并将残余物通过短硅胶柱(20-50%二氯甲烷/己烷)纯化,以提供粗产物,将其从己烷-二氯甲烷重结晶,以提供作为白色粉末的纯产物(17.2g,88%)。1hnmr(300mhz,cdcl3):δ8.00(brs,1h),7.67(dd,2h,j=8.7,2.7hz),7.36(dd,2h,j=8.7,4.2hz),7.19(td,2h,j=9.0,2.7hz)。
制备例3:9-(环氧乙烷-2-基甲基)-9h-咔唑
将粉状氢氧化钾(3.36g,60mmol)添加至咔唑(8.36g,50mmol)于无水n,n-二甲基甲酰胺(50ml)中的溶液,并在环境温度下搅拌1小时。将反应混合物在冰浴中冷却,并添加表溴醇(10.3ml,125mmol)。将冰浴去除,并将反应物在室温下搅拌20小时。将混合物分配于乙酸乙酯和水之间。将有机层依次用水和饱和氯化钠水溶液洗涤,干燥(无水硫酸钠),过滤,并浓缩。将粗材料用己烷研磨,并从乙酸乙酯/己烷重结晶,以得到作为白色针的期望产物(6.41g,58%产率)。从母液结晶第二批晶体以得到额外产物(1.2g,11%)。1hnmr(300mhz,cdcl3)δ8.11-8.08(m,2h),7.46-7.44(m,4h),7.28-7.25(m,2h),4.68-4.62(dd,1h,j=3.1,15.8hz)4.45-4.38(dd,1h,j=4.8,15.9hz),3.37(m,1h),2.84-2.81(dd,1h,j=4.2,4.3hz),2.60-2.57(dd,1h,j=2.5,5.0hz);hplc分析:(c18,水中的5-95%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):7.83分钟,98.7%。
类似地制备以下化合物:
制备例4:1-苯甲酰基吡咯烷-2-酮
向2-吡咯烷酮(4.4g,51.7mmol,1.0当量)和三乙胺(15.4ml,111.2mmol,2.1当量)于无水四氢呋喃(120ml)中的冷0℃溶液中添加4-二甲基氨基吡啶(0.075g)和苯甲酰氯(6.9ml,59.5mmol,1.1当量)。将所得混合物在室温下搅拌16小时。将混合物倒入水中并用乙酸乙酯萃取。将有机级分用0.1m盐酸水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩,以得到红色油。将粗产物通过硅胶柱色谱纯化,用己烷中的20-65%乙酸乙酯梯度洗脱,以得到灰白色固体(5.63g,58%)。1hnmr(300mhz,cdcl3):δ7.61-7.57(m,2h),7.53-7.47(tt,1h,j=1.5,7.5hz),7.42-7.37(m,2h),3.98-3.94(t,2h,j=7.1hz),2.61-2.58(t,2h,j=8.0hz),2.20-2.10(quint,2h,j=7.5hz)。esi(m/z):190.1(m+h)。
制备例5:1-苯甲酰基-3-氟吡咯烷-2-酮
向1-苯甲酰基吡咯烷-2-酮(1g,5.3mmol,1.0当量)于无水四氢呋喃(26ml)中的-78℃溶液中添加二异丙基氨基锂(3.382ml的四氢呋喃中的2m溶液,6.8mmol,1.3当量),并将混合物在-78℃下搅拌30分钟。在-78℃下缓慢添加n-氟苯磺酰亚胺(2.5g,7.9mmol,1.5当量)于无水四氢呋喃(5ml)中的溶液,并将反应物在-40℃下搅拌1小时。添加饱和碳酸氢钠水溶液,将溶液温热至室温,并用乙酸乙酯萃取。将有机层用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩,以提供黄色固体。将粗产物通过硅胶柱色谱纯化,用己烷中的15-60%乙酸乙酯梯度从硅胶洗脱,以得到白色固体(0.595g,54%)。1hnmr(300mhz,cdcl3):δ7.64-7.61(m,2h),7.57-7.52(tt,1h,j=1.5,7.5hz),7.45-7.39(m,2h),5.28-5.06(dt,1h,j=7.8,51hz),4.15-4.07(m,1h),3.87-3.78(m,1h),2.68-2.56(m,1h),2.45-2.27(m,1h)。19fnmr(282mhz,cdcl3):δ-188.9至-189.2(ddd,j=12.1,24.2,51.8hz)。
制备例6:3-氟吡咯烷-2-酮
向1-苯甲酰基-3-氟吡咯烷-2-酮(0.282g,1.4mmol,1.0当量)于无水四氢呋喃(5ml)中的溶液中添加辛胺(0.259ml,1.6mmol,1.1当量),并将反应物在室温下搅拌16小时。将反应混合物在减压下浓缩以得到黄色油。将粗产物通过硅胶柱色谱纯化,用己烷中的70-100%乙酸乙酯梯度洗脱,以提供白色固体。(0.104g,74%产率)。1hnmr(300mhz,cdcl3):δ7.81(brs,1h),5.11-4.89(ddd,1h,j=6.3,7.8,52.8hz),3.49-3.42(m,1h),3.36-3.27(m,1h),2.57-2.41(m,1h),2.34-2.13(m,1h)。13cnmr(75mhz,cdcl3):δ173.5-173.3(d,j=20hz),89.9-87.4(d,j=182hz),39.1(d,j=4hz),28.6-28.4(d,j=20hz)。19fnmr(282mhz,cdcl3):δ-190.1至-190.4(ddd,j=15,27,52hz)。
制备例7:2-氧代哌啶-1-甲酸叔丁酯
在0℃下,向哌啶-2-酮(5g,50.4mmol,1.0当量)、三乙胺(14.022ml,100.9mmol,2.0当量)和n,n-4-二甲基氨基吡啶(0.123g,1.0mmol)于二氯甲烷(100ml)中的搅拌溶液中添加二碳酸二叔丁酯(16.512g,75.7mmol,1.5当量)。将混合物缓慢温热至室温并搅拌48小时。将反应物用水淬灭并将有机层依次用1n盐酸水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,并经无水硫酸钠干燥,过滤并在真空中浓缩。将残余物通过硅胶柱(0-100%乙酸乙酯/己烷)纯化,以提供作为黄色油的期望产物(8.5g,85%)。1hnmr(300mhz,cdcl3):δ3.72-3.62(m,2h),2.58-2.48(m,2h),1.90-1.78(m,4h),1.55(s,9h)。
制备例8:3-氟-2-氧代哌啶-1-甲酸叔丁酯
在-78℃在氮气下,经30分钟的时段,向2-氧代哌啶-1-甲酸叔丁酯(3g,15.1mmol,1.0当量)于无水四氢呋喃(70ml)中的搅拌溶液中逐滴添加双(三甲基甲硅烷基)氨基钠(22.586ml的四氢呋喃中的1m溶液,22.6mmol,1.5当量)。将所得溶液在−78℃下搅拌45分钟,然后经30分钟的时段逐滴添加n-氟苯磺酰亚胺(7.122g,22.6mmol,1.5当量)于无水四氢呋喃(30ml)中的溶液。将反应物在−78℃下搅拌1小时,然后经2小时使其缓慢温热至室温,并在室温下搅拌1小时。将反应物用饱和氯化铵水溶液淬灭并用乙酸乙酯萃取。将有机相用饱和氯化钠水溶液洗涤,并经无水硫酸镁干燥,过滤并在真空中浓缩。将残余物用二乙醚处理并将固体丢弃。将溶液浓缩并将残余物通过硅胶柱色谱(0-100%乙酸乙酯/己烷)纯化,以提供粗产物级分和作为白色固体的二氟副产物(1.5g)。将粗产物级分通过第二轮硅胶色谱进一步纯化,以提供作为粘稠油的期望产物(0.46g,14%)。1hnmr(300mhz,cdcl3):δ4.92(ddd,1h,j=47.4,8.7,6.3hz),3.78-3.60(m,2h),2.35(m,1h),2.15-1.80(m,3h),1.55(s,9h)。19fnmr(282mhz,cdcl3):δ−185.2(dt,j=45.7,15.5hz)。
制备例9:3-氟哌啶-2-酮
向3-氟-2-氧代哌啶-1-甲酸叔丁酯(0.450g,2.1mmol,1.0当量)于二氯甲烷(5ml)中的0℃溶液中添加三氟乙酸(1ml,13.5mmol,6.5当量),并将所得溶液搅拌3小时。将反应物在减压下浓缩,并将残余物通过硅胶柱(0-100%乙酸乙酯/己烷,然后0-20%甲醇/乙酸乙酯)纯化,以提供作为白色粉末的期望产物(0.23g,95%)。1hnmr(300mhz,cdcl3):δ6.36(brs,1h),4.85(ddd,1h,j=46.8,8.1,5.4hz),3.50-3.20(m,2h),2.40-1.70(m,4h)。19fnmr(282mhz,cdcl3):δ−186.5(dt,j=46.5,15.5hz)。
制备例10:3,3-二氟哌啶-2-酮
根据报道的程序(kim,b.c.等人synthesis2012,44,3165-3170)制备3,3-二氟哌啶-2-酮。
制备例11:1-苯甲酰基-3,3-二氟吡咯烷-2-酮
向来自制备例21b的1-苯甲酰基-3-氟吡咯烷-2-酮(0.3g,1.4mmol,1.0当量)和n-氟苯磺酰亚胺(0.639g,2.0mmol,1.4当量)于无水四氢呋喃(10ml)中的-78℃溶液中添加二异丙基氨基锂(0.905ml的四氢呋喃中的2m溶液,1.8mmol,1.3当量),并将混合物在-78℃下搅拌30分钟。添加额外份的二异丙基氨基锂溶液(0.5当量)和n-氟苯磺酰亚胺(0.5ml无水四氢呋喃中的0.5当量),并将混合物在-78℃下搅拌1小时。添加饱和碳酸氢钠水溶液,将混合物温热至室温,并用乙酸乙酯萃取。将有机层用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。将粗产物通过硅胶柱色谱纯化,用己烷中的15-50%乙酸乙酯梯度洗脱,以得到白色固体(0.09g,23%)。1hnmr(300mhz,cdcl3):δ7.66-7.61(m,2h),7.59-7.55(m,1h),7.47-7.44(m,2h),4.02-3.97(m,2h),2.70-2.56(tt,2h,j=6.6,14.7hz)。19fnmr(282mhz,cdcl3):δ-106.0to-106.1(t,j=15hz)。
制备例12:3,3-二氟吡咯烷-2-酮
向1-苯甲酰基-3,3-二氟吡咯烷-2-酮(0.085g,0.4mmol,1.0当量)于无水四氢呋喃(1ml)中的溶液中添加辛胺(0.075ml,0.5mmol,1.1当量),并将反应物在室温下搅拌16小时。将混合物在减压下浓缩以提供黄色油。将粗残余物通过硅胶柱色谱纯化,用己烷中的50-100%乙酸乙酯梯度洗脱,以得到白色固体(0.024g,52%产率)。1hnmr(300mhz,cdcl3):δ7.93(brs,1h),3.50-3.46(brt,2h,j=6.0hz),2.63-2.48(tt,2h,j=6.6,15.2hz)。19fnmr(282mhz,cdcl3):δ-107.33至-107.44(t,j=15.2hz)。13cnmr(75mhz,cdcl3):δ167.5-166.7(t,j=31hz),121.1-114.4(t,j=248hz),37.1(t,j=3.3hz),31.2-30.6(t,j=23.1hz)。
制备例13:1-苄基-3-甲基吡咯烷-2-酮;通用程序
向1-苄基-2-吡咯烷酮(0.422g,2.4mmol,1.0当量)于无水四氢呋喃(15ml)中的冷-78℃溶液中添加二异丙基氨基锂(2.4ml的2m溶液,4.8mmol,2.0当量),并将所得红色溶液在-78℃下搅拌30分钟,并添加碘甲烷(0.6ml,9.6mmol,4.0当量)。将溶液在-78℃下搅拌1小时,并使其缓慢温热至室温,持续16小时。添加饱和氯化铵水溶液并将混合物用乙酸乙酯萃取。将有机级分用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。将粗产物通过硅胶柱色谱纯化,用己烷中的35-80%乙酸乙酯梯度洗脱,以提供作为褐色液体的产物(0.374g,82%)。1hnmr(300mhz,cdcl3):δ7.37-7.34(m,5h),4.52-4.41和4.46-4.41(abq,2h,j=14.6hz),3.27-3.15(m,2h),2.60-2.46(m,1h),2.28-2.15(m,1h),1.68-1.58(m,1h),1.28-1.25(d,3h,j=7.2hz)。
类似地制备以下化合物:
制备例14:1-苄基-3-环己基哌啶-2-酮
在氮气气氛下,将10%碳载钯(0.09g)添加至1-苄基-3-(环己-2-烯-1-基)哌啶-2-酮(0.6g,2.3mmol)于乙醇(10ml)中的溶液。将混合物置于氢气气氛下并搅拌2天。将悬浮液过滤通过硅藻土,并在减压下浓缩,以提供作为澄清液体的期望产物(0.578g,98%)。1hnmr(300mhz,cdcl3):δ7.33-7.22(m,5h),4.66-4.61和4.59-4.54(abq,2h,j=14.7hz),3.19-3.14(m,2h),2.34-2.21(m,2h),1.86-1.52(m,9h),1.39-1.04(m,5h);esi(m/z):272.2(m+h)。
制备例15:1-苄基-3-苯基哌啶-2-酮
根据来自defilippis,a.等人tetrahedron,2004,60,9757的程序合成。向n-苄基-2-哌啶酮(1.326g,7.0mmol,2.2当量)于无水四氢呋喃(14ml,0.5m)中的冷(-20℃)搅拌溶液中添加双(三甲基甲硅烷基)氨基锂(6.4ml的无水四氢呋喃中的1m溶液,6.4mmol,2.0当量),并将混合物在-20℃下搅拌20分钟。添加氯化锌(0.955g,7.0mmol,2.2当量)于无水四氢呋喃(8ml)中的溶液,并在-20℃下将溶液搅拌20分钟。将所得溶液用套管插入(cannulated)2-二环己基膦基-2'-(n,n-二甲基氨基)联苯(0.094g)、三(二亚苄基丙酮)二钯(0)(0.092g)和溴苯(0.335ml,3.2mmol,1.0当量)于无水四氢呋喃(6ml)中的溶液中,并将所得混合物在70℃下加热6小时。将反应物用氯化铵水溶液淬灭并用乙酸乙酯萃取。将有机级分用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。将粗产物通过硅胶柱色谱纯化,用己烷中的15-60%乙酸乙酯梯度洗脱,以得到黄色液体(0.629g,74%)。1hnmr(300mhz,cdcl3):δ7.38-7.21(m,10h),4.74-4.69和4.66-4.61(ab,2h,j=14.4hz),3.77-3.72(dd,1h,j=6.0,8.1hz),3.41-3.28(m,2h),2.23-2.13(m,1h),2.05-1.69(m,3h)。
制备例16:3-甲基吡咯烷-2-酮
将三氟甲磺酸(0.604ml,6.8mmol,4.0当量)添加至1-苄基-3-甲基吡咯烷-2-酮(0.323g,1.7mmol,1.0当量)于甲苯(2ml,1m)中的溶液。将混合物在195℃下在微波反应器中加热25分钟。将混合物倒入少量饱和碳酸氢钠水溶液中,用乙酸乙酯萃取,用饱和氯化钠水溶液洗涤,并将合并的水层用乙酸乙酯再次萃取。将合并的有机级分经无水硫酸钠干燥,过滤并在真空中浓缩。将粗残余物通过硅胶柱色谱纯化,用二氯甲烷中的0-10%甲醇洗脱,以得到期望产物(0.087g)。1hnmr(300mhz,cdcl3):δ6.49(brs),3.37-3.26(m,2h),2.53-2.28(m,2h),1.80-1.65(m,1h),1.21-1.19(d,3h,j=6.6hz)。
类似地制备以下化合物:
制备例17:1-苄基-3-(1-羟基环丁基)吡咯烷-2-酮
向1-苄基-2-吡咯烷酮(1.0g,5.7mmol,1.0当量)于无水四氢呋喃(19ml)中的冷(-78℃)溶液中添加二异丙基氨基锂(3.15ml的四氢呋喃中的2m溶液,1.1当量),并将混合物在-78℃下搅拌1小时。添加环丁酮(0.426ml,5.7mmol,1.0当量)和三氟化硼二乙基醚合物(0.704ml,5.7mmol,1.0当量),并将反应混合物在-78℃下搅拌4小时。将反应物用饱和氯化铵水溶液淬灭并用乙酸乙酯萃取。将有机级分用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在减压下浓缩。将粗产物通过硅胶柱色谱纯化,用己烷中的50-100%乙酸乙酯梯度从硅胶洗脱,以得到白色固体(0.714g,51%)。1hnmr(300mhz,cdcl3):δ7.36-7.20(m,5h),4.56-4.51和4.42-4.37(ab,2h,j=14.7hz),4.24(s,1h),3.28-3.21(m,2h),2.78-2.72(t,1h,j=2.7hz),2.34-1.89(m,7h),1.66-1.52(m,1h);esi(m/z):246.0(m+h)。
类似地制备以下化合物:
制备例18:1-苄基-3-环亚丁基吡咯烷-2-酮:
向1-苄基-3-(1-羟基环丁基)吡咯烷-2-酮(0.7g,2.9mmol,1.0当量)于无水二氯甲烷(12ml)中的冷(0℃)溶液中添加n,n-二异丙基乙胺(2.485ml,14.3mmol,5.0当量)、n,n-4-二甲基氨基吡啶(0.07g,0.6mmol,0.2当量)和甲磺酰氯(0.331ml,4.3mmol,1.5当量)。将混合物在0℃下搅拌2小时,在室温下搅拌16小时并在回流下搅拌3小时。将混合物冷却至室温并分配于乙酸乙酯和饱和氯化铵水溶液之间。将有机层用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩,以提供橙色油。将粗产物通过硅胶柱色谱纯化,用己烷中的20-60%乙酸乙酯梯度洗脱,以得到黄色油(0.25g,38%)。1hnmr(300mhz,cdcl3):δ7.33-7.23(m,5h),4.47(s,2h),3.27-3.19(m,4h),2.75-2.69(m,2h),2.52-2.46(m,2h),2.18-2.08(quint,2h,j=7.8hz);esi(m/z):228.2(m+h)。
类似地制备以下化合物:
制备例19:1-苄基-3-环丁基吡咯烷-2-酮
向1-苄基-3-环亚丁基吡咯烷-2-酮(0.25g,1.0mmol)于乙醇(11ml)中的溶液中添加10%碳载钯(0.05g),并将反应混合物在氢气气氛下搅拌72小时。将混合物过滤通过硅藻土,并在减压下浓缩,以提供澄清油(0.242g,100%)。1hnmr(300mhz,cdcl3):δ7.34-7.20(m,5h),4.49-4.47和4.40-4.35(abq,2h,j=14.4hz),3.18-3.13(m,2h),2.69-2.47(m,2h),2.20-1.64(m,8h);esi(m/z):230.2(m+h)。
类似地制备以下化合物:
制备例20:3-环丁基吡咯烷-2-酮:
与制备例18类似地由1-苄基-3-环丁基吡咯烷-2-酮制备。1hnmr(300mhz,cdcl3):δ5.45(brs,1h),3.34-3.27(m,2h),2.65-2.54(m,1h),2.43-2.35(m,1h),2.28-1.79(m,8h)。
类似地制备以下化合物:
制备例21:n1-环己基乙烷-1,2-二胺
向环己酮(6.26g,63.8mmol)、乙二胺(42.64ml,637.8mmol,10.0当量)、乙酸(36.515ml,637.8mmol,10.0当量)和4å分子筛(25g)于无水甲醇(250ml)中的混合物中添加氰基硼氢化钠(8.017g,127.6mmol,2.0当量)。将混合物搅拌48小时,过滤以去除固体,并浓缩为半固体。将粗材料溶解于3n氢氧化钠水溶液(150ml)中并用二氯甲烷萃取三次。合并的有机级分用弱碱性饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩,以提供淡黄色液体,将其通过真空蒸馏纯化,以得到透明液体(4.1g,45%)。1hnmr(300mhz,cdcl3):δ2.80-2.76(td,2h,j=0.9,6.0hz),2.68-2.64(td,2h,j=0.9,6.0hz),2.43-2.34(m,1h),1.89-1.83(m,2h),1.74-1.70(m,2h),1.62-1.57(m,1h),1.32-0.98(m,8h)。
制备例22:3-(环丁基氨基)丙腈
在室温下,经15分钟将环丁胺(5.90ml,59.8mmol,1.0当量)逐滴添加至丙烯腈(4.76g,89.7mmol,1.5当量)于甲醇(7ml)中的溶液。将混合物在室温下搅拌30分钟并在回流下搅拌1小时,冷却至室温,在减压下浓缩,并将期望产物在真空下蒸馏以提供澄清液体(7.7g,98%)。1hnmr(300mhz,cdcl3):δ3.29-3.21(m,1h),2.88-2.83(t,2h,j=6.6hz),2.50-2.46(t,2h,j=6.6hz),2.26-2.20(m,2h),1.76-1.63(m,4h),1.30(brs,1h)。
制备例23:n1-环丁基丙烷-1,3-二胺
经45分钟向氢化锂铝(3.056g,80.5mmol,2.0当量)于无水乙醚(120ml)中的冷(0℃)悬浮液中逐滴添加3-(环丁基氨基)丙腈(5.0g,40.3mmol,1.0当量)于无水二乙醚(40ml)中的溶液。将反应混合物在室温下搅拌15分钟并在回流下搅拌4小时,冷却至室温并搅拌1小时。将混合物冷却至0℃并剧烈搅拌,同时逐滴添加水(3.1ml),随后逐滴添加15%氢氧化钠水溶液(3.1ml),最后逐滴添加水(9.3ml)。将所得浆料温热至室温,搅拌15分钟,并添加硫酸镁,再搅拌15分钟。通过过滤通过烧结玻璃过滤器(glassfrittedfilter)、用温热二氯甲烷洗涤多次而去除固体材料,并将有机溶液在减压下浓缩,以得到作为淡黄色液体的期望产物(3.44g,66%)。1hnmr(300mhz,cdcl3):δ3.14(m,1h),2.69-2.62(m,2h),2.53-2.45(m,2h),2.13-2.10(m,2h),1.56-1.48(m,6h),1.33(brs,3h)。
制备例24:3-(环戊基氨基)丙腈
在室温下,将环戊胺(5.794ml,58.7mmol,1.0当量)逐滴添加至丙烯腈(5.79ml,88.1mmol,1.5当量)于甲醇(7ml)中的溶液。将溶液在室温下搅拌30分钟并在回流下搅拌1小时,冷却至室温,在减压下浓缩,并将期望产物在真空下蒸馏以提供澄清液体(7.4g,91%)。1hnmr(300mhz,cdcl3):δ3.14-3.04(quin,1h,j=6.3hz),2.91-2.87(t,2h,j=6.9hz),2.53-2.48(td,2h,j=0.9,6.9hz),1.88-1.78(m,2h),1.73-1.49(m,4h),1.36-1.24(m,2h),1.19(brs,1h)。
制备例25:n1-环戊基丙烷-1,3-二胺
经45分钟向氢化锂铝(3.295g,86.8mmol,2.0当量)于无水二乙醚(150ml)中的冷(0℃)悬浮液中逐滴添加3-(环戊基氨基)丙腈(6.0g,43.4mmol,1.0当量)于无水二乙醚(40ml)中的溶液。将反应混合物在室温下搅拌15分钟并在回流下搅拌4小时,冷却至室温并搅拌1小时。将混合物冷却至0℃并剧烈搅拌,同时逐滴添加水(3.4ml),随后逐滴添加15%氢氧化钠水溶液(3.4ml),最后逐滴添加水(10.2ml)。将所得浆料温热至室温,搅拌15分钟,并添加硫酸镁,再搅拌15分钟。通过过滤通过烧结玻璃过滤器、用温热二氯甲烷洗涤多次而去除固体材料,并将有机溶液在减压下浓缩,以得到作为澄清油的期望产物(4.5g,73%)。1hnmr(300mhz,cdcl3):δ3.05-2.96(quint,1h,j=6.6hz),2.74-2.71(t,2h,j=6.6hz),2.68-2.58(t,2h,j=6.9hz),1.85-1.68(m,2h),1.62-1.42(m,6h),1.34(brs,3h),1.30-1.21(m,2h)。
制备例26:1-((3-(环己基氨基)丙基)氨基)-3-(3,6-二氟-9h-咔唑-9-基)-2-甲基丙-2-醇;通用程序
向n-环己基-1,3-丙二胺(或其它n-官能化的1,3-丙二胺,8.0当量)于乙醇中的溶液(1m)中添加3,6-二氟-9-((2-甲基环氧乙烷-2-基)甲基)-9h-咔唑(1.0当量,或可替代地3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑),并将反应混合物在70℃下搅拌16小时或直至通过lcms确定反应完成,冷却至室温,在真空中浓缩,以得到粗残余物,其通过柱色谱纯化,用二氯甲烷中的甲醇的适当梯度和0.1%三乙胺从hp硅胶洗脱,以得到期望产物。
制备例27:(1-氨基-1-氧代丙-2-基)氨基甲酸叔丁酯
将boc-dl-丙氨酸(5.0g,26.4mmol,1.0当量)、n,n,n′,n′-四甲基-o-(1h-苯并三唑-1-基)脲鎓六氟磷酸盐(15.033g,39.6mmol,1.5当量)、n,n-二异丙基乙胺(8.735ml,52.9mmol,2.0当量)和无水二甲基甲酰胺(50ml)的混合物在室温下搅拌20分钟,然后用冰-水冷却,并将氨(2.250g,132.1mmol,5.0当量)缓慢鼓泡至混合物中。在密封容器中将反应物在室温下搅拌3小时。将反应物用水稀释并用乙酸乙酯萃取。将有机层用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。将获得的固体用冷乙酸乙酯和乙醚洗涤并干燥,以提供作为白色粉末的产物(2.9g,58%)。1hnmr(300mhz,cdcl3):δ6.20(brs,1h),5.50(brs,1h),5.00(brs,1h),4.20(m,1h),1.47(s,9h),1.40(d,3h,j=7.2hz)。
制备例28:(1-氨基丙-2-基)氨基甲酸叔丁酯
将(1-氨基-1-氧代丙-2-基)氨基甲酸叔丁酯(2.2g)溶解于无水四氢呋喃(100ml)中并添加硼烷(四氢呋喃中的40ml的1m溶液)。将混合物在室温下搅拌2小时,然后在90℃下加热2小时。冷却至室温之后,将反应物用甲醇淬灭,直至不产生气泡。将混合物在90℃下加热1小时,然后浓缩至干燥,以提供作为浆料(syrup)的粗产物(2.2g),其直接用于下一步骤反应。1hnmr(300mhz,cdcl3):δ4.60(brs,1h),3.65(m,1h),2.76(dd,1h,j=12.9,5.1hz),2.64(dd,1h,j=12.9,6.3hz),1.47(s,9h),1.14(d,3h,j=6.9hz)。
制备例29:(1-((3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯
在氮气气氛下,将3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.7g)和(1-氨基丙-2-基)氨基甲酸叔丁酯(1.5g)于乙醇(50ml)中的溶液在70℃下搅拌16小时。将混合物在减压下浓缩并通过硅胶柱色谱纯化,用二氯甲烷中的0-20%甲醇梯度洗脱,以得到灰白色泡沫(1.28g)。产物未经额外纯化即直接用于下一步骤:1hnmr(300mhz,cdcl3):δ7.67(dd,2h,j=8.7,2.7hz),7.42-7.37(m,2h),7.22(td,2h,j=9.0,2.7hz),4.55-4.30(m,3h),4.13(m,1h),3.78(brs,1h),2.88和2.82(dd,1h,j=12.0,3.6hz),2.70-2.50(m,3h),1.45(s,9h),1.13和1.11(d,3h,j=6.6hz);esi(m/z):434.0(m+h)。
制备例30:3-(环丙基氨基)丙腈
在室温下,将环丙胺(4.214ml,60.8mmol,1.0当量)缓慢添加至丙烯腈(4.840g,91.2mmol,1.5当量)于甲醇(7ml)中的溶液并搅拌30分钟。将反应物加热至回流并搅拌1小时,冷却,浓缩并在真空下蒸馏,以得到5.5g澄清液体(5.5g,82%)。1hnmr(300mhz;cdcl3):δ2.99(t,2h,j=6.3hz),2.51(t,2h,j=6.3hz),2.12(m,1h),1.78(brs,1h),0.49-0.32(m,4h);esi(m/z):111.5(m+h)。
制备例31:n1-环丙基丙烷-1,3-二胺
经十分钟向氢化锂铝(3.445g,90.8mmol,2.0当量)于无水四氢呋喃(120ml)中的冷(0℃)悬浮液中缓慢添加3-(环丙基氨基)丙腈(5.000g,45.4mmol,1.0当量)于无水四氢呋喃(20ml)中的溶液。将反应物在室温下搅拌15分钟,然后加热至回流并搅拌3小时。将混合物冷却至室温,并添加硫酸钠十水合物,直至发泡停止。将悬浮液搅拌10分钟并将固体滤出(用四氢呋喃洗涤)。将溶液在减压下浓缩,以得到粗产物,其直接用于下一步骤。1hnmr(300mhz,cdcl3):δ2.74-2.69(m,4h),2.10-2.04(m,1h),1.65-1.56(m,2h),0.43-0.27(m,4h);esi(m/z):115.4(m+h)。
制备例32:1-乙基四氢嘧啶-2(1h)-酮;从二胺合成脲的通用方法
在剧烈搅拌下,将适当的n-官能化的1,3-丙二胺或1,2-乙二胺(10.0mmol,1.0当量)添加至1,1'-羰基二咪唑(1.622g,10.0mmol,1.0当量)于无水四氢呋喃(0.05m)中的溶液中,将其用外部冰浴保持在0℃。将溶液缓慢温热至室温并搅拌16小时。将混合物通过以下任一种后处理:i)将混合物在减压下浓缩并通过柱色谱纯化,用二氯甲烷中的甲醇梯度从硅胶洗脱,以得到期望产物;或ii)将混合物用乙酸乙酯稀释,并依次用1n盐酸水溶液洗涤两次,并用饱和氯化钠水溶液洗涤一次,用乙酸乙酯反萃取有机层一次,经无水硫酸钠干燥合并的有机级分,过滤,并在真空中浓缩,以提供期望产物,其不经进一步纯化即使用。
制备例31:1-乙基-3-(环氧乙烷-2-基甲基)四氢嘧啶-2(1h)-酮;用于制备(环氧乙烷-2-基甲基)-官能化的脲的通用方法
向1-乙基四氢嘧啶-2(1h)-酮或制备例6中产生的替代环脲(1.0当量)于无水四氢呋喃中的溶液(0.2m)中添加矿物油中的60%氢化钠(1.1当量),并将所得悬浮液在室温下搅拌1小时。添加表溴醇(3.0当量)并将混合物在室温或35℃下搅拌24小时。添加硅胶,并将悬浮液在减压下浓缩,并通过硅胶柱色谱直接纯化-用二氯甲烷中的甲醇的适当梯度洗脱期望产物。
制备例32:1-乙基-3-((2-甲基环氧乙烷-2-基)甲基)四氢嘧啶-2(1h)-酮;用于制备n-((2-甲基环氧乙烷-2-基)甲基)官能化的脲的通用方法
向制备例7中产生的替代环脲(1.0当量)于无水四氢呋喃中的溶液(0.2m)中添加矿物油中的60%氢化钠(1.1当量),并将所得悬浮液在室温下搅拌1小时。在室温下添加2-(氯甲基)-2-甲基环氧乙烷(4.0当量),并将混合物在70-90℃下在密封管中搅拌过夜。添加硅胶,并将悬浮液在减压下浓缩,并通过硅胶柱色谱直接纯化-用二氯甲烷中的甲醇梯度洗脱期望产物。
制备例33:3-(甲基氨基)丁腈
将甲胺(158.584ml的40%w/w水溶液,1842.3mmol,10.0当量)和丁烯腈(15ml,184.2mmol,1.0当量)的混合物在室温下搅拌16小时。将反应物用二氯甲烷(3x100ml)萃取并将合并的有机层经无水硫酸钠干燥,过滤并在真空中浓缩,以提供作为无色油的期望产物(18g,100%)。1hnmr(300mhz,cdcl3):δ2.96(m,1h),2.47(d,2h,j=6.0hz),2.46(s,3h),1.36(d,3h,j=6.6hz)。
制备例34:n3-甲基丁烷-1,3-二胺
将parr振荡烧瓶装入甲醇(100ml),冷却至0℃并用氨鼓泡。添加3-(甲基氨基)丁腈(4.8g,48.9mmol,1.0当量)和一匙的raneyni。将反应物在氢气下在50psi下振荡10小时。将反应物过滤通过硅藻土并将滤液在真空中浓缩,以提供澄清油(5.0g,100%)。1hnmr(300mhz,cdcl3):δ2.90-2.60(m,3h),2.43(s,3h),1.70-1.40(m,2h),1.08(d,3h,j=6.0hz)。
制备例35:1,6-二甲基四氢嘧啶-2(1h)-酮
在0℃下向n3-甲基丁烷-1,3-二胺(5.0g,48.9mmol,1.0当量)于无水四氢呋喃(100ml)中的搅拌溶液中添加1,1'-羰基二咪唑(7.935g,48.9mmol,1.0当量)。将混合物缓慢温热至室温并搅拌16小时。将反应物在减压下浓缩,并将残余物用饱和氯化铵水溶液处理并用二氯甲烷萃取两次。将合并的有机层用饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。将残余物通过硅胶柱(0-20%乙醇/二氯甲烷)纯化,以提供作为白色固体的期望产物(1.8g,29%)。1hnmr(300mhz,cdcl3):δ4.66(brs,1h),3.53-3.35(m,2h),3.25(m,1h),2.95(s,3h),2.05(m,1h),1.70(m,1h),1.24(d,3h,j=6.3hz)。
制备例36:2-(氨基甲基)-n-苄基苯胺
在氮气气氛下,将2-(苄基氨基)苯甲腈(4.0g,19.2mmol,1.0当量)于无水四氢呋喃(25ml)中的溶液缓慢添加至氢化锂铝(2.187g,57.6mmol,3.0当量)于无水四氢呋喃(60ml)中的冷(0℃)悬浮液。将混合物冷却,并添加硫酸钠十水合物,直至发泡停止(用外部水/冰浴冷却)。将混合物过滤以去除固体并将溶液在真空中浓缩,以得到澄清液体(3.2g,79%)。1hnmr(300mhz,cdcl3):δ7.42-7.23(m,5h),7.17-7.11(td,1h,j=1.8,7.5hz),7.07-7.04(m,1h),6.68-6.61(m,2h),6.29(brs,1h),4.40(s,2h),3.99(s,2h),1.31(brs,2h)。
制备例37:1-苄基-3,4-二氢喹唑啉-2(1h)-酮
向2-(氨基甲基)-n-苄基苯胺(1.5g,7.1mmol,1.0当量)于无水四氢呋喃(142ml)中的溶液中添加1,1'-羰基二咪唑(1.318g,8.1mmol,1.1当量),并将溶液在室温下搅拌24小时。添加1n盐酸水溶液(20ml)并将混合物用乙酸乙酯萃取三次。将有机级分用无水硫酸钠干燥,过滤并在真空中浓缩,以提供白色固体(1.68g,99%)。1hnmr(300mhz,cdcl3):δ7.33-7.20(m,5h),7.11-7.03(m,2h),6.95-6.91(m,1h),6.74-6.71(d,1h,j=8.1hz),5.13(s,2h),4.54(s,2h),1.60(brs,2h)。esi(m/z):239.2(m+h)。
制备例38:1-苄基-3-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3,4-二氢喹唑啉-2(1h)-酮
向1-苄基-3,4-二氢喹唑啉-2(1h)-酮(0.105g,0.4mmol,1.8当量)于无水二甲基甲酰胺(1ml)中的搅拌溶液中添加矿物油中的60%氢化钠(0.01g,0.3mmol,1.0当量),并将混合物搅拌30分钟。添加3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.065g,0.3mmol,1.0当量),并将混合物在55℃下搅拌16小时。将混合物倒入饱和氯化铵水溶液并用乙酸乙酯萃取三次。将有机级分经无水硫酸钠干燥,过滤并浓缩,以提供褐色油。将粗残余物通过硅胶柱色谱纯化,用20-60%乙酸乙酯/己烷的梯度洗脱,以得到产物(35%),其未经额外纯化即直接用于下一步骤。esi(m/z):498.2(m+h);hplc分析:(c18,水中的5-95%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):15.2分钟,51%。
制备例39:1-苄基-3-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基-2-甲基丙基)-3,4-二氢喹唑啉-2(1h)-酮
向1-苄基-3,4-二氢喹唑啉-2(1h)-酮(0.099g,0.4mmol,1.8当量)于无水二甲基甲酰胺(1ml)中的搅拌溶液中添加矿物油中的60%氢化钠(0.01g,0.3mmol,1.0当量),并将混合物搅拌30分钟。添加3,6-二氟-9-((2-甲基环氧乙烷-2-基)甲基)-9h-咔唑(0.065g,0.2mmol,1.0当量),并将混合物在55℃下搅拌16小时。将混合物倒入饱和氯化铵水溶液并用乙酸乙酯萃取三次。将有机级分经硫酸钠干燥,过滤并浓缩,以提供褐色油。将粗残余物通过硅胶柱色谱纯化,用20-60%乙酸乙酯/己烷的梯度洗脱,以得到灰白色固体(0.086g,65%)。1hnmr(300mhz,cdcl3):δ7.66-7.62(dd,2h,j=2.4,8.7hz),7.45-7.40(dd,2h,j=4.1,8.9hz),7.30-7.09(m,8h),7.04-6.93(m,2h),6.75-6.72(d,1h,j=8.1hz),5.20-5.15和5.08-5.03(abq,2h,j=16.6hz),4.74-4.69和4.59-4.54(abq,2h,j=14.3hz),4.39-4.34和4.32-4.26(abq,2h,j=15.3hz),4.09(s,1h),3.97-3.93和3.51-3.47(abq,2h,j=14.4hz),1.36(s,3h);esi(m/z):512.3(m+h)。
制备例40:(r)-(2-甲基环氧乙烷-2-基)甲醇
将粉碎的4å活化分子筛(15.0g)和二氯甲烷(300ml)的混合物冷却至-10℃,通过注射器添加异丙醇钛(iv)(2.072ml,7.0mmol,0.05当量)和(-)-d-酒石酸二乙酯(2.126g,10.3mmol,0.07当量),随后添加80%氢过氧化枯烯(50.000g,262.8mmol,1.8当量)。将混合物在-10℃下搅拌30分钟。将混合物冷却至-35℃,并经30分钟以1-2ml部分通过注射器添加2-甲基-2-丙烯-1-醇(10.620g,147.3mmol,1.0当量)于二氯甲烷(10ml)中的溶液。将反应混合物在-35℃下搅拌1小时,然后在-20℃冷冻机中放置3天。将混合物温热至0℃,添加水并在室温下搅拌30分钟。将混合物冷却至0℃并添加30%氢氧化钠于饱和氯化钠水溶液中的溶液(10ml),并在该温度下搅拌1小时。将混合物过滤通过硅藻土垫并用二氯甲烷(50ml)洗涤。将水性部分分离并用二氯甲烷(3x30ml)萃取。将有机层合并并干燥(无水硫酸镁),过滤并在真空中浓缩,以得到无色液体。将粗残余物通过硅胶柱色谱纯化,用20-100%二乙醚/己烷的梯度洗脱,以得到无色油(6.2349g,48%)。1hnmr(300mhz,cdcl3):δ3.76(dd,1h,j=4.5,12.3hz),3.6(dd,1h,j=8.1,12.3hz),2.92(d,1h,j=4.5hz),2.66(d,1h,j=4.8hz),1.79(brm,1h),1.36(s,3h)。
以类似的方式由(+)-酒石酸二乙酯合成(s)对映异构体。
制备例41:(s)-3-硝基苯磺酸(2-甲基环氧乙烷-2-基)甲酯
在-20℃下,经15分钟向(r)-(2-甲基环氧乙烷-2-基)甲醇(5.000g,56.8mmol,1.0当量)、n,n-4-二甲基氨基吡啶(0.100g,0.8mmol,1.4mol%)和n,n-二异丙基乙胺(15.776ml,88.9mmol,2.0当量)于无水二氯甲烷(100ml)中的搅拌溶液中以小份缓慢添加3-硝基苯磺酰氯(15.092g,68.1mmol,1.2当量)。使混合物达到0℃并搅拌3小时。将反应物用水淬灭并用二氯甲烷萃取。将合并的有机层依次用水、1n盐酸水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤。将有机层干燥(无水硫酸钠),过滤并在真空中浓缩。将粗残余物通过硅胶柱(0-80%乙酸乙酯/己烷)纯化,以提供作为黄色油的期望产物(6.73g,43.4%)。1hnmr(300mhz,cdcl3):δ8.77(t,1h,j=1.8hz),8.54(m,1h),8.27(m,1h),7.84(t,1h,j=7.95hz),4.29(d,1h,j=11.1hz),4.05(d,1h,j=11.1hz),2.73(dd,2h,j=17.7,4.8hz),1.37(s,3h)。
以类似的方式合成(r)对映异构体。
制备例42:(s)-9-(环氧乙烷-2-基甲基)-9h-咔唑
在0℃下,向咔唑(5.15g,30.8mmol,1.0当量)于无水二甲基甲酰胺(100ml)中的搅拌溶液中添加矿物油中的60%氢化钠(1.355g,33.9mmol,1.1当量),并将混合物在0℃下搅拌1小时。添加(r)-(-)-间硝基苯磺酸缩水甘油酯(9.981g,38.5mmol,1.3当量)并将反应混合物搅拌1小时,然后缓慢温热至室温并搅拌16小时。将混合物分配于水和乙酸乙酯之间。将有机层用饱和氯化钠水溶液洗涤,干燥(无水硫酸钠),过滤并在减压下浓缩,以得到红色油。将粗残余物通过硅胶柱(15-80%二氯甲烷/己烷)纯化,以提供作为白色固体的期望产物(4.95g,72%)。1hnmr(300mhz,cdcl3):δ8.11-8.08(dt,2h,j=0.9,7.5hz),7.48-7.46(m,4h),7.28-7.23(m,2h),4.67-4.61(dd,1h,j=2.4,15.9hz),4.45-4.38(dd,1h,j=5.0,15.9hz),3.39-3.34(m,1h),2.83-2.80(t,1h,j=4.2hz),2.60-2.57(dd,1h,j=2.4,4.8hz)。hplc分析:(c18,水中的5-95%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):13.2分钟,99.5%。手性hplc分析:(chiralcelad-h,己烷中的5-15%异丙醇,经20分钟:保留时间,在254nm的%面积):8.12分钟,3.8%;8.54分钟,96.1%(92.2%ee)。
类似地制备以下化合物:
制备例43:(1s,4r)-2-氮杂双环[2.2.1]庚-3-酮
将(1r)-(-)-2-氮杂双环[2.2.1]庚-5-烯-3-酮(1.0g,9.2mmol)和10%碳载钯(0.4g)于甲醇(50ml)中的混合物在氢气气氛下搅拌3小时。将混合物过滤通过硅藻土并将滤饼用甲醇洗涤。将合并的有机物在真空中浓缩以提供所需产物(1g,98%)。1hnmr(300mhz,cdcl3):δ5.91(brs,1h),3.89(s,1h),2.74(s,1h),1.96-1.59(m,5h),1.42-1.37(m,1h)。
制备例44:(1r,4s)-2-氮杂双环[2.2.1]庚-3-酮
将(1s)-(+)-2-氮杂双环[2.2.1]庚-5-烯-酮(1.0g,9.2mmol,1.0当量)和10%碳载钯(0.4g)于甲醇(40ml)中的混合物在氢气气氛下在室温下搅拌2小时。将混合物过滤通过硅藻土并将滤饼用甲醇洗涤。将合并的有机物在真空中浓缩以提供所需产物(1g,98%)。1hnmr(300mhz,cdcl3):δ5.83(brs,1h),3.89(s,1h),2.74(s,1h),1.96-1.59(m,5h),1.42-1.38(m,1h)。
制备例45:(r)-5-(羟基甲基)-2-吡咯烷酮对甲苯磺酸酯
将(r)-(-)-5-(羟基甲基)-2-吡咯烷酮(1.0g,8.7mmol,1.0当量)溶解于二氯甲烷(40ml)中。在冰冷却下添加三乙胺(1.569ml,11.3mmol,1.3当量)、对甲苯磺酰氯(1.904g,10.0mmol,1.1当量)和4-(二甲基氨基)吡啶(0.12g),并将混合物在室温下搅拌18小时。将反应混合物在减压下浓缩,添加0.5n盐酸水溶液,并将混合物用乙酸乙酯萃取。将有机层用0.5n盐酸水溶液、水、饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤。将有机级分干燥(无水硫酸钠),过滤并在减压下浓缩,以提供白色固体(1.91g,81%)。1hnmr(300mhz,cdcl3):δ7.79-7.76(m,2h),7.38-7.35(m,2h),5.73(brs,1h),4.08-4.04(dd,1h,j=3.5,9.5hz),3.98-3.93(m,1h),3.85-3.82(dd,1h,j=7.5,9.5hz),2.47(s,3h),2.36-2.22(m,3h),1.81-1.73(m,1h)。
制备例46:(s)-5-(碘甲基)吡咯烷-2-酮
将(s)-4-甲基苯磺酸(5-氧代吡咯烷-2-基)甲酯(4.5g,16.7mmol,1.0当量)溶解于无水乙腈(140ml)中,添加碘化钠(5.009g,33.4mmol,2.0当量),并将混合物加热至回流持续8小时。将反应混合物冷却至室温,在减压下浓缩,添加水并将混合物用乙酸乙酯萃取。将有机层用饱和硫代硫酸钠水溶液、水和饱和氯化钠水溶液洗涤。将有机级分干燥(无水硫酸钠),过滤并在真空中浓缩,以得到作为白色固体的标题化合物(2.0g,53%)。1hnmr(300mhz,cdcl3):δ6.42(brs,1h),3.90-3.82(s,1h),3.27-3.16(m,2h),2.53-2.29(m,3h),1.88-1.17(m,1h)。
制备例47:(r)-5-(碘甲基)吡咯烷-2-酮
将(r)-5-(羟基甲基)-2-吡咯烷酮对甲苯磺酸酯(1.9g,7.1mmol,1.0当量)溶解于无水乙腈(60ml)中,添加碘化钠(2.09g),并将混合物在回流下加热8小时。将反应混合物冷却至室温,在减压下浓缩,添加水并将混合物用乙酸乙酯萃取。将有机层用饱和硫代硫酸钠水溶液、水和饱和氯化钠水溶液洗涤。将有机级分干燥(无水硫酸钠),过滤并在真空中浓缩,以得到作为灰白色固体的标题化合物(0.97g,61%)。1hnmr(300mhz,cdcl3):δ5.92(brs,1h),3.89-3.85(m,1h),3.28-3.15(m,2h),2.53-2.30(m,3h),1.88-1.78(m,1h)。
制备例48:(r)-5-甲基吡咯烷-2-酮
将(s)-5-(碘甲基)吡咯烷-2-酮(2.0g,8.9mmol,1.0当量)溶解于乙醇(60ml)中,添加碳酸钠(1.036g,9.8mmol,1.1当量)和10%碳载钯(0.4g),并将混合物在氢气气氛下搅拌16小时。将混合物过滤通过硅藻土并将滤液在减压下浓缩,以提供橙色半固体。向获得的残余物中添加5%硫代硫酸钠水溶液,并将混合物用乙酸乙酯萃取。将有机层干燥(无水硫酸钠),过滤并在真空中浓缩,以得到作为淡黄色油的标题化合物(0.564g,64%)。1hnmr(300mhz,cdcl3):δ6.61(brs,1h),3.82-3.72(sext,1h,j=6.6hz),2.45-2.22(m,3h),1.71-1.59(m,1h),1.23-1.21(d,3h,j=6.6hz)。
制备例49:(s)-5-甲基吡咯烷-2-酮
将(s)-5-碘甲基吡咯烷-2-酮(1.12g)溶解于乙醇(30ml)中,添加碳酸钠(0.53g)和10%碳载钯(0.22g),并将混合物在氢气气氛下搅拌8小时。将混合物过滤通过硅藻土并将滤液在减压下浓缩。向获得的残余物中添加5%硫代硫酸钠水溶液,并将混合物用乙酸乙酯萃取。将有机层干燥(无水硫酸钠),过滤并在真空中浓缩,以得到标题化合物(0.263g,61%)。1hnmr(300mhz,cdcl3):δ6.34(brs,1h),3.83-3.72(sext,1h,j=6.3hz),2.46-2.21(m,3h),1.72-1.60(m,1h),1.23-1.21(d,3h,j=6.0hz)。
制备例50:(s)-1-((2-氨基乙基)氨基)-3-(3,6-二氟-9h-咔唑-9-基)丙-2-醇
将(r)-3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.1g,0.4mmol,1.0当量)和乙二胺(0.232g,3.9mmol,10.0当量)于乙醇(2ml)中的混合物在55℃下搅拌5小时。将反应混合物冷却至室温,并在真空中浓缩以提供淡黄色浆料,其缓慢固化以形成灰白色固体(0.122g,96%)。1hnmr(300mhz,cdcl3):δ7.68(dd,2h,j=8.7,2.7hz),7.42(dd,2h,j=8.7,4.2hz),7.22(td,2h,j=9.0,2.7hz),4.33-4.31(d,2h,j=5.4hz),4.15(m,1h),2.85-2.55(m,6h)1.84(brs,4h)。esi(m/z):320.2(m+h)。
制备例51:(r)-4-苄基-3-(4-溴丁酰基)噁唑烷-2-酮
将圆底烧瓶装入4-溴丁酸(19.226g,115.1mmol,1.0当量)和干燥二乙醚(500ml)。将所得溶液冷却至-78℃,添加三乙胺(16.473ml,118.5mmol,1.1当量),随后添加三甲基乙酰氯(14.596ml,118.5mmol,1.1当量)。形成白色沉淀物,此时去除冷浴,并将反应混合物温热至0℃并搅拌2小时,将浆料再冷却至-78℃。
在单独的反应容器中,将己烷中的2.5m正丁基锂溶液(45.146ml,112.9mmol,1.0当量)逐滴添加至在-78℃下于无水四氢呋喃(170ml)中搅拌的(r)-4-苄基-2-噁唑烷酮(20.000g,112.9mmol,1.0当量)的溶液。
10分钟之后,将所得浆料通过大口径套管添加至混合酸酐(用约100ml无水四氢呋喃洗涤)。在-78℃下15分钟之后,将混合物经30分钟温热至0℃,然后在该温度下维持1小时。
然后将浆料用水(180ml)小心地淬灭,再搅拌5分钟,然后温热至室温。将所得溶液用乙酸乙酯(2x500ml)萃取。将合并的有机萃取物用水、饱和碳酸氢钠水溶液(500ml)、饱和氯化钠水溶液(400ml)洗涤,干燥(无水硫酸钠),过滤并在真空中浓缩。将粗残余物通过快速色谱(硅胶,10-50%乙酸乙酯/己烷)纯化,以提供澄清油(26.0g,71%)。1hnmr(300mhz,cdcl3):δ7.19-7.37(m,5h),4.63-4.71(m,1h),4.16-4.25(m,2h),3.52(t,2h,j=6.5hz),3.29(dd,1h,j=3.3,13.5hz),3.08-3.18(m,2h),2.78(dd,1h,j=9.6,13.5hz),2.21-2.30(m,2h)。
以类似的方式合成(s)对映异构体。
制备例52:(r)-3-(4-叠氮基丁酰基)-4-苄基噁唑烷-2-酮
将叠氮化钠(7.623g,117.3mmol,1.5当量)添加至(r)-4-苄基-3-(4-溴丁酰基)噁唑烷-2-酮(25.500g,78.2mmol,1.0当量)于无水n,n-二甲基甲酰胺(225ml)中的搅拌溶液。将所得溶液在55℃下加热15分钟并在70℃下加热2小时。冷却至室温之后,将溶液倒入饱和氯化钠水溶液/乙酸乙酯(1.4l)中并用水和饱和氯化钠水溶液洗涤,干燥(无水硫酸钠),过滤并在真空中浓缩,以得到油(22.0g,98%),其未经进一步纯化即使用。1hnmr(300mhz,cdcl3):δ7.36-7.19(m,5h),4.62-4.72(m,1h),4.10-4.25(m,2h),3.41(t,2h,j=6.6hz),3.30(dd,1h,j=3.3,13.2hz),2.99-3.10(m,2h),2.79(dd,2h,j=9.9,13.5hz),1.93-2.02(m,2h);hplc分析:(c18,水中的10-90%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):12.3分钟,95%。
以类似的方式合成(s)对映异构体。
制备例53:(r)-3-((r)-4-叠氮基-2-甲基丁酰基)-4-苄基噁唑烷-2-酮
向在-78℃下于无水四氢呋喃(125ml)中搅拌的(r)-3-(4-叠氮基丁酰基)-4-苄基噁唑烷-2-酮(20.600g,71.5mmol,1.0当量)的溶液中缓慢添加四氢呋喃中的1.0m双(三甲基甲硅烷基)氨基钠溶液(119.088ml,71.5mmol,1.0当量)。15分钟之后,将所得溶液用碘甲烷(4.671ml,75.0mmol,1.0当量)处理。去除冷却浴,并在5分钟之后将反应容器置于冰水浴中,并再搅拌15分钟。将反应物用饱和碳酸氢钠水溶液(300ml)淬灭并用乙酸乙酯(2x300ml)萃取。将合并的有机萃取物用饱和氯化钠水溶液(2x200ml)洗涤,干燥(无水硫酸镁),过滤并在真空中浓缩。通过快速色谱(400g硅胶,10-50%乙酸乙酯/己烷)纯化,提供作为澄清油的期望产物(9.7g,45%)。1hnmr(300mhz,cdcl3):δ7.20-7.38(m,5h),4.65-4.72(m,1h),4.15-4.26(m,2h),3.85-3.79(m,1h),3.35(app.t,2h,j=6.0hz),3.25(dd,1h,j=13.5,3.6hz),2.78(dd,1h,j=13.0hz,9.0hz),2.04-2.18(m,1h),1.67-1.78(m,1h),1.27(d,3h,j=6.9hz);hplc分析:(c18,水中的10-90%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):13.0min,99.4%。
以类似的方式合成(s)对映异构体。
制备例54:(r)-3-甲基吡咯烷-2-酮
向在室温下于无水四氢呋喃(125ml)中搅拌的(r)-3-((r)-4-叠氮基-2-甲基丁酰基)-4-苄基噁唑烷-2-酮(9.650g,31.9mmol,1.0当量)的溶液中添加三苯基膦(16.744g,63.8mmol,2.0当量)。5分钟之后(溶液变为黄色并鼓泡),添加水(0.575ml,31.9mmol,1.0当量)并将反应混合物在25℃下搅拌18小时。将混合物浓缩,并将所得残余物通过快速色谱(硅胶,75-100%乙酸乙酯/己烷,然后100%至90%乙酸乙酯/甲醇梯度)纯化,以提供期望产物(2.98g,95%)。1hnmr(300mhz,cdcl3):δ6.10(br.s,1h),3.25-3.35(m,2h),2.27-2.50(m,2h),1.68-1.80(m,1h),1.20(d,3h,j=7.5hz)。
以类似的方式合成(s)对映异构体。
制备例55:(s)-3-((三甲基甲硅烷基)氧基)吡咯烷-2-酮
遵循harris,b.d.等人.synth.commun.1986,16,1815的程序。在室温下将三甲基甲硅烷基氯(0.805ml,6.3mmol,0.1当量)添加至(s)-(-)-4-氨基-2-羟基丁酸(15.000g,125.9mmol,1.0当量)于二甲苯(1l)和六甲基二硅氮烷(184.757ml,881.5mmol,7.0当量)中的搅拌溶液。将反应混合物加热至回流持续4小时,冷却至室温,并用无水乙醇/甲醇(1l)稀释。在减压下去除溶剂以得到粗产物,其通过柱色谱纯化,使用乙酸乙酯/二氯甲烷(30-80%梯度)作为洗脱液,以提供白色固体(17.9g,82%)。1hnmr(300mhz,cdc13):δ6.49(brs,1h),4.28-4.23(t,1h,j=7.7hz),3.40-3.21(m,2h),2.42-2.32(m,2h),2.08-1.95(m,2h),0.18(s,9h)。
制备例56:(s)-2-氧代-3-((三甲基甲硅烷基)氧基)吡咯烷-1-甲酸叔丁酯
遵循dirocco,d.a.等人.j.am.chem.soc.2009,131,10872&dirocco,d.a.等人.wo2012/009372的程序。向(s)-3-(三甲基甲硅烷基氧基)吡咯烷-2-酮(6.00g,34.62mmol,1.0当量)于无水二氯甲烷(150ml)中的溶液中添加二碳酸二叔丁酯(15.11g,69.24mmol,2.0当量)、三乙胺(4.82ml,34.62mmol,1.0当量)和4-二甲基氨基吡啶(4.23g,34.62mmol,1.0当量)。将混合物在室温下搅拌过夜,然后添加1n盐酸水溶液(100ml)并将层分离。将有机层用1n盐酸水溶液(2×50ml)和饱和氯化钠水溶液(1×50ml)洗涤,干燥(无水硫酸钠)并过滤。将溶液在真空中浓缩以提供粗油,其通过硅胶色谱(用0-15%乙酸乙酯/己烷洗脱)纯化以提供澄清粘稠油,其在冷冻机中固化。(3.93g,42%)。1hnmr(300mhz,cdcl3):δ4.32-4.26(dd,1h,j=8.4,9.3hz),3.82-3.74(ddd,1h,j=2.1,9.0,11.1hz),3.50-3.41(m,1h),2.28-2.25(m,1h),1.94-1.87(m,1h),1.51(s,9h),0.18(s,9h)。
制备例57:(r)-3-氟吡咯烷-2-酮
将(s)-2-氧代-3-((三甲基甲硅烷基)氧基)吡咯烷-1-甲酸叔丁酯(3g,11mmol)于无水二氯甲烷(55ml)中的溶液冷却至-78℃,在该点逐滴添加二乙基氨基三氟化硫(2.9ml,22mmol,2.0当量)。然后将溶液缓慢温热至室温,然后添加饱和碳酸氢钠水溶液(50ml)以淬灭反应。将层分离,然后将有机层用饱和氯化铵水溶液(2x25ml)洗涤,干燥(无水硫酸钠),过滤并在真空中浓缩,以得到粗固体。然后将该粗材料溶解于二氯甲烷(40ml)中并添加三氟乙酸(2.5ml,33mmol,3.0当量)。将溶液搅拌3小时,在该点气体的逸出已减少。在真空中浓缩提供褐色液体,将其通过硅胶色谱(用0-10%甲醇/二氯甲烷洗脱)纯化,得到作为白色固体的期望产物(0.77g,68%)。1hnmr(300mhz,cdc13):δ7.35(brs,1h),5.15-4.93(dt,1h,j=7.6,53.4hz),3.50-3.34(m,2h),2.53(m,1h),2.39-2.21(m,1h)。
制备例58:(r)-3-羟基吡咯烷-2-酮
在氮气气氛下,向4-硝基苯甲酸(9.273g,55.5mmol,1.1当量)和(s)-(-)-3-羟基-2-吡咯烷酮(5.100g,50.4mmol,1.0当量)于无水四氢呋喃(175ml)中的搅拌混合物中添加三苯基膦(26.461g,100.9mmol,2.0当量)。向该反应混合物中逐滴添加偶氮二甲酸二异丙酯(14.898ml,75.7mmol,1.5当量)(用冷水浴外部冷却)。将反应物在室温下搅拌过夜。将反应混合物在真空中浓缩以提供粗残余物。在室温下,将甲醇(130ml)添加至残余物,随后添加碳酸钾(0.38g)。将反应混合物在室温下搅拌8小时。将反应混合物用二氯甲烷稀释并过滤通过硅藻土。将硅藻土床用二氯甲烷中的1%甲醇洗涤。将滤液合并并浓缩至干燥。将残余物分配于乙酸乙酯:稀盐酸水溶液(20ml,9:1)之间并搅拌15分钟。将层分离并将水层用乙酸乙酯洗涤三次。将水层浓缩至干燥并获得固体残余物。将粗残余物用二氯甲烷中的1-2%甲醇(3x50ml)洗涤,干燥(无水硫酸钠),过滤并浓缩以提供褐色油(3.3g,60%)。1hnmr(300mhz,cdcl3):δ4.32-4.27(t,1h,j=8.5hz),3.36-3.19(m,2h),2.48-2.40(m,1h),2.07-1.93(m,1h),1.16-1.14(d,1h,j=6.3hz)。
制备例59:(r)-3-((三甲基甲硅烷基)氧基)吡咯烷-2-酮
在室温下将三甲基甲硅烷基氯(0.405ml,3.2mmol,0.1当量)添加至(r)-3-羟基-2-吡咯烷酮(3.200g,31.7mmol,1.0当量)、二甲苯(45ml)和六甲基二硅氮烷(39.8ml,189mmol,6.0当量)的搅拌悬浮液。将反应混合物在回流温度下加热5小时,并用无水乙醇(50ml)稀释。在减压下去除溶剂。将粗产物通过柱色谱纯化,使用二氯甲烷中的乙酸乙酯(30-80%梯度)作为洗脱液,以提供澄清油,其在静置时固化为灰白色固体。(2.57g,47%)。1hnmr(300mhz,cdc13):δ6.89(brs,1h),4.28-4.23(t,1h,j=8.1hz),3.40-3.21(m,2h),2.42-2.32(m,1h),2.08-1.95(m,1h),0.18(s,9h)。
制备例60:(r)-2-氧代-3-((三甲基甲硅烷基)氧基)吡咯烷-1-甲酸叔丁酯
向(r)-3-((三甲基甲硅烷基)氧基)吡咯烷-2-酮(2.770g,16.0mmol,1.0当量)于无水二氯甲烷(75ml)中的溶液中添加二碳酸二叔丁酯(6.971g,31.9mmol,2.0当量)、三乙胺(2.222ml,16.0mmol,1.0当量)和n,n-4-二甲基氨基吡啶(1.953g,16.0mmol,1.0当量)。将混合物在室温下搅拌过夜,然后用二氯甲烷稀释并用0.1n盐酸水溶液(100ml)洗涤。将有机层用0.1n盐酸水溶液(2×100ml)和饱和氯化钠水溶液(1×100ml)洗涤,干燥(无水硫酸钠)并过滤。将溶液在真空中浓缩并通过硅胶色谱(用0-15%乙酸乙酯/己烷洗脱)纯化,以提供澄清粘稠油(2.1g,48%)。1hnmr(300mhz,cdcl3):δ4.32-4.26(dd,1h,j=8.1,9.3hz),3.82-3.74(ddd,1h,j=2.1,9.0,11.1hz),3.50-3.41(m,1h),2.32-2.23(m,1h),1.97-1.87(m,1h),1.54(s,9h),0.18(s,9h)。
制备例61:(s)-3-氟吡咯烷-2-酮
将(r)-2-氧代-3-((三甲基甲硅烷基)氧基)吡咯烷-1-甲酸叔丁酯(2.100g,7.7mmol,1.0当量)于无水二氯甲烷(37ml)中的溶液冷却至-78℃,在该点逐滴添加二乙基氨基三氟化硫(2.030ml,15.4mmol,2.0当量)。然后将溶液缓慢温热至室温,然后添加饱和碳酸氢钠水溶液(33ml)以淬灭反应。将层分离并将有机层用饱和氯化铵水溶液(2x16ml)洗涤,干燥(无水硫酸钠),过滤并在真空中浓缩,以得到粗固体。然后将该粗材料溶解于二氯甲烷(30ml)中并添加三氟乙酸(1.7ml,33mmol,3.0当量)。将溶液搅拌3小时,在该点气体的逸出已减少。在真空中浓缩和通过硅胶色谱(用0-10%甲醇/二氯甲烷洗脱)纯化,得到作为灰白色固体的期望产物(0.71g,90%)。1hnmr(300mhz,cdc13):δ7.35(brs,1h),5.15-4.93(dt,1h,j=7.6,53.4hz),3.50-3.34(m,2h),2.53(m,1h),2.39-2.21(m,1h)。
制备例62:4-甲基-5-氧代戊酸甲酯
遵循oikawa,m.等人tetrahedron,1995,51,62377的程序。将容纳有哌啶(54.425ml,551.0mmol,2.0当量)和碳酸钾(13.774g,99.7mmol,0.4当量)的烧瓶浸入水浴中,并经20分钟在剧烈搅拌下添加丙醛(16.000g,275.5mmol,1.0当量)。搅拌18小时之后,通过过滤通过硅藻土垫(用乙醚洗涤的垫)而去除不溶性材料。将滤液干燥(无水硫酸钠),过滤并在真空中浓缩。将因此获得的粗烯胺溶解于乙腈(150ml)中,并向其中逐滴添加丙烯酸甲酯(47.433g,551.0mmol,2.0当量)。将反应混合物在回流下搅拌24小时,随后添加乙酸(31.541ml,551.0mmol,2.0当量)和水(150ml)。在回流下搅拌24小时之后,将其用氯化钠饱和并用二乙醚(3x100ml)萃取。将合并的有机萃取物干燥(无水硫酸镁),过滤并在真空中浓缩。通过硅胶快速色谱(0-20%乙酸乙酯/己烷)纯化,提供作为无色油的加合物(22g,55%)。1hnmr(300mhz,cdc13):δ9.64(d,1h,j=1.8hz),3.69(s,3h),2.50-2.35(m,3h),2.07(sext,1h,j=7.2hz),1.71(sext,1h,j=7.2hz),1.14(d,3h,j=7.2hz)。
制备例63:(3r,8s,8ar)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮和(3r,8r,8as)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮
遵循amat,m.等人.j.org.chem.2014,79,2792的程序。向4-甲基-5-氧代戊酸甲酯(5.780g,40.1mmol,1.0当量)于甲苯(100ml)中的搅拌溶液中添加(r)-(-)-苯基甘氨醇(glycinol)(5.500g,40.1mmol,1.0当量)。将反应混合物在回流下加热25小时,用dean-stark装置共沸去除产生的水。冷却之后,将混合物在真空中浓缩,并将残余物通过硅胶柱(柱用tea预处理,然后用0-70%乙酸乙酯/己烷洗脱)纯化,以提供期望产物:作为淡黄色固体的(3r,8s,8as)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮(1.3g,14%)和作为无色浆料的(3r,8s,8ar)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮(6.5g,70%)。(3r,8s,8as)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮:1hnmr(300mhz,cdcl3):δ7.40-7.20(m,5h),5.25(t,1h,j=7.5hz),4.61(d,1h,j=8.4hz),4.48(t,1h,j=8.7hz),3.75(dd,1h,j=9.0,7.8hz),2.55(dd,1h,j=18.0,6.0hz),2.46-2.33(m,1h),1.88-1.51(m,3h),1.19(d,3h,j=5.7hz);esi(m/z):232.7(m+h)。(3r,8s,8ar)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮:1hnmr(300mhz,cdcl3):δ7.40-7.20(m,5h),4.93(d,1h,j=6.3hz),4.44(d,1h,j=9.3hz),4.14(dd,1h,j=8.7,6.3hz),4.01(dd,1h,j=8.7,1.2hz),2.47-2.25(m,2h),2.05-1.87(m,2h),1.60-1.43(m,1h),1.20(d,3h,j=6.6hz);esi(m/z):232.7(m+h)。
制备例64:(s)-1-((r)-2-羟基-1-苯基乙基)-5-甲基哌啶-2-酮
遵循amat,m.等人j.org.chem.2014,79,2792的程序。向(3r,8s,8ar)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮(3.600g,15.6mmol,1.0当量)于无水二氯甲烷(100ml)中的搅拌溶液中添加三乙基硅烷(7.458ml,46.7mmol,3.0当量)和氯化钛(iv)(7.697ml,70.0mmol,4.5当量),并将混合物在50℃下搅拌24小时。然后,添加额外的氯化钛(iv)(7.7ml)和三乙基硅烷(7.5ml),并在50℃下继续搅拌24小时。将混合物倒入饱和碳酸氢钠水溶液(100ml)中。将水层经硅藻土过滤并用二氯甲烷萃取。将合并的有机萃取物干燥(无水硫酸钠),过滤并在真空中浓缩,以提供残余物,将其在硅胶上色谱分离(0-100%乙酸乙酯/己烷,然后纯乙酸乙酯),以提供作为无色油的期望产物(1.6g,44%),并回收起始材料(0.6g)。1hnmr(300mhz,cdcl3):δ7.40-7.20(m,5h),5.80(dd,1h,j=9.6,4.8hz),4.20-4.00(m,2h),2.97(ddd,1h,j=11.7,4.8,2.4hz),2.84(dd,1h,j=11.7,9.9hz),2.70(brs,1h),2.59(ddd,1h,j=17.7,6.3,3.0hz),2.47(ddd,1h,j=17.7,11.1,6.6hz),1.90-1.75(m,2h),1.50(m,1h),0.93(d,3h,j=6.3hz)。
制备例65:(s)-5-甲基哌啶-2-酮
在配备有干冰冷凝器的双颈烧瓶中装入(s)-1-((r)-2-羟基-1-苯基乙基)-5-甲基哌啶-2-酮(1.600g,6.9mmol,1.0当量)和无水四氢呋喃(20ml)。将混合物在氮气气氛下冷却至-78℃,然后冷凝氨(50ml)。将反应温度升高至-33℃。
添加小片金属钠,直至蓝色持续,并将混合物在-33℃下搅拌5分钟。
通过添加固体氯化铵淬灭反应,直至蓝色消失。将混合物在室温下搅拌5小时并添加二氯甲烷。将混合物过滤通过硅藻土并将滤液在真空中浓缩。将残余物通过硅胶柱(0-100%乙酸乙酯/己烷,然后20%甲醇/乙酸乙酯)纯化,以提供作为无色油的期望产物(0.480g,62%)。1hnmr(300mhz,cdcl3):δ5.84(brs,1h),3.10(m,1h),2.94(t,1h,j=10.8hz),2.50-2.28(m,2h),2.05-1.80(m,2h),1.50(m,1h),1.03(d,3h,j=6.9hz)。
制备例66:(r)-1-((r)-2-羟基-1-苯基乙基)-5-甲基哌啶-2-酮
遵循amat,m.等人j.org.chem.2014,79,2792的程序。向(3r,8r,8as)-8-甲基-3-苯基四氢-2h-噁唑并[3,2-a]吡啶-5(3h)-酮(1.000g,4.3mmol,1.0当量)于无水二氯甲烷(50ml)中的搅拌溶液中添加三乙基硅烷(2.072ml,13.0mmol,3.0当量)和氯化钛(iv)(2.138ml,19.5mmol,4.5当量),并将混合物在50℃下搅拌6小时。将混合物倒入饱和碳酸氢钠水溶液(50ml)中。将水相经硅藻土过滤并用二氯甲烷萃取。将合并的有机萃取物干燥(无水硫酸钠),过滤并在真空中浓缩,以提供残余物,将其色谱分离(0-100%乙酸乙酯/己烷,然后乙酸乙酯),以提供作为无色浆料的期望产物(0.200g,20%)。1hnmr(300mhz,cdcl3):δ7.40-7.20(m,5h),5.67(dd,1h,j=7.8,6.3hz),4.20-4.05(m,2h),3.15-3.00(m,2h),2.65-2.40(m,3h),2.00-1.75(m,2h),1.40(m,1h),0.89(d,3h,j=6.9hz)。
制备例67:(r)-5-甲基哌啶-2-酮
在配备有干冰冷凝器的双颈烧瓶中装入(r)-1-((s)-2-羟基-1-苯基乙基)-5-甲基哌啶-2-酮(0.200g,0.9mmol,1.0当量)和无水四氢呋喃(5ml)。将混合物在氮气气氛下冷却至-78℃,然后冷凝氨(15ml)。将反应温度升高至-33℃。添加小片金属钠,直至蓝色持续,并将混合物在-33℃下搅拌5分钟。通过添加固体氯化铵淬灭反应,直至蓝色消失。将混合物在室温下搅拌5小时并添加二氯甲烷。将混合物过滤通过硅藻土并将滤液在真空中浓缩。将残余物通过硅胶柱(0-100%乙酸乙酯/己烷,然后20%甲醇/乙酸乙酯)纯化,以提供作为黄色油的期望产物(0.080g,82%)。1hnmr(300mhz,cdcl3):δ5.85(brs,1h),3.10(m,1h),2.93(t,1h,j=10.8hz),2.50-2.28(m,2h),2.05-1.80(m,2h),1.50(m,1h),1.03(d,3h,j=6.6hz)。
制备例68:(s)-(1-氨基-1-氧代丙-2-基)氨基甲酸叔丁酯
将boc-ala-ome(5.000g,24.6mmol,1.0当量)和28%氢氧化铵水溶液(100.00ml,1479.7mmol,60.1当量)于甲醇(100ml)中的混合物在室温下搅拌16小时。将反应混合物在真空中浓缩,以提供作为白色固体的期望产物(4.65g,100%)。1hnmr(300mhz,cdcl3):δ6.15(br,1h),5.55(br,1h),4.95(br,1h),4.20(br,1h),1.46(s,9h),1.39(d,3h,j=7.2hz)。
制备例69:(s)-(1-氨基丙-2-基)氨基甲酸叔丁酯
在氮气下,向boc-ala-nh2(4.600g,24.4mmol,1.0当量)于无水四氢呋喃(100ml)中的搅拌溶液中添加四氢呋喃中的1.0m硼烷-四氢呋喃复合物(85.536ml,85.5mmol,3.5当量)。将混合物在室温下搅拌16小时,然后在70℃下加热2小时。冷却之后,将反应物用甲醇淬灭,直至不产生气泡。将混合物在70℃下加热2小时,然后在真空中浓缩。将残余物通过硅胶柱(0-100%乙酸乙酯/己烷,然后0-30%甲醇/二氯甲烷)纯化,以提供作为半固体的期望产物(1.4g,33%)。1hnmr(300mhz,cdcl3):δ4.60(brs,1h),3.65(m,1h),2.76(dd,1h,j=12.9,4.8hz),2.64(dd,1h,j=12.9,6.6hz),1.45(s,9h),1.13(d,3h,j=6.9hz)。
制备例70:((s)-1-(((s)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯
将(r)-3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.600g,2.3mmol,1.0当量)和(s)-(1-氨基丙-2-基)氨基甲酸叔丁酯(1.210g,6.9mmol,3.0当量)于乙醇(10ml)中的混合物在70℃下搅拌。15小时之后,将反应混合物在真空中浓缩并通过硅胶柱(0-100%乙酸乙酯/己烷,然后0-30%甲醇/二氯甲烷)纯化,以提供作为白色泡沫的期望产物(0.750g,75%),并回收胺起始材料(0.2g)。1hnmr(300mhz,cdcl3):δ7.67(dd,2h,j=8.7,2.4hz),7.42(dd,2h,j=8.7,3.9hz),7.22(td,2h,j=9.0,2.7hz),4.50-4.25(m,3h),4.13(m,1h),3.78(brs,1h),2.86(dd,1h,j=12.0,3.6hz),2.70-2.50(m,3h),1.43(s,9h),1.10(d,3h,j=6.3hz);esi(m/z):434.0(m+h)。
制备例71:((s)-1-(((s)-3-(9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯
将(r)-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.150g,0.7mmol,1.0当量)和(s)-(1-氨基丙-2-基)氨基甲酸叔丁酯(0.200g,1.1mmol,1.7当量)于乙醇(5ml)中的混合物在70℃下搅拌。15小时之后,将反应混合物在真空中浓缩并通过硅胶柱(0-100%乙酸乙酯/己烷)纯化,以提供作为白色泡沫的期望产物(0.120g,45%)。1hnmr(300mhz,cdcl3):δ8.09(d,2h,j=7.8hz),7.52-7.41(m,4h),7.25-7.20(m,2h),4.50-4.35(m,3h),4.17(m,1h),3.73(m,1h),2.83(dd,1h,j=11.7,3.6hz),2.66-2.47(m,3h),1.43(s,9h),1.08(d,3h,j=6.6hz);esi(m/z):398.1(m+h)。
制备例72:(r)-(1-氨基-1-氧代丙-2-基)氨基甲酸叔丁酯
将boc-d-ala-ome(5.000g,24.6mmol,1.0当量)和28%氢氧化铵水溶液(100ml,1479.7mmol,60.1当量)于甲醇(100ml)中的混合物在室温下搅拌16小时。将反应混合物在真空中浓缩,以提供作为白色固体的期望产物(4.65g,100%)。1hnmr(300mhz,cdcl3):δ6.15(br,1h),5.60(br,1h),5.00(br,1h),4.20(br,1h),1.46(s,9h),1.39(d,3h,j=6.9hz)。
制备例73:(r)-(1-氨基丙-2-基)氨基甲酸叔丁酯
在氮气下,向boc-d-ala-nh2(4.600g,24.4mmol,1.0当量)于无水四氢呋喃(100ml)中的搅拌溶液中添加四氢呋喃中的1.0m硼烷-四氢呋喃复合物(97.756ml,97.8mmol,4.0当量)。将混合物在室温下搅拌16小时,然后在70℃下加热2小时。
冷却之后,将反应物用甲醇淬灭,直至不产生气泡。将混合物在70℃下加热2小时,然后在真空中浓缩。将残余物通过硅胶柱(0-30%甲醇/二氯甲烷)纯化,以提供作为无色油的期望产物(1.5g,35%)。1hnmr(300mhz,cdcl3):δ4.60(brs,1h),3.65(m,1h),2.75(dd,1h,j=12.9,5.1hz),2.63(dd,1h,j=12.9,6.6hz),1.45(s,9h),1.41(s,2h),1.12(d,3h,j=6.3hz)。
制备例74:((r)-1-(((s)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯
将(r)-3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.200g,0.8mmol,1.0当量)和(r)-(1-氨基丙-2-基)氨基甲酸叔丁酯(0.403g,2.3mmol,3.0当量)于乙醇(10ml)中的混合物在70℃下搅拌。15小时之后,将反应混合物在真空中浓缩并通过硅胶柱(0-30%甲醇/二氯甲烷)纯化,以分离作为白色粉末的期望产物(0.250g,75%)。1hnmr(300mhz,cdcl3):δ7.68(dd,2h,j=8.7,2.7hz),7.41(dd,2h,j=9.3,4.2hz),7.22(td,2h,j=9.3,2.4hz),4.43(brs,1h),4.35(d,2h,j=5.7hz),4.12(m,1h),3.78(brs,1h),2.80(dd,1h,j=12.3,3.6hz),2.63(dd,1h,j=12.3,5.7hz),2.57(d,2h,j=7.2hz),1.44(s,9h),1.11(d,3h,j=6.6hz);esi(m/z):434.0(m+h)。
制备例75:((r)-1-(((s)-3-(9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯
将(r)-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.150g,0.7mmol,1.0当量)和(r)-(1-氨基丙-2-基)氨基甲酸叔丁酯(0.351g,2.0mmol,3.0当量)于乙醇(10ml)中的混合物在70℃下搅拌。15小时之后,将反应混合物在真空中浓缩并通过硅胶柱(0-30%甲醇/二氯甲烷)纯化,以分离作为白色泡沫的期望产物(0.210g,78%)。1hnmr(300mhz,cdcl3):δ8.10(d,2h,j=7.5hz),7.55-7.40(m,4h),7.27-7.20(m,2h),4.60-4.30(m,3h),4.16(m,1h),3.78(m,1h),2.80(dd,1h,j=12.3,3.6hz),2.67(dd,1h,j=12.0,8.4hz),2.60-2.50(m,2h),1.44(s,9h),1.10(d,3h,j=6.6hz);esi(m/z):398.1(m+h)。
实施例2:式i化合物的制备
化合物1:1-(3-(9h-咔唑-9-基)-2-羟基丙基)哌啶-2-酮
向哌啶-2-酮(0.133g,1.3mmol)于二甲亚砜(5ml)的搅拌溶液中添加叔丁醇钾(0.151g,1.3mmol),并将混合物在室温搅拌1小时。添加9-(环氧乙烷-2-基甲基)-9h-咔唑(0.150g,0.7mmol)并将混合物在室温下搅拌16小时。将混合物用水稀释并用乙酸乙酯萃取。将有机层用饱和氯化钠水溶液洗涤,干燥(无水硫酸钠),过滤并在真空中浓缩。将残余物通过硅胶柱(50-100%乙酸乙酯/己烷),然后通过制备型hplc(c18,30-80%乙腈/含有0.1%甲酸的水,0-8分钟)纯化,以提供作为白色泡沫的产物(0.098g,45%)。1hnmr(300mhz,cdcl3):δ8.08(d,2h,j=7.8hz),7.50-7.40(m,4h),7.28-7.18(m,2h),4.60-4.25(m,4h),3.87(dd,1h,j=14.1,7.8hz),3.15-2.95(m,3h),2.36(t,2h,j=5.7hz),1.85-1.55(m,4h);esi(m/z):323.2(m+h)。
化合物2至72:
通过与用于化合物1的程序类似的程序或通过使用氢化钠(0.4当量)代替叔丁醇钾来制备化合物2至72。或者,也可以使用磷腈碱p4-t-bu代替叔丁醇钾。在以下目标的起始材料无市售的情况下,所述合成描述于前述制备实施例中。
化合物71:1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)四氢嘧啶-2(1h)-酮
将3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.06g,0.2mmol)和1,3-二氨基丙烷(0.195ml,2.3mmol)于乙醇(2ml)中的混合物在40℃下搅拌5小时。将反应混合物在真空中浓缩以提供淡黄色油。esi(m/z):334.2(m+h)。在0℃下将残余物溶解于二氯甲烷(10ml)中,添加4-二甲基氨基吡啶(0.005g)和1,1'-羰基二咪唑(0.056g,0.3mmol)。将混合物温热至室温并搅拌16小时。将反应物在真空中浓缩并将残余物通过硅胶色谱(0-10%甲醇/二氯甲烷)纯化,以提供作为白色粉末的期望产物(0.060g,72%)。1hnmr(300mhz,d6-dmso):δ7.99(dd,2h,j=9.6,2.7hz),7.56(dd,2h,j=9.0,4.2hz),7.30(td,2h,j=9.0,2.7hz),6.29(s,1h),5.24(d,1h,j=5.4hz),4.35(dd,1h,j=15.0,3.6hz),4.24(dd,1h,j=15.0,8.1hz),4.07(m,1h),3.55-3.05(m,6h),1.90-1.70(m,2h);esi(m/z):360.1(m+h)。
化合物72至84:
通过与用于化合物71的程序类似的程序使用适当的二胺诸如n-甲基-1,3-二氨基丙烷、乙二胺、n-乙基乙二胺、n1-环己基丙烷-1,3-二胺、n1-环丁基丙烷-1,3-二胺、n1-环戊基丙烷-1,3-二胺或丙烷-1,2-二胺代替1,3-二氨基丙烷来制备化合物72至84。使用的非市售二胺的制备描述于中间体的制备中。
化合物85:1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-4-甲基咪唑烷-2-酮
将(1-((3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)氨基)丙-2-基)氨基甲酸叔丁酯(1.400g,80%纯,2.6mmol,1.0当量)和叔丁醇钾(0.290g,2.6mmol,1.0当量)于无水四氢呋喃(270ml)中的混合物在回流下搅拌2小时。将反应混合物冷却至室温,添加乙酸(0.1ml)和硅胶,并将混合物在减压下浓缩成浆料。将粗残余物通过硅胶柱色谱纯化,通过用0-10%甲醇/二氯甲烷的梯度洗脱,以得到固体。将固体从乙酸乙酯结晶,以得到白色固体(0.673g,72%)。1hnmr(300mhz,cdcl3;非对映异构体的混合物):δ7.69-7.65(dd,2h,j=2.7,8.7hz),7.40-7.35(dd,2h,j=4.1,9.0hz),7.24-7.18(td,2h,j=2.7,9.0hz),4.47-4.19(m,5h),3.82(brm,1h),3.58-2.93(m,4h),1.26-1.24(d,3h,j=6.3hz);esi(m/z):360.9(m+h)。
化合物86:1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3-乙基四氢嘧啶-2(1h)-酮
向3,6-二氟-9h-咔唑(0.065g,0.3mmol)于无水n,n-二甲基甲酰胺(0.3ml)中的溶液中添加矿物油中的60%氢化钠(0.009g,0.2mmol),并将混合物在室温下搅拌30分钟。添加1-乙基-3-(环氧乙烷-2-基甲基)四氢嘧啶-2(1h)-酮(0.055g,0.3mmol)于无水n,n-二甲基甲酰胺(0.3ml)中的溶液并将混合物在70℃下加热8小时。将反应混合物用甲醇稀释,过滤并通过制备型hplc(c18,水中30-95%乙腈)纯化,以提供白色固体(0.072g,62%)。1hnmr(300mhz,cdcl3):δ7.67-7.63(dd,2h,j=2.6,9.0hz),7.39-7.35(dd,2h,j=4.2,8.7hz),7.23-7.16(td,2h,j=2.4,9.0hz),5.52(d,1h,j=2.7hz),4.37-4.21(m,3h),3.86-3.79(m,1h),3.43-2.98(m,6h),2.88-2.83(dd,1h,j=1.8,14.7hz),1.91-1.83(quin,2h,j=5.9hz),1.12-1.07(t,3h,j=7.4hz);esi(m/z):388.1(m+h);hplc分析:(c18,水中的10-90%乙腈,经20分钟:保留时间,在254nm的%面积):12.8分钟,100%。
化合物87-100:
通过与用于化合物88的程序类似的程序制备化合物87-100。
化合物101:1-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-3,4-二甲基四氢嘧啶-2(1h)-酮
向3,6-二氟-9h-咔唑(0.38g,1.9mmol,1.2当量)于无水n,n-二甲基乙酰胺(2ml)中的搅拌溶液中添加矿物油中的60%氢化钠(0.075g,1.9mmol,1.2当量)。在室温下搅拌2小时之后,所得咔唑钠溶液准备用于使用。
在0℃下向1,6-二甲基四氢嘧啶-2(1h)-酮(0.2g,1.6mmol,1.0当量)于干燥n,n-二甲基乙酰胺(3ml)的搅拌溶液中添加矿物油中的60%氢化钠(0.075g,1.9mmol,1.2当量),并将混合物在室温下搅拌1小时。在0℃下添加表溴醇(0.155ml,1.9mmol,1.2当量),并将混合物缓慢温热至室温并搅拌16小时。添加咔唑钠溶液并将混合物在70℃下加热5小时。将反应物用水稀释并用乙酸乙酯萃取。将有机层用饱和氯化钠水溶液洗涤,经硫酸钠干燥,过滤并在真空中浓缩。将残余物通过硅胶柱(0-100%乙酸乙酯/己烷)纯化,以提供作为白色泡沫的纯产物(0.116g,19%)。1hnmr(300mhz,cdcl3):(两种非对映异构体的混合物)δ7.68(dd,2h,j=8.7,2.7hz),7.40(dd,2h,j=9.0,4.2hz),7.27-7.18(m,2h),5.51和5.06(d,1h,j=2.7hz),4.50-4.20(m,3h),3.90-3.74(m,1h),3.50-2.75(m,7h),2.05(m,1h),1.60(m,1h),1.21和1.17(d,3h,j=6.6hz);esi(m/z):388.2(m+h)。
化合物102:3-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基-2-甲基丙基)-3,4-二氢喹唑啉-2(1h)-酮
将1-苄基-3-(3-(3,6-二氟-9h-咔唑-9-基)-2-羟基-2-甲基丙基)-3,4-二氢喹唑啉-2(1h)-酮(0.102g,0.2mmol,1.0当量)和20%碳载氢氧化钯(0.035g)于乙酸(4ml)和四氢呋喃(2ml)中的混合物在50psi氢气下搅拌48小时。添加20%碳载氢氧化钯(0.02g)和10%碳载钯(0.01g),并将反应混合物在50psi氢气下搅拌72小时。将混合物过滤,浓缩,并通过制备型hplc(c18,水中的40-80%乙腈)纯化,以得到白色固体(0.013g,15%)。1hnmr(300mhz,cd3od):δ7.73-7.70(dd,2h,j=2.6,8.6hz),7.55-7.51(dd,2h,j=4.1,9.2hz),7.27-7.05(m,3h),7.07-7.05(d,1h,j=7.2hz),6.96-6.91(td,1h,j=1.1,7.5hz),6.81-6.78(d,1h,j=8.1hz),4.71(s,2h),4.33(s,2h)3.75-3.70,3.59-3.54(abq,2h,j=14.4hz),1.22(s,3h);esi(m/z):422.1(m+h);hplc分析:(c18,水中的5-95%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):13.5分钟,91.5%。
通过与用于化合物102的程序类似的程序制备以下化合物。
化合物104:(1s,4r)-2-((r)-3-(3,6-二氟-9h-咔唑-9-基)-2-羟基丙基)-2-氮杂双环[2.2.1]庚-3-酮
向(1s,4r)-2-氮杂双环[2.2.1]庚-3-酮(0.051g,0.5mmol,2.0当量)于无水四氢呋喃(1.5ml)中的搅拌溶液中添加矿物油中的60%氢化钠(0.009g,0.2mmol,1.0当量),并将混合物在室温下搅拌60分钟。添加(r)-3,6-二氟-9-(环氧乙烷-2-基甲基)-9h-咔唑(0.060g,0.2mmol,1.0当量),并将混合物在80℃下在密封管中搅拌16小时。将混合物冷却至室温,并添加甲醇中的1n乙酸(0.02ml),然后在减压下浓缩。将粗残余物通过制备型hplc(c18,水中的30-95%乙腈)纯化,以得到白色固体(0.053g,61%)。1hnmr(300mhz,cdcl3):δ7.68-7.65(dd,2h,j=2.6,8.6hz),7.38-7.33(dd,2h,j=4.1,8.9hz),7.24-7.17(td,2h,j=2.5,9.0hz),4.38-4.28(m,4h),3.64(brs,1h),3.43-3.38(dd,1h,j=2.7,14.1hz),3.02-2.96(dd,1h,j=2.7,14.4hz),2.90-2.89(m,1h),1.96-1.40(m,6h);esi(m/z):371.1(m+h);hplc分析:(c18,水中的5-95%乙腈+0.1%三氟乙酸,经20分钟:保留时间,在254nm的%面积):12.2分钟,100%;手性hplc分析(chiralcelad-h,己烷中的15%乙醇,经42分钟:保留时间,在254nm的%面积):7.7分钟,98.5%;12.6分钟,0.7%(98.5%de)。
化合物105-138:
通过与用于化合物104的程序类似的程序制备化合物105-138。
可用于评估式i化合物的特定测定法包括如下所述的用于评估测试化合物的效力的per2测定法和用于评估测试化合物的目标的cry1测定法。
实施例3:用于评估测试化合物效力的per2测定法
将化合物通过使用如先前描述于zhang,e.e.等人cell,2009,139,199-210中的高通量昼夜节律测定系统进行筛选。简而言之,将携带per2-dluc的稳定u2os报道子细胞以30,000个细胞/孔的密度铺板于corning96孔固体白色平底的tc处理的微板(corning®)中,并在37℃、在5%co2存在下、在补充有10%胎牛血清(fbs)和青霉素(100单位/ml)-链霉素(100µg/ml)的dulbecco氏改良的eagle培养基(dmem)中培育48小时。将式i化合物通常以2mg/ml的浓度溶解于二甲亚砜(dmso)中。然后将dmso储液在dmso中连续稀释,通常每个稀释步骤3倍稀释。48小时时段后,将细胞培养基从铺板的细胞中移取,并将细胞与200µl/孔补充有5μm毛喉素(tocris®)和1mm甲虫荧光素(promega®)的完全细胞培养基(上述)同步化。同步化之后立即地将1µl化合物稀释液添加至各孔中。将板密封,短暂地摇动,并通过在35℃连续测量发光(tecan®infinitem200或tecan®infinitem200pro)最少3天来监测基因表达。原始发光数据(计数)首先使用multicycle™软件(actimetrics,inc.)分析以测定各化合物浓度的幅度(amp)、周期和相位(phz)。对照孔(即无化合物,仅dmso)的周期长度应为26-30小时。然后将amp数据相对于对数化合物浓度(m)作图,并通过非线性回归分析法分析以测定ec50。
下表提供指定化合物的per2ec50数据。ec50被报道为微摩尔浓度。
本领域普通技术人员可容易地优化该测定法以测定本文所述的任何化合物的per2ec50数据。
实施例4:热偏移结合测定
化合物与分离的人cry1蛋白(hcry1)的fad结合结构域的结合使用差示扫描荧光分析(‘热偏移’)测定法(pantoliano等人(2001)jbiomolscreening6,429;niesen等人(2007)natureprotocols2,2212)测定。具有c端myc-ddk标签的hcry1的fad结合结构域(氨基酸残基1-494)(fadbd)通过hek293t细胞(目录#crl-3216,americantypeculturecollection)的瞬时转染来产生且通过抗-flag亲合色谱(目录#a2220,sigma-aldrich)进行纯化。将fadbd(每孔0.5µg)与化合物于dmso中的稀释液(反应中5%dmso最终浓度)在17.5µltris-缓冲盐水(tbs)中在冰上培育10分钟,然后将2.5µl8xsypro-orange染料(lifetechnologies)添加至各孔中。对各化合物浓度测定一式三份孔。在abi7500定量pcr仪器中使用熔化曲线模式以在25℃下2分钟、随后1℃/分钟的升温速率(ramprate)上升至99℃的热曲线(profile)测量熔化温度。从熔化曲线的一阶导数测定各孔的熔化温度。通过减去单独5%dmso中的fadbd的熔化温度而获得熔化温度的改变(δtm)。如图21中所示,观察到化合物72的δtm的剂量依赖性提高,表明化合物与hcry1fadbd蛋白物理相关。
实施例5:对时钟基因和糖异生基因表达的体内影响
在本实施例中,检查含有咔唑的酰胺类、氨基甲酸酯类和脲类对各种小鼠模型中的时钟和糖异生基因表达的影响。具体地,使用四种不同的小鼠模型:icr小鼠、balb/c小鼠、c57b1/6jdio(饮食诱导性肥胖症)小鼠和db/db小鼠。c57b1/6jdio和db/db小鼠两者均为本领域公认的糖尿病、肥胖症和血脂异常的模型。饮食诱导性肥胖(dio)小鼠(其响应于高脂喂食而展现ii型糖尿病表型)发展肥胖症、高胰岛素血症、胰岛素抗性和葡萄糖耐受不良(srinivasan和ramarao,2007)。db/db小鼠(leprdb小鼠)在db基因(其编码瘦素受体)中具有突变。db/db小鼠自发摄食过度且变得肥胖、高血糖、高胰岛素血和胰岛素抗性。
使用下述的各种实验模型进行检查cry调节剂化合物对基因表达的影响的体内研究。
四天研究.获得自charlesriverlaboratories(hollister,ca)的雄性icr小鼠(重30–35g)在环境适应至少3天后用于实验。向小鼠给予媒介物(wfi或10%kolliphor)或化合物(50mg/kg,剂量体积5ml/kg,po)4天bid(一日两次),其在第一天的下午开始。化合物或媒介物的最后一次剂量在收获日早上给药。在收获当日(最终剂量之后6小时),通过co2窒息法使小鼠安乐死,并切出50mg肝组织,并置于容纳有500µlrnalater的管中。
24小时基因表达研究.购买17周龄的雄性c57b1/6jdio小鼠(thejacksonlaboratory,sacramento,ca),并在用于实验前适应环境2周时段。整体组大小为每次处理为15只,分成5个时间点以得到3只小鼠的最终组大小。向小鼠以5ml/kg(bid)的剂量体积经由经口管饲法给予媒介物(注射用水(wfi))或cry调节剂化合物化合物72(50mg/kg,在wfi中)2天,其中最终第五次剂量在收获前12小时给药。
每只小鼠在实验过程中总计接受5个剂量的化合物。在研究开始之前的晚上,将小鼠称重,并基于重量将其随机分配至各处理组。在第3天的3:00pm开始,使用co2窒息法将来自媒介物和化合物72处理组的动物组安乐死,分别切出50mg肝脏、副睪脂肪和骨骼肌,并置于容纳有500µlrnalater的管中。对于时间点组的剩余部分在其给定收获时间进行该程序。也取每只动物的血浆样品并冷冻,待用于化合物水平的随后测量。
小鼠肝脏总rna制备.利用e.z.n.a.®hp总rna分离试剂盒(r6812-01和2010年修订的手册中描述的规程)以便从肝脏样品制备和分离rna。为了制备rna样品,将10-30mg样品从rna-later中移出,并置于1.5ml微量离心管中。将gtc裂解缓冲液(700µl)添加至组织,将其用转子-定子均质器(例如tissue-tearor,型号#985370biospecproducts,其具有4.5mm探针,目录#985370-04)均质化,然后以全速(≥13,000xg)离心5分钟。通过移液至预插于2ml收集管中的dna清除柱而转移澄清的上清液。将组装的柱以13,000xg离心1分钟,并保存流通物(flow-through)。将等体积(700µl)70%乙醇添加至裂解物并混合。然后将样品施加至置于2ml收集管中的hibindrna旋转柱上,将其在室温下以10,000xg离心60秒。通过直接移液至插入2ml收集管中的新hibindrna柱上而添加rna洗涤缓冲液i(250μl)。将组装的柱以10,000xg离心60秒。将rna柱置于新的2ml收集管中。将dnasei储备溶液直接移液(75μl)至每个柱中的hibindrna树脂的表面上(使用具有无rnase的dnase组(e1091)的dnase消化:对于每个hibindrna柱,如下制备dnasei储备溶液:e.z.n.a.®dnasei消化缓冲液73.5μl,无rnase的dnasei(20kunitz/µl)1.5µl=总体积75μl。)将具有结合的rna的柱在室温(25-30℃)下培育15分钟。将rna洗涤缓冲液i(500μl)添加至柱,并置于台面上2分钟。以10,000xg离心60秒之后,弃去流通物,添加500μlrna洗涤缓冲液ii,并以10,000xg离心60秒。再添加500μlrna洗涤缓冲液ii,并将柱组件以10,000xg离心60秒。将该柱以最大速度离心2分钟以完全干燥hibind基质。将该柱置于干净的1.5ml微量离心管中,并添加40-70μl分子生物学级水。放置1分钟之后,将该柱以最大速度离心2分钟以洗脱rna。将分离的rna收集至收集管中。
小鼠血液总rna制备.对于全血rna研究,使用雄性db/db小鼠(9周龄,thejacksonlaboratory,barharbor,maine)用于实验,每个实验组n=8只小鼠。向小鼠给予化合物72(100mg/kg,p.o;剂量体积5ml/kg,在10%kolliphor中)或10%kolliphor,在zt0(7:00am)每日一次,持续三天(zt是指zeitgeber时间,并指示在小鼠设施中打开灯以刺激白天的时间)。在最后一天的zt7.5(2:30pm),使用co2窒息法使动物安乐死,并且经由心脏穿刺从心脏收集血液。将血液置于rnalater溶液中至1.5ml总体积。如下使用ambionmouseribopure血液rna分离试剂盒am1951制备总rna。将样品离心3分钟,弃去上清液。添加2ml裂解溶液并涡旋,转移至15ml管,随后添加几微升3m乙酸钠。添加裂解缓冲液至3.8ml的总体积并涡旋。将样品混合物用1.5ml酸性苯酚:氯仿萃取,并回收水相。在添加0.5体积的100%乙醇并涡旋之后,将样品通过试剂盒中提供的过滤柱,并用750微升洗涤缓冲液1洗涤。将过滤器用2次通过750微升洗涤缓冲液2/3来洗涤,并干燥。将rna洗脱于200微升分子生物学级水(无rnase)中。
总rna的定量.通过将20μl重构的rna标准品转移至180μlrediplatete缓冲液中重构的rediplate孔中来制备rediplate96ribogreenrna定量试剂盒(invitrogen)rediplate标准曲线。对于使用与omegabio-tekhp总rna试剂盒类似的试剂盒从30-100mg组织制备并以50μl(微升)体积洗脱于无rnase水中的肝脏rna,将5μl总rna稀释于195μlrediplatete缓冲液中(rna的1:40稀释液),混合。将5µl转移至195µlte缓冲液中重构的rediplate孔并在rt下培育10分钟之后,在tecanm200中读取具有标准品和样品的孔的荧光强度,激发设置为480nm,且发射设置为520nm,增益设置为~70%。或者,可以使用具有ex488nm和em525nm以及515nm的截止值的flexstation3。在graphpadprism中产生标准曲线,并经由线性回归分析内插样品读数(未知),并计算rna样品浓度。
cdna的制备.将高容量cdna逆转录试剂盒(invitrogen)10xrt缓冲液(40-70μl)、dntp和随机引物在冰上解冻。使用每种样品的相同量的输入rna(通常为0.5-4.0μg),将反应设置于40µl的总体积中。混合适当量的总rna和无核酸酶的h2o以获得20μl的总体积。对于每个反应,用4.2μl无rnase的h2o、2μl10xrt缓冲液、0.8μl25xdntp和2μl随机引物产生主混合物(任选地,可以再添加10%至待进行的反应的总数以确保足够体积)。对于每个反应,添加逆转录酶(1μl),并小心地混合,而不涡旋。将一些一式两份样品(总共~10%)分配至rt(-)组,并制备足够的缺乏逆转录酶的主混合物以包括这些对照。添加主混合物(20μl)(或rt(-)主混合物)至20μl固定输入rna样品。将反应物在37℃下培育2小时,加热至85℃持续5分钟,并置于冰上。cdna的样品,如果到第二天使用,则储存于4℃,或在-20℃下储存更长的时间。
rt-pcr.对于pcr分析,利用的试剂盒是taqman®fastuniversalmastermix(2x),noamperase®ung。对于待在abi7500上运行的反应,将2μlcdna模板或rt(-)对照模板置于每个孔中。对于每个待运行的样品,制备包含1.0μltaqman表达测定(引物/探针)和7μl无核酸酶的h2o的主混合物,并将18μl主混合物+表达测定+无核酸酶的h2o添加至各2µl样品,通过移液混合。将板密封,旋转下来并装载于abi7500中。在每组待评价的rna样品中包括至少一个持家(housekeeping)mrna表达测定(例如gapdh;mm03302249_g1或hs02758991_g1)。
在糖尿病小鼠和非糖尿病小鼠中检查cry调节剂化合物72对核心时钟功能的影响。将17周龄的雄性c57b1/6jdio小鼠(thejacksonlaboratory,sacramento,ca)维持高脂肪饮食(hfd),并在治疗前适应环境2周时段以重现(recapitulate)糖尿病和肥胖症。对于5个时间点中的每一个,用化合物或媒介物处理三只小鼠。向小鼠以5ml/kg,bid(每日两次)的剂量体积经由经口管饲法给予媒介物(注射用水(wfi))或化合物72(50mg/kg,在wfi中)。每只小鼠在实验过程中总计接受5个剂量的化合物。在研究开始之前的晚上,将小鼠称重,并基于重量将其随机分配至各处理组。在第3天的3:00pm开始,使用co2窒息法将来自媒介物和化合物72处理组的动物组安乐死,切出50mg肝脏、副睪白脂肪和骨骼肌用于rna制备。
还经24小时在正常balb/c小鼠中检查化合物72对昼夜节律mrna的影响。小鼠为8周龄,获得自charlesriver,并使其适应环境2周。向小鼠bid给药3天,每只动物总共7个剂量,最后剂量在获得组织之前12小时。向小鼠以5ml/kg,bid的剂量体积经由经口管饲法给予媒介物(wfi)或化合物72(50mg/kg,在wfi中)。在第3天的3:00pm开始,将来自媒介物和化合物72处理组的动物组处死,并切出约50mg肝、肺、肾、肾上腺、脾、附睾脂肪和棕色脂肪组织,并置于rnalater中。
来自媒介物处理的c57bl/6jdio小鼠的核心时钟mrna展现特征性昼夜节律表达模式(图1)。然而,用化合物72处理,在c57bl/6jdio和balb/c小鼠两者中,per2mrna经24小时受抑制,并且这些在zt8时最低,并且在24小时后在zt8时再次最低(图1a和b)。在两种小鼠品系中,在zt8和初始zt0后32小时,bmal1mrna被化合物72处理显著增加。bmal1转录物还在c57bl/6jdio小鼠中显示显著的相位延迟,并在balb/c小鼠中显示较小程度的相位延迟(图1c和d)。在黑暗周期期间,cry1的mrna在其表达峰期间被抑制(图1e和f,阴影区)。dio小鼠中相对于媒介物处理的balb/c小鼠观察到的媒介物处理的cry1转录物的相位提前可能部分是由于已知的高脂肪饮食对许多昼夜模式的影响(eckel-mahan等人(2013)cell)。与cry1mrna相反,cry2的mrna在媒介物处理的小鼠中在白天时间达到峰值,但这在c57bl/6jdio和balb/c小鼠中被用化合物72处理强烈减弱(图1g和h)。
在上述相同的24小时研究中,在c57bl/6jdio小鼠中,化合物72相对于媒介物显著地改变糖异生基因pck1(pepck)和g6pc(葡萄糖6-磷酸酶催化亚基)的mrna的昼夜模式(图2a和c)。媒介物处理的小鼠展现相比于其它研究(hughes等人(2009))中对于食物饲喂的c57b1/6j小鼠观察到的模式扁平化和相位提前的模式。化合物72处理的c57bl/6jdio小鼠在傍晚(zt14)展现这两种糖异生基因的表达峰,这更接近于食物饲喂的小鼠中观察到其表达的峰值时间(hughes等人(2009))。在c57b1/6jdio小鼠中化合物72相对于媒介物对pck1和g6pc的表达的昼夜模式的改变比在balb/c小鼠中更大(图2b和d)。
在icr小鼠中检查多种cry调节剂化合物化合物72、化合物48、化合物9和化合物57的影响。将小鼠用50mg/kg的每种化合物(化合物72、化合物48、化合物9和化合物57)po(口服给药)以5ml/kg的剂量体积处理4天(bid),或用媒介物对照处理。每种化合物都引起肝脏per2表达的抑制(图3a)。化合物48处理导致bmax1mrna在zt6的8倍的增加,化合物72和化合物9处理的小鼠展现4倍的增加,并且化合物57处理的小鼠展现至少2倍的增加(图3b)。化合物72、化合物48和化合物9也引起cry2转录物的减少(图3c)。
全血中的核心时钟基因mrna的水平可以提供确定化合物在处理的对象中的影响的非侵入性方法。使用雄性db/db小鼠(9周龄,thejacksonlaboratory,barharbor,maine),其中每个实验组n=8。向小鼠给予化合物72(100mg/kg,p.o;剂量体积5ml/kg,在10%kolliphor中)或10%kolliphor,在zt0(7:00am)每日一次,持续三天(zt是指zeitgeber时间,并指示在小鼠设施中打开灯以刺激白天的时间)。在最后一天的zt7.5(2:30pm),使用co2窒息法使动物安乐死,并且经由心脏穿刺从心脏收集血液。将全血转移至容纳有rnalater的管中,用于通过rt-qpcr测定。
d-盒结合蛋白dbp以强昼夜节律方式被调节。在本研究中化合物72引起dbp基因表达的统计学显著抑制(图4),表明用此类化合物处理的小鼠中的白血细胞可提供关于化合物对整个生物体中的核心时钟机制的影响的信息。此类信息可以用作诊断标志物或用作生物标志物以评价影响核心昼夜节律机制的cry调节剂和其它治疗剂的影响。
对于与核心时钟机制直接相互作用的化合物,给药时间对于使其影响最大化可能是关键的。用在zt0或zt10给予的单剂量的化合物72(50mg/kg)处理db/db小鼠。前者(zt0)与小鼠肝脏中cry1和bmal1蛋白的峰一致,且后者(zt10)对应于cry1和bmal1的近似最低点。对于每个在7.5小时后取肝脏组织,并通过rt-qpcr检查样品的核心时钟基因mrna。由于化合物72在峰值时与最低点相比对时钟mrna具有更大的相对影响(图5),所以在大约前者时给药提供对时钟机制的更大影响,并且这可以进一步导致对时钟的代谢输出的更大影响。
实施例6:在糖尿病小鼠模型中在时钟基因表达的峰值或最低点给药的单剂量的化合物72的影响
当在ii型糖尿病的db/db小鼠模型中的核心时钟基因cry1/bmal1表达的峰值或最低点作为单剂量给药时,评价化合物72对葡萄糖代谢的影响。
leprdb纯合的雄性db/db小鼠(6周龄)获得自thejacksonlaboratory(barharbor,maine)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取标准成团的小鼠饮食和水。在实验之前,使动物习惯于这些条件2周。将小鼠分成两个研究组,待在cry1和bmal1基因表达的峰值或最低点给药。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(峰值,7:00am)或zt10(最低点,5:00pm)一次给予媒介物(10%kolliphor,sigma-aldrich)或化合物72(50mg/kg,在10%kolliphor/水中)。将动物在第0天称重,并随机分配至处理组,使得每组都具有相似的平均起始重量。在zt0给药的小鼠在10:30pm开始禁食过夜,在10:30pm时,它们被转移至清洁笼子中并且自由获取水,而不是食物,持续12小时的时段。在zt10给药的小鼠以相同的方式在8:30am开始禁食。在研究当天,在给药之后,小鼠在测量空腹血糖前2小时经历尾部切伤,以允许从该程序可能引起的任何应激恢复。使用alphatrak血糖仪(abbottlaboratories,usa)在10:30am或8:30pm从动物评价空腹血糖(fbg)。在11:30am(峰值给药的小鼠)或9:30pm(最低点给药的小鼠),向每只动物给予0.5g/kg葡萄糖,然后在葡萄糖负载之后的t=15、30、60、90和120分钟测量血糖。在最后一次采血后终止动物,并收获组织和血液用于其它终点测定。
将在ogtt期间获取的空腹血糖值和葡萄糖测量值平均化并作图(graphpadprism,graphpadsoftware,lajolla,ca)。计算每只个别动物的曲线下面积(auc)。使用单因素anova、随后适当的后检验进行统计学分析。当p<0.05时接受显著性。数据呈现为平均值和s.e.m。
在cry1和bmal1基因表达的峰值向db/db小鼠给药的以单剂量给药化合物72(50mg/kg,po)与媒介物对照相比导致对ogtt测量值的明显影响(图6a),但当在最低点给药时没有影响(图6b)。从在基因表达的峰值给药的动物的ogtt计算的auc显示化合物72处理导致葡萄糖偏移减少14%(74098+/-4194至63842+/-4318;图7)。
实施例7:在糖尿病小鼠模型中经7天给药的单剂量的化合物72的影响
当在ii型糖尿病的db/db小鼠模型中作为经7天给药的单剂量给药时,评价化合物72对葡萄糖代谢和胰岛素水平的影响。
leprdb纯合的雄性db/db小鼠(6周龄)获得自thejacksonlaboratory(barharbor,maine)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取标准成团的小鼠饮食和水。在实验之前,使动物习惯于这些条件2周。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(7:00am)给予媒介物(10%kolliphor,sigma-aldrich)或化合物72(50mg/kg,在10%kolliphor/水中),持续七天。将小鼠在第0天称重,并随机分配至处理组,使得每组都具有相似的平均起始重量。在终点测量前的晚上10:30pm,将小鼠放入清洁笼子中,并且自由获取水,而不是食物,在空腹血糖测量之前持续12小时的时段。在研究的最后一天,将动物正常给药,然后在测量空腹血糖前2小时经历尾部切伤,以允许从该程序可能引起的任何应激恢复。使用alphatrak血糖仪(abbottlaboratories,usa)在10:30am从动物评价空腹血糖(fbg)。在fbg测量之后,使用尾部挤压技术从每只小鼠将血液收集至毛细管中。将毛细管在分血器(bdtriac0200)中离心,并将所得血浆转移至eppendorff管。将标记为t=0小时的该样品冷冻于-80℃,以允许以后测量胰岛素。在11:30am,向每只动物给予0.5g/kg葡萄糖,然后在葡萄糖负载之后的t=15、30、60、90和120分钟测量血糖。在ogtt结束时,收集血液用于如上所述的t=2小时胰岛素测定。在最后一次采血后终止动物,并收获组织和血液用于其它终点测定(在别处详述)。将来自化合物72处理的动物的血浆和肝组织送至cro,用于使用lc/ms/ms测量化合物水平并与已知化合物量的标准曲线比较。
将在ogtt期间获取的空腹血糖值和葡萄糖测量值平均化并作图(graphpadprism,graphpadsoftware,lajolla,ca)。计算每只个别动物的曲线下面积(auc)。使用超敏胰岛素elisa(alpco,salem,nh)测定血浆胰岛素水平。使用下式计算homa-ir(体内平衡模型评价-胰岛素抵抗):(fpi(µu/l)xfpg(mmol/l))/22.5,其中fpi和fpg分别表示空腹血浆胰岛素和空腹血浆葡萄糖。胰岛素数据也以graphpadprism格式表示。使用单因素anova、随后适当的后检验进行统计学分析。当p<0.05时接受显著性。数据呈现为平均值和s.e.m。
向db/db小鼠给药化合物72(50mg/kg,po)7天与媒介物对照相比导致fbg的显著减少(484.9+/-34.37mg/dl至385.0+/-29.69mg/dl;图8a)。在ogtt测量过程期间,化合物72处理的动物低于媒介物对照组(图8b)。从ogtt计算的auc显示化合物72给药导致葡萄糖偏移的显著减少(54845+/-4112至35942+/-3192;图8c)。
从在t=0和t=2小时获取的样品进行血浆胰岛素测量,并显示于图9a中。用化合物72处理使胰岛素在t=0和t=2小时时间点分别降低20%和21%(分别为4.70+/-0.76至3.78+/-0.69ng/ml和3.17+/-0.67至2.53+/-0.50ng/ml)。homa-ir(对胰岛素的再致敏的指示)从139.91+/-26.57至93.69+/-23.60单位降低33%(图9b)。
从在研究终止时获取的样品评价化合物72化合物水平,并连同如实施例3中所述从per2测定法确定的ec50值(用于比较目的)显示于图10中。在给药最后剂量之后约8小时在血浆和肝脏两者中都发现化合物72(血浆:0.53+/-0.03µm;肝脏:0.67+/-0.05µm,显示为平均值和s.e.m)。在两种情况下,化合物水平略高于针对化合物72测定的per2ec50值(0.4μm;分别为血浆和肝脏中的ec50值1.3倍和1.7倍)。
实施例8:糖尿病小鼠模型中的递增剂量的化合物72的影响
在经7天给药的递增剂量评价化合物72对ii型糖尿病的db/db小鼠模型中的葡萄糖代谢和胰岛素水平的影响。
leprdb纯合的雄性db/db小鼠(5周龄)获得自thejacksonlaboratory(barharbor,maine)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取标准成团的小鼠饮食和水。在实验之前,使动物习惯于这些条件2周。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(7:00am)给予媒介物(10%kolliphor,sigma-aldrich)或10、50或100mg/kg的化合物72(在10%kolliphor/水中),持续七天。进行的实验方法与实施例11中详述的那些相同。来自化合物72处理的动物的血浆和肝脏组织中的化合物水平使用lc/ms/ms测量,并与已知化合物量的标准曲线比较。
与媒介物对照组相比,在50和100mg/kg下,向db/db小鼠以递增剂量给药化合物727天导致空腹血糖水平降低,尽管这没有达到统计学显著性(媒介物对照:491.0+/-51.30mg/dl,50mg/kg:402.8+/-25.25mg/dl,100mg/kg:420.7+/-26.44mg/dl;图11a)。以10mg/kg的剂量给药的化合物72表明空腹血糖水平没有降低(503.5+/-49.68mg/dl)。在ogtt测量过程期间,化合物72处理的动物表明对葡萄糖负载之后来自动物的葡萄糖偏移的剂量依赖性影响(图11b)。从ogtt计算的曲线下面积显示化合物72给药以剂量依赖性方式降低葡萄糖auc,这在100mg/kg是显著的(媒介物:46088+/-330,10mg/kg:39771+/-4244,50mg/kg:35527+/-3215,100mg/kg:28499+/-3079;图11c)。
从在t=0和t=2小时获取的样品进行血浆胰岛素测量,并显示于图12a中。当以100mg/kg给药时,用化合物72处理在t=0时降低胰岛素(从5.68+/-0.43至4.63+/-0.17ng/ml(分别为媒介物和100mg/kg组))。在化合物72给药之后,homa-ir以剂量依赖性方式减少(媒介物:169.3+/-18.41单位,10mg/kg:172.7+/-16.61单位,50mg/kg:149.2+/-16.49单位,100mg/kg:111.9+/-9.02单位;图12b)。在100mg/kg,化合物72的影响是显著的(与媒介物对照组相比减少34%)。
从在研究终止时获取的样品评价化合物72化合物水平,并连同(如实施例3中所述)per2ec50值(用于比较目的)显示于图13中。在给药最后剂量之后约8小时在血浆和肝脏两者中都发现化合物72,其中暴露水平相对于给药剂量的增加而增加(血浆,10mg/kg:0.09+/-0.01µm;50mg/kg:0.57+/-0.03µm;100mg/kg:1.22+/-0.17µm;肝脏,10mg/kg:0.12+/-0.01µm;50mg/kg:0.78+/-0.06µm;100mg/kg:1.81+/-0.22µm)。在血浆和肝脏两者中,暴露水平分别在50mg/kg下为血浆和肝脏中的per2ec50值的1.4倍和1.95倍,在100mg/kg下为血浆和肝脏中的per2ec50值的3倍和4.5倍。
实施例9:糖尿病小鼠模型中的递增剂量的化合物9的影响
在经7天给药的递增剂量评价化合物9对ii型糖尿病的db/db小鼠模型中的葡萄糖代谢和胰岛素水平的影响。
leprdb纯合的雄性db/db小鼠(5周龄)获得自thejacksonlaboratory(barharbor,maine)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取标准成团的小鼠饮食和水。在实验之前,使动物习惯于这些条件2周。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(7:00am)给予媒介物(10%kolliphor,sigma-aldrich)或30、100或300mg/kg的化合物化合物9或30mg/kg的罗格列酮(在10%kolliphor/水中),持续七天。罗格列酮是用于阳性对照的抗糖尿病治疗剂。进行的实验方法与实施例11中详述的那些相同。来自化合物9处理的动物的血浆和肝脏组织中的化合物水平使用lc/ms/ms测量,并与已知化合物量的标准曲线比较。
向db/db小鼠以递增剂量给药化合物97天与媒介物对照组相比导致在100mg/kg的空腹血糖水平降低(从492.8+/-48.07至403.1+/-39.73mg/dl;图14a),但总体上没有统计学显著影响。以30和100mg/kg的剂量给药的化合物9表明在ogtt期间葡萄糖水平测量值的剂量依赖性降低,其中在300mg/kg的最高测试剂量下没有观察到增加的影响(图14b)。从ogtt计算的曲线下面积显示化合物9的给药以剂量依赖性方式降低葡萄糖auc,这在100和300mg/kg两者均是显著的(媒介物:56046+/-3204,30mg/kg:44442+/-3895,100mg/kg:33643+/-4822,300mg/kg:33650+/-4688;图8c)。在30、100和300mg/kg,葡萄糖auc相比于媒介物对照组分别降低21%、40%和40%。用作动物模型的阳性对照的罗格列酮显著抑制空腹血糖(从492.8+/-48.07至280.4+/-13.66mg/dl;图14a)和葡萄糖auc(从56046+/-3204至11502+/-2118单位;图14c)。
从在t=0和t=2小时获取的样品进行血浆胰岛素测量,并显示于图15a中。用化合物9处理之后在t=0(媒介物:14.89+/-2.93ng/ml,30mg/kg:10.94+/-1.62ng/ml,100mg/kg:7.71+/-1.26ng/ml,300mg/kg:10.54+/-1.6ng/ml)和t=2小时(媒介物:7.44+/-0.92ng/ml,30mg/kg:5.76+/-0.11ng/ml,100mg/kg:3.70+/-0.29ng/ml,300mg/kg:4.01+/-0.44ng/ml),胰岛素减少。在给药化合物9之后,homa-ir以剂量依赖性方式减少,尽管在该终点,300mg/kg的该化合物的影响较小(媒介物:438.8+/-87.88单位,30mg/kg:289.9+/-24.40单位,100mg/kg:175.3+/-27.52单位,300mg/kg:301.4+/-52.66单位;图15b)。在100mg/kg,化合物9的影响是显著的(与媒介物对照组相比减少60%)。罗格列酮在t=0和t=2小时降低胰岛素水平(分别至3.05+/-0.14ng/ml和2.28+/-0.08ng/ml;图15a),以及显著降低homa-ir(至50.58+/-3.52单位,图15b)。
从在研究终止时获取的肝脏样品评价化合物9组织水平,并连同per2ec50值(用于比较目的)显示于图16中。在给药最后剂量之后约8小时在血浆和肝脏中发现化合物9,其中暴露水平相对于给药30mg/kg和100mg/kg之间剂量的剂量增加而增加。在300mg/kg的暴露水平表明药物的累积(7.1倍增加,而不是如预期的3倍)。给药30、100或300mg/kg化合物9的动物的肝脏样品中的化合物水平分别为0.19+/-0.02µm、0.67+/-0.05µm和4.77+/-1.06µm。给药30mg/kg化合物9之后的肝脏暴露水平比per2ec50值(0.3μm)低约1.6倍,而在100mg/kg和300mg/kg下,水平分别为2.2倍和15.9倍。
实施例10:饮食诱导的肥胖小鼠模型中的化合物72的影响
在ii型糖尿病的饮食诱导的肥胖(dio)小鼠模型中检查化合物72的影响。
雄性c57/bl6jdio小鼠获得自thejacksonlaboratory(sacramento,ca)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取高脂肪饮食(d12492(60kcal%脂肪),researchdiets,inc.)和水。在实验之前,使动物习惯于这些条件至少2周,并在约24周龄时使用。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(7:00am)给予媒介物(10%kolliphor,sigma-aldrich)、化合物72(100mg/kg,在10%kolliphor/水中)或罗格列酮(30mg/kg,在10%kolliphor/水中),持续七天。罗格列酮是用于阳性对照的抗糖尿病治疗剂。将小鼠在第0天称重,并随机分配至处理组,使得每组都具有相似的平均起始重量。在终点测量前的晚上10:30pm,将小鼠放入清洁笼子中,并且自由获取水,而不是食物,在空腹血糖测量之前持续12小时的时段。在研究的最后一天,将动物作为正常给药,然后在测量空腹血糖前2小时经历尾部切伤,以允许从该程序可能引起的任何应激恢复。使用alphatrak血糖仪(abbottlaboratories,usa)在10:30am从动物评价空腹血糖(fbg)。在fbg测量之后,使用尾部挤压技术从每只小鼠将血液收集至毛细管中。将毛细管在分血器(bdtriac0200)中离心,并将所得血浆转移至eppendorff管。将标记为t=0小时的该样品冷冻于-80℃,以允许以后测量胰岛素。在11:30am,向每只动物给予1.5g/kg葡萄糖,然后在葡萄糖负载之后的t=15、30、60、90和120分钟测量血糖。在ogtt结束时,收集血液用于如上所述的t=2小时胰岛素测定。在最后一次采血后终止动物,并收获组织和血液用于其它终点测定。
将在ogtt期间获取的空腹血糖值和葡萄糖测量值平均化并作图(graphpadprism,graphpadsoftware,lajolla,ca)。计算每只个别动物的曲线下面积(auc)。使用超敏胰岛素elisa(alpco,salem,nh)测定血浆胰岛素水平。使用下式计算homa-ir(体内平衡模型评价-胰岛素抵抗):(fpi(µu/l)xfpg(mmol/l))/22.5,其中fpi和fpg分别表示空腹血浆胰岛素和空腹血浆葡萄糖。胰岛素数据也以graphpadprism格式表示。使用单因素anova、随后适当的后检验进行统计学分析。当p<0.05时接受显著性。数据呈现为平均值和s.e.m。
向c57/bl6jdio小鼠给药化合物72(100mg/kg,po)7天与媒介物对照相比导致空腹血糖水平的显著减少(237.2+/-15.29mg/dl至177.1+/-8.28mg/dl;图17a)。在ogtt测量过程期间,化合物72处理的动物比媒介物对照组低得多(图17b)。从ogtt计算的auc显示化合物72给药导致葡萄糖偏移的显著减少(31511+/-1670至17055+/-769.1;图17c)。用作动物模型的阳性对照的罗格列酮将空腹血糖降低至153.9+/-5.05mg/dl并将葡萄糖auc降低至11500+/-1104单位。
从在t=0和t=2小时获取的样品进行血浆胰岛素测量,并显示于图18a中。用化合物72处理之后在t=0(媒介物:5.00+/-0.92ng/ml,100mg/kg:3.12+/-0.24,ng/ml)和t=2小时(媒介物:4.82+/-0.60ng/ml,100mg/kg:2.88+/-0.21ng/ml),胰岛素减少。在化合物72给药之后,homa-ir显著减少(媒介物:70.76+/-11.30单位,100mg/kg:32.54+/-3.37单位;图18b)。罗格列酮(30mg/kg)在t=0和t=2小时降低胰岛素(分别至2.70+/-0.12ng/ml和2.30+/-0.06ng/ml),并显著降低homa-ir(至24.60+/-1.42单位)。
实施例11:化合物72对大鼠中皮质酮诱导的胰岛素抵抗的发展的影响
向大鼠重复给药皮质酮6天导致体重的显著降低,这与血浆胰岛素和葡萄糖的显著升高相关。这些影响经由通过11-βhsd1活性产生的皮质醇介导。糖皮质激素受体拮抗剂诸如米非司酮减轻皮质醇对胰岛素抵抗的影响。这些实验的目的是确定化合物72对大鼠中皮质酮诱导的胰岛素抵抗的发展的影响。
向动物给予皮质酮(30mg/kgscqd)与测试化合物的组合6天,然后在最终剂量的皮质酮之后27小时终止。还包括参考标准(米非司酮)。皮质酮21-乙酸盐(sigmac-3130)由renasci提供,并且使用5ml/kg的剂量体积经由皮下途径作为1%甲基纤维素中的细悬浮液给药。使用5ml/kg的剂量体积经由经口管饲法qd给予化合物72(50mg/kg,在10%kolliphor/水中)。米非司酮(sigmam8046)由renasci提供。
对从12小时禁食之后(在最后一次皮质酮剂量之后约27小时)获取的尾静脉血获得的血浆样品进行葡萄糖和胰岛素测定。终止动物,并取出终末(心脏)血液样品,从其制备血浆。
三十四只雄性spraguedawley大鼠(体重范围为200-250g)从charlesriver,margate,kent,uk订购。将大鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随时自由获取标准成团的大鼠饮食和自来水。在实验之前,使动物习惯于这些条件2周。随后,动物经历3天基线期,在此期间,它们在t=0h(07:00)每天一次给予媒介物。在研究中已经发现该程序减少应激相关影响的发生率。所有药物都给药6天,如下表2中所示。在07:00(t=0h)开始给药之前立即记录体重。经由皮下途径(sc)给药皮质酮,同时在t=0h给药皮质酮之后立即经由管饲法经口给药化合物72和米非司酮。
在给药的第6天,将大鼠从22:30开始禁食12小时(定时至与第7天终止一致)。在第7天,向大鼠给药媒介物,但不是皮质酮(sc),随后如通常在7:00经口给药媒介物/化合物72/米非司酮。在第7天的10:30,在皮质酮的最终剂量之后27小时,将血液样品(300μl)从侧尾静脉取入容纳有edta的管(sarstedt16.444)中。离心血液,并将所得血浆等分试样保存于-75℃。通过co2窒息法、随后颈椎脱臼将动物安乐死。通过心脏穿刺将终末血液(约10ml)收集至容纳有edta的管(sarstedt5ml32.332)中,然后离心并将血浆储存于-75℃。使用商业临床试剂(thermoelectroninfinity葡萄糖试剂(tr15421))分析尾静脉血浆的葡萄糖(n=2),并使用mercodia超敏大鼠胰岛素大鼠elisa(10-1251-10)分析其胰岛素(n=1)。
通过稳健回归或以处理作为因子和以采血顺序和基线体重作为协变量的一般线性模型分析血浆葡萄糖和胰岛素。如果适当,使用对数转换。使用适当的多重比较检验(双尾)来确定与媒介物组和皮质酮组的显著差异。p<0.05被认为是统计学显著的。
向大鼠给药化合物72显著降低皮质酮给药处理引起的血浆葡萄糖和胰岛素的增加。用皮质酮处理之后,血浆葡萄糖水平从6.28+/-0.30mm增加至10.17+/-0.51mm,这被化合物72(50mg/kg)显著减少至8.55+/-0.3mm(p<0.01;平均值和s.e.m)。皮质酮处理后,血浆胰岛素水平从0.70+/-0.11ng/ml增加至8.19+/-0.91ng/ml,这被化合物72(50mg/kg)减少至5.24+/-1.11ng/ml(p<0.05;数据表示为平均值和s.e.m;图19)。用作动物模型的阳性对照的米非司酮将血浆葡萄糖和血浆胰岛素分别显著减少至7.43+/-0.27ng/ml和3.62+/-0.29ng/ml。
homa-ir值如化合物9中所述计算,且数据显示于图20中。与媒介物:媒介物对照组(5.27+/-1.04单位)相比,皮质酮处理将homa-ir增加至95.57+/-11.4单位。化合物72(50mg/kg)和米非司酮的给药将胰岛素抵抗大鼠中的homa-ir值分别显著减少至56.94+/-11.18单位和29.99+/-2.54单位。
实施例12:化合物9和化合物72的药代动力学(pk)分析
雄性icr小鼠(体重30-40g,charlesriverlaboratories)用于实验,其中每个实验组n=3只小鼠(总共27只小鼠用于研究)。向小鼠给予cry调节剂化合物9或化合物72(50mg/kg,p.o;剂量体积5ml/kg,在10%kolliphor中)。在给药之后的以下时间点收集血液和肝脏组织:15分钟、30分钟、60分钟、90分钟、3小时、6小时、12小时和24小时。还对动物对照组(t0)进行采样。用co2将动物实施安乐死,并使用心脏穿刺从心脏收集血液,转移至edta管,然后在4℃下以5400rpm离心5分钟。将所得血浆使用干冰冷冻,然后储存于-80℃,直至准备用于测定。从每只动物取出肝脏组织,将0.5g收集于eppendorff中,冷冻并送去进行药代动力学测量。将来自每只动物的血浆和肝脏组织送至cro,用于使用lc/ms/ms测量血浆和肝脏中的化合物水平并与已知化合物量的标准曲线比较。使用winnonlin分析原始数据的pk参数(cmax、tmax、消除t1/2,mrt(平均停留时间)、auc(曲线下面积)-(0-最后和外推的%)。
雄性sd大鼠(称重250-300g,charlesriverlaboratories)用于实验,其中每个实验组n=4只大鼠。向大鼠给予化合物72(50mg/kg,p.o;剂量体积5ml/kg,在10%kolliphor中)。在给药之后的以下时间点收集血液:15分钟、30分钟、60分钟、90分钟、3小时、6小时、12小时和24小时。还收集剂量前样品。在重新设置时递送前,由charlesriver的技术人员将动物插管。在每个时间点从右颈总静脉中的插管收集全血(0.3ml)。将全血转移至edta管,然后在4℃下以5400rpm离心5分钟。将所得血浆使用干冰冷冻,然后储存于-80℃,直至准备用于测定。在每次抽血之后给药0.9%氯化钠(0.3ml)用于补充流体。在12小时时间点之后,使用0.1ml肝素钠(500iu/ml)作为锁定溶液。如上所述测定样品。表3和4概述分析结果。
*表示来自4次实验的数据,显示为平均值和s.e.m。
*表示来自4次实验的数据,显示为平均值和s.e.m。
实施例13:饮食诱导的糖尿病小鼠模型中的递增剂量的化合物72的影响
在ii型糖尿病的饮食诱导的肥胖(dio)小鼠模型中经递增剂量评估化合物72的影响。
雄性c57/bl6jdio小鼠获得自thejacksonlaboratory(sacramento,ca)。将小鼠以正常的光/暗循环(亮灯:07:00–19:00h)成组圈养,其随意获取高脂肪饮食(d12492(60kcal%脂肪),researchdiets,inc.)和水。在实验之前,使动物习惯于这些条件至少2周,并在约26周龄时使用。向小鼠以5ml/kg(qd)的剂量体积经由经口管饲法在zt0(7:00am)给予媒介物(10%kolliphor,sigma-aldrich)、化合物72(10、30或100mg/kg,在10%kolliphor/水中)或罗格列酮(30mg/kg,在10%kolliphor/水中),持续七天。进行的实验方法与实施例10中详述的那些相同。
向c57/bl6jdio小鼠以递增剂量给药化合物727天与媒介物对照相比导致空腹血糖水平的降低,这在100mg/kg达到显著性(媒介物对照:226.9+/-13.11mg/dl,10mg/kg:206.8+/-8.36mg/dl,30mg/kg:197.5+/-12.06mg/dl,100mg/kg:176.3+/-7.83mg/dl,图22a)。在ogtt测量过程期间,化合物72处理的动物表明葡萄糖负载之后葡萄糖偏移的减少(图22b)。从ogtt计算的曲线下面积显示化合物72给药降低葡萄糖auc,其在30和100mg/kg表明显著性(媒介物:26090+/-1917单位,10mg/kg:22563+/-1224单位,30mg/kg:19033+/-1934单位,100mg/kg:19502+/-2404单位;图22c)。用作动物模型的阳性对照的罗格列酮显著抑制空腹血糖(从226.9+/-13.11mg/dl至161.1+/-8.06mg/dl;图22a)和葡萄糖auc(从26090+/-1917单位至9858+/-1281单位;图22c)。
- 还没有人留言评论。精彩留言会获得点赞!