一种高效感染支持细胞和毛细胞的AAV载体的制作方法
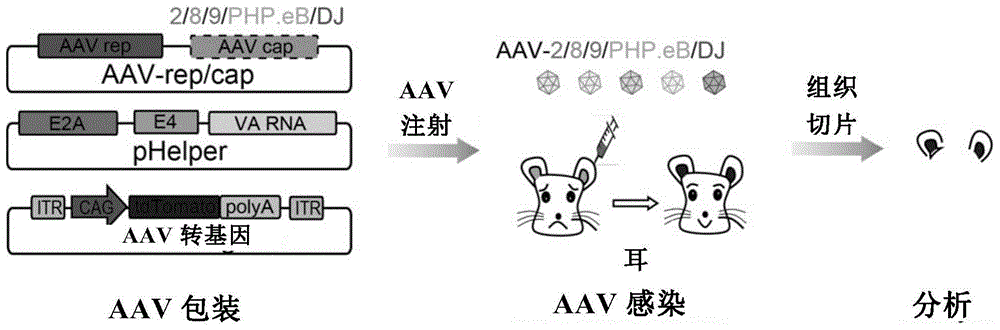
本发明属于生物技术领域,具体涉及一种高效感染支持细胞和毛细胞的aav载体。
背景技术:
内耳的耳蜗是我们的外周声音感知器官。耳蜗的听觉细胞在我们感知外周声音的过程中扮演着非常重要的角色,它把外界的声波信号转化为电生理信号,然后通过内耳螺旋神经节细胞逐步传递到大脑听觉中枢。
先天遗传性或者后天各种创伤引起的毛细胞死亡均可以引起不同程度的听力损伤,甚至终身性耳聋。根据世界卫生组织(who)的调查,0.3%的新生儿、5%的45岁以前的人群和50%的70岁以上的人群患有不同程度的听力损伤。听力损伤不仅仅影响听力本身,而且也能引起不同程度的社交障碍。
其中,遗传性耳聋是由于内耳中某些基因的突变所导致的。同时,内耳细胞的基因导入效率低下不仅影响了内耳基因功能的研究,而且阻碍了遗传性耳聋的基因治疗。
目前已知的导致耳聋的基因已经多达100多个。其中比例最高的是gjb2突变,约占遗传性耳聋的50%;其次是slc26a4基因突变,约占遗传性耳聋的15%,这两个基因都是表达于支持细胞。myo15a和otof基因则是表达于毛细胞,分别占遗传性耳聋的5~8%。
因此,筛选出可以高效转导进内耳细胞的载体是非常重要的。
腺相关病毒(adeno-associatedvirus,aav)在人类基因治疗领域有着广阔的应用前景,由于其具有长时程的基因表达能力,且无致病性,在各种研究中被广泛应用于肝、肌、心、脑、眼、肾等组织。
然而,已经发现的能高效感染内耳细胞的aav载体还很少。
对于内耳毛细胞,人们在已有的研究中发现,acn80l65这个病毒对内耳毛细胞有一定的感染效果。但这个病毒非常难以获得,在包病毒的时候出毒率极低,非常难以达到1.0×1012vg/ml的滴度。所以这个病毒虽然能够感染内耳毛细胞,但是不可能实现大范围应用。
对于内耳支持细胞,人们在已有的研究中发现,aav1-aav9等各种血清型的aav对内耳支持细胞几乎不感染。最新发表的aav2.7m8这个病毒虽然能感染支持细胞,但感染效率不到20%,而且需要较高的滴度才能达到20%左右的感染效率。
因此,本领域迫切需要开发一种易于获得的、能够高效感染内耳细胞的毛细胞和/或支持细胞细胞的aav载体。
技术实现要素:
本发明的目的就是提供一种易于获得的、能够高效感染内耳细胞的毛细胞和/或支持细胞的aav载体。
本发明的另一目的是提供一种药物组合物,所述药物组合物包含本发明提供的aav载体。
本发明的另一目的是提供本发明所述aav载体的用途,用于制备治疗听觉障碍疾病的制剂或药物组合物。
在本发明的第一方面,提供了一种用于治疗听觉障碍疾病的基因表达载体,所述的表达载体为aav载体,其中,所述的aav载体中,插入有或携带有用于治疗听觉障碍疾病的治疗基因的表达盒;
其中,所述的aav载体选自下组:aav-php.eb、aav-dj,或其组合。
在另一优选例中,所述治疗基因包括:正常个体中表达的听力相关基因(即野生型的听力相关基因),或用于基因编辑的相关基因。
在另一优选例中,所述用于基因编辑的相关基因包括:基因编辑酶的编码基因和靶向特定位点的导向rna(sgrna)。
在另一优选例中,所述的aav载体是aav-php.eb,并且所述的治疗基因是在内耳毛细胞中表达的基因。
在另一优选例中,所述在毛细胞中表达的基因选自下组:myo15a、otof、myo6、vglut3、tmc1、myo7a、kcnq4、slc26a5、pou4f3等,或其组合。
在另一优选例中,所述的aav载体是aav-dj,并且所述的治疗基因是在内耳支持细胞中表达的基因。
在另一优选例中,所述在支持细胞中表达的基因选自下组:gjb2、scl26a4、gjb3、brn4等,或其组合。
在本发明的第二方面,提供了一种药物组合物,包括:
(i)如本发明第一方面所述的基因表达载体;
(ii)药学上可接受的载体。
在另一优选例中,所述组分(i)占所述药物组合物总重量的0.1-99.9wt%,较佳地10-99.9wt%,更佳地70-99wt%。
在另一优选例中,所述药物组合物是液态剂型的。
在另一优选例中,所述药物组合物的剂型为注射剂。
在另一优选例中,所述药物组合物是用于耳蜗内注射的注射剂型。
在另一优选例中,所述的载体为注射剂载体,较佳地,所述的载体是选自下组的一种或多种载体:生理盐水、葡萄糖盐水、或其组合。
在另一优选例中,所述的药物组合物在治疗听觉障碍疾病的应用中,可单独使用,或联合使用。
在另一优选例中,所述的联合使用包括:与其他治疗听觉障碍疾病的药物联合使用。
在另一优选例中,所述的其他治疗听觉障碍疾病的药物包括:抗感染的抗生素类药物、神经营养因子类药物、离子通道调节剂类药物、维生素类药物等,或其组合。
在本发明的第三方面,提供了如本发明第一方面所述的基因表达载体的用途,用于制备一制剂或药物组合物,所述制剂或药物组合物用于治疗听觉障碍疾病。
在另一优选例中,所述制剂或药物组合物用于治疗内耳毛细胞或支持细胞中发生基因突变所导致的听觉障碍疾病患者。
在另一优选例中,所述的听觉障碍疾病选自下组:遗传性耳聋、非遗传性耳聋,或其组合。
在另一优选例中,所述遗传性耳聋包括由选自下组的因素引起的耳聋:基因突变、基因缺失,或其组合。
在另一优选例中,所述非遗传性耳聋包括由选自下组的因素引起的耳聋:使用药物、外伤、感染、衰老,或其组合。
在本发明的第四方面,提供了一种治疗听觉障碍疾病的方法,给需要的对象施用如本发明第一方面所述的基因表达载体。
在另一优选例中,所述施用的方式为耳蜗内注射。
在另一优选例中,当所述听觉障碍疾病的病因是表达于内耳毛细胞的听觉相关基因发生突变时,所述基因表达载体中,aav载体为aav-php.eb或aav-dj,优选地为aav-php.eb。
在另一优选例中,所述基因表达载体中,aav-php.eb的使用剂量为1×1011-2×1012vg,较佳地为3×1011-1.2×1012vg,更佳地为5×1011-1×1012vg。
在另一优选例中,当所述听觉障碍疾病的病因是表达于内耳支持细胞的听觉相关基因发生突变时,所述基因表达载体中,aav载体为aav-dj。
在另一优选例中,所述基因表达载体中,aav-dj的使用剂量为1×1011-5×1012vg,较佳地为5×1011-4×1012vg,更佳地为1×1012-3×1012vg。
在本发明的第五方面,提供了一种制备本发明第一方面所述的基因表达载体的方法,将用于治疗听觉障碍的治疗基因的表达盒连入aav载体,从而获得如本发明第一方面所述的基因表达载体。
在本发明的第六方面,提供了一种体外对听觉相关细胞进行转染的方法,包括步骤:
用aav载体对所述听觉相关细胞进行转染;
其中,所述的aav载体选自下组:aav-php.eb、aav-dj,或其组合;所述的听觉相关细胞为毛细胞或支持细胞。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了不同亚型aav对小鼠毛细胞感染的筛选实验设计。
其中,分别包装不同aav亚型(aav--2/8/9/dj)的病毒,然后注射到p1icr小鼠的耳蜗中,2-3周后取材对毛细胞的感染情况进行荧光观察和表型分析。
图2显示了不同亚型aav对小鼠耳蜗顶端部分毛细胞的感染结果。
(a)aav不同亚型病毒注射后,顶端部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5--1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内顶端部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图3显示了不同亚型aav对小鼠耳蜗中间部分毛细胞的感染结果。
(a)aav不同亚型病毒注射后,中间部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5-1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内中间部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图4显示了不同亚型aav对小鼠耳蜗基底部分毛细胞的感染结果。
(a)aav不同亚型病毒注射后,基底部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5-1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内基底部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图5显示了不同剂量aav-php.eb对小鼠耳蜗顶端部分毛细胞的感染结果。
(a)不同剂量aav-php.eb病毒注射后,顶端部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05-1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内基底部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图6显示了不同剂量aav-php.eb对小鼠耳蜗中间部分毛细胞的感染结果。
(a)不同剂量aav--php.eb病毒注射后,中间部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05--1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内基底部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图7显示了不同剂量aav-php.eb对小鼠耳蜗基底部分毛细胞的感染结果。
(a)不同剂量aav--php.eb病毒注射后,基底部分毛细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05-1×1010vgaav病毒。
(b-c)通过统计随机100微米视野内基底部分毛细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图8显示了不同血清型aav对小鼠支持细胞感染的筛选实验设计。
其中,分别包装不同aav血清型(aav-2/8/9/dj)的病毒,然后注射到p1icr小鼠的耳蜗中,2-3周后取材对支持细胞的感染情况进行荧光观察和表型分析。
图9显示了不同血清型aav对小鼠耳蜗顶端部分支持细胞的感染结果。
(a)aav不同亚型病毒注射后,顶端部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5-1×1010vgaav病毒。
(b)通过统计随机100微米视野内顶端部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图10显示了不同血清型aav对小鼠耳蜗中间部分支持细胞的感染结果。
(a)aav不同亚型病毒注射后,中间部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5-1×1010vgaav病毒。
(b)通过统计随机100微米视野内中间部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图11显示了不同血清型aav对小鼠耳蜗基底部分支持细胞的感染结果。
(a)aav不同亚型病毒注射后,基底部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每只小鼠注射0.5-1×1010vgaav病毒。
(b)通过统计随机100微米视野内基底部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图12显示了不同剂量aav-dj对小鼠耳蜗顶端部分支持细胞的感染结果。
(a)不同剂量aav-dj病毒注射后,顶端部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05-1×1010vgaav病毒。
(b)通过统计随机100微米视野内基底部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图13显示了不同剂量aav-dj对小鼠耳蜗中间部分支持细胞的感染结果。
(a)不同剂量aav-dj病毒注射后,中间部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05-1×1010vgaav病毒。
(b)通过统计随机100微米视野内基底部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
图14显示了不同剂量aav-dj对小鼠耳蜗基底部分支持细胞的感染结果。
(a)不同剂量aav-dj病毒注射后,基底部分支持细胞的代表性荧光图。p1icr小鼠在病毒注射后3周取材。每组小鼠注射0.05-1×1010vgaav病毒。
(b)通过统计随机100微米视野内基底部分支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
具体实施方式
本发明人经过广泛而深入的研究,经过大量的筛选,首次意外地发现一种高效感染小鼠内耳的毛细胞和支持细胞的aav载体。
在具体的实施方式中,本发明人针对aav的不同亚型(aav-2、aav-8、aav-9、aav-dj以及aav-eb),分别包装表达tdtomato的病毒并注射到小鼠的耳蜗中。注射后三周,对耳蜗(apical、middle、basal)的细胞进行免疫荧光分析。实验结果表明,在毛细胞中,aav-php.eb相比于平行实验中的其他aav载体,具有更高的感染效率。
其中,在内毛细胞中,aav-php.eb和aav-9可以达到100%的感染,aav-8感染效率相对较低,而aav-2和aav-dj几乎不感染;在外毛细胞中,aav-php.eb几乎可以达到100%的感染,aav-8感染效率相对较低,而aav-2和aav-dj几乎不感染。随着aav-php.eb剂量的升高,毛细胞的感染效率也逐步提升。当注射剂量达到3×109vg时,耳蜗(apical、middle、basal)顶端,中间以及基底三个部分的内毛细胞和外毛细胞中mcherry+细胞比例几乎接近100%,实现完全感染。
而在支持细胞中,aav-dj比aav-2/8/9具有更高的感染效率,可以达到50%左右的感染效率。
在此基础上完成了本发明。
本发明基因表达载体
在本发明中,提供了一种用于治疗听觉障碍疾病的基因表达载体,其特征在于,所述的表达载体为aav载体,其中,所述的aav载体中,插入有或携带有用于治疗听觉障碍疾病的治疗基因的表达盒;其中,所述的aav载体选自下组:aav-php.eb、aav-dj,或其组合。
优选地,所述的治疗基因包括:正常个体中表达的听力相关基因(即野生型的听力相关基因),或用于基因编辑的相关基因。在一个优选的实施方式中,所述的用于基因编辑的相关基因包括:基因编辑酶的编码基因和靶向特定位点的导向rna(sgrna)。
在另一个优选的实施方式中,所述的治疗基因为正常个体中表达的听力相关基因。
听觉障碍疾病非常广泛,全球大约有5亿人有不同程度的听觉障碍,其中大部分是60岁以上的老人。新生儿耳聋发病率约为千分之二到千分之三,其中有一半是由于遗传因素导致的先天性耳聋。
目前已知的导致耳聋的基因已经多达100多个。其中比例最高的是gjb2突变,约占遗传性耳聋的50%;其次是slc26a4基因突变,约占遗传性耳聋的15%,这两个基因都是表达于支持细胞。myo15a和otof基因则是表达于毛细胞,分别占遗传性耳聋的5~8%。
在本发明所提供的基因表达载体中,提供了能高效感染内耳支持细胞和毛细胞的aav载体。
在一个优选的实施方式中,所述的aav载体是aav-php.eb,并且所述的治疗基因是在内耳毛细胞中表达的基因。优选地,所述在毛细胞中表达的基因选自下组:myo15a、otof、myo6、vglut3、tmc1、myo7a、kcnq4、slc26a5、pou4f3等,或其组合。
在另一个优选的实施方式中,所述的aav载体是aav-dj,并且所述的治疗基因是在内耳支持细胞中表达的基因。优选地,所述在支持细胞中表达的基因选自下组:gjb2、scl26a4、gjb3、brn4等,或其组合。
药物组合物和施用方法
在本发明中,还提供了一种药物组合物,它含有(i)安全有效量的本发明第一方面所述的基因表达载体;(ii)药学上可接受的载体。
如本文所用,术语“包括”包括了“含有”、“基本上由……构成”和“由……构成”。
如本文所用,术语“基本上由……构成”指在药物组合物中,除了含有有效活性成分或辅助成分之外,还可含有少量的且不影响有效成分的次要成分和/或杂质。
如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。
术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。
本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。
本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
在一个优选的实施方式中,所述药物组合物是液态剂型的。
在一个更加优选的实施方式中,所述药物组合物的剂型为注射剂。优选地,本发明所述药物组合物是用于耳蜗内注射的注射剂型。
在本发明的一个实施方式中,所述的载体为注射剂载体,较佳地,所述的载体是选自下组的一种或多种载体:生理盐水、葡萄糖盐水、或其组合。
在本发明的一个实施方式中,所述的药物组合物在治疗听觉障碍疾病的应用中,可单独使用,或联合使用。
在本发明中,所述的联合使用包括:与其他治疗听觉障碍疾病的药物联合使用。
在一个更加优选的实施方式中,所述的其他治疗听觉障碍疾病的药物包括:抗感染的抗生素类药物、神经营养因子类药物、离子通道调节剂类药物、维生素类药物等,或其组合。
如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明的主要优点包括:
1)效率高:php.eb对内耳毛细胞感染效率高,aav-dj对内耳支持细胞的感染效率高。
2)易生产:本发明的两种aav载体出毒率高,稳定性也高,在生产过程中容易获得高滴度高质量的aav。
3)安全性好:aav时fda批准用于临床治疗的载体,并且本发明的aav载体对内耳组织无损伤。
4)靶向性高:相对于小分子药物,本发明的aav载体具有组织和细胞特异性感染的特性,可以靶向特定的细胞类型;
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
除非另外说明,否则百分比和份数是重量百分比和重量份数。
实验材料和方法
小鼠
icr小鼠(p1)被用于aav病毒注射。动物的使用和照料都在动物伦理委员会的指导下。
细胞培养和感染
hek293t细胞用10%fbs培养基,成分为杜尔贝科改良伊格尔培养基(dmem)(gibco,11965-02)、10%胎牛血清(fbs)(gibco)、2mm谷氨酰胺(gibco)、1%青霉素/链霉素(thermofisherscientific)和0.1mm非必需氨基酸(gibco)。所有细胞都在5%co2、37℃下培养。
hek293t细胞用aav感染后48小时,通过荧光显微镜观察tdtomato表达情况。
aav病毒包装
三质粒系统转染293t细胞,转染4-6h后换液。收集第四天上清和细胞。上清用peg沉淀过夜,4200rpm、4℃离心30min,再4400rpm离心10min,弃上清。用1xgb溶解。细胞用液氮反复冻融三次。上清及细胞都加benzonase、5mnacl消化30min。消化完后,3000g离心10min,取上清。密度梯度超速离心,68000rpm18℃1h25min。取层,加pbs稀释后用超滤管浓缩。
aav病毒注射
icrp1小鼠,雌雄不限,按照不同的aav血清型随机分组,每组4只小鼠。在体式显微镜下,以眼科剪于耳后沟2mm处剪开皮肤,稍分离皮下组织。可见面神经,听泡后壁以及二腹肌后腹。用玻璃微电极刺破耳蜗侧壁韧带并将1微升病毒注射至小鼠耳蜗。注射完毕后轻轻拔出玻璃电极,缝合切口。注射3周后取材分析表型。
免疫染色分析
免疫染色实验中,小鼠用戊巴比妥钠(50mg/kg,sigma)麻醉后,通过蠕动泵(gilson)用0.9%生理盐水和4%多聚甲醛进行心脏灌流,然后在4%多聚甲醛中4℃固定过夜。第二天组织在10%edta中脱钙处理。在脱钙完成后,在解剖显微镜下分离出基底膜,并剪成三段(顶端,中间和基底部分)。分离后的基底膜用0.1m磷酸缓冲液(pb)洗三遍,然后用5%ngs稀释的一抗在4℃孵育过夜。
第二天,切片用pb洗三遍,然后在回转式摇床上用二抗室温孵育两小时。最后切片用dapi复染20分钟,在载玻片上用slowfadediamondantifademountant(life)进行封片。
抗体
支持细胞:
一抗:goat-anti-sox2(santacruzbiotechnology,sc-17320)
二抗:alexa
毛细胞:
一抗:rabbitanti-myosin-vipolyclonal(proteusbiosciences,25-6791)
二抗:cytm5affinipuredonkeyanti-rabbitigg(h+l)(jacksonimmuno
research,711-175-152)
数据统计分析及软件
对支持细胞和毛细胞内的感染效率进行量化,通过统计随机100微米视野内支持细胞中mcherry+细胞比例来说明感染效率。结果从至少3只小鼠中获得,并且以平均数±标准差表示。*p<0.05,***p<0.001,不配对t检验。
snapgene:用于质粒图谱构建设计
excel:原始数据处理
nis-elementsviewer4.0:实验图片处理
imagej:实验图片处理
adobephotoshopcs6:实验图片处理
adobeillustratorcs4:实验图片处理
实施例1:不同亚型aav对小鼠毛细胞感染的筛选
在本实施例中,分别使用不同的aavcapsid(aav-2、aav-8、aav-9、aav-php.eb以及aav-dj)去包装cag-tdtomato-polya,通过观察毛细胞的感染率,来判断不同aav亚型的感染效率(图1),以筛选出在体内能高效感染小鼠毛细胞的aav亚型。
将不同的aavcapsid(aav-2、aav-8、aav-9、aav-php.eb以及aav-dj)包装的cag-tdtomato-polya病毒分别注射至p1icr小鼠的耳蜗。每只小鼠注射0.5-1×1010vgaav病毒。在注射3周后,对小鼠的耳蜗基底膜进行剥离并且染色,通过统计随机100微米视野内毛细胞中mcherry+细胞比例来说明感染效率。
分别统计顶端、中间以及基底(apical,middle,basal)三个部分的毛细胞。
实验结果显示,aav-php.eb、aav-8、aav-9在顶端部分的内毛细胞(myo6阳性)中几乎100%的细胞为tdtomato阳性,而aav-2、aav-dj则不感染毛细胞(图2)。但是aav-php.eb在顶端部分的外毛细胞(myo6阳性)中有98.14±0.59%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9、aav-dj各组只有0%、5.45±1.00%、38.14±5.82%、0%的毛细胞为tdtomato阳性(图2,表1)。
aav-php.eb和aav-9在中间部分的内毛细胞(myo6阳性)中有98.89±1.11%和93.55±2.48%的细胞为tdtomato阳性,而aav-2、aav-8、aav-dj各组只有0%,65.56±11.96%,0%的毛细胞为tdtomato阳性(图3)。但是aav-php.eb在中间部分的外毛细胞(myo6阳性)中有96.05±1.65%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9、aav-dj各组只有0%,2.64±0.59%,26.25±9.31%的毛细胞为tdtomato阳性(图3,表1)。
aav-php.eb在基底部分的内毛细胞(myo6阳性)中有100%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9、aav-dj各组只有0%、77.64±9.89%、60.76±7.35%、0%的毛细胞为tdtomato阳性(图4)。aav-php.eb在基底部分的外毛细胞(myo6阳性)中有97.11±1.78%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9、aav-dj各组只有0%、8.94±5.09%、32.28±4.96%、0%的毛细胞为tdtomato阳性(图4,表1)。
以上结果表明,在内毛细胞中,aav-php.eb和aav-9可以达到100%的感染,aav-8感染效率相对较低,而aav-2和aav-dj几乎不感染。但是在外毛细胞中,aav-php.eb几乎可以达到100%的感染,aav-9和aav-8感染效率相对较低,而aav-2和aav-dj几乎不感染。
实施例2:不同剂量的aav-php.eb对小鼠毛细胞的感染
在本实施例中,测试了不同剂量下的aav-php.eb病毒对毛细胞的感染情况。在实验中,对aav-php.eb病毒进行了剂量梯度分组,每组小鼠分别注射5×108、1×109、3×109、5×109和1×1010vg病毒。同样的在注射3周后,对小鼠的耳蜗基底膜进行剥离并且染色,分别统计顶端、中间以及基底三个部分的毛细胞中mcherry+细胞比例。
实验结果显示,随着aav-php.eb剂量的升高,毛细胞的感染效率也逐步提升。当注射剂量达到3×109vg时,顶端、中间以及基底三个部分的内毛细胞和外毛细胞中mcherry+细胞比例几乎接近100%,实现完全感染(图5-7,表2)
实施例3:不同血清型aav对小鼠支持细胞感染的筛选
在本实施例中,分别使用不同的aavcapsid(aav-2、aav-8、aav-9、aav-php.eb以及aav-dj)去包装cmv-tdtomato-polya,通过观察支持细胞的感染率,来判断不同aav亚型的感染效率(图8),以筛选出在体内能高效感染小鼠支持细胞的aav亚型。
将不同的aavcapsid(aav-2、aav-8、aav-9以及aav-dj)包装的cag-tdtomato-polya病毒分别注射至p1icr小鼠的耳蜗。每只小鼠注射0.5-1×1010vgaav病毒。
在注射3周后,对小鼠的耳蜗基底膜进行剥离并且染色,通过统计随机100微米视野内支持细胞中mcherry+细胞比例来说明感染效率。分别统计顶端、中间以及基底(apical,middle,basal)三个部分的支持细胞。
实验结果显示,aav-dj在顶端部分的支持细胞(sox2阳性)中有53.35±2.16%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9各组只有0%、8.01±1.69%、12.26±2.41%的支持细胞为tdtomato阳性(图9,表1)。
aav-dj在中间部分的支持细胞(sox2阳性)中有50.84±1.55%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9各组只有0%、2.78±0.83%、10.85±2.57%的支持细胞为tdtomato阳性(图10,表1)。
aav-dj在中间部分的支持细胞(sox2阳性)中有55.40±1.97%的细胞为tdtomato阳性,而aav-2、aav-8、aav-9各组只有0%、4.84±1.29%、8.05±1.22%的支持细胞为tdtomato阳性(图11,表1)。
以上结果表明,在支持细胞中,aav-dj比aav-2/8/9具有更高的感染效率。
实施例4:不同剂量的aav-dj对小鼠支持细胞的感染
在本实施例中,测定了不同剂量下的aav-dj病毒对支持细胞的感染情况。在实验中,对aav-dj病毒进行了剂量梯度分组,每组小鼠分别注射5×108、1×109、3×109、5×109和1×1010vg病毒。同样的在注射3周后,对小鼠的耳蜗基底膜进行剥离并且染色,分别统计顶端,中间以及基底三个部分的支持细胞中mcherry+细胞比例。
实验结果显示,随着aav-dj剂量的升高,支持细胞的感染效率也逐步提升。当注射最高剂量1×1010vg病毒时,顶端、中间以及基底三个部分的支持细胞中mcherry+细胞比例分别是58.54±3.52%,55.26±2.05%,52.36±1.81%(图12-14,表2)。
表1不同aav亚型对小鼠耳蜗细胞的感染效率
aav不同亚型病毒注射后3周,对小鼠的耳蜗基底膜进行剥离并且染色,分别统计顶端,中间以及基底三个部分的支持细胞中mcherry+细胞比例。结果从至少3只小鼠中获得,并且以平均数±标准差表示。
表2不同剂量aav--php.eb和aav--dj对小鼠耳蜗细胞的感染效率
对aav--php.eb和aav--dj病毒进行了剂量梯度分组,每组小鼠分别注射5×108、1×109、3×109、5×109和1×1010vg病毒。在注射3周后,对小鼠的耳蜗基底膜进行剥离并且染色,分别统计顶端、中间以及基底三个部分的支持细胞中mcherry+细胞比例。结果从至少3只小鼠中获得,并且以平均数±标准差表示。
讨论
本发明是首次在内耳中研究aav-php.eb的感染性能。已有的研究所使用的病毒为aav1-aav9、rh10等病毒,而php.eb是一个人工改造的新的病毒血清型。前人的研究表明aav-php.eb在体内对中枢神经系统的感染性能很强,而对于内耳系统,还没有研究过。本研究首次证明aav-php.eb对内耳毛细胞有非常高的感染,在滴度为5.0x1012vg/ml的时候依然能维持95%左右的感染效率。
最新发表的acn80l65这个病毒对内耳毛细胞也有很高的感染,但这个病毒非常难以获得,在包病毒的时候出毒率极低,非常难以达到1.0x1012vg/ml的滴度,所以这个病毒虽然感染率高,但是不可能实现大范围应用。而本研究所使用的php.eb非常容易获得,很容易能达到3.0x1013vg/ml的滴度,能轻松超过acn80l65这个病毒30倍的滴度。
综上所述,aav-php.eb具有较大的潜力成为广泛应用于内耳毛细胞感染的aav病毒。
本发明所用的aav-dj在内耳中没有研究过,本发明是第一次在内耳中探究aav-dj对内耳的感染情况。本发明人发现aav-dj对内耳支持细胞有很高的感染性能,能达到50%以上的感染。而之前的研究发现aav1-aav9等各种血清型的aav对内耳支持细胞几乎不感染。最新发表的aav2.7m8这个病毒虽然能感染支持细胞,但感染效率不到20%,而且需要较高的滴度才能达到20%左右的感染效率。
而本发明所使用的aav-dj在滴度为1.0x1013vg/ml的时候就能达到50%以上的感染效率,远远超过了aav2.7m8的感染效率。并且,aav-dj很容易包装,产毒率非常高,很容易获得高质量高滴度的病毒(在我们的研究中经常能获得5.0x1013vg/ml的高滴度病毒)。
因此,aav-dj具有较大的潜力被广泛应用于内耳支持细胞感染的aav。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!