一种提高lunasin多肽在大豆中表达量的方法与流程
本发明涉及基因工程技术领域,特别涉及一种提高lunasin多肽在大豆中表达量的方法以及其在功能食品中的应用。
背景技术:
lunasin是在大豆中分离获得的一种含有43个氨基酸的多肽化合物,具有抗癌、抗炎、抗氧化和降胆固醇等特性。研究发现,lunasin在天然原料中含量较低,单纯从天然原料中提取、分离纯化等来获得lunasin,成本较高。鉴于其重要的实用价值,如何高效大量的获得lunasin是需要攻克的难题。
随着生物技术的不断发展,基因工程和植物遗传转化技术使这一设想成为可能,将lunasin基因整合到大豆的基因组中,通过基因的过表达来提高大豆中lunasin多肽提取物的含量,利用大豆自身的表达系统生产lunasin多肽。大豆作为世界上重要的粮食作物之一,在食品、营养和医药等方面都发挥重要作用,通过基因工程技术获取优良的转基因大豆的手段日趋成熟。
技术实现要素:
本发明所要解决的技术问题是提供一种提高lunasin多肽在大豆中表达量的方法,其将lunasin基因整合到大豆基因组中,这样不仅避免了繁琐的分离纯化加工工程,而且还可以直接为人们日常生活食用。
本发明所要解决的技术问题是通过以下技术方案来实现的:
一种提高lunasin多肽在大豆中表达量的方法,包括以下步骤:
1)大豆lunasin基因克隆和植物表达载体构建:
提取大豆新鲜组织的rna,反转录cdna,以cdna为模板,进行pcr扩增,pcr产物进行琼脂糖凝胶电泳获得lunasin基因片段,回收目的片段,并连接到t载体;得到的重组质粒转化大肠杆菌感受态细胞,然后进行测序验证;酶切,连接,将克隆载体中的lunasin基因片段连入dts1001表达载体中,连接产物转化大肠杆菌感受态细胞;对重组质粒进行酶切验证,测序;
2)将lunasin基因转入大豆基因组:
将包含lunasin基因的重组质粒通过电击转化农杆菌,测序鉴定后选取阳性菌株转化大豆,提取大豆基因组,pcr鉴定验证阳性转基因大豆,胶回收进行测序。
优选地,上述技术方案中,所述引物包含上游引物和下游引物,其中:
上游引物:cgagctcatgtccaaatggcagcaccagc;
下游引物:ggggtacctcagtcgtcgtcatcatcatc。
优选地,上述技术方案中,所述方法还包括:3)转基因大豆中lunasin的表达检测。
优选地,上述技术方案中,所述步骤3)具体包括:31)试剂盒提取大豆rna;32)反转录为cdna;以及qrt-pcr检测转基因大豆中lunasin的表达量。
优选地,上述技术方案中,所述步骤31)具体为:
(1)取500μl裂解液rltplus2,转入1.5ml离心管中,加入50μlplantaid混匀备用;
(2)液氮中研磨适量植物组织成细粉后,取50mg细粉转入上述装有rltplus2和plantaid的离心管,立即用手剧烈振荡20秒,充分裂解;
(3)将裂解物12000rpm离心5-10分钟,将所有裂解物上清转移至一个基因组dna清除柱中,12000rpm离心30~60秒,收集滤液;
(4)向收集的滤液中加入0.5倍体积的无水乙醇,立即吹打混匀,将混合物加入一个吸附柱ra中,12,000rpm离心60秒,弃掉废液;
(5)向吸附柱ra中加500μl去蛋白液rw1,室温放置30秒,12,000rpm离心30秒,弃掉废液;
(6)向吸附柱ra中加入500μl漂洗液rw,12,000rpm离心30秒,弃掉废液。加入500μl漂洗液rw,重复一遍;
(7)将吸附柱ra放回空收集管中,12,000rpm离心2分钟,尽量除去漂洗液;
(8)取出吸附柱ra,放入一个rnasefree离心管中,加30-50μlrnasefreewater,室温放置1分钟,12000rpm离心1分钟,收集用于下一步实验。
优选地,上述技术方案中,所述步骤32)具体为:将rna模板和引物混合,65℃金属浴孵育5min后,立即置于冰上冰浴2min,加入其它反应试剂;42℃孵育15min后,85℃加热5s,反转录完成。
优选地,上述技术方案中,所述步骤33)具体为:反转录结束后,将cdna稀释10倍,用于qrt-pcr,分析lunasin在不同转基因系中的表达情况。
一种lunasin多肽过表达的大豆,所述大豆是根据上述任一所述的提高lunasin多肽在大豆中表达量的方法获得的。
一种lunasin多肽过表达的大豆的提纯方法,包括以下步骤:
1)将上述放放获得的含lunasin多肽的大豆置于预冷的研钵中,加入液氮进行充分研磨,至粉末状;
2)加入pbs缓冲液,低温条件下震荡提取48h;
3)将混合物12000g离心30min,收集上清液,用10kd和3kd孔径的截留柱超滤纯化上清液;
4)将收集到的浓缩液经真空冷冻干燥,得高纯的lunasin多肽。
一种lunasin多肽过表达的大豆在功能食品中的应用。
优选地,上述技术方案中,应用于制备抗氧化性食品、抗炎性食品以及抗癌性食品。
本发明上述技术方案,具有如下有益效果:
1、通过本申请的方法已获得稳定遗传的转lunasin大豆,并通过qrt-pcr检测和westernblot印记杂交分析,表明lunasin在大豆中成功表达,而且在转lunasin大豆中的lunasin表达明显升高;
2、对获得的大豆中的lunasin进行分离纯化,经uplc-ms/ms和酶联免疫方法鉴定lunasin在大豆中的含量分别为1.44mg·g-1(wt),2.14mg·g-1(l12),1.66mg·g-1(l43),2.62mg·g-1(l45);
3、进行抗氧化活性分析,表明过表达lunasin的大豆多肽提取物抗氧化性明显高于野生型大豆;
4.lps诱导的炎症反应中,过表达lunasin的大豆多肽提取物抗炎活性明显高于野生型大豆;
5.抗癌活性分析表明,过表达lunasin的大豆多肽提取物对人乳腺癌细胞mb-mda-231无毒性,且可以显著抑制癌细胞mda-231的增值生长。
附图说明
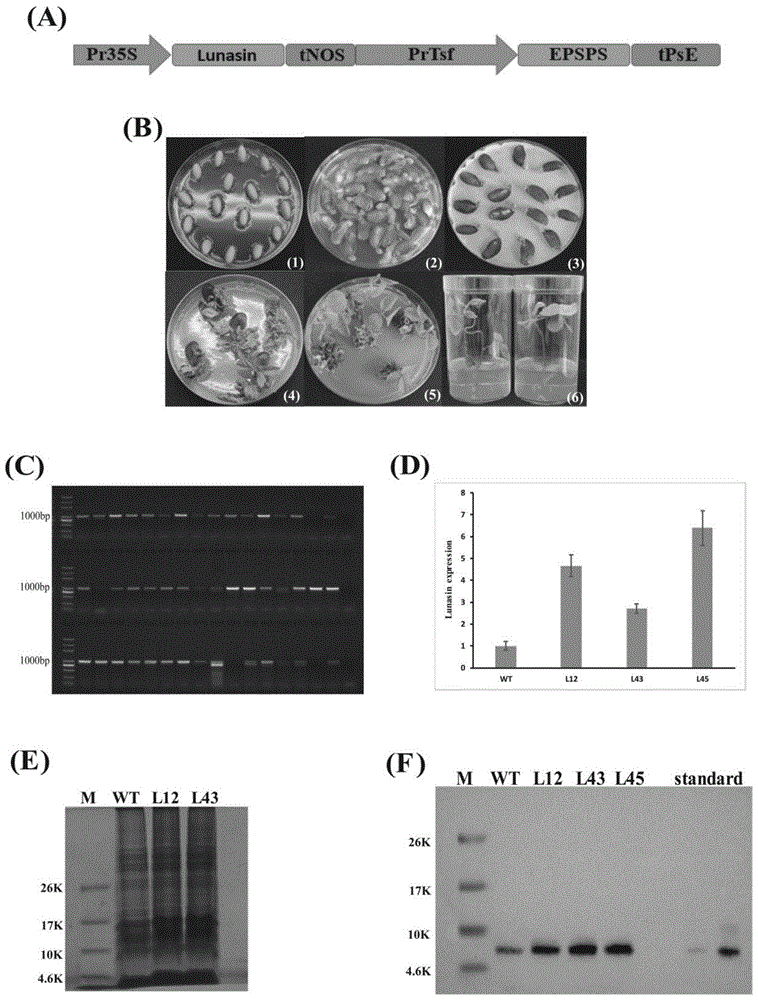
图1为转基因大豆的获得及其分子鉴定,其中1a为构建dts1001植物表达载体图;1b为通过农杆菌介导法将lunasin基因整合入大豆基因组;1c为用eps-f/eps-r为上下游引物进行pcr验证;1d为荧光定量检测图;1e为大豆蛋白sds-page分析图;图1f为westernblot印记杂交结果图。
图2为lunasin标准品图,其中2a为lunasin标准品色谱图;2b为lunasin标准品质谱图。
图3为大豆lunasin提取物样品的图,其中3a为色谱图;3b为质谱图。
图4a为lunasin标准品进行系列浓度稀释的标准曲线图。
图4b为大豆lunasin提取物样品进行倍比稀释后的lunasin含量图。
图5a为let对dpph自由基的清除活性。
图5b为lew对abts+自由基的清除活性。
图5c为let的orac值图。
图6a为let、lew样品在系列浓度梯度(0.25-4g·l-1)范围内对小鼠巨噬细胞raw264.7毒性图。
图6b为lew对no的抑制率。
图6c为let、lew对il-1的抑制率。
图6d为let、lew对对il-6的抑制率。
图7a为let、lew样品在系列浓度梯度(0.25-4g·l-1)范围内对人乳腺癌细胞mda-231毒性图。
图7b为let、lew对癌细胞mda-231的抑制率对比图。
具体实施方式
下面对本发明的具体实施例进行详细描述,以便于进一步理解本发明。
以下实施例中所有使用的实验方法如无特殊说明,均为常规方法。以下实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径获得。
实施例1
1.大豆lunasin基因克隆和植物表达载体构建
提取大豆新鲜组织的rna,反转录cdna,以cdna为模板,以iun-f:cgagctcatgtccaaatggcagcaccagc和iun-r:ggggtacctcagtcgtcgtcatcatcatc为上下游引物进行pcr扩增,pcr产物进行琼脂糖凝胶电泳得到lunasin基因片段,回收目的片段,并连接到t载体;得到的重组质粒转化大肠杆菌感受态细胞,然后进行测序验证;酶切,连接,将克隆载体中的lunasin基因片段连入dts1001表达载体中,连接产物转化大肠杆菌感受态细胞;对重组质粒进行酶切验证,测序。
2.农杆菌电击转化和大豆遗传转化,将lunasin基因转入大豆基因组
将包含lunasin基因的重组质粒通过电击转化农杆菌,测序鉴定后选取阳性菌株转化大豆,提取大豆基因组,pcr鉴定验证阳性转基因大豆,胶回收进行测序。
大豆基因组的提取利用dna提取试剂盒进行提取。(植物组织基因组dna提取试剂盒-天津生化科技)上下游引物序列为epsps-f:actggttgccgtttgactatg,epsps-r:acccataacgaggaagctcat;pcr反应体系为20ul.
pcr扩增程序为:95℃5min;95℃30s,56℃30s,72℃45s;72℃10min;30个循环。
3.转基因大豆中lunasin的表达检测
3.1试剂盒提取大豆rna
(1).取500μl裂解液rltplus2(已加入β-巯基乙醇),转入1.5ml离心管中,加入50μlplantaid混匀备用;
(2).液氮中研磨适量植物组织成细粉后,取50mg细粉转入上述装有rltplus2和plantaid的离心管,立即用手剧烈振荡20秒,充分裂解;
(3).将裂解物12000rpm离心5-10分钟,将所有裂解物上清转移至一个基因组dna清除柱中,12000rpm离心30~60秒,收集滤液;
(4).向收集的滤液中加入0.5倍体积的无水乙醇,立即吹打混匀,将混合物加入一个吸附柱ra中,12,000rpm离心60秒,弃掉废液;
(5).向吸附柱ra中加500μl去蛋白液rw1,室温放置30秒,12,000rpm离心30秒,弃掉废液;
(6).向吸附柱ra中加入500μl漂洗液rw,12,000rpm离心30秒,弃掉废液。加入500μl漂洗液rw,重复一遍;
(7).将吸附柱ra放回空收集管中,12,000rpm离心2分钟,尽量除去漂洗液;
(8).取出吸附柱ra,放入一个rnasefree离心管中,加30-50μlrnasefreewater,室温放置1分钟,12,000rpm离心1分钟,收集用于下一步实验。
3.2反转录为cdna
反应体系:
将rna模板和引物混合,65℃金属浴孵育5min后,立即置于冰上冰浴2min,加入其它反应试剂。42℃孵育15min后,85℃加热5s,反转录完成。
3.3qrt-pcr检测转基因大豆中lunasin的表达量
反转录结束后,将cdna稀释10倍,用于qrt-pcr,分析lunasin在不同转基因系中的表达情况.
荧光定量程序:
holdingstage:50℃1min,95℃1min;
cycllingstage:95℃15s,55℃15s,72℃45s,45个循环;
meltcurvestage:95℃15s,60℃1min,95℃30s,60℃15s;
荧光定量体系:
4.提取转lunasin大豆蛋白,分离纯化lunasin,uplc-ms/ms鉴定大豆中的lunasin:
取转基因大豆于预冷的研钵中,加入液氮进行充分研磨,至粉末状,然后加入pbs缓冲液,低温条件下震荡提取48h。将混合物12000g离心30min,收集上清液,用10kd和3kd孔径的截留柱超滤纯化上清液,将收集到的浓缩液经真空冷冻干燥后得到高纯的lunasin多肽。最后将分离纯化的lunasin提取物let(lunasinextractsfromtransgenicsoybean)溶于超纯水中。
与此类似,将野生型大豆进行研磨,超滤,分离纯化出相同分子量大小的lunasin多肽lew(lunasinextractsfromwildtypesoybean)。
取适量let和lew进行westernblot,检测lunasin的表达情况。let,lew经uplc-ms/ms进行检测,鉴定大豆中的lunasin。uplc连接sciextripletof6600质谱仪,该仪器在离子电喷雾电离模式下进行一级,二级碎片扫描。分离柱为cshc18(1.7μm,2.1mm×100mm),流速为0.2ml/min,a相为0.1%甲酸水溶液,b相为0.1%甲酸乙腈。流动条件为:2分钟95%a,15分钟65%a,18分钟20%a,23分钟20%a,24分钟95%a,30分钟95%a。根据样品的一级,二级质谱信号鉴定lunasin。
5.酶联免疫法检测转基因大豆中lunasin含量,lunasin标准品进行系列浓度稀释(0.78125、1.5625、3.125、6.25、12.5、25、50、100及200ng·ml-1)。
(1)抗原包被:于96孔板中加入每孔100μl包被液(含样品),37℃孵育2小时。
(2)封闭:倒去抗原,每孔加入100μl封闭液[pbst(0.05%tween-20),5%脱脂奶粉,ph=7.2]。37℃孵育1小时。倒去封闭液,pbst洗板3次。
(3)孵育一抗:加入每孔100μl的一抗,稀释度为1:1000。37℃孵育1小时。倾去一抗,pbst洗板3次。
(4)孵育二抗:每孔加入二抗稀释液100μl(hrp标记羊抗兔1:5000),37℃孵育45min。洗板3次,同上。
(5)显色:加入每孔100μl的tmb底物(现用现配),室温孵育5-20分钟。
(6)终止:加入每孔100μl的终止液(2mh2so4)终止显色。
(7)在酶标仪上读取450nm的吸光度,计算lunasin含量。
6.抗氧化性检测
自由基的清除是抗氧化剂发挥抗氧化作用的主要机制。自由基的清除能力是通过检测在简化的“无脂”体系中潜在的抗氧化剂提供的氢或者电子向自由基迁移的能力。通过检测let(lunasinextractsfromtransgenicsoybeanlinesl12、l43andl45),lew(lunasinextractsfromwildsoybean)的abts+,dpph,氧自由基清除能力来评估转基因大豆中lunasin多肽的抗氧化性。
6.1abts+自由基清除实验
配制适量的abts+储备液(7.4mmol/l),abts+储备液与k2s2o8储备液(2.6mmol/l)等体积混合,制成abts+高浓度工作液,室温避光存放12–16h,使用前用80%乙醇进行稀释,稀释后的abts+工作液的吸光度值减去乙醇空白对照的吸光度值后,a734要求在0.7±0.05范围内。将let,lew配置成0.5、1、2、4、8g·l-1系列梯度浓度,将样品溶液与abts+工作液混匀于96孔板中,反应5min,测定734nm处吸光值。实验以trolox(0.3mmol/l)作为阳性对照,空白组包括样品空白组和试剂空白组,每个实验组重复三次。按下式计算abts的清除率:abts+清除率(%)=[1-(at-b)/a0]×100%,at:样品反应后的吸光度值;b:样品空白组的吸光度值;a0:试剂空白组的吸光度值。
6.2dpph自由基清除实验
将let,lew配置成0.5、1、2、4、8g·l-1系列梯度浓度,将dpph溶液(2×10-4mol/l),与样品等体积充分混合,测定517nm处吸光度值ai,室温避光保存30min后再在517nm处测定其吸光度aj,对照试验为只加dpph的乙醇溶液,其吸光值记为ac。按下式计算dpph的清除率:k(%)=[1-(ai-aj)/ac]*100%
6.3氧自由基清除实验
orac(oxygenradicalabsorbancecapacity),氧化自由基吸收能力又称为抗氧化能力指数。orac分析方法是根据自由基破坏荧光探针,使荧光强度产生变化原理,以维生素e水溶性类似物trolox为定量标准,使用荧光微孔板分析仪进行分析。荧光强度的变化大小反映自由基破坏的程度。在抗氧化剂存在时,它可以抑制由自由基引起的荧光变化。抑制程度反映了它对自由基的抗氧化能力。
将let,lew配置成0.1、0.25、0.5、1、2g·l-1系列梯度浓度,配置适合浓度的荧光钠溶液(4125mmol/l)和aaph(153mmol/l)溶液。将100ul荧光钠稀释液与50ul样品混匀于96孔荧光板中,振荡5min,37℃温育10min后迅速加入50ulaaph液启动反应,以激发波长485nm,发射波长535nm进行测定并记录荧光值,反应过程中每隔2min测定一次荧光值(记为fn)。orac实验需要设定两种对照,即没有添加自由基的fl荧光自然衰减对照(-aaph)和没有抗氧化剂存在时的自由基作用对照(+aaph)。orac值以trolox当量(μmoltrolox当量/μmol,μmoltrolox当量/ml及μmoltrolox当量/mg)表达,其计算公式为:orac值=[(aucsample-auc+aaph)/(auctrolox-auc+aaph)]×(molarityoftrolox/molarityofsample)
7.抗炎性检测
一氧化氮,作为一种多功能的内源性气体信号分子,具有重要的生理和病理功能。no的合成是巨噬细胞被激活的重要标志。巨噬细胞被激活后可迅速表达il-6、tnf-α以及il-1等细胞因子来介导宿主细胞免疫,一定浓度的no、il-6、tnf-α以及il-1表达对机体的免疫具有积极意义。然而若机体产生过量的no、il-6、tnf-α以及il-1,便会引发炎症反应,造成组织细胞病理损伤。本研究通过分析let,lew对lps引发的炎症反应的抑制能力来评估转lunasin大豆中lunasin多肽的抗炎活性。
小鼠巨噬细胞raw264.7在rp1640培养基置恒温培养箱中(37℃,5%co2,饱和湿度)培养,当培养细胞铺满整个培养瓶的底面积70-80%时(处于对数生长期),用细胞刮收取对数生长期的raw264.7细胞,转移至离心管中,1000rpm,离心5分钟,将密度调整为2.5×106个/ml,按照100μl/孔,接种于96孔细胞培养板,设置三组实验,分别加入100μl不同浓度的样品(样品组),lps(阳性对照组),培养基(空白对照组),加入完成后,96孔板放入培养箱培养2小时,之后,除空白对照组,其他两组均加入lps,培养24小时后,测定上述各组中上清液no浓度。il-6、tnf-α以及il-1表达量的测定参考bdpharmingen公司酶联免疫试剂盒进行测定。
8.抗增殖活性检测
人乳腺癌细胞mda-231细胞是广泛应用于癌症机理研究、遗传学和营养学等方面的一类细胞株。细胞毒性试验采用亚甲基蓝染色法,即将mda-231细胞悬液接种于96孔细胞培养板上(要求每孔的细胞数达到4×104个),每孔加入100μl培养液,37℃下培养24h,待细胞贴壁生长后,每孔加入100μl不同浓度的样品(样品组),lps(阳性对照组),培养基(空白对照组),37℃下培养24h后,去除上清液,用pbs清洗每个孔后去除溶液,每孔加入50μl亚甲基蓝着色液,置于37℃下培养1h。取出96孔细胞培养板,去除染色液,浸入去离子水中洗板6次直到去离子水变清澈透明。甩干细胞培养板中的去离子水,每孔加入100μl洗脱缓冲液,在平板振荡器上振荡20min,570nm下用酶标仪测定其吸光度值,比较不同浓度的样品与对照的区别。
抗增殖作用采用mda-231细胞亚甲基蓝比色测定方法,将mda-231细胞悬液接种于96孔细胞培养板上(要求每孔的细胞数达到2.5×104个),96孔细胞培养板外围四周的孔不加细胞悬液,仅加入100μl不含细胞的培养液,其目的是用于和内部加入悬液的孔进行空白对照。内部每孔加入100μl培养液,37℃下培养4h,使细胞完全贴壁生长。去除上清液,每孔加入100μl含不同浓度的样品(样品组),lps(阳性对照组),培养基(空白对照组),放置于37℃下培养培养96h。取出96孔细胞培养板,去除染色液,浸入去离子水中洗板6次直到去离子水变清澈透明。甩干细胞培养板中的去离子水,每孔加入100μl洗脱缓冲液,在平板振荡器上振荡20min,570nm下用酶标仪测定其吸光度值。每个样品至少做3次平行,以半最大效应浓度(ec50)来判定细胞的抗增殖作用。
结果分析:
1.以大豆lunasincdna序列为模板,设计特异性引物,通过pcr扩增获得目的序列,然后构建dts1001植物表达载体(图1a),通过农杆菌介导法将lunasin基因整合入大豆基因组中(图1b),提取大豆基因组dna,以大豆dna为模板,用eps-f/eps-r为上下游引物进行pcr验证,结果与预期相符(图1c),表明lunasin基因已成功整合入大豆基因组中,选取了3个转基因株系l12、l43和l45进行后续实验。
2.提取转lunasin大豆总rna,反转录cdna,以cdna为模板,进行实时荧光定量检测(图1d),测定lunasin在各个转基因系中的表达情况。结果显示,lunasin在野生型大豆和转基因大豆中均有表达,但转基因大豆中lunasin的表达量显著提高,表明在大豆中过表达lunasin确实提高了其在转录水平的表达。
3.提取大豆总蛋白,经过分离纯化得到了富含lunasin的多肽化合物,westernblot印记杂交结果显示(图1f),lunasin多肽在野生型大豆和转基因大豆中成功表达,而且与转录水平的结果一致,转基因大豆中lunasin多肽蛋白表达量显著上升,表明通过转基因技术确实提高了大豆中lunasin多肽的产量。采用uplc-ms-ms检测大豆中的lunasin,lunasin标准品的色谱图[m+7h]7+为718.90,[m+5h]5+为1006.45,[m+4h]4+为1257.39,在保留时间12.893min时中出峰(图2),分子量为5kd左右,这与之前报道的研究相符.样品中lunasin提取物中物质成分较多,峰图较复杂(图3),但也可检测到母离子峰为838.54的峰图,同位素之间带有6个电荷,结果表明lunasin多肽在大豆中成功表达。
4.通过酶联免疫的方法检测大豆样品中lunasin含量。lunasin标准品进行系列浓度稀释(0.78125、1.5625、3.125、6.25、12.5、25、50、100及200ng·ml-1),标准曲线为y=00.63x+0.0342r2=0.998(图4a)。样品进行倍比稀释(1:1024),检测lunasin含量,结果表明过表达lunasin提高了lunasin含量(图4b),lunasin在野生型和转基因大豆中的含量分别为1.44mg·g-1(wt),2.14mg·g-1(l12),1.66mg·g-1(l43),2.62mg·g-1(l45).
5.通过检测let,lew的abts+自由基清除能力,dpph自由基清除能力,氧自由基清除能力(orac)来评估转基因大豆中lunasin多肽的抗氧化性。
在dpph自由基测定中,let-l12,let-l43,let-l45dpph自由基清除活性(ic50值为4g·l-1)明显高于野生型lew,其dpph自由基清除活性显示ic50值为6.95g·l-1(图5a);在abts+自由基测定中,let-l12,let-l43,let-l45的ic50值分别为4.68,4.46,4.61g·l-1;而lew的abts+自由基清除活性明显较低,ic50值为5.38g·l-1(图5b)。此外,在orac分析中,let的orac值也明显高于lew(图5c)。结果表明,转基因大豆中lunasin多肽提取物抗氧化性高于野生型大豆中lunasin多肽提取物,呈差异显著。
6.通过分析let,lew对lps诱发的raw264.7内no、tnf-α,il-1和il-6过量表达的抑制能力来评估转基因大豆中lunasin多肽的抗炎活性。
研究表明,let、lew样品在系列浓度梯度(0.25-4g·l-1)范围内对小鼠巨噬细胞raw264.7无毒性(图6a)。且小鼠巨噬细胞raw264.7在经过lps刺激之后,细胞内no,il-1和il-6表达量显著升高,但这种上调可明显被let,lew抑制,且let抑制效果明显强于lew。研究结果表明,在let、lew浓度均为1g·l-1时,let对no的抑制率为47.5%,而lew对no的抑制率为30%(图6b)。在细胞因子的测定中,let、lew(浓度均为1g·l-1)对il-1的抑制率分别为85.1%,74.7%(图6c);对il-6的抑制率分别为43.1%,27.56%(图6d)。上述结果表明,在lps诱导的炎症反应中,转lunasin大豆多肽提取物抗炎性明显高于野生型大豆。
7.通过分析let、lew对人乳腺癌细胞mda-231的抗增值活性来检测大豆lunasin提取物的抗癌活性。研究表明,let、lew样品在系列浓度梯度(0.25-4g·l-1)范围内对人乳腺癌细胞mda-231无毒性(图7a)。在抗增值实验中,let、lew可显著抑制人乳腺癌细胞mda-231的增值生长;然而,let的抑制活性明显高于lew,在浓度为4g·l-1时,let对癌细胞mda-231的抑制率为43%,而lew对癌细胞mda-231的抑制率为23.8%(图7b)。
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!