一种双功能荧光探针及其制备方法和应用与流程
本发明属于荧光探针技术领域,尤其涉及一种双功能荧光探针及其制备方法和应用。
背景技术:
金属,在自然界广泛分布。在现代社会起着举足轻重并且不可替代的作用,广泛的用于化学工业、制造业、建筑业和国防科工等诸多行业。部分金属元素为人体必需微量元素。部分金属元素为人体不必需元素,当摄入或接触这些元素后,会影响人的生理功能。重金属,是指密度大于等于4.5g/cm3的金属。常见的重金属包括铁、铜、锌、银、金、汞和铅等。重金属污染不同于有机物污染。大部分有机物可以通过自然界自身的物理、化学和生物降解净化,使其毒害性降低。重金属不仅不能通过自然界降解净化,并且具有生物富集性,直接造成人体伤害。因此,重金属离子的检测在生命科学和环境科学都具有重要的意义。
传统的检测方法包括原子光谱法、比色法及色谱法等。这些方法成本高且灵敏度低,不能实时进行简单快速的分析。同时这些方法仅适合检测环境中的重金属离子,并不能实现在活细胞内的检测。而小分子荧光探针的方法因其具有选择性强、灵敏度高、响应时间快速且成本低廉等优势近年来越来越多地被应用于各个领域。同时,小分子荧光探针可以实现对活细胞等生物样品中特定物质的在线监测。
因此,开发可以对特定重金属离子进行特异性检测,反应快速的小分子荧光探针非常有意义。
技术实现要素:
本发明公开了一种可检测银离子、铜离子和汞离子并同时具有解毒作用的双功能荧光探针,该荧光探针灵敏度高,且检测方法简单快速,解决了现有的荧光探针灵敏度低、检测方法复杂等问题。
具体的,本发明的技术方案如下:
本发明一方面公开了一种荧光探针,所述荧光探针具有如下式ⅰ的结构:
优选的,将式1结构作如下标示:
其中,以7-二乙胺基香豆素为荧光团,荧光团的3位与d-青霉胺衍生的四氢噻唑的2’位直接相连,其中四氢噻唑4’位的手性中心为s构型,2’位的手性中心为r或s构型,所述荧光探针含一对无法分离的非对映异构体。
本文中的“荧光探针”是指在紫外-可见-近红外区有特征荧光,并且其荧光性质(激发和发射波长、强度、寿命、偏振等)可随所处环境的性质,如极性、折射率、粘度等改变而灵敏地改变的一类荧光性分子。
本发明第二个方面公开了一种制备上述的荧光探针的方法,包括以下步骤:
将醛基香豆素与d-青霉胺在混合溶剂中进行回流反应,然后冷却至室温并过滤即可得到上述的荧光探针;其中,所述混合溶剂包括甲醇和水。
优选的,将醛基香豆素与d-青霉胺在混合溶剂中进行回流反应2小时,所述混合溶剂中甲醇和水的体积比为1:1。
本发明第三个方面公开了上述的方法制备得到的荧光探针。
本发明第四个方面公开了上述的荧光探针在检测水环境中是否含有重金属离子中的应用。
优选的,所述重金属离子为银离子、铜离子和汞离子。
应当理解,本发明的荧光探针检测的重金属离子并不限于银离子、铜离子和汞离子,利用本发明公开的荧光探针检测到的任意重金属离子均在本发明的保护范围之内。
优选的,所述应用包括以下步骤:
(1)将所述的荧光探针加入待测水环境;
(2)观察加入前后的荧光光谱变化;
其中,检测银离子时,荧光激发波长为396nm,所述荧光光谱变化是指:若荧光光谱中,在488nm处荧光峰值变小,两小时内无荧光增强,则表明所述水环境中含有银离子;
检测铜离子时,荧光激发波长为360nm,所述荧光光谱变化是指:若荧光光谱中,449nm处荧光峰值变大,488nm处荧光峰值变小,449nm与488nm处荧光比值变大,则表明所述水环境中含有铜离子;
检测汞离子时,荧光激发波长为477nm,所述荧光光谱变化是指:若荧光光谱中,502nm处荧光峰值变大,则表明所述水环境中含有汞离子。
应该理解,本发明不限于上述步骤,还可以包含其他的步骤,例如在步骤(1)之前、步骤(1)和(2)之间、步骤(2)之后,还包含其他额外的步骤,而不超出本发明的保护范围。
本发明第五个方面公开了上述的荧光探针在检测细胞中是否含有重金属离子中的应用。
优选的,所述应用包括以下步骤:
s1:向待测细胞内加入所述荧光探针;
s2:观察加入前后细胞荧光成像图的变化;
其中,所述荧光成像图的变化是指:收集荧光显微镜蓝色通道荧光,若蓝色通道荧光减弱,则说明检测到银离子;
收集荧光显微镜蓝色通道荧光,若随着时间延长,蓝色通道荧光先减弱,后逐渐增强,则说明检测到铜离子;
收集荧光显微镜绿色通道荧光,若绿色通道荧光增强,则说明检测到汞离子。
应该理解,本发明不限于上述步骤,还可以包含其他的步骤,例如在步骤s1之前、步骤s1和s2之间、步骤s2之后,还包含其他额外的步骤,而不超出本发明的保护范围。
本发明第六个方面公开了上述的荧光探针在驱除细胞内重金属离子以降低重金属离子的毒害作用中的应用。具体的,包括以下步骤:
1)向待测细胞内加入上述荧光探针;
2)计算细胞存活率;
其中,所述细胞存活率增大,表明本发明的诊断治疗型重金属荧光探针可以驱除细胞内的银离子,铜离子或汞离子,减少重金属的毒害作用。
本发明第六个方面公开了一种试剂盒,所述试剂盒包括上述的荧光探针。
优选的,所述试剂盒还包括纸质说明书等。
本发明第七个方面公开了一种检测系统,所述检测系统包括上述的荧光探针,或者所述检测系统包括上述的试剂盒。
本发明第八个方面公开了如下应用:
a)所述的试剂盒或者所述的检测系统在检测水环境或者细胞中是否含有重金属离子中的应用;
b)所述的试剂盒或者所述的检测系统在驱除细胞内重金属离子毒害中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,而不超出本发明的构思与保护范围。
本发明相对于现有技术具有如下的显著优点及效果:
(1)灵敏度高
本发明的荧光探针可以选择性与银离子,铜离子和汞离子快速发生特异性反应,生成荧光变化的产物。相较于常见的其他金属离子,本发明的诊断治疗型重金属荧光探针对于银离子,铜离子或汞离子表现出了较高的选择性和灵敏性。
(2)抗干扰能力强
本发明的诊断治疗型重金属荧光探针,能抗锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子的干扰。
(3)应用广泛、潜力大
除了能用于检测水环境中的银离子,铜离子和汞离子外,本发明荧光探针可以实现对细胞内银离子,铜离子和汞离子的检测,且可以驱除细胞内银离子、铜离子和汞离子,减少重金属的毒害作用,具有潜在的实际应用价值。
(4)制备优势显著
本发明的荧光探针制备方法简单,产率较高。
附图说明
图1是实施例中荧光探针ⅰ的1hnmr图谱。
图2是实施例中荧光探针ⅰ的13cnmr图谱。
图3是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ随不同量银离子的加入荧光谱图的变化情况;图中,从上至下,银离子浓度依次为0到5μmol/l的荧光光谱图,反应时间为30秒。
图4是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ随不同量铜离子的加入荧光谱图的变化情况;图中,从右至左,铜离子浓度依次为0到10μmol/l的荧光光谱图,反应时间为30分钟。
图5是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ随不同量汞离子的加入荧光谱图的变化情况;图中,从下至上,汞离子浓度依次为0到1μmol/l的荧光光谱图,反应时间为15分钟。
图6是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ与5μmol/l银离子在250秒内488nm处荧光强度随时间变化图。
图7是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ与5μmol/l铜离子在60分钟内449nm处荧光强度随时间变化图。
图8是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ与0.5μmol/l汞离子在40分钟内502nm处荧光强度随时间变化图。
图9是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子存在下的选择性柱状荧光数据图(黑色)以及1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子和5μmol/l银离子存在下的竞争性柱状荧光数据图(红色),图中其他金属离子分别为:锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,反应时间为30秒。
图10是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子存在下的选择性柱状荧光数据图(黑色)以及1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子和5μmol/l铜离子存在下的竞争性柱状荧光数据图(红色),图中其他金属离子分别为:银离子、汞离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,反应时间为30分钟。
图11是在pbs(20mm,ph=7.4)中浓度为1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子存在下的选择性柱状荧光数据图(黑色)以及1μmol/l的实施例中荧光探针ⅰ在50μmol/l不同金属离子和5μmol/l汞离子存在下的竞争性柱状荧光数据图(红色),图中其他金属离子分别为:银离子、铜离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,反应时间为15分钟。
图12是实施例中荧光探针ⅰ与mcf-7细胞中银离子响应的荧光成像图,图中,(a-d)是没有加入任何物质的成像图;(e-h)是加入20μmol/l荧光探针ⅰ孵育5小时后的成像图;(i-l)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l银离子孵育20分钟后的成像图;(m-p)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l银离子孵育40分钟后的成像图;(q-t)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l银离子孵育80分钟后的成像图(a,e,i,m,q)为蓝色通道荧光成像;(b,f,j,n,r)为绿色通道荧光成像;(c,g,k,o,s)为明场成像;(d,h,l,p,t)为混合通道荧光成像,标尺为20微米。
图13是实施例中荧光探针ⅰ与mcf-7细胞中铜离子响应的荧光成像图,图中,(a-d)是没有加入任何物质的成像图;(e-h)是加入20μmol/l荧光探针ⅰ孵育5小时后的成像图;(i-l)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l铜离子孵育20分钟后的成像图;(m-p)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l铜离子孵育40分钟后的成像图;(q-t)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l铜离子孵育80分钟后的成像图(a,e,i,m,q)为蓝色通道荧光成像;(b,f,j,n,r)为绿色通道荧光成像;(c,g,k,o,s)为明场成像;(d,h,l,p,t)为混合通道荧光成像,标尺为20微米。
图14是实施例中荧光探针ⅰ与mcf-7细胞中汞离子响应的荧光成像图,图中,(a-d)是没有加入任何物质的成像图;(e-h)是加入20μmol/l荧光探针ⅰ孵育5小时后的成像图;(i-l)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l汞离子孵育20分钟后的成像图;(m-p)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l汞离子孵育40分钟后的成像图;(q-t)是先加入20μmol/l荧光探针ⅰ孵育5小时后,再加入20μmol/l汞离子孵育80分钟后的成像图(a,e,i,m,q)为蓝色通道荧光成像;(b,f,j,n,r)为绿色通道荧光成像;(c,g,k,o,s)为明场成像;(d,h,l,p,t)为混合通道荧光成像,标尺为20微米。
图15是实施例中荧光探针ⅰ和d-青霉胺驱除mcf-7细胞内银离子毒性的数据图,图中,细胞内加入的银离子浓度为20μmol/l,荧光探针ⅰ和d-青霉胺浓度分别为:0,0.032,0.16,0.8,4,20μmol/l。
图16是实施例中荧光探针ⅰ和d-青霉胺驱除mcf-7细胞内铜离子毒性的数据图,图中,细胞内加入的铜离子浓度为50μmol/l,荧光探针ⅰ和d-青霉胺浓度分别为:0,0.4,2,10,50μmol/l。
图17是实施例中荧光探针ⅰ和d-青霉胺驱除mcf-7细胞内汞离子毒性的数据图,图中,细胞内加入的汞离子浓度为8μmol/l,荧光探针ⅰ和d-青霉胺浓度分别为:0,0.5,1,2,4,8,16μmol/l。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行详细描述,但并不因此将本发明限制在所述的实施例范围之中。
实施例1荧光探针ⅰ的合成
合成设计路线如下:
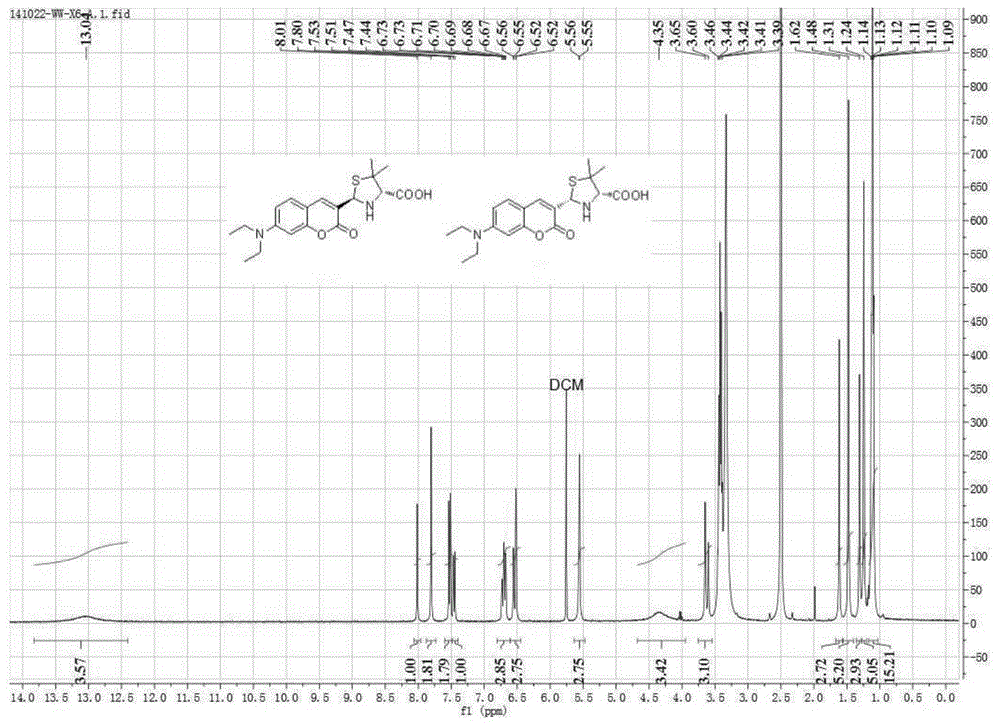
具体的,称取原料醛基香豆素123mg(0.50mmol)加入20ml的甲醇和水(其中,甲醇和水的体积比为1:1)的混合溶剂中得到反应液。在n2保护下,于0℃,将d-青霉胺89mg(0.60mmol)加入到反应液中,于回流温度80℃下反应2h。减压旋干混合溶剂,残余物中加入10ml水,使用二氯甲烷萃取。合并有机相,依次使用1m盐酸和饱和氯化钠洗涤。合并有机相,使用无水硫酸钠干燥,过滤得滤液,接着减压旋干之后,经硅胶柱层析分离,洗脱液为二氯甲烷:甲醇:甲酸体积比60:2:1,分离得到荧光探针ⅰ共135mg(产率为72%)。得到的荧光探针ⅰ含有两个无法分离的非对映异构体,从氢谱的积分可以得知它们的比例为3:2(如图1所示)。
从图1中可以得到主要异构体的核磁共振氢谱1hnmr(400mhz,dmso-d6):δ=13.04(bs,1h),7.80(s,1h),7.52(d,j=8.9hz,1h),6.69(dd,j=8.9,2.2hz,1h),6.52(d,j=2.2hz,1h),5.55(s,1h),4.35(bs,1h),3.65(s,1h),3.41(q,j=6.9hz,4h),1.48(s,3h),1.24(s,3h),1.11(t,j=6.9hz,6h);从图2中可以得到主要异构体的核磁共振碳谱13cnmr(100mhz,dmso-d6):δ=170.6,160.9,155.0,149.9,135.4,129.6,123.3,109.0,107.7,96.3,72.9,63.0,57.8,44.0,28.7,27.0,12.3。
从图1中可以得到次要异构体的氢谱为1hnmr(400mhz,dmso-d6):δ=13.04(bs,1h),8.01(s,1h),7.46(d,j=8.9hz,1h),6.72(dd,j=8.9,2.2hz,1h),6.55(d,j=2.2hz,1h),5.56(s,1h),4.35(bs,1h),3.60(s,1h),3.43(q,j=6.8hz,4h),1.62(s,3h),1.31(s,3h),1.12(t,j=6.8hz,6h);从图2中可以得到次要异构体的碳谱为13cnmr(100mhz,dmso-d6):δ=170.4,160.2,155.6,150.6,141.1,129.6,116.4,109.3,107.3,96.2,74.1,66.0,59.1,44.1,27.9,27.1,12.3。
实施例2荧光探针ⅰ与不同浓度银离子反应的荧光光谱变化
取实施例1中制备的荧光探针ⅰ溶于dmso中,制成浓度为1mmol/l的荧光探针母液;将一水合高氯酸银加入到蒸馏水中,制成浓度为1mmol/l的银离子母液。根据荧光探针和银离子的浓度计算好所需的pbs水溶液(20mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl荧光探针母液加入到pbs水溶液中,再加入不同浓度的银离子母液(0-5μmol/l),配置成探针浓度为1μmol/l的测试溶液共3ml。反应30秒后,用荧光光谱仪测试荧光探针ⅰ与不同浓度银离子反应的荧光光谱变化(激发波长为396nm)。荧光光谱变化如图3所示。可见随着银离子浓度的逐渐增加,探针溶液在488nm处的荧光峰值逐渐减弱。
实施例3荧光探针ⅰ与不同浓度铜离子反应的荧光光谱变化
将六水合高氯酸铜加入到蒸馏水中,制成浓度为1mmol/l的铜离子母液。根据荧光探针和铜离子的浓度计算好所需的pbs水溶液(20mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl实施例2中的荧光探针母液加入到pbs水溶液中,再加入不同浓度的铜离子母液(0-10μmol/l),配置成探针浓度为1μmol/l的测试溶液共3ml。反应30分钟后,用荧光光谱仪测试荧光探针ⅰ与不同浓度铜离子反应的荧光光谱变化(激发波长为360nm)。荧光光谱变化如图4所示。可见随着铜离子浓度的逐渐增加,探针溶液在488nm处的荧光峰值逐渐减弱,在449nm处的荧光峰值增强。
实施例4荧光探针ⅰ与不同浓度汞离子反应的荧光光谱变化
将三水合高氯酸汞加入到蒸馏水中,制成浓度为1mmol/l的汞离子母液。根据荧光探针和汞离子的浓度计算好所需的pbs水溶液(20mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl实施例2中的荧光探针母液加入到pbs水溶液中,再加入不同浓度的汞离子母液(0-1μmol/l),配置成探针浓度为1μmol/l的测试溶液共3ml。反应15分钟后,用荧光光谱仪测试荧光探针ⅰ与不同浓度汞离子反应的荧光光谱变化(激发波长为477nm)。荧光光谱变化如图5所示。可见随着汞离子浓度的逐渐增加,探针溶液在502nm处的荧光峰值逐渐增强。
实施例5荧光探针ⅰ与银离子反应随时间变化的荧光谱图变化
根据荧光探针和甲醛的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl实施例2中的荧光探针母液加入到pbs水溶液中,再加入15μl银离子母液,配制成探针浓度为1μmol/l,银离子浓度为5μmol/l的测试溶液共3ml。用396nm作激发波长,测试其随时间变化的荧光谱图变化。如图6所示,随着时间增加,488nm处荧光峰值逐渐减弱,在30秒内达到最小值。
实施例6荧光探针ⅰ与铜离子反应随时间变化的荧光谱图变化
根据荧光探针和甲醛的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl实施例2中的荧光探针母液加入到pbs水溶液中,再加入15μl铜离子母液,配制成探针浓度为1μmol/l,铜离子浓度为5μmol/l的测试溶液共3ml。用360nm作激发波长,测试其随时间变化的荧光谱图变化。如图7所示,随着时间增加,449nm处荧光峰值逐渐增强,在30分钟后增强速度逐渐减缓。
实施例7荧光探针ⅰ与汞离子反应随时间变化的荧光谱图变化
根据荧光探针和甲醛的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml),取3μl实施例2中的荧光探针母液加入到pbs水溶液中,再加入1.5μl汞离子母液,配制成探针浓度为1μmol/l,汞离子浓度为0.5μmol/l的测试溶液共3ml。用477nm作激发波长,测试其随时间变化的荧光谱图变化。如图8所示,随着时间增加,502nm处荧光峰值逐渐增强,在15分钟后增强速度逐渐减缓。
实施例8荧光探针ⅰ检测银离子对不同金属离子的选择性竞争性研究
根据荧光探针和不同金属离子的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml)。本实施例分为a组和b组,其中a组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中,除第一个空白样品不外加任何其它离子外,其它分别再加不同金属离子:为锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针最终浓度为1μmol/l,不同金属离子最终浓度为50μmol/l的测试溶液共3ml。b组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中后,除第一个样品仅加入银离子(最终银离子浓度为5μmol/l)外,其它样品除了加入银离子外还分别加入10当量的不同金属离子,分别为锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针最终浓度为1μmol/l,银离子最终浓度为5μmol/l,不同金属离子最终浓度为50μmol/l的测试溶液共3ml。反应30秒后,用荧光光谱仪测试不同样品的488nm处荧光发射强度(激发波长为396nm)。如图9所示,相对于探针i的pbs水溶液(图9左起第一黑色柱状图),5μmol/l的银离子的加入使得溶液的荧光强度发生了明显下降(图9左起第一灰色柱状图),而a组其它样品的荧光强度(见图9中黑色柱状图)不下降,同时b组其它样品的荧光强度(见图9中灰色柱状图)发生明显下降。实验结果说明荧光探针ⅰ对于银离子具有良好的选择性,且对银离子的检测不会受到10当量的其他金属离子存在的干扰。
实施例9荧光探针ⅰ检测铜离子对不同金属离子的选择性竞争性研究
根据荧光探针和不同金属离子的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml)。本实施例分为a组和b组,其中a组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中,除第一个空白样品不外加任何其它离子外,其它分别加入不同的金属离子:银离子、汞离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针最终浓度为1μmol/l,不同金属离子最终浓度为50μmol/l的测试溶液共3ml。b组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中后,除第一个样品仅加入铜离子(最终铜离子浓度为5μmol/l)外,其它样品除了加入铜离子外还分别加入不同金属离子,分别为银离子、汞离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针最终浓度为1μmol/l,铜离子最终浓度为5μmol/l,不同金属离子最终浓度为50μmol/l的测试溶液共3ml。反应30分钟后,用荧光光谱仪测试不同样品的449nm处与488nm处荧光发射强度比值(激发波长为360nm)。如图10所示,相对于探针i的pbs水溶液(图10左起第一黑色柱状图),5μmol/l的铜离子的加入使得溶液的荧光比值发生了明显上升(图10左起第一灰色柱状图),而a组其它样品荧光比值(见图10中黑色柱状图,除银离子少量上升外)不上升,同时b组其它样品的荧光比值(见图10中灰色柱状图)发生明显上升。实验结果说明荧光探针ⅰ对于铜离子具有良好的选择性,且对铜离子的检测基本不会受到10当量其他金属离子存在的干扰。
实施例10荧光探针ⅰ检测汞离子对不同金属离子的选择性竞争性研究
根据荧光探针和不同金属离子的浓度计算好所需的pbs水溶液(10mm,ph=7.4)加入到1cm×1cm石英比色皿中(体积3.5ml)。本实例分为a组和b组,其中a组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中,除第一个空白样品不外加任何其它离子外,其它分别加入不同的金属离子:为银离子、铜离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针浓度为1μmol/l,不同金属离子浓度为50μmol/l的测试溶液共3ml。b组:取3μl实施例2中的荧光探针母液加入到pbs水溶液中后,除第一个样品仅加入汞离子(最终汞离子浓度为0.5μmol/l)外,其它样品除了加入汞离子外还分别加入100当量的不同金属离子,分别为银离子、铜离子、锂离子、钠离子、钾离子、镁离子、钙离子、钴离子、亚铁离子、镍离子、锌离子、铅离子、镉离子、铝离子、铬离子和铁离子,配制成探针最终浓度为1μmol/l,汞离子最终浓度为0.5μmol/l,不同金属离子最终浓度为50μmol/l的测试溶液共3ml。反应15分钟后,用荧光光谱仪测试不同样品的502nm处荧光发射强度(激发波长为477nm)。如图11所示,相对于探针i的pbs水溶液(图11左起第一黑色柱状图),0.5μmol/l的汞离子的加入使得溶液的荧光强度发生了明显上升(图11左起第一灰色柱状图),而a组其它样品的荧光强度(见图11中黑色柱状图)不上升,同时b组其它样品的荧光强度(见图11中灰色柱状图)发生明显上升。实验结果说明荧光探针ⅰ对于汞离子具有良好的选择性,且对汞离子的检测不会受到100当量其他金属离子存在的干扰。
实施例11荧光探针ⅰ与mcf-7细胞中银离子的荧光成像
取实施例1中制备的荧光探针ⅰ溶于dmso中,制成浓度为20mmol/l的荧光探针母液。第一组细胞(含0.5mldmem培养基)不加任何分析物作为空白对照;第二组细胞加入0.5μl荧光探针母液,探针浓度为20μmol/l,孵育5小时,作为控制组。第三组细胞先加入20μmol/l探针孵育5小时后,加入20μmol/l银离子,孵育20、40和60分钟,作为实验组。随后分别用共聚焦荧光显微镜对三组细胞进行荧光成像,第三组细胞分不同时间点进行荧光成像。收集蓝色通道及绿色通道的荧光。如图12所示,空白对照组没有荧光,控制组有明显蓝色荧光,实验组随反应时间延长,蓝色荧光逐渐减弱。实验结果说明荧光探针ⅰ可以对mcf-7细胞内的银离子进行荧光成像。
实施例12荧光探针ⅰ与mcf-7细胞中铜离子的荧光成像
本实施例中包括三组细胞,第一组细胞(含0.5mldmem培养基)不加任何分析物作为空白对照;第二组细胞加入0.5μl实施例11中的荧光探针母液,探针浓度为20μmol/l,孵育5小时,作为控制组。第三组细胞先加入20μmol/l探针孵育5小时后,加入20μmol/l铜离子,孵育20、40和60分钟,作为实验组。随后分别用共聚焦荧光显微镜对三组细胞进行荧光成像,第三组细胞分不同时间点进行荧光成像。收集蓝色通道及绿色通道的荧光。如图13所示,空白对照组没有荧光,控制组有明显蓝色荧光,实验组随反应时间延长,蓝色荧光先减弱,后逐渐增强。实验结果说明荧光探针ⅰ可以对mcf-7细胞内的铜离子进行荧光成像。
实施例13荧光探针ⅰ与mcf-7细胞中汞离子的荧光成像
本实施例中包括三组细胞,第一组细胞(含0.5mldmem培养基)不加任何分析物作为空白对照;第二组细胞加入0.5μl实施例11中的荧光探针母液,探针浓度为20μmol/l,孵育5小时,作为控制组。第三组细胞先加入20μmol/l探针孵育5小时后,加入20μmol/l汞离子,孵育20、40和60分钟,作为实验组。随后分别用共聚焦荧光显微镜对三组细胞进行荧光成像,第三组细胞分不同时间点进行荧光成像。收集蓝色通道及绿色通道的荧光。如图14所示,空白对照组没有荧光,控制组有明显蓝色荧光,基本无绿色荧光,实验组随反应时间延长,绿色荧光逐渐增强。实验结果说明荧光探针ⅰ可以对mcf-7细胞内的汞离子进行荧光成像。
实施例14荧光探针ⅰ驱除mcf-7细胞中银离子毒性的实验
细胞不经任何分析物处理为空白对照。细胞中加入20μmol/l银离子孵育24小时作为损伤组。细胞用20μmol/l银离子处理2小时后用分别加入0,0.032,0.16,0.8,4,20μmol/l探针孵育24小时为探针组。细胞用20μmol/l银离子处理2小时后用分别加入0,0.032,0.16,0.8,4,20μmol/ld-青霉胺孵育24小时为阳性对照组。计算各组的细胞存活率。如图15所示,损伤组,细胞存活率为51.56±5.17%。当探针浓度增大至0.032μm时,细胞存活率开始增大。并且,随着探针浓度的增大细胞存活率继续增大。当探针浓度增大至4μm时,细胞存活率不再增大,值为66.82±5.91%。该结果说明,探针可用于驱除银离子的毒害。阳性对照组结果显示,当d-青霉胺浓度增大至0.16μm时,细胞存活率开始增大。并且,随着d-青霉胺浓度的增大细胞存活率继续增大。当d-青霉胺浓度增大至4μm时,细胞存活率不再变大,数值为63.85±4.20%。结果显示,探针和d-青霉胺抗银离子损伤的效果相近。
实施例15荧光探针ⅰ驱除mcf-7细胞中铜离子毒性的实验
细胞不经任何分析物处理为空白对照。细胞中加入50μmol/l铜离子孵育24小时作为损伤组。细胞用20μmol/l铜离子处理2小时后用分别加入0,0.4,2,10,50μmol/l探针孵育24小时为探针组。细胞用50μmol/l铜离子处理2小时后用分别加入0,0.4,2,10,50μmol/ld-青霉胺孵育24小时为阳性对照组。计算各组的细胞存活率。如图16所示,损伤组,细胞存活率为60.71±3.90%。结果显示,探针和d-青霉胺均可恢复cu2+损伤组细胞的活性,两者效果相近。
实施例16荧光探针i驱除mcf-7细胞中汞离子毒性的实验
细胞不经任何分析物处理为空白对照。细胞中加入8μmol/l汞离子孵育24小时作为损伤组。细胞用8μmol/l汞离子处理2小时后用分别加入0,0.5,1,2,4,8,16μmol/l探针孵育24小时为探针组。细胞用8μmol/l汞离子处理2小时后用分别加入0,0.5,1,2,4,8,16μmol/ld-青霉胺孵育24小时为阳性对照组。计算各组的细胞存活率。如图17所示,损伤组,细胞存活率为38.10±7.38%。当探针i浓度增大至0.5μm时,细胞存活率有明显增大。之后,随着探针i浓度的增大细胞存活率呈浓度依赖性增大。探针最高可提高汞离子处理组细胞存活率至74.81±9.47%。该结果说明,探针可用于驱除汞离子的毒害。阳性药组结果显示,当d-青霉胺浓度增大至0.5μm时,细胞存活率增大。之后,随着d-青霉胺浓度的增大细胞存活率呈浓度依赖性增大。当d-青霉胺浓度增大至8μm后,细胞存活率不再变大,数值为76.60±2.30%。结果显示,探针和d-青霉胺抗汞离子损伤的效果相近,可提高汞离子致损伤细胞的存活率至近75%。这说明探针具有驱汞离子疗效,具有潜在的驱汞离子应用前景。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!