一种高通量筛选高产油裂殖壶菌突变体的方法与流程
本发明属于基因工程技术领域,尤其涉及一种高通量筛选高产油裂殖壶菌突变体的方法。
背景技术:
目前,最接近的现有技术:
dha的作用和功效
二十二碳六烯酸(docosahexenoicacid,dha)是一种具有重要生理功能的ω-3系列长链不饱和脂肪酸,作为一种重要的营养成分,它具有促进婴幼儿大脑视网膜发育、预防多种心血管疾病以及提高机体免疫能力等重要生理功能。因此,dha已被广泛应用于婴幼儿食品、保健品、医药和养殖等行业,人们对dha的需求也日益增加。
裂殖壶菌合成的富含dha油脂是工业化生产dha的新型来源。为了获得适用于工业化的高产油、高产dha的裂殖壶菌工程株,我们设计了一套操作简单的基于尼罗红染色的高通量筛选方案。
现有的筛选高产dha裂殖壶菌突变株的方法主要有:
1).菌株诱变后挑选生长快速的突变株,该方法主要是依据菌落形态大小来判断的,而且目标菌株往往需要多轮验证,因此,此方法存在肉眼观察不可确信性、工作量大和时间成本较高等缺点。
2).诱变后添加相关酶抑制剂,该方法是通过抑制dha合成通路中某个关键酶来反向筛选出该酶活性强的突变体,而判断依据往往也是通过菌落形态大小来判断,而且目标菌株也需要多轮验证。因此,此方法也存在方法一中同样的缺点,而且筛选出来的突变株存在特征单一性,不适用于工业应用。
3).利用dha的特性如抗氧化性和增加细胞流动性来改变筛选条件,此方法筛选依据方法一,假阳性较高,验证过程漫长。
4).采用驯化手段,通过连续胁迫条件如高氧、高盐来驯化菌株,此方法虽能部分提高dha产量,但其驯化周期过长,且易于恢复,菌株稳定性不足,并不适合大规模育种。
综上所述,现有技术存在的问题是:
(1)现有技术中,采用的一般筛选流程为:平板筛选-试管筛选-摇瓶筛选,而在每轮筛选中需要对所筛突变株的油脂含量和dha含量进行一一验证,这会大大增加实验的工作量,即存在弊端如筛选的通量不高,工作量大。
(2)现有技术中,虽有人利用尼罗红染色来检测油脂含量,但在实际筛选过程由于各个突变体的细胞密度不一样,若直接使用尼罗红染色荧光作为筛选依据的话,会增加结果的假阳性。
(3)现有技术中,会采用多种诱变方式,然后加入一些起筛选作用的化合物,虽也能筛选出高产油突变体,但存在多种诱变方式操作复杂、成本较高的问题,以及加入化合物都存在一定毒性或致癌,存在安全问题,而且筛选的周期较长,假阳性较高。这就增加了验证过程,增加工作量。
解决上述技术问题的难度:
现有技术不易解决或只能部分解决上述问题。
解决上述技术问题的意义:
(1)可以大大增加高产油、高产dha裂殖壶菌突变体的育种效率,而裂殖壶菌在工业上具有广泛的应用。
(2)能够降低大规模育种的门槛,较低的硬件条件就可以实施本方案。增加筛选效率的同时,操作更简单,成本更低,更安全。
(3)本方案不仅可以筛选出高产油突变体还能筛选出低产油突变体,相较于传统技术只能单方面筛选高产油突变体,功能性更强。与此同时,这些高产和低产突变体是裂殖壶菌中脂肪酸合成机制研究的重要资源,因此,本筛选方案可能加快这方面的研究。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种高通量筛选高产油裂殖壶菌突变体的方法。
本发明是这样实现的,一种高通量筛选高产油裂殖壶菌突变体的方法,所述高通量筛选高产油裂殖壶菌突变体的方法包括:
步骤一,接种培养:吸取筛选培养基于96孔板中,并挑取少量突变体单克隆于对应96孔板孔中,挑完后,让单克隆均匀分散于培养基中,在恒温摇床中培养;
步骤二,od595测量:将96孔板取出,吹扫各孔培养物后,检测595nm吸光值;
步骤三,尼罗红染色:利用排枪吸取20%dmso水溶液于96孔黑色酶标板中,再将96孔板中的培养物转于96孔黑色酶标板中,加入后用排枪轻吹,再加入0.1mg/ml尼罗红试剂,然后用排枪轻吹混匀;包好后放于恒温水浴锅中水浴;孵育结束后取出酶标板,利用多功能酶标仪检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度;
步骤四,数据分析:将每两板96孔板中的荧光值与od595值的比值的最大或最小的各五个突变体转板保存,并记录对应单克隆板的编号;
步骤五,复筛:挑选步骤四中的fi/od595前五的突变体进行复筛。
进一步,步骤一中,用排枪吸取200μl筛选培养基于96孔板中;
在恒温摇床中培养30h,培养条件:28℃,摇床转速200rpm。
进一步,步骤二中,将96孔板取出,用200μl排枪轻吹各孔培养物后,放于多功能酶标仪检测595nm吸光值。
进一步,步骤三中,用排枪取50μl20%dmso水溶液于96孔黑色酶标板中;
再加入4μl0.1mg/ml尼罗红试剂,然后用排枪轻吹混匀;
用锡箔纸包好后放于40℃恒温水浴锅中水浴10min。
进一步,步骤五中,复筛具体操作方法同步骤一~步骤四。
进一步,进行接种培养前,需进行:利用紫外uvc诱变建立随机突变体库。
进一步,所述高通量筛选高产油裂殖壶菌突变体的方法进一步包括:
筛选条件优化:进行裂殖壶菌尼罗红染色条件优化、选用单位细胞密度油脂量作为筛选依据、确定尼罗红的染色时间点;
对复筛中的fi/od595前三的突变体,进行表型验证。
进一步,裂殖壶菌尼罗红染色条件优化,具体有:
1)取裂殖壶菌培养至对数期的培养液适量,3000g离心15min,弃上清,细胞沉淀用新鲜的种子培养基重悬,使细胞密度约为107个/ml,分别取1ml重悬液于棕色离心管中,分别加入250μl的一定体积分数的dmso溶液,振荡混匀,再加入一定体积的0.1mg/ml尼罗红染液,再次振荡混匀,于一定温度的恒温水浴锅中孵育一段时间后,取96孔黑色酶标板,每孔加入200μl尼罗红菌细胞染液,使用多功能酶标仪(filtermaxf5,moleculardevices,usa)检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度,为所测得的荧光强度;
2)初始尼罗红染色条件:溶剂载体dmso溶液浓度为25%;尼罗红染液的用量为15μl;孵育的时间为15min;孵育的温度为50℃。然后对这4个条件逐一进行优化。dmso溶液浓度范围为0,5%,10%,15%,20%,25%,30%,40%,50%;尼罗红用量范围为0,5μl,10μl,15μl,20μl,25μl,30μl,35μl;孵育时间的范围为0,5min,10min,15min,20min,25min;孵育温度的范围为10℃,20℃,30℃,40℃,50℃,60℃,70℃。所有染色组和未染色组均设置3个生物学平行。
进一步,选用单位细胞密度油脂量作为筛选依据包括:
将裂殖壶菌培养至对数期,细胞密度约为3.362×107个/ml,分别吸取培养液2ml,并稀释使得其细胞密度为原液的3/4,1/2,1/4,1/5,1/8,1/10,1/16,1/20后,平均分装为两份,一份用多功能酶标仪分别测量od595值。各个实验组均设3个生物学重复,不同细胞密度的od595值为实测的od595值减去新鲜培养基所测的od595值;
将另一份,分别吸取装入棕色离心管中,进入裂殖壶菌最佳尼罗红染色体系如下,向各个体系中加入250μl20%(v/v)的dmso溶液,振荡混匀后,再加入20μl的0.1mg/ml尼罗红染液,再次振荡混匀,于40℃的恒温水浴锅中孵育10min后,向96孔黑色酶标板中每孔加入200μl尼罗红菌细胞染液,每个样加3次,使用多功能酶标仪(filtermaxf5,moleculardevices,usa)检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度,为各个不同细胞密度菌液的荧光强度。
进一步,确定尼罗红的染色时间点具体包括:
将裂殖壶菌接种于种子培养基中,培养24h,使od595值达到0.8;种子培养基组份为葡萄糖5g/l、酵母提取物1g/l、蛋白胨1g/l及海水晶30g/l;
将种子液以4%的接种量接种于筛选培养基中,每6个小时取1ml培养液,用于测量od595值,以及用多功能酶标仪检测尼罗红染色荧光,直到48个小时;筛选培养基组份为葡萄糖5g/l、酵母提取物1g/l、蛋白胨1g/l和海水晶40g/l。
综上所述,本发明的优点及积极效果为:
本发明利用尼罗红染料与中性油脂结合发出荧光强度与中性油脂的含量存在一定线性关系这一原理,使用尼罗红染色便可检验突变株的中性油脂含量,相较于传统检测方法省时省力,并结合多功能酶标仪的使用,可实现高通量作业,提高筛选效率。
与此同时,为适用实际筛选过程,本发明优化了筛选条件(创新点):优化了裂殖壶菌的尼罗红染色条件,使裂殖壶菌的中性油脂检测更准确;选用更合理的筛选依据,即单位细胞密度油脂量;根据出发菌株的细胞生长和油脂积累的时间分析,找到油脂的最佳检测时间点,即尼罗红的染色时间点。
由此,相较于现有技术,本发明的优点还有:操作简单,更准确,目的性强;高通量作业,工作量较小,适合大规模育种;筛选效率高,筛选得到高产油、高产dha突变株整个流程需花费3周时间,大大缩短育种周期。
附图说明
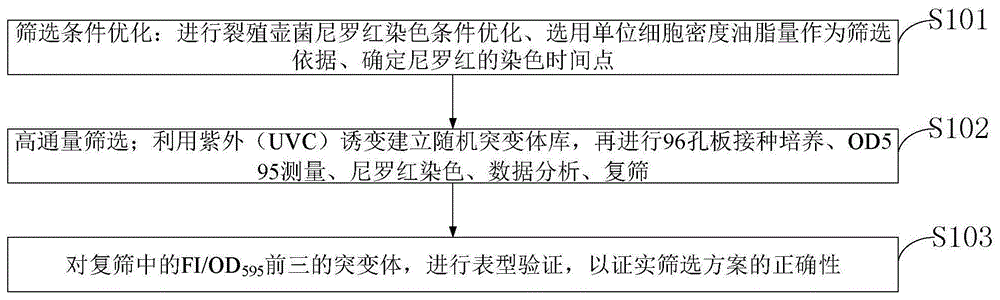
图1是本发明实施例提供的高通量筛选高产油裂殖壶菌突变体的方法流程图。
图2是本发明实施例提供的高通量筛选高产油裂殖壶菌突变体的方法原理图。
图3本发明实施例提供的实测的od595值与对应的尼罗红染色荧光强度(fi)的相关性图,用以证实fi/od595来表示单位细胞密度的正确性,并以此量作为筛选依据。
图4是本发明实施例提供的确定尼罗红的染色时间点图。
图5是本发明实施例提供的生长情况中,突变体d01521,d03432,d05106比出发菌株生长快图。
图6是本发明实施例提供的图6a表示突变体d01521,d03432,d05106的含油量均高于出发菌株。图6b左,表示突变体d01521,d03432,d05106的dha占干重含量均高于出发菌株;图6b中,表示突变体d01521的dha占总油脂的含量稍有降低,但突变体d03432,d05106的dha占总油脂量与出发菌株无明显差异,说明突变体合成的油脂仍保持高品质;图6b右,表示突变体d01521,d03432,d05106的dha产量均高于出发菌株。
图7是本发明实施例提供表示突变体d01521,d03432,d05106与出发菌株(又称野生型,wildtype,wt)的油滴经尼罗红染色后由激光扫描共聚焦显微镜拍摄得到图。从图看出突变体d01521,d03432,d05106细胞内油滴数目要多余出发菌株,其中油滴是储存油脂的细胞器,此图说明本发明筛选的突变体确实为高产油突变体。
图8是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株,生长情况图。
图9是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株的含油量图。
图10是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株的dha产量图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
现有技术中,采用的一般筛选流程为:平板筛选-试管筛选-摇瓶筛选,而在每轮筛选中需要对所筛突变株的油脂含量和dha含量进行一一验证,这会大大增加实验的工作量,即存在弊端如筛选的通量不高,工作量大。
为解决上述技术问题,下面结合具体方案对本发明作进一步描述。
如图1所示,本发明实施例提供的高通量筛选高产油裂殖壶菌突变体的方法包括:
s101,筛选条件优化:进行裂殖壶菌尼罗红染色条件优化、选用单位细胞密度油脂量作为筛选依据、确定尼罗红的染色时间点。
s102,高通量筛选;利用紫外(uvc)诱变建立随机突变体库,再进行96孔板接种培养、od595测量、尼罗红染色、数据分析、复筛。
s103,对复筛中的fi/od595前三的突变体,进行表型验证,以证实筛选方案的正确性。
步骤s101具体包括:
(一)裂殖壶菌尼罗红染色条件优化:
1)取裂殖壶菌培养至对数期(18h左右)的培养液适量,3000g离心15min,弃上清,细胞沉淀用新鲜的种子培养基重悬,使细胞密度约为107个/ml,分别取1ml重悬液于棕色离心管中,分别加入250μl的一定体积分数的dmso溶液,振荡混匀,再加入一定体积的0.1mg/ml尼罗红染液,再次振荡混匀,于一定温度的恒温水浴锅中孵育一段时间后,取96孔黑色酶标板,每孔加入200μl尼罗红菌细胞染液,使用多功能酶标仪(filtermaxf5,moleculardevices,usa)检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度,即为所测得的荧光强度。
2)初始尼罗红染色条件:溶剂载体dmso溶液浓度为25%;尼罗红染液的用量为15μl;孵育的时间为15min;孵育的温度为50℃。然后对这4个条件逐一进行优化。dmso溶液浓度范围为0,5%,10%,15%,20%,25%,30%,40%,50%;尼罗红用量范围为0,5μl,10μl,15μl,20μl,25μl,30μl,35μl;孵育时间的范围为0,5min,10min,15min,20min,25min;孵育温度的范围为10℃,20℃,30℃,40℃,50℃,60℃,70℃。所有染色组和未染色组均设置3个生物学平行。
结果:得到最佳的染色条件是20%的dmso溶液,20μl的0.1mg/ml尼罗红染液,40℃水浴10min。并用于后续油脂测量。
(二)选用单位细胞密度油脂量作为筛选依据,具体包括:
1)将裂殖壶菌培养至对数期(约24h),细胞密度约为3.362×107个/ml,分别吸取培养液2ml,并稀释使得其细胞密度为原液的3/4,1/2,1/4,1/5,1/8,1/10,1/16,1/20后,平均分装为两份,其中一份用多功能酶标仪分别测量od595值。各个实验组均设3个生物学重复,不同细胞密度的od595值为实测的od595值减去新鲜培养基所测的od595值(如图3所示)。
2)将另一份(也就是剩下的1ml),分别吸取装入棕色离心管(避光)中,进入裂殖壶菌最佳尼罗红染色体系如下,向各个体系中加入250μl20%(v/v)的dmso溶液,振荡混匀后,再加入20μl的0.1mg/ml尼罗红染液,再次振荡混匀,于40℃的恒温水浴锅中孵育10min后,向96孔黑色酶标板中每孔加入200μl尼罗红菌细胞染液,每个样加3次,使用多功能酶标仪(filtermaxf5,moleculardevices,usa)检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度,即为各个不同细胞密度菌液的荧光强度。
(三)确定尼罗红的染色时间点:具体包括:
1)将裂殖壶菌接种于种子培养基中,培养24h,使od595值达到0.8左右。种子培养基组份为葡萄糖5g/l、酵母提取物1g/l、蛋白胨1g/l及海水晶30g/l。
2)将种子液以4%的接种量接种于筛选培养基中,每6个小时取1ml培养液,用于测量od595值,以及用多功能酶标仪检测尼罗红染色荧光,步骤同2中步骤二,直到48个小时。筛选培养基组份(g/l)为葡萄糖5g/l、酵母提取物1g/l、蛋白胨1g/l和海水晶40g/l。如图4本发明实施例提供的确定尼罗红的染色时间点图所示。
步骤s102具体包括:
第一步,利用紫外(uvc)诱变建立随机突变体库;
第二步,高通量筛选:
1)接种培养:用排枪吸取200μl筛选培养基于96孔板中,用灭菌的枪头挑取少量突变体单克隆于对应96孔板孔中,待96个克隆挑完后,需旋转枪头,让单克隆尽可能均匀分散于培养基中,再扔掉枪头,盖上盖子,封口,在恒温摇床中培养30h(培养条件:28℃,摇床转速200rpm)。
2)od595测量:将96孔板取出,用200μl排枪轻吹各孔培养物后,放于多功能酶标仪检测595nm吸光值(目的:使od测量值更准确表征细胞密度)。
3)尼罗红染色:先用排枪取50μl20%dmso水溶液于96孔黑色酶标板中,再用排枪将96孔板中的培养物转于96孔黑色酶标板中,加入后用排枪轻吹,再加入4μl0.1mg/ml尼罗红试剂,然后用排枪轻吹混匀。用锡箔纸包好后放于40℃恒温水浴锅中水浴10min。孵育结束后取出酶标板,使用多功能酶标仪(filtermaxf5,moleculardevices,usa)检测激发光波长为485±20nm,发射光波长为595±10nm的荧光强度,并扣除未染色菌液的荧光强度,即为各个突变体的荧光强度(fluorescenceintensity,fi)。
4)数据分析:将每两板96孔板中的荧光值与od595值的比值(fi/od595)的最大或最小的各五个突变体转板保存,并记录对应单克隆板的编号。
5)复筛:挑选4)中的fi/od595前五的突变体进行复筛,复筛具体操作同上步骤1),2),3),4)。(目的:增加筛选的正确率,降低所筛突变体的假阳性,减少验证的工作量,提高准确性)。
在本发明实施例中,图2是本发明提供的高通量筛选高产油裂殖壶菌突变体的方法原理图。
下面结合具体实验对本发明作进一步描述。
实施例
本发明进行表型验证中,进行摇瓶发酵,验证三个候选高产油突变体在产油和产dha方面优于出发菌株。
1)生长情况,突变体d01521,d03432,d05106比出发菌株生长快。如图5所示。
2)产油、产dha,突变体d01521,d03432,d05106的含油量也高于出发菌株,生产的油脂仍保持高品质(dha占总油脂的含量几乎没变)。再者,从微观上,油滴形态数量,突变体要优于出发菌株。如图6-图7所示。
3)扩大培养至5l发酵(可以初步显示工业应用前景),突变体d03432和d05106在产油和产dha方面均优于出发菌株,展现出良好的工业应用前景。
其中生长情况如图8所示。含油量如图9所示。dha产量如图10所示。
下面结合附图的含义对本发明作进一步描述。
在本发明实施例中,图3本发明实施例提供的实测的od595值与对应的尼罗红染色荧光强度(fi)的相关性图,用以证实fi/od595来表示单位细胞密度的正确性,并以此量作为筛选依据。
图4是本发明实施例提供的确定尼罗红的染色时间点图。
图5是本发明实施例提供的生长情况中,突变体d01521,d03432,d05106比出发菌株生长快图。
图6是本发明实施例提供的图6a表示突变体d01521,d03432,d05106的含油量均高于出发菌株。图6b左,表示突变体d01521,d03432,d05106的dha占干重含量均高于出发菌株;图6b中,表示突变体d01521的dha占总油脂的含量稍有降低,但突变体d03432,d05106的dha占总油脂量与出发菌株无明显差异,说明突变体合成的油脂仍保持高品质;图6b右,表示突变体d01521,d03432,d05106的dha产量均高于出发菌株。
图7是本发明实施例提供表示突变体d01521,d03432,d05106与出发菌株(又称野生型,wildtype,wt)的油滴经尼罗红染色后由激光扫描共聚焦显微镜拍摄得到图。从图看出突变体d01521,d03432,d05106细胞内油滴数目要多余出发菌株,其中油滴是储存油脂的细胞器,此图说明本发明筛选的突变体确实为高产油突变体。
图8是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株,生长情况图。
图9是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株的含油量图。
图10是本发明实施例提供的扩大培养至5l发酵中,突变体d03432和d05106在产油和产dha方面均优于出发菌株的dha产量图。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!