皂苷元内酯的制备方法与流程
本发明涉及一种苦丁皂苷元内酯的制备方法。
背景技术:
苦丁茶冬青为冬青科植物苦丁茶冬青的叶,有清热解暑功效,用于暑月外感风寒,内伤生冷而致恶寒发热,头痛脘痞,呕恶泄泻等症。近年来,有人对苦丁茶冬青叶的化学成分和药理作用进行了深入研究。研究表明,苦丁茶冬青中的主要成分有酚类、五环三萜皂苷和三萜等,五环三萜内酯为苦丁茶皂苷元。实验证明,苦丁茶冬青中皂苷具有改善心血管系统、降血脂、降血压、降血糖和提高免疫力方面的功能,其在体内发挥活性的形式可能是苦丁茶皂苷元α-苦丁内酯、β-苦丁内酯和γ-苦丁内酯。
cn101775061a公开了一组苦丁茶皂苷类化合物,其中公开了苦丁酮a,b,d,e,f和g,上述苦丁酮均通过苦丁茶有机溶剂萃取分离获得。cn104402965a公开了一种从苦丁茶冬青中分离苦丁苷a和苦丁苷d的方法,该方法通过有机溶剂萃取和液相色谱分离的方法分别获得苦丁苷a和苦丁苷d,但是苦丁苷a和苦丁苷d均为五环三萜皂苷。cn102600214a公开了一种苦丁茶冬青叶的提取方法、总皂苷及用途,所述提取方法制备的是苦丁茶总皂苷及其单体化合物。
技术实现要素:
有鉴于此,本发明的一个目的在于提供一种皂苷元内酯的制备方法,从苦丁茶冬青中提取了苦丁茶皂苷在体内的真正活性成分皂苷元α-苦丁内酯。
本发明采用如下技术方案实现上述目的。
本发明提供一种皂苷元内酯的制备方法,所述的皂苷元内酯为皂苷元α-苦丁内酯,包括如下步骤:
(1)将苦丁茶冬青皂苷d溶于有机溶剂中形成样品溶液;
(2)制备肠道菌孵育液;
(3)将样品溶液与肠道菌孵育液混合均匀后得混合液,将混合液置于厌氧环境中恒温振荡培育20~150h,培育后的混合液加入萃取溶剂进行萃取,萃取后取上清液,然后除去萃取溶剂得到残渣,将残渣溶于甲醇中,得到醇溶液;
(4)将醇溶液通过反相液相色谱柱分离,收集皂苷元α-苦丁内酯流出时间段内的流出液,将收集的流出液浓缩得皂苷元α-苦丁内酯。
根据本发明的制备方法,优选地,步骤(1)中,将苦丁茶冬青皂苷d溶于二甲基亚砜中,再加入无菌水得到样品溶液;其中,样品溶液中的苦丁茶冬青皂苷d的浓度为1~6mg/ml。
根据本发明的制备方法,优选地,步骤(2)中,制备肠道菌孵育液包括以下步骤:
(a)制备灭菌厌氧培养基;
(b)取粪便与生理盐水混合均匀制成混悬液,所述混悬液中粪便与生理盐水的配比为1mg:2~6ml;
(c)取混悬液沉淀后的上清液,加入灭菌厌氧培养基混匀,然后将混合液恒温振荡厌氧培养15~35h,得到肠道菌孵育液;其中,上清液与灭菌厌氧培养基的体积比为1:6~12。
根据本发明的制备方法,优选地,还包括如下步骤:
(d)将步骤(c)制备的肠道菌孵育液经过分离和鉴定,分离出肠球菌孵育液或拟杆菌孵育液作为步骤(2)中的肠道菌孵育液。
根据本发明的制备方法,优选地,步骤(c)中,所述混悬液经离心沉淀处理,处理时间为5~15min,离心频率为2000~6000rpm;所述混合液在36~38℃下恒温振荡,振荡频率为100~200rpm。
根据本发明的制备方法,优选地,步骤(3)中,样品溶液与肠道菌孵育液的体积比为1:1~20;萃取溶剂为乙酸乙酯-水饱和正丁醇的混合溶剂,混合液与乙酸乙酯-水饱和正丁醇的混合溶剂的体积比为1:0.2~10;乙酸乙酯-水饱和正丁醇的混合溶剂中,乙酸乙酯与水饱和正丁醇的体积比为1:0.5~2。
根据本发明的制备方法,优选地,步骤(3)中,所述混合液于36~38℃下恒温振荡培育,振荡频率为100~300rpm;萃取时进行蜗旋和离心处理,蜗旋1~10min,离心处理为1~20min,离心频率为2000~20000rpm。
根据本发明的制备方法,优选地,还包括如下步骤:将步骤(3)获得的醇溶液进行离心处理,处理时间为1~20min,处理频率为2000~20000rpm,再通过0.2~0.5μm的滤膜过滤,然后通过反相液相色谱柱分离。
根据本发明的制备方法,优选地,步骤(4)中,反相液相色谱柱为c18色谱柱,冲洗液为浓度70~85vol%的甲醇水溶液。
根据本发明的制备方法,优选地,步骤(4)中,皂苷元α-苦丁内酯流出时间段为15~18min。
本发明的方法能够从苦丁茶冬青皂苷d中提取皂苷元α-苦丁内酯,药效强于皂苷d,便于后续有关药效学评价的研究。
附图说明
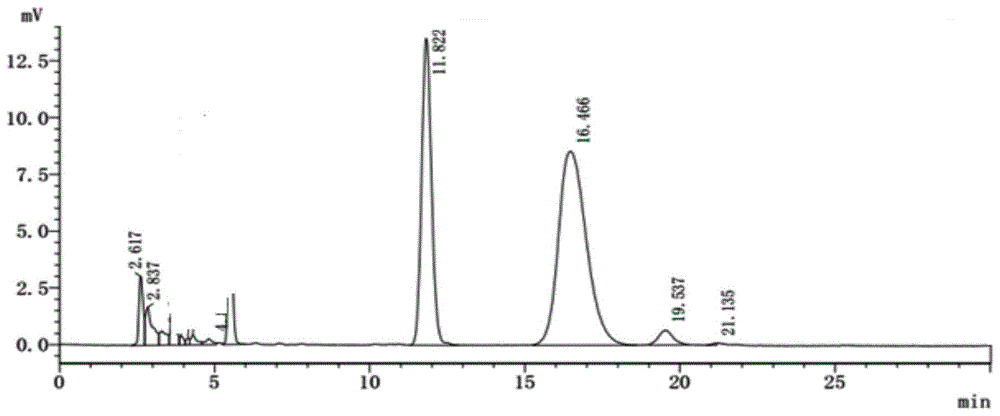
图1为本发明的实施例1的反相高效液色谱图。
图2为本发明的实施例1的uplc-ms谱图。
具体实施方式
下面结合具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
在本发明中,水饱和正丁醇为将水最大限度溶入正丁醇中形成的溶液。将正丁醇和蒸馏水混合(混合比例为体积比1:1),振摇,混匀,放置过夜,得到的混合液分层,上层为水饱和正丁醇,下层为正丁醇饱和的水溶液。
本发明从苦丁茶冬青皂苷d中提取制备皂苷元α-苦丁内酯,获得了皂苷d中真正的活性成分,相对皂苷d药效更强。其中苦丁茶冬青皂苷d的结构式见式i:
皂苷元α-苦丁内酯的结构式见式ii:
本发明的制备方法包括:(1)苦丁茶冬青皂苷d溶液形成步骤;(2)制备肠道菌孵育液的步骤;(3)萃取步骤;(4)分离提纯步骤。下面进行详细阐述。
<苦丁茶冬青皂苷d溶液形成步骤>
苦丁茶冬青皂苷d为从苦丁茶冬青中分离获取。可以采用cn104402965a的方法获得,也可以采用其他现有方法分离获得苦丁皂苷d。
将苦丁茶冬青皂苷d溶于有机溶剂中形成样品溶液。有机溶剂可以选自dmf、二甲基亚砜、四氢呋喃、二氯甲烷、三氯甲烷、丙酮、乙酸乙酯中的任一种或多种的混合液;优选地,所述有机溶剂选自dmf、二甲基亚砜、四氢呋喃中的任一种或多种的混合液;更优选地,所述有机溶剂为二甲基亚砜。采用上述有机溶剂,对苦丁茶皂苷d的溶解性更好。样品溶液中的苦丁茶皂苷d的浓度为1~6mg/ml;优选地,所述样品溶液中的苦丁茶皂苷d的浓度为2~5mg/ml;更优选地,所述样品溶液中的苦丁茶皂苷d的浓度为3~4mg/ml。采用上述浓度有利于苦丁茶皂苷d的溶解,而且有利于接下来样品溶液在肠道菌孵育液中的代谢,提高最终产品皂苷元α-苦丁内酯的代谢量。
根据本发明的一个实施方式,将苦丁茶冬青皂苷d溶于二甲基亚砜中,再加入无菌水得到样品溶液;其中,样品溶液中的苦丁茶冬青皂苷d的浓度为1~6mg/ml。
<制备肠道菌孵育液的步骤>
本发明中,肠道孵育液用于模拟人体肠道环境,将药物与肠道菌孵育液在体外进行培育,通过肠道菌孵育液对药物的代谢产物,来研究皂苷d在人体内发挥作用的真正活性成分。
本发明制备肠道菌孵育液包括以下步骤:
(a)制备灭菌厌氧培养基;
(b)取粪便与生理盐水混合均匀制成混悬液,所述混悬液中粪便与生理盐水的配比为1mg:2~6ml;
(c)取混悬液沉淀后的上清液,加入灭菌厌氧培养基混匀,其中上清液与灭菌厌氧培养基的体积比为1:6~12,然后将混合液恒温振荡厌氧培养15~35h,得到肠道菌孵育液。
本发明采用上述方法制备的肠道菌孵育液能够更好地模拟人体代谢环境,有利于苦丁茶冬青皂苷d的代谢,便于获取苦丁茶冬青皂苷d的在人体内发挥作用的真正活性成分皂苷元α-苦丁内酯。
步骤(a)中,制备灭菌厌氧培养基。取肠道菌培养基溶于水中,加热搅拌使其完全溶解形成培养基溶液,将培养基溶液置于高压灭菌锅中进行灭菌,获得灭菌厌氧培养基,取出冷却备用。肠道菌培养基选自gam肉汤粉末,培养基溶液的浓度为0.002~0.02g/ml;优选地,培养基溶液的浓度为0.005~0.15g/ml;更优选地,培养基溶液的浓度为0.008~0.12g/ml。高压灭菌锅的压力为0.08~0.2mpa,灭菌时间为10~20min;优选地,高压灭菌锅的压力为0.1~0.18mpa,灭菌时间为12~18min;更优选地,高压灭菌锅的压力为0.1~0.15mpa,灭菌时间为12~15min。本发明采用上述方法制备灭菌厌氧培养基,可以更好地与样品溶液进行培育,使苦丁茶皂苷d更好地代谢,提高苦丁茶皂苷d的代谢效果,而且可以提高代谢生成的皂苷元α-苦丁内酯的活性。本发明的上述灭菌条件对培养基溶液进行灭菌,提高灭菌效果。
步骤(b)中,取粪便与生理盐水混合均匀制成混悬液,所述混悬液中粪便与生理盐水的配比为1mg:2~6ml。粪便选自动物粪便和人的粪便,优选大鼠粪便。取大鼠粪便与生理盐水通过蜗旋混合均匀制成混悬液,所述混悬液中粪便与生理盐水的配比为1mg:2~6ml;优选地,所述混悬液中粪便与生理盐水的配比为1mg:3~5ml;更优选地,所述混悬液中粪便与生理盐水的配比为1mg:3~4ml。
步骤(c)中,将步骤(b)制备的混悬液经过离心处理,取离心处理后的混悬液的上清液,加入灭菌厌氧培养基混匀得到混合液,然后将混合液恒温振荡厌氧培养,得到肠道菌孵育液。上清液与灭菌厌氧培养基的体积比为1:6~12;优选地,上清液与灭菌厌氧培养基的体积比为1:7~10;更优选地,上清液与灭菌厌氧培养基的体积比为1:8~9。恒温振荡时间为15~35h;优选为20~30h;更优选为24~28h。振荡温度为36~38℃;优选为36.5~37.5℃。振荡频率为100~300rpm;优选地为120~250rpm;更优选为150~200rpm。
根据本发明的一个实施方式,还包括如下步骤:
(d)将步骤(c)制备的肠道菌孵育液经过分离和鉴定,分离出肠球菌孵育液或拟杆菌孵育液作为步骤(2)中的肠道菌孵育液。
在某些实施方案中,肠道菌孵育液为肠球菌孵育液。通过上述方法制备出肠道菌孵育液后,再从肠道菌孵育液中分离出来的肠球菌孵育液。在另一些实施方案中,肠道菌孵育液为拟杆菌孵育液。通过上述方法制备出肠道菌孵育液后,再从肠道菌孵育液中分离出来的拟杆菌孵育液。
采用肠球菌孵育液或者拟杆菌孵育液来进行苦丁茶冬青皂苷d的代谢,代谢后α-苦丁内酯的含量高于肠道菌孵育液代谢后α-苦丁内酯的含量。本发明发现,肠球菌孵育液代谢后的α-苦丁内酯的含量高于拟杆菌孵育液代谢后的α-苦丁内酯的含量。
<萃取步骤>
在萃取步骤中,将样品溶液与肠道菌孵育液混合均匀后得混合液,将混合液置于厌氧环境中恒温振荡培育20~150h;优选地,样品溶液与肠道菌孵育培育时间为20~100h;更优选地,样品溶液与肠道菌孵育培育时间为24~96h。培育后的混合液加入萃取溶剂进行萃取,萃取后取上清液,然后除去萃取溶剂得到残渣,将残渣溶于甲醇中,得到醇溶液。实验证明,在上述条件下培育的皂苷元内酯在24h时开始出现,在96h时皂苷元内酯含量最高。
样品溶液与肠道菌孵育液的体积比可以为1:1~20;优选为1:4~15;更优选为1:8~12。加入的萃取剂为乙酸乙酯与醇的混合液;优选为水饱和正丁醇。萃取剂中,乙酸乙酯与水饱和正丁醇的体积比为1:0.5~2;优选为1:0.6~1.5;更优选为1:0.8~1.2。培育后的混合液与加入的萃取剂的体积比为1:0.4~5;优选为1:0.6~2;更优选为1:0.8~1.5。采用上述样品溶液与肠道菌孵育液混合的体积比,有利于样品溶液在肠道菌孵育液中的代谢,提高最终产品皂苷元α-苦丁内酯的量。采用上述萃取剂,提高萃取效果,而且不影响α-苦丁内酯的活性。
样品溶液与肠道菌孵育液混合的混合液放入有厌氧产气包的厌氧培养袋中,在36~38℃下通过摇床恒温振荡培育,振荡频率为100~300rpm;优选地,在36.5~37.5℃下通过摇床恒温振荡培育,振荡频率为120~200rpm;更优选地,在37℃下通过摇床恒温振荡培育,振荡频率为150~180rpm。萃取时,进行蜗旋和离心处理,蜗旋时间为1~10min,离心处理时间为1~20min,离心处理频率为2000~20000rpm;优选地,蜗旋时间为1~8min,离心处理时间为5~18min,离心处理频率为5000~15000rpm;更优选地,蜗旋时间为2~5min,离心处理时间为8~12min,离心处理频率为8000~12000rpm。采用上述范围内的培育温度,能够稳定代谢出α-苦丁内酯。萃取时,采用上述涡旋处理可以使萃取效果更好,采用上述离心处理,可以获得质量更高的萃取上清液,将杂质去除更彻底。
萃取后的取上清液置于离心管中,放置在氮吹仪上脱除萃取剂,用36~38℃水浴氮气流脱除萃取剂。采用上述脱除萃取剂的方法,不影响α-苦丁内酯的活性。本发明还可以采用现有技术中其他任何可以恒温脱除萃取剂的方法,除去萃取剂后得到残渣。
根据本发明的一个实施方式,样品溶液与肠道菌孵育液的体积比为1:1~20;萃取溶剂为乙酸乙酯-水饱和正丁醇的混合溶剂,混合液与乙酸乙酯-水饱和正丁醇的混合溶剂的体积比为1:0.2~10;乙酸乙酯-水饱和正丁醇的混合溶剂中,乙酸乙酯与水饱和正丁醇的体积比为1:0.5~2。所述混合液于36~38℃下恒温振荡培育,振荡频率为100~300rpm;萃取时进行涡旋和离心处理,涡旋1~10min,离心处理为1~20min,离心频率为2000~20000rpm。
根据本发明的一个实施方式,还包括如下步骤:将步骤(3)获得的醇溶液进行离心处理,离心处理时间为1~20min,离心处理频率为2000~20000rpm,再通过0.2~0.5μm的滤膜过滤,然后通过反相液相色谱柱分离。优选地,离心处理时间为5~15min,离心处理频率为5000~15000rpm。更优选地,离心处理时间为8~12min,离心处理频率为8000~12000rpm。将残渣采用上述方法进行处理,在不影响皂苷元α-苦丁内酯活性的条件下,可以更好除去残渣中的固体杂质。
<分离提纯步骤>
在分离提纯步骤中,将醇溶液通过反相液相色谱柱分离,收集皂苷元α-苦丁内酯流出时间段内的流出液,将收集的流出液浓缩得皂苷元α-苦丁内酯。反相液相色谱柱可以为c18色谱柱,冲洗液为浓度70~85vol%的甲醇水溶液。皂苷元α-苦丁内酯流出时间段为15~18min。
根据本发明的一个实施方式,将步骤(3)中获得的醇溶液通过反相液相色谱柱进行分离,反相液相色谱柱可以为c18色谱柱,冲洗液为浓度70~85vol%的甲醇水溶液,收集15~18min内的流出液进行减压浓缩获得皂苷元α-苦丁内酯。优选地,冲洗液为浓度72~80%的甲醇水溶液,收集15.2~17.8min内的流出液。更优选地,冲洗液为浓度74~76%的甲醇水溶液,收集17.5~17.8min内的流出液。在本发明中,冲洗液的流速可以为0.5~2.5ml/min,优选为0.8~1.5ml/min,更优选为1~1.2ml/min。采用上述流速可以更好的分离获得纯度更高的目标产物。
采用上述液相色谱柱,可以将代谢产生的皂苷元α-苦丁内酯从代谢物种分离出来。采用上述浓度范围内的冲洗液提高了分离效果和分离速度,而且不影响皂苷元α-苦丁内酯的结构;收集上述范围内的流出液,获得的皂苷元α-苦丁内酯纯度更高。
制备例1
<样品溶液的制备>
将苦丁茶冬青皂苷d39mg加入二甲基亚砜中使其完全溶解,再加入无菌水定容至10ml形成样品溶液,放入4℃的冰箱中冷藏备用。
制备例2
<大鼠肠道菌群孵育液的制备>
(a)取gam肉汤粉末10g放入500ml烧杯中,加入蒸馏水,水浴加热搅拌使其完全溶解,冷却后转移至1000ml容量瓶中,加蒸馏水定容至1000ml,然后放入高压灭菌锅中灭菌,0.1mpa,121℃灭菌15min,灭菌后获得灭菌厌氧培养基,冷却备用;
(b)取sd大鼠新鲜粪便3.5g,加入14ml生理盐水中,生理盐水的浓度为0.0085~0.009g/ml;蜗旋形成混悬液,将形成的混悬液经过离心处理10min,离心频率为4000rpm;取离心后的上清液加入灭菌厌氧培养基混合均匀,其中上清液与灭菌厌氧培养基的体积比为1:9,在37℃,150rpm振荡频率的恒温振荡器中厌氧培养24h,得到大鼠肠道菌培养基。
制备例3
<大鼠肠道菌群孵育液的制备>
(a)取gam肉汤粉末10g放入500ml烧杯中,加入蒸馏水,水浴加热搅拌使其完全溶解,冷却后转移至1000ml容量瓶中,加蒸馏水定容至1000ml,然后放入高压灭菌锅中灭菌,0.1mpa,121℃灭菌15min,灭菌后获得灭菌厌氧培养基,冷却备用;
(b)取sd大鼠新鲜粪便3.5g,加入14ml生理盐水中,生理盐水的浓度为0.0085~0.009g/ml;蜗旋形成混悬液,将形成的混悬液经过离心处理10min,离心频率为4000rpm;取离心后的上清液加入灭菌厌氧培养基混合均匀,其中上清液与灭菌厌氧培养基的体积比为1:9,在37℃,150rpm振荡频率的恒温振荡器中厌氧培养24h,得到大鼠肠道菌培养基;
(c)从步骤(b)获得的大鼠肠道菌培养基中经过分离和鉴定获得肠球菌培养基。
实施例1
<皂苷元α-苦丁内酯的制备>
1)取制备例1中制备样品溶液3ml,加入到27ml制备例2中制备的肠道菌孵育液中混匀,取1ml置于试管中;
2)将试管放置于有厌氧产气包的厌氧培养袋中,放入摇床在37℃,150rpm的条件下培育96h;
3)培育完成后,取出试管并加入1ml乙酸乙酯-水饱和正丁醇的混合溶剂萃取液,其中萃取液中的乙酸乙酯与水饱和正丁醇的体积比为1:1,加入萃取液后先进行蜗旋处理,蜗旋时间为3min,再进行离心处理,离心处理时间为10min,离心频率为10000rpm;
4)取离心处理后的上清液置于离心管中并放置在氮吹仪上,用37℃的水浴氮气流脱除萃取剂,获得残渣;
5)将残渣溶于甲醇1ml中得到醇溶液,甲醇为75vol%的甲醇水溶液;
6)将醇溶液上填料为c18的反相液相色谱柱,用浓度为75vol%的甲醇水溶液冲洗,流速为1ml/min,收集15.5~17.5min内的流出液,并进行浓缩获得最终产物皂苷元α-苦丁内酯。
反相高效液相色谱图见图1,收集15.5~17.5min内的流出液。将上述时间段内流出液进行浓缩,并将浓缩液进行uplc-ms检测,获得的uplc-ms谱图见图2,证明在15~18min处的峰为皂苷元内酯的峰。
实施例2
<皂苷元α-苦丁内酯的制备>
1)取制备例1中制备样品溶液3ml,加入到27ml制备例3中制备的肠球菌孵育液中混匀,取1ml置于试管中;
2)将试管放置于有厌氧产气包的厌氧培养袋中,放入摇床在37℃,150rpm的条件下培育96h;
3)培育完成后,取出试管并加入1ml乙酸乙酯-水饱和正丁醇的混合溶剂萃取液,其中萃取液中的乙酸乙酯与水饱和正丁醇的体积比为1:1,加入萃取液后先进行蜗旋处理,蜗旋时间为3min,再进行离心处理,离心处理时间为10min,离心频率为10000rpm;
4)取离心处理后的上清液置于离心管中并放置在氮吹仪上,用37℃的水浴氮气流脱除萃取剂,获得残渣;
5)将残渣溶于甲醇1ml中得到醇溶液,甲醇为75vol%的甲醇水溶液;
6)将醇溶液上填料为c18的反相液相色谱柱,用浓度为75vol%的甲醇水溶液冲洗,流速为1ml/min,收集15.5~17.5min内的流出液,并进行浓缩获得最终产物皂苷元α-苦丁内酯。
本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员可以想到的任何变形、改进、替换均落入本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!