蜂王幼虫中蛋白质酶解制备抗氧化肽的方法与流程
本发明属于天然物质的提取
技术领域:
,具体涉及一种蜂王幼虫中蛋白质酶解制备抗氧化肽的方法。
背景技术:
:蜂王幼虫,又称蜂王胎、蜂皇胎,是王台里蜜蜂受精卵消化吸收工蜂分泌的新鲜蜂王柴生长发育的幼虫。祖国传统医学早在公元年前《尔雅》中己有蜂王幼虫的药用和食用价值的文字记载。《本草纲目》中写道:“蜂子,甘、平、微寒,去风头,除盛毒、补虚羸中。”古典医书《五十二病方》也有将蜂王幼虫用于配方治病的记述。蜂王幼虫是生产蜂王菜时产生的副产品,长期以来大部分蜂王幼虫未被充分利用。近年来,科学工作者对蜂王幼虫的化学成分、加工技术及生理功效进行了研究。研宄表明,蜂王幼虫具有丰富的营养成分,是一类优质食用昆虫蛋白质资源,具有广阔的开发应用前景。蜂王幼虫含有丰富的氨基酸、蛋白质、维生素、矿物质等,具有很高的营养价值。蜂王幼虫蛋白质功效比值、生物价蛋白质净利用率均与大豆分离蛋白相一致,是一种很好的动物蛋白质资源。但由于自身极易发生氧化而腐败变质,从而限制了蜂王幼虫的加工、利用。生物活性肽是指具有调节人体代谢和生理活动功能的一类蛋白质。一般情况下,生物活性肽被隐藏在蛋白质长链中,没有任何活性。当加入特定的蛋白酶对其进行水解时,就会释放出带活性的片段。许多研究发现昆虫蜜白质酶解产生的肽具有降血压、抗氧化等生物活性所以幵发蜂王幼虫生物活性肽,成为蜂王幼虫蛋白质开发的又一热点。所以,通过对蜂王幼虫进行酶解给蜂王幼虫的加工、利用提供了另一种方式,效果比较理想。中国授权公告号cn102251004b的发明专利提供了一种蜂王浆多肽的制备方法,本方法通过从蜂王幼虫体内提取肠道酶,模拟蜂王体内酶解环境对蜂王浆进行酶解得到3-5kda的蜂王浆多肽,制得的蜂王浆多肽能够用于制备aβ抑制剂。中国授权公告号cn103725742b的发明专利提供了一种酶解法制备蜂王胚胎肽的方法,包括:样品预处理、蜂王幼虫粉末脱脂、蜂王幼虫粉样品液配制、超声波处理蜂王幼虫粉样品液、蜂王幼虫粉样品液酶解反应、将酶解液置于沸水浴中加热20分钟灭酶,冷却至常温,将酶解液ph值调至7.0,离心后取上清液、干燥上述上清液获得水解的蜂王胚胎肽粉。中国授权公告号cn103725742b制得的蜂王胚胎多肽能够用于制作改善人体机能的保健品,且更重要的是从水解的蜂王胚胎多肽中筛选得到对人体真正有效的生物活性多肽。技术实现要素:本发明的第一个目的在于提供一种蛋白酶的使用量低,更利于生成生物活性肽,提升蛋白酶解液的水解度的蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,制得的抗氧化肽具有较高的保存稳定性和活性。本发明为实现上述目的所采取的技术方案为:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:将蜂王幼虫脱脂粉中加水搅拌均匀后的蛋白液经超声和动态超高压微射流预处理;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液;s3步骤:用超滤膜对所述酶解液进行超滤处理,得含有蛋白肽的溶液;s4步骤:将含有蛋白肽的溶液通过凝胶柱进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,根据220nm下的吸光度曲线收集洗脱组分,即得抗氧化肽。本发明制备方法首先采用超声和动态超高压微射流对蛋白液进行预处理,超声和动态超高压微射流的相互结合能够破坏维持蛋白质结构的作用力,使蛋白质分子结构伸展,分子间部分氢键、二硫键发生断裂,改变溶液中蜂王幼虫蛋白的组织结构,使隐藏的酶结合点和疏水性氨基酸基团暴露出来,提高蜂王幼虫蛋白对蛋白酶的敏感性,降低酶的使用量的同时更利于生成生物活性肽,提升蛋白酶解液的水解度,从而获得具备良好抗氧化活性的肽;本发明制备方法制得的抗氧化肽的肽链上不易发生脱酰胺、环化、氧化、水解等作用,具有良好的热稳定性、酸碱稳定性和体外消化稳定性,从而具有较长的保存期。优选的,超声温度为80-90℃、频率为85-100kh、时间为10-14min;超高压微射流的压力为200-260mpa、处理1-2次。优选的,s1步骤中蜂王幼虫脱脂粉和水的料液比为1:3-5(g/ml)。优选的,酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶。蜂王幼虫中含有较多低分子量蛋白质和多肽,经过适度酶解即可获得特定分子量和肽组成的抗氧化。优选的,蛋白酶的添加量为0.25-0.34%,所述酶解ph为7.0-8.0、温度为50-60℃、时间为1-2h。优选的,预处理前的蛋白液中含有氨基磺酸和聚环氧琥珀酸。氨基磺酸和聚环氧琥珀酸的加入配合超声和动态超高压微射流的作用能够打断相对分子质量较大的链,降解大分子多糖,使得蛋白液中含有单糖,同时在预处理过程中可提高蛋白液中牛磺酸的含量,而单糖和牛磺酸的存在一方面可避免酶解产物-抗氧化肽在酶解环境下发生外消旋反应而产生部分d-型氨基酸,保证所得抗氧化肽中的氨基酸为l-型氨基酸,维持抗氧化肽的极性、空间位阻等结构性质,提高所得抗氧化肽的保存稳定性和活性;另一方面能够在酶解过程中与酶解产物-抗氧化肽上的氨基结合,可提高抗氧化肽的保存稳定性和活性。更优选的,预处理前的蛋白液中含有蛋白酶重量0.3-0.4%的氨基磺酸和0.22-0.28%的聚环氧琥珀酸。优选的,凝胶柱为sephadexg-15;反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.1-0.15%的三氟乙酸的乙腈溶液,流速5-10ml/min。优选的,反相高效液相色谱分离的过程中,收集15-18min分离得到的肽溶液。本发明的另一目的是保护本发明方法制备得到的蛋白肽在制备治疗和/或预防骨质疏松症制剂中的用途。上述方法制得到的抗氧化肽的用途,在制备治疗和/或预防骨质疏松症制剂中的用途。骨质疏松症(osteoporosis,op)是一种老年退化性全身骨科疾病,主要特点为骨密度降低及骨微结构破坏,易导致发生骨折,常见脊柱、髋和桡骨三个部位。新骨形成主要由成骨细胞介导,而骨量减少主要取决于破骨细胞的功能,破骨功能强于成骨功能导致骨质疏松症。因此,正常骨重建过程中,能抑制破骨细胞前体细胞分化、成熟为破骨细胞,必能抑制骨质疏松症的发生。本发明制备方法制得的抗氧化肽可抑制破骨细胞前体细胞分化成熟为破骨细胞,抑制破骨细胞的肌动蛋白环的形成,而肌动蛋白环是成熟破骨细胞具有骨吸收作用的重要标志,进而能抑制破骨细胞骨吸收,同时也对破骨细胞成活具有重要作用,所以上述抗氧化肽具有抗骨质疏松的生物活性,能够有效地治疗和/或预防骨质疏松症。与现有技术相比,本发明的有益效果为:本发明制备方法能改变溶液中蜂王幼虫蛋白的组织结构,使隐藏的酶结合点和疏水性氨基酸基团暴露出来,提高蜂王幼虫蛋白对蛋白酶的敏感性,降低酶的使用量的同时更利于生成生物活性肽,提升蛋白酶解液的水解度,从而获得具备良好抗氧化活性的肽;本发明制备方法能维持抗氧化肽的极性、空间位阻等结构性质,产生的单糖或牛磺酸能够与酶解产物-抗氧化肽上的氨基结合,提高所得抗氧化肽的保存稳定性和活性,从而具有较长的保存期;本发明制备方法制得的抗氧化肽可抑制破骨细胞前体细胞分化成熟为破骨细胞和抑制破骨细胞骨吸收以及破骨细胞的肌动蛋白环的形成,也对破骨细胞成活具有重要作用,具有抗骨质疏松症的作用,有望成为预防、治疗骨质疏松症的新选择。本发明采用了上述技术方案提供蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,弥补了现有技术的不足,设计合理,操作方便。附图说明图1为本发明试验例1中ph对抗氧化肽的dpph·清除率的影响结果;图2为本发明试验例1中ph对抗氧化肽的螯合fe2+活性的影响结果;图3为本发明试验例1中温度对抗氧化肽的dpph·清除率的影响结果;图4为本发明试验例1中温度对抗氧化肽的螯合fe2+活性的影响结果;图5为本发明试验例2中450nm处细胞的od值;图6为本发明试验例2中各组trap染色后破骨细胞数量的比较结果;图7为本发明试验例2中各组破骨细胞骨吸收面积比的比较结果。具体实施方式为使本发明实施方式的目的、技术方案和优点更加清楚,下面将对本发明实施方式中的技术方案进行清楚、完整地描述。实施方式或实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
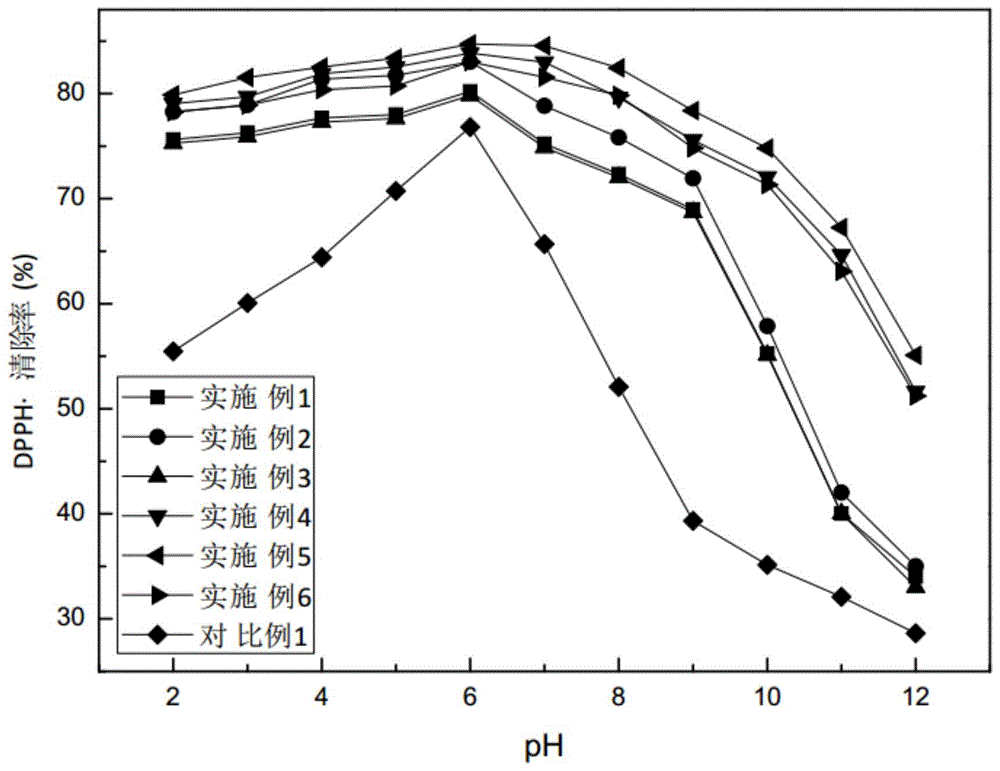
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。本发明的一个实施例是,蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:将蜂王幼虫脱脂粉中加水搅拌均匀后的蛋白液经超声和动态超高压微射流预处理;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液;s3步骤:用超滤膜对所述酶解液进行超滤处理,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过凝胶柱进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,根据220nm下的吸光度曲线收集洗脱组分,即得抗氧化肽。本申请制备方法首先采用超声和动态超高压微射流对蛋白液进行预处理,超声和动态超高压微射流的相互结合能够破坏维持蛋白质结构的作用力,使蛋白质分子结构伸展,分子间部分氢键、二硫键发生断裂,改变溶液中蜂王幼虫蛋白的组织结构,使隐藏的酶结合点和疏水性氨基酸基团暴露出来,提高蜂王幼虫蛋白对蛋白酶的敏感性,降低酶的使用量的同时更利于生成生物活性肽,提升蛋白酶解液的水解度,从而获得具备良好抗氧化活性的肽;本发明制备方法制得的抗氧化肽的肽链上不易发生脱酰胺、环化、氧化、水解等作用,具有良好的热稳定性、酸碱稳定性和体外消化稳定性,从而具有较长的保存期。其中,超声温度为80-90℃(例如82℃、83.5℃、86℃、88℃或89℃等)、频率为85-100kh(例如88kh、89.5kh、90kh、94kh或98kh等)、时间为10-14min(例如10.5min、11min、13.5min或14min等);超高压微射流的压力为200-260mpa(例如205mpa、210mpa、220mpa、230mpa或250mpa等)、处理1-2次。其中,s1步骤中蜂王幼虫脱脂粉和水的料液比为1:3-5(g/ml),例如1:3.2(g/ml)、1:3.5(g/ml)、1:4.2(g/ml)或1:4.6(g/ml)等。其中,酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶。蜂王幼虫中含有较多低分子量蛋白质和多肽,经过适度酶解即可获得特定分子量和肽组成的抗氧化。为了进一步提提高酶解度,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.3-0.5:1.2-1.6,例如1:0.32:1.6、1:0.35:1.25、1:0.4:1.3、1:0.45:1.5或1:0.46:1.55。其中,蛋白酶的添加量为0.25-0.34%,例如0.26%、0.28%、0.295%、0.32%或0.33%,所述酶解ph为7.0-8.0(例如7.2、7.6或7.8)、温度为50-60℃(例如52℃、53.5℃、56℃、57℃或58℃)、时间为1-2h。其中,预处理前的蛋白液中含有氨基磺酸和聚环氧琥珀酸。氨基磺酸和聚环氧琥珀酸的加入配合超声和动态超高压微射流的作用能够打断相对分子质量较大的链,降解大分子多糖,使得蛋白液中含有单糖,同时在预处理过程中可提高蛋白液中牛磺酸的含量,而单糖和牛磺酸的存在一方面可避免酶解产物-抗氧化肽在酶解环境下发生外消旋反应而产生部分d-型氨基酸,保证所得抗氧化肽中的氨基酸为l-型氨基酸,维持抗氧化肽的极性、空间位阻等结构性质,提高所得抗氧化肽的保存稳定性和活性;另一方面能够在酶解过程中与酶解产物-抗氧化肽上的氨基结合,可提高抗氧化肽的保存稳定性和活性。其中,预处理前的蛋白液中含有蛋白酶重量0.3-0.4%的氨基磺酸和0.22-0.28%的聚环氧琥珀酸。其中,凝胶柱为sephadexg-15;反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.1-0.15%的三氟乙酸的乙腈溶液,流速5-10ml/min。其中,反相高效液相色谱分离的过程中,收集15-18min分离得到的肽溶液。本发明的一个实施例是,上述方法制得到的抗氧化肽的用途,在制备治疗和/或预防骨质疏松症制剂中的用途。骨质疏松症(osteoporosis,op)是一种老年退化性全身骨科疾病,主要特点为骨密度降低及骨微结构破坏,易导致发生骨折,常见脊柱、髋和桡骨三个部位。新骨形成主要由成骨细胞介导,而骨量减少主要取决于破骨细胞的功能,破骨功能强于成骨功能导致骨质疏松症。因此,正常骨重建过程中,能抑制破骨细胞前体细胞分化、成熟为破骨细胞,必能抑制骨质疏松症的发生。本发明制备方法制得的抗氧化肽可抑制破骨细胞前体细胞分化成熟为破骨细胞,抑制破骨细胞的肌动蛋白环的形成,而肌动蛋白环是成熟破骨细胞具有骨吸收作用的重要标志,进而能抑制破骨细胞骨吸收,同时也对破骨细胞成活具有重要作用,所以上述抗氧化肽具有抗骨质疏松的生物活性,能够有效地治疗和/或预防骨质疏松症。下面,结合具体实施例对本发明实施方式作进一步说明。实施例1:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:3(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后的蛋白液经超声和动态超高压微射流预处理,其中超声温度为80℃、频率为85kh、时间为10min;超高压微射流的压力为200mpa、处理1次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.3:1.2,蛋白酶的添加量为0.25%,酶解ph为7.0、温度为50℃、时间为1h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.1%的三氟乙酸的乙腈溶液,流速5ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。实施例2:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:4(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后的蛋白液经超声和动态超高压微射流预处理,其中超声温度为85℃、频率为90kh、时间为12min;超高压微射流的压力为240mpa、处理2次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.4:1.5,蛋白酶的添加量为0.3%,酶解ph为7.5、温度为56℃、时间为1.5h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.12%的三氟乙酸的乙腈溶液,流速8ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。实施例3:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:5(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后的蛋白液经超声和动态超高压微射流预处理,其中超声温度为90℃、频率为100kh、时间为14min;超高压微射流的压力为260mpa、处理2次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.5:1.6,蛋白酶的添加量为0.34%,酶解ph为8.0、温度为60℃、时间为2h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.15%的三氟乙酸的乙腈溶液,流速10ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。实施例4:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:4(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后得蛋白液,蛋白液中加入蛋白酶重量0.3%的氨基磺酸和0.22%的聚环氧琥珀酸,经超声和动态超高压微射流预处理,其中超声温度为85℃、频率为90kh、时间为12min;超高压微射流的压力为240mpa、处理2次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.4:1.5,蛋白酶的添加量为0.3%,酶解ph为7.5、温度为56℃、时间为1.5h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.12%的三氟乙酸的乙腈溶液,流速8ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。实施例5:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:4(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后得蛋白液,蛋白液中加入蛋白酶重量0.35%的氨基磺酸和0.25%的聚环氧琥珀酸,经超声和动态超高压微射流预处理,其中超声温度为85℃、频率为90kh、时间为12min;超高压微射流的压力为240mpa、处理2次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.4:1.5,蛋白酶的添加量为0.3%,酶解ph为7.5、温度为56℃、时间为1.5h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.12%的三氟乙酸的乙腈溶液,流速8ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。实施例6:蜂王幼虫中蛋白质酶解制备抗氧化肽的方法,包括以下步骤:s1步骤:按料液比为1:4(g/ml)将蜂王幼虫脱脂粉中加水搅拌均匀后得蛋白液,蛋白液中加入蛋白酶重量0.4%的氨基磺酸和0.28%的聚环氧琥珀酸,经超声和动态超高压微射流预处理,其中超声温度为85℃、频率为90kh、时间为12min;超高压微射流的压力为240mpa、处理2次;s2步骤:用蛋白酶对所述预处理的蛋白液进行酶解,得酶解液,其中酶解用蛋白酶为碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的复合酶,蛋白酶中碱性蛋白酶、中性蛋白酶和木瓜蛋白酶的重量比为1:0.4:1.5,蛋白酶的添加量为0.3%,酶解ph为7.5、温度为56℃、时间为1.5h;s3步骤:用超滤膜对所述酶解液进行超滤处理,分离得到分子量低于的3kda部分,干燥,得含有蛋白肽的溶液;s4步骤:将所述含有蛋白肽的溶液通过sephadexg-15进行分离,根据280nm下的吸光度曲线收集洗脱组分,然后利用反相高效液相色谱进行分离,反相高效液相色谱分离的流动相a为纯水,流动相b为体积分数0.12%的三氟乙酸的乙腈溶液,流速8ml/min,根据220nm下的吸光度曲线收集洗脱组分,即收集15-18min分离得到的肽溶液,即得抗氧化肽。对比例1:本对比例与实施例2的技术方案的区别在于:本对比例s1步骤中蛋白液未经超声和动态超高压微射流预处理。试验例1:抗氧化肽的稳定性1.ph对抗氧化肽的稳定性的影响配制8mg/ml的大黄鱼抗氧化肽,分别采用1mhcl或1mnaoh调节ph值至2、3、4、5、6、7、8、9、10、11、12后静置1h,测定其dpph·清除率和螯合fe2+活性。结果如图1和图2所示。从图1和图2中可看出:1)随着ph上升,实施例1-6所得抗氧化肽的dpph·清除率先上升后下降,当ph接近中性时,抗氧化肽的dpph·清除率达到最强,dpph·清除率在酸性条件下没有显著降低,而当抗氧化肽处于碱性环境下,dpph·清除活性显著下降,但是实施例1、2、3所得抗氧化肽的dpph·清除率下降的显著性大于实施例4、5、6;实施例1-6所得抗氧化肽的螯合fe2+能力随ph上升呈显著上升趋势,但是实施例1、2、3所得抗氧化肽的螯合fe2+能力上升的显著性大于实施例4、5、6;这说明实施例1、2、3所得抗氧化肽的ph稳定性差于实施例4、5、6,进一步表明氨基磺酸和聚环氧琥珀酸的加入可提高抗氧化肽的酸碱稳定性和活性;2)随着ph上升,对比例1所得抗氧化肽的dpph·清除率先上升后下降,当ph接近中性时,抗氧化肽的dpph·清除率达到最强,dpph·清除率在酸性和碱性条件下均显著降低,其dpph·清除率和下降的显著性大于实施例1-6;对比例1所得抗氧化肽的螯合fe2+能力随ph上升呈显著上升趋势,其螯合fe2+能力上升的显著性大于实施例1-6;这说明对比例1所得抗氧化肽的ph稳定性差于实施例1-6,进一步表明本发明制备方法制得的抗氧化肽具有良好的酸碱稳定性和抗氧化活性。2.温度对抗氧化肽的稳定性的影响配制8mg/ml的大黄鱼内脏抗氧化肽,分别在20℃、40℃、60℃、80℃、100℃的水浴锅中保温2h,快速冷却至室温,并测定其dpph·清除率和螯合fe2+活性。结果如图3和图4所示。从图3和图4中可看出:实施例1-6所得抗氧化肽的dpph·清除活性和螯合fe2+能力基本保持稳定,但是实施例1、2、3所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例4、5、6,进一步表明氨基磺酸和聚环氧琥珀酸的加入可提高抗氧化肽的热稳定性和活性;对比例1所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例1-6,进一步表明本发明制备方法制得的抗氧化肽具有良好的热稳定性和抗氧化活性。3.体外模拟胃肠消化3.1体外模拟胃液连续消化配制8mg/ml的大黄鱼抗氧化肽,并用1m的hcl调节溶液至ph=2,以e/s=4%(质量分数)加入胃蛋白酶,在37℃下反应2h,接着用沸水浴加热10min以终止消化,冷却至室温后离心(8000g)15min,取上清液并分为两份,一份继续进行体外模拟消化,另一份在冷冻干燥后进行抗氧化活性和表面疏水性的鉴定。实施例1-6所得氧化肽经胃蛋白酶消化2h后,由于胃蛋白酶的作用可能导致多肽疏水残基进一步暴露,使表面疏水性提高但表现的并不显著,然而在胃蛋白酶消化2h后,抗氧化肽的疏水性显著降低,但是实施例1、2、3所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例4、5、6,进一步表明氨基磺酸和聚环氧琥珀酸的加入可提高抗氧化肽的体外消化稳定性和活性;对比例1所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例1-6,进一步表明本发明制备方法制得的抗氧化肽具有良好的体外消化稳定性和抗氧化活性。3.2体外模拟肠道连续消化将胃液消化后的大黄鱼内脏肽用0.9mol/l的nahco3调节至ph=5.3,然后用1m的naoh调节值ph=7.5,以e/s=4%(质量分数)加入糜蛋白酶,在37℃下反应2h,接着用沸水浴加热10min以终止消化,冷却至室温后离心(8000r/min)15min,取上清液进行抗氧化活性和表面疏水性的鉴定。实施例1-6所得氧化肽经糜蛋白酶消化2h后,由于糜蛋白酶的作用可能导致多肽疏水残基进一步暴露,使表面疏水性提高但表现的并不显著,然而在糜蛋白酶消化2h后,抗氧化肽的疏水性显著降低,但是实施例1、2、3所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例4、5、6,进一步表明氨基磺酸和聚环氧琥珀酸的加入可提高抗氧化肽的体外消化稳定性和活性;对比例1所得抗氧化肽的dpph·清除率和螯合fe2+能力的稳定性差于实施例1-6,进一步表明本发明制备方法制得的抗氧化肽具有良好的体外消化稳定性和抗氧化活性。试验例2:1.蜂王幼虫抗氧化肽对破骨细胞的影响1.1主要试剂配制方法α-mem培养液配制:4℃冰箱中解冻500ml的胎牛血清,在超净工作台里无菌分装胎牛血清,移液于50ml的离心管中。将500mlα-mem培养液,用移液枪移除55ml。将50ml胎牛血清、5ml青霉素、链霉素双抗,加入至445mlα-mem培养液里,吹打混和均匀,保存于4℃冰箱中待用;pbs溶液的配制:购买的pbs固体+2000ml双蒸水稀释,完全溶化后予分装,消毒后4℃保存备用。1.2小鼠骨髓单核细胞(bmms)分离培养取小鼠(c57bl/6)股骨、胫骨,去干净软组织,后将其移入超净台,转至无菌pbs中;用2-3mlα-mem培养液冲洗骨髓腔,冲出骨髓直至骨髓腔发白;骨髓细胞收集于15ml离心管中,1000rpm离心5min,弃上清,使用5ml不完全的α-mem培养液重悬细胞;加入2ml红细胞裂解液,上下摇晃多次而后室温静置1-2min;随后1000rpm离心5min,弃上清;加入预热的1mlpbs,用吸管吹打混匀,1000rpm离心5min,弃上清,重复三次;弃上清,细胞重悬于完全的α-mem培养液中并转移至10cm培养皿中,加入10ng/m1m-csf,培养过夜;收集悬浮细胞,将细胞转移至六孔板中。培养基中加入30ng/mlm-csf继续培养细胞3d。1.3cck-8细胞增殖-毒性检测法检测抗氧化肽对细胞活性的影响把贴壁bmms用吸管吹打法与胰酶消化制成细胞悬液,将其均匀,然后调整细胞数是10×l04个/ml;在96孔板中接种bmms悬液(1.5×104个/孔),将细胞在含有30ng/mlm-csf和50ng/mlrankl的诱导培养基中在培养箱中培养(在37℃,5%co2的条件下);培养过夜后,移除原培养基,加入含有不同抗氧化肽(0,0.01,0.1,1,5,10,20,30,40μm)的诱导培养基,诱导培养48小时;向每孔加入含10μlcck-8溶液的α-mem培养基100μl,每组设4个复孔;将培养板在培养箱内孵育3小时;用酶标仪测定在450nm处的吸光度(od)。图5为450nm处细胞的od值,由图可知:5μm以内蜂王幼虫抗氧化肽作用于bmms,其od值与对照组比较差异无统计学意义(p>0.05);蜂王幼虫抗氧化肽浓度大于5μm时,其与bmms共培养的od值与对照组比较具有统计学差异(p<0.05)。说明浓度小于5μm的抗氧化肽对bmms增殖活性无明显影响,对bmms无明显毒性;而浓度大于10μm时,抗氧化肽能明显抑制bmms增殖。4)蜂王幼虫抗氧化肽对bmms分化成熟为破骨细胞的影响将生长良好的bmms以1×104/孔接种于96孔板中,在37℃、5%co2培养箱中培养过夜;在培养箱中培养过夜后,移除原有培养基,先在m-csf(30ng/ml)和抗氧化肽(0、0.01、0.1、1μm)的培养基预处理细胞4h,随后加入rankl(50ng/ml),每3d换液,培养5d后,光镜下观察破骨细胞大体形态;或加入含有rankl(50ng/ml)、m-csf(30ng/ml)的培养基诱导,在d0、d2、d4再加入抗氧化肽(1μm),每隔3d换液,总共培养5d,光镜下观察ocs大体形态;弃去上清,用pbs洗涤2遍,使用sigma公司提供的trap染色试剂盒进行染色:用4%多聚甲醛固定细胞10min;移除固定液,用预热的pbs清洗细胞3次,再在以萘酚asbi磷酸盐作为底物的抗酒石酸酸性磷酸酶(trap)染液中37℃孵育lh;移除trap染液,pbs清洗细胞2-3次,在倒置显微镜下观察拍照;计数trap染色阳性多核破骨细胞(细胞核≥3),以及测量trap染色阳性多核破骨细胞所占面积比,作统计学分析。图6为各组trap染色后破骨细胞数量的比较,由图可知:给药后破骨细胞均减少,且干预组(0.1,1μm抗氧化肽)与对照组比较,破骨细胞数明显减少;这说明抗氧化肽能在早期抑制rankl诱导的破骨细胞的活化,且还能抑制rankl诱导的破骨细胞分化成熟的作用。5)骨细胞培养表面板(osteoassaysurface,oas)检测抗氧化肽对破骨细胞骨吸收能力的影响将生长状态良好的bmms以1×105个/孔接种于24孔骨细胞培养表面板,在37℃、5%co2培养箱中培养过夜;在培养箱中培养过夜后,移除原有培养基,先用含有m-csf(30ng/ml)和抗氧化肽(0、0.01、0.1、1μm)的培养基预处理细胞4h,随后加入rankl(50ng/ml),每组复孔3个,每3d换液1次,共培养5d;弃去上清液,用超声波清洗机反复冲洗2次,每次7分钟以清洗残留的细胞,最后再用pbs冲洗后自然状态下晾干,将oas板置于(蔡司)倒置显微镜下选取每组骨吸收陷窝图像并拍摄照片;对拍摄的照片采用imagej图像分析软件进行分析,并计算及比较各组骨吸收陷窝面积比。图7各组破骨细胞骨吸收面积比的比较,由图可知:给药后骨吸收面积比减少,且干预组(0.1,1μm抗氧化肽)与对照组比较,骨吸收面积比减少显著降低,这说明抗氧化肽对rankl诱导ocs的骨吸收具有明显的抑制作用。6)蜂王幼虫抗氧化肽对破骨细胞肌动蛋白环(f-actin环)形成的影响将生长状态良好的bmms以1.0×104个/孔接种于96孔板,在37℃、5%co2培养箱中培养过夜;在培养箱中培养过夜后,移除原有培养基,先用含有m-csf(30ng/ml)和抗氧化肽(0、0.01、0.1、1μm)的培养基预处理细胞4h,随后加入rankl(50ng/ml);每组复孔3个,每3d换液,培养5d;用4%多聚甲醛固定10min,然后加入0.1%triton-x100,透化5min,用pbs洗涤3遍;在室温下、暗室内,绿色荧光标记的鬼笔环肽(3.5μl溶液+500μlpbs,等比例加入),染色30min;pbs洗涤3次后,4',6-二脒基-2-苯基吲哚(dapi)染色10min,再用pbs洗涤3次;免疫荧光电镜观察f-actin环形态、大小。结果表明:随着抗氧化肽浓度增加,ocs的f-actin环的外形、大小显著减小,这说明抗氧化肽能抑制ocs的f-actin环的形成。综上所述,抗氧化肽具有抗骨质疏松的生物活性,能够有效地治疗和/或预防骨质疏松症。2.抗氧化肽的骨质疏松药效动物实验雌性sd大鼠,6周龄,体重200±20g,饲养于spf级动物房中,适应性喂养一周,随机分为正常对照组、假手术组、去势模型组、给药组1(实施例2制得,100mg/kg)、给药组2(实施例2制得,200mg/kg)、给药组3(实施例2制得,300mg/kg)、给药组4(实施例2制得,500mg/kg)、给药组4(实施例5制得,100mg/kg)、给药组5(实施例5制得,200mg/kg)、西药对照组(雌二醇)、中药对照组(更年安)。于去卵巢手术后2周开始,正常对照组、假手术组、去势模型组按体重1ml/100g灌胃给予溶剂0.5%羧甲基纤维素钠,其余各组按1ml/100g体重灌胃给药;给药时间为2个月(每天给药1次),每周大鼠称重一次,根据体重变化情况调整给药剂量。其中,去卵巢手术即去势手术以及假手术的操作与效果例2相同。末次给药后24小时,10%水合氯醛腹腔注射麻醉大鼠,仰卧体位固定,分离得到左侧胫骨备用,扫描前,将10%甲醛液中浸泡的左侧胫骨沿长轴垂直置于样品容器内,四周填塞适量纱条以固定样本。运行vivact40系统软件,对胫骨标本进行x线预扫描并获得x线图像。在x线图像上选取适当部位和长度,启动开始ct扫描程序。扫描完成后,进行2d图像重建。之后根据2d图像,选取区域的位置和体积,运用vivact40系统软件进行分析。设置扫描参数如下:电流111μa,电压70kvp,层厚度10.5μm,扫描时间60min。分析部位:左侧胫骨骺线以下1.05mm厚度,测定左侧胫骨松质骨的微结构参数:骨体积密度(tv)、骨体积分数(bv/tv)、骨小梁数量(tb.n*)、骨小梁厚度(tb.th*)。实验结果见表5。表5:抗氧化肽对大鼠骨密度相关指标的影响表组别动物数量(只)骨体积密度骨体积分数骨小梁数目骨小梁厚度正常对照组15541.860.675.170.36假手术组15530.090.665.160.35去势模型组15364.370.503.240.36给药组115473.550.604.300.38给药组215510.290.644.870.42给药组315515.380.644.980.43给药组415507.060.654.900.44给药组515512.760.664.950.45西药对照组15477.290.584.070.39中药对照组15505.220.613.660.43由表5可知:1)与正常组比较,去势模型组松质骨的骨体积密度显著下降,与去势模型组比较,给药组1-5、西药对照组和中药对照组的松质骨骨体积密度均明显增加;2)与正常组比较,去势模型组松质骨的骨体积分数显著下降,与去势模型组比较,给药组1-5、西药对照组和中药对照组的松质骨骨体积分数均明显增加;2)与正常组比较,去势模型组骨小梁数目减少,与去势模型组比较,给药组1-5、西药对照组和中药对照组的去势模型组骨小梁数目减少;4)与正常组比较,去势模型组骨小梁厚度不变,与去势模型组比较,给药组1-5、西药对照组和中药对照组的去势模型组骨小梁厚度增加。此外,给药组对骨质疏松的综合药效优于西药对照组和中药对照组,这说明,本发明抗氧化肽具有抗骨质疏松的生物活性,能够有效地治疗和/或预防骨质疏松症;同时给药组1的松质骨骨体积密度低于给药组4,这说明给药量为100mg/kg,实施例2的效果差于实施例5,这说明实施例5获得的抗氧化肽能更有效地治疗和/或预防骨质疏松症。上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1