制备如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的β-芳基氨基醇类药物的方法与流程
本发明属于有机合成领域,具体涉及一种制备如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的β-芳基氨基醇类药物的方法。
背景技术:
妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔是β-芳基氨基醇类药物。其结构式如下:
这类化合物具有广泛的药物活性。例如,妥洛特罗主要用于缓解支气管哮喘、急性支气管炎、慢性支气管炎、肺气肿等气道阻塞性疾病所致的呼吸困难(hanx,liur,jil,etal.journal.chromatogr.b,2016,1008:108-114)。氯丙那林具有支气管扩张作用,主要用于治疗支气管炎和哮喘等呼吸系统疾病(luc,luoz,huangl,etal.tetrahedron:asymmetry,2011,22(7):722-727.)。二氯异丙肾上腺素主要用于治疗心绞痛、心律失常以及充血性心力衰竭等疾病(weis,messererr,tsogoevasb.chem.eur.j.,2011,17(51):14380-14384.)。索他洛尔属于ⅲ类抗心律失常化合物(kamala,sandbhorm,shaikaa,bioorg.med.chem.lett.,2004,14(17):4581-4583),用于有效控制折返性室性心律失常以及心血管疾病的治疗(kapoorm,anandn,ahmadk,etal.tetrahedronasymmetry,2005,16(3):717-725)。
经过几十年的发展,有关这类化合物的报道很多,方法虽然也有各自的优势,但是从环保、安全、成本等方面考虑,仍期望提供改进的方案。
2005年,munishkapoor等人(kapoorm,anandn,ahmadk,etal.tetrahedron:asymmetry,2005,16(3):717-725)以芳基乙酮为原料,经溴素单溴化/nabh4还原/胺类化合物亲核取代胺化得到β-芳基氨基醇类药物。但是在第一步用到了具有毒性和强烈腐蚀性的发烟液体溴素。从环保和生产安全的方面考虑,溴素不宜用于工业化生产。
2011年,shengweiwei等人(weis,messererr,tsogoevasvetlanab.chem.eur.j.,2011,17(51):14380-14384)以α-卤代酮为原料,经对映选择性1,3,2-恶唑硼烷催化还原胺化得到相应的β-芳基氨基醇类药物。该合成方法,成本较高,反应时间长,且反应过程中环氧化合物开环时存在区域选择性,分离过程复杂,产率较低。
2014年,dr.ye-qianwen等人(wenyq,hertzbergr,gonzalezi,etal.chem.eur.j.,2014,20(13):3806-3812)以芳基醛类化合物为原料,在钛络合物和酶存在下与芳基醛类化合物进行亲核加成得到乙酸氰基醇酯,随后于酸性条件下,经bh3还原以及nabh4/丙酮还原胺化得到相应的β-芳基氨基醇类药物。该方法用到了剧毒的乙酰氰,不利于工业化生产。
2015年,razvanc.cioc等人(ciocrc,vandernietdjh,janssene,etal.chem.eur.j.,2015,21(21):7808-7813)以芳基醛类化合物和氰化合物为原料,在六甲基磷酰胺和四氯化硅存在下,经氨硼烷还原得到β-芳基氨基醇类药物。该合成方法用到了异腈化物,不仅价格昂贵而且异腈有恶臭,不符合绿色化学生产要求。
2015年,emiliaobijalska(obijalskae,utechtg,kowalskimk,etal.tetrahedronletters,2015,56(32):4701-4703)以芳基乙酮为原料,经二氧化硒氧化,得到缩醛类化合物,再经胺类化合物亲核加成得到亚胺类化合物,最后经硼氢化钠还原得到β-芳基氨基醇类药物。该方法使用了剧毒品二氧化硒,对皮肤和粘膜具有很大的刺激性,因此工业生产中有一定的限制。
上述合成方法中,有的需要用到剧毒的二氧化硒、溴素、乙酰氯,有的反应时间长,后处理复杂,产率较低。此外,上述合成方法只能合成一种β-芳基乙醇胺类化合物或其类似物,对其它的β-芳基乙醇胺类化合物并不适用,适用性差。
技术实现要素:
因此,本发明的目的是针对现有技术中存在的缺陷,提供一种制备如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的β-芳基氨基醇类药物的方法,该方法的原料简单易得,操作简便,产率高。
本发明的目的是通过以下技术方案实现的。
一方面,本发明提供了一种制备β-芳基氨基醇类药物的方法,所述β-芳基氨基醇类药物具有式4所示的化学结构,其中,所述方法包括以下步骤:
(1)式1所示的芳基乙酮与卤化试剂和亚砜反应,得到式2所示的芳基酮醛和/或式3所示的1,1-二羟基芳基酮;
(2)式2所示的芳基酮醛和/或式3所示的1,1-二羟基芳基酮与化学式为r1-nh2的胺类化合物进行亲核加成反应和还原剂存在下的还原胺化反应,得到β-芳基氨基醇类药物;
其中,ar表示芳基或取代的芳基;r1表示烃基或官能团修饰的烃基。
根据本发明提供的方法,其中,芳基乙酮与卤化试剂和亚砜经kornblum氧化反应得到芳基酮醛和/或1,1-二羟基芳基酮。步骤(1)中生成的芳基酮醛和1,1-二羟基芳基酮可以相互转化,其反应如下。
步骤(1)中生成的芳基酮醛和1,1-二羟基芳基酮都可以与所述胺类化合物反应生成亚胺并且进一步地在还原剂的存在下进行还原胺化,进而得到相应的β-芳基氨基醇类药物。本发明方法中,反应体系的水含量对制备目标产物影响小。
根据本发明提供的方法,其中,作为ar的芳基或取代的芳基的实例包括但限于:苯基、邻甲基苯基、间甲基苯基、对甲基苯基、邻氟苯基、间氟苯基、对氟苯基、邻氯苯基、间氯苯基、对氯苯基、邻碘苯基、间碘苯基、对碘苯基、邻三氟甲基苯基、间三氟甲基苯基、对三氟甲基苯基、邻硝基苯基、间硝基苯基、对硝基苯基、邻甲氧基苯基、间甲氧基苯基、对甲氧基苯基、3,4-二甲基苯基、3,4-二氟苯基、3,4-二氯苯基、邻氨基苯基、间氨基苯基、对氨基苯基、对甲磺酰基氨基苯基、萘-1-基、萘-2-基、呋喃-2-基、呋喃-3-基、吡咯-3-基、噻吩-3-基、吲哚-2-基和吲哚-3-基等。
在一些实施方案中,所述芳基乙酮的实例包括但不限于:苯乙酮、对甲基苯乙酮、对氟苯乙酮、对氯苯乙酮、对碘苯乙酮、对三氟甲基苯乙酮、对硝基苯乙酮、邻甲氧基苯乙酮、邻硝基苯乙酮、间甲氧基苯乙酮、3,4-二甲基苯乙酮、3,4-二氯苯乙酮、对氨基苯乙酮和对甲磺酰基氨基苯乙酮(n-对乙酰基苯基甲磺酰胺)。
根据本发明提供的方法,其中,r1-nh2和式4中的r1为具有1~20个碳原子的烃基或官能团修饰的烃基,优选为具有1~15个碳原子的烃基或官能团修饰的烃基。
根据本发明提供的方法,其中,所述烃基或官能团修饰的烃基可以为链烷基、环烷基、环烷基烷基、芳基烷基、取代的芳基烷基、芳基或取代的芳基。
在一些实施方案中,所述链烷基为具有1~15个碳原子的直链烷基或支链烷基;在一些实施方案中为具有1~12个碳原子的直链烷基或支链烷基;在一些实施方案中为具有1~10个碳原子的直链烷基或支链烷基;以及在一些实施方案中为具有1~8个碳原子的直链烷基或支链烷基。
适合的链烷基的实例包括但不限于:甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、仲丁基、戊基、异戊基、仲戊基、新戊基、己基、异己基、仲己基、庚基、异庚基和仲庚基。
在一些实施方案中,所述环烷基为具有3~15个碳原子的环烷基;以及在一些实施方案中,所述环烷基具有3~8个碳原子的环烷基。
适合的环烷基的实例包括但不限于:环丙基、环丁基、环戊基、环己基、环庚基和环辛基。作为优选的实施方案,所述环烷基为环丙基、环戊基、环己基、环庚基或环辛基。
在一些实施方案中,所述环烷基烷基为具有4~15个碳原子的环烷基烷基;在一些实施方案中,所述环烷基烷基具有4~12个碳原子的环烷基烷基;以及在一些实施方案中,所述环烷基烷基具有4~10个碳原子的环烷基烷基。
适合的环烷基烷基的实例包括但不限于:环丙基甲基、环丙基乙基、环丙基丙基、环丙基丁基、环丁基甲基、环丁基乙基、环丁基丙基、环丁基丁基、环戊基甲基、环戊基乙基、环戊基丙基、环戊基丁基、环己基甲基、环己基乙基、环己基丙基、环己基丁基、环庚基甲基、环庚基乙基、环庚基丙基、环庚基丁基、环辛基甲基、环辛基乙基、环辛基丙基和环辛基丁基。进一步地,作为优选的实施方案,所述环烷基烷基为环丙基甲基、环丙基乙基、环丙基丙基、环丁基甲基、环丁基乙基、环丁基丙基、环戊基甲基、环戊基乙基、环戊基丙基、环己基甲基、环己基乙基、环己基丙基、环庚基甲基、环庚基乙基或环庚基丙基。
在一些实施方案中,所述芳基烷基为具有7~15个碳原子的芳基烷基。
作为r1的、适合的芳基烷基和取代的芳基烷基的实例包括但不限于:苯甲基;卤素(如,氟、氯和溴)、氨基、硝基、羟基、甲磺酰基氨基或氰基取代的苯甲基;芳基乙基;卤素(如,氟、氯和溴)、氨基、硝基、羟基或氰基取代的芳基乙基;芳基丙基;卤素(如,氟、氯和溴)、氨基、硝基、羟基或氰基取代的芳基丙基;芳基丁基;卤素(如,氟、氯和溴)、氨基、硝基、羟基或氰基取代的芳基丁基;芳基戊基;卤素(如,氟、氯和溴)、氨基、硝基、羟基或氰基取代的芳基戊基;1-萘甲基;2-萘甲基;以及卤素(如,氟、氯和溴)、氨基、羟基、硝基或氰基取代的萘甲基。
在一些实施方案中,作为r1的芳基或取代的芳基具体4~15个碳原子。
适合的芳基和取代的芳基的实例包括但不限于:苯基;萘基;呋喃;吡咯;噻吩;吡啶;羟基、卤素、氨基、硝基、氰基、甲磺酰基氨基或c1-3烃基取代的苯基;联苯基;和羟基、氨基、硝基、氰基、卤素或c1-3烃基取代的萘基。
在一些优选实施方案中,所述胺类化合物为叔丁胺、异丙胺、正丁胺、异丁胺、苯胺、对甲基苯胺、4-甲氧基苯、4-氟苯胺、4-氯苯胺、3-氯苯胺、2-氯苯胺、邻甲基苯胺、2-甲氧基苯胺或2,6-二甲基苯胺。
根据本发明提供的方法,其中,所述β-芳基氨基醇类药物为妥洛特罗、氯丙那林、二氯异丙肾上腺素、索他洛尔或具有式4a-4x中任一项所示化学结构的β-芳基氨基醇类药物:
本发明中,妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的化学式依次为:
根据本发明提供的方法,其中,适合的卤化试剂的实例包括但不限于:卤代试剂,例如,n-氯代琥珀酰亚胺、n-溴代琥珀酰亚胺、n-碘代琥珀酰亚胺和n-氯代异丙胺;氟氢化钾/四氟化硅;卤素单质,例如,氯气、溴素和碘;四氟化氙;和卤代卡宾试剂。
根据本发明提供的方法,其中,所述步骤(1)中芳基乙酮与卤化试剂的摩尔比为1:0.1~6。
在一些实施方案中,所述步骤(1)中芳基乙酮与卤化试剂的摩尔比为1:0.3~2。
根据本发明提供的方法,其中,适合的亚砜的实例包括但不限于:二甲基亚砜、甲基乙基亚砜、甲基丙基亚砜、甲基丁基亚砜、甲基苯基亚砜、二乙基亚砜、二正丙基亚砜、二异丙基亚砜、二异丁基亚砜、二仲丁基亚砜、二叔丁基亚砜、二苯基亚砜、乙基丙基亚砜、乙基异丙基亚砜、乙基丁基亚砜、苯基乙烯基亚砜、甲基异丙基亚砜、氯化亚砜、4-苯甲酰基苯基甲基亚砜、正丁基亚砜、十二烷基甲基亚砜和氯甲基苯亚砜。
根据本发明提供的方法,其中,所述步骤(1)中芳基乙酮与亚砜的质量比为0.05~0.15:1,优选为0.05~0.08:1。
根据本发明提供的方法,其中,所述步骤(2)中的亲核加成反应是在第一溶剂中进行的。
在一些实施方案中,所述第一溶剂为选自乙腈、乙醚、甲醇、丙醇、丙酮、正丁醇、乙醇、异丁醇、二氯甲烷、二氯乙烷、三氯甲烷、丁醇、异丁醇和乙二醇中的一种或多种。
根据本发明提供的方法,其中,所述步骤(2)中的还原胺化反应是在第二溶剂中进行的。
在一些实施方案中,所述第二溶剂为选自乙腈、乙醚、甲醇、丙醇、丙酮、正丁醇、乙醇、异丁醇、二氯甲烷、二氯乙烷、三氯甲烷、丁醇、异丁醇和乙二醇中的一种或多种。
根据本发明提供的方法,其中,所述第一溶剂和所述第二溶剂可以相同,也可以不同。在一些实施方案中,所述第一溶剂和第二溶剂相同,以及在另一些实施方案中,在亲核加成反应之后,可以根据需要补加部分第二溶剂,可以不补加而直接进行还原胺化反应。
根据本发明提供的方法,其中,本发明对第一溶剂和第二溶剂的用量没有特殊要求。
根据本发明提供的方法,其中,适合的还原剂的实例包括但不限于:氢化铝锂、氢气、过氧化氢、氯化亚锡、硼氢化钾、硼氢化钠、草酸、乙醇、铁粉和锌粉。
根据本发明提供的方法,其中,所述步骤(2)中芳基酮醛和1,1-二羟基芳基酮的物质的量之和、胺类化合物和还原剂的摩尔比为1:0.2~5:0.2~5。
在一些实施方案中,所述步骤(2)中芳基酮醛和1,1-二羟基芳基酮的物质的量之和、胺类化合物和还原剂的摩尔比为1:1~1.2:1~1.2。
根据本发明提供的方法,其中,所采用的诸如芳基乙酮、卤代试剂、亚砜、胺类化合物、还原剂、第一溶剂和第二溶剂等原料可以通过商购得到,也可以通过本领域中已知的合成方法来制备。
根据本发明提供的方法,其中,所述方法可以分步进行,也可以通过三步一锅法合成。
根据本发明提供的方法,其中,所述步骤(1)中的反应是在60~150℃的温度下进行的。
在一些实施方案中,所述步骤(1)中的反应是在100~120℃的温度下进行的。
根据本发明提供的方法,其中,所述步骤(2)中的亲核加成反应和还原胺化反应是在0~40℃的温度下进行的。
在一些实施方案中,所述步骤(2)中的亲核加成反应和还原胺化反应是在0~25℃的温度下进行的。
根据本发明提供的方法,其中,所述步骤(1)中的反应以及所述步骤(2)中的亲核加成反应和还原反应是在搅拌下进行的。
另一方面,本发明还提供了具有式4a-4x中任一项所示化学结构的β-芳基氨基醇类药物:
本发明具有以下优势:
(1)本发明以芳基乙酮(式1)为原料,与卤化试剂和亚砜经kornblum氧化反应得到芳基酮醛(式2)和1,1-二羟基芳基酮(式3),然后再与胺类化合物发生亲核加成反应和还原胺化反应,进而制得诸如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的β-芳基氨基醇类药物。
本发明方法所使用的原料均简单易得,均可以在公开的商业渠道或根据文献已报道的合成方法合成得到。本发明的方法操作简单,反应时间短,后处理简便,对水和空气不敏感。
特别地,步骤(1)中通过kornblum氧化反应,体系中水含量影响不大,因为生成的式2产物和式3产物都可以与胺反应生成亚胺并进一步地经还原胺化得到诸如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔的β-芳基氨基醇类药物。本发明方法的产率高,适合工业化生产。
(2)本发明方法制备的诸如妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔是重要的药物和有机合成中间体,具有重要的研究价值。另外,其它的β-芳基氨基醇类药物的制备丰富了药物种类,便于进一步筛选药物。
(3)本发明方法是一种通用的、操作简便、经济环保以及收率高的合成妥洛特罗、氯丙那林、二氯异丙肾上腺素和索他洛尔及其类似物的制备方法,适用性强。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
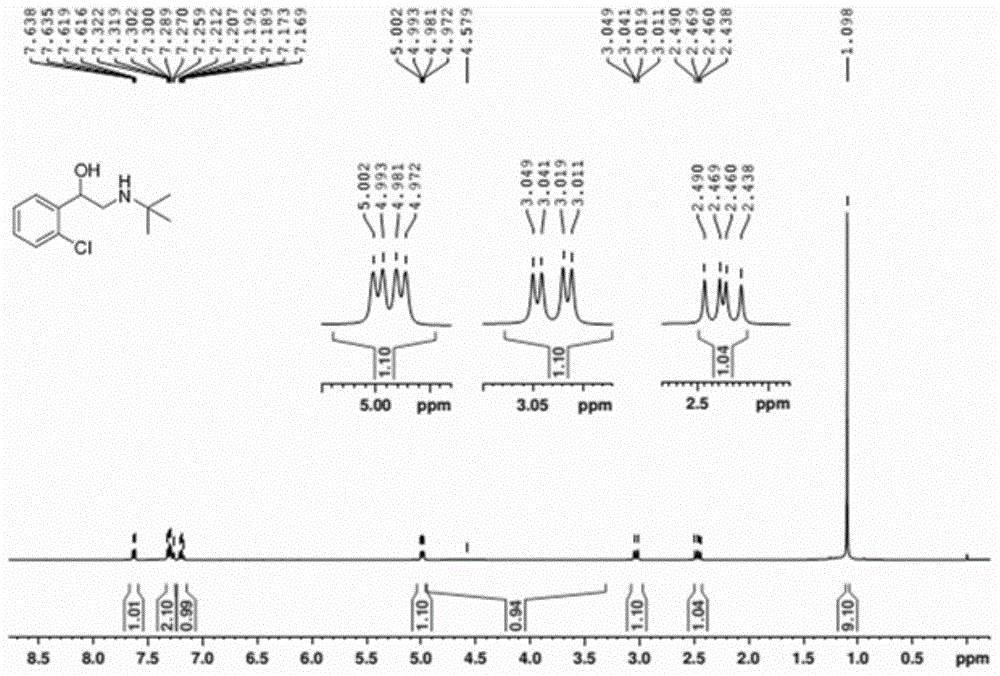
图1示出了实施例1制备的妥洛特罗的核磁共振氢谱图;
图2示出了实施例1制备的妥洛特罗的核磁共振碳谱图;
图3示出了实施例3制备的氯丙那林的核磁共振氢谱谱图;
图4示出了实施例3制备的氯丙那林的核磁共振碳谱谱图;
图5示出了实施例4制备的二氯异丙肾上腺素的核磁共振氢谱谱图;
图6示出了实施例4制备的二氯异丙肾上腺素的核磁共振碳谱谱图;
图7示出了实施例5制备的索他洛尔的核磁共振氢谱谱图;
图8示出了实施例5制备的索他洛尔的核磁共振碳谱谱图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:一锅法合成妥洛特罗
向50ml梨形瓶中加入邻氯苯乙酮(309.2mg,2.0mmol)、碘(152.3mg,0.6mmol)和二甲基亚砜(5ml),在120℃的油浴下反应,tlc检测反应,每隔20min检测一次,直至原料完全消失,经乙酸乙酯和饱和食盐水分液萃取,得到2-(2-氯苯基)-2-氧代乙醛。
将制得的2-(2-氯苯基)-2-氧代乙醛转移到50ml梨形瓶中,加入5ml的1,2-二氯乙烷,加入叔丁胺(175.5mg),25℃温度下反应2h。然后向体系中少量多次加入硼氢化钠(90.8mg),0℃温度下反应2h。旋蒸除去溶剂后,通过硅胶柱分离(洗脱剂,石油醚:乙酸乙酯=5:1-0:1),得到332.5mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为91-93℃。对该白色固体进行核磁表征。图1和2示出了实施例1制备的白色固体的核磁共振氢谱图和碳谱图,其中,1h-nmr(400mhz,cdcl3):δ7.64-7.62(m,1h),7.32-7.26(m,2h),7.21-7.17(m,2h),4.97(dd,j=3.4,8.5hz,1h),3.03(dd,j=3.9,12.0hz,1h),2.46(dd,j=8.6,12.0hz,1h),1.10(s,9h)。13c-nmr(100mhz,cdcl3):δ140.2,131.6,129.1,128.1,127.1,126.8,68.8,50.3,47.8,29.1。由此,该白色固体为妥洛特罗,经计算产率为73%。
实施例2:克级反应合成妥洛特罗
于200ml梨形瓶中加入邻氯苯乙酮(10.0g,64.7mmol)、碘(4.93g,19.4mmol)和二甲基亚砜(65ml)于120℃的油浴下加热反应,tlc检测反应,每隔20min检测一次,直至原料完全消失,经乙酸乙酯和饱和食盐水分液萃取,浓缩得到2-(2-氯苯基)-2-氧代乙醛。
向体系中加入1,2-二氯乙烷(65ml)作为溶剂和叔丁胺(5.9g,77.6mmol),25℃温度下反应2h。然后向体系中少量多次地加入硼氢化钠(2.9g,77.6mmol),25℃温度下反应2h。旋蒸除去溶剂后,通过硅胶柱分离(洗脱剂,石油醚:乙酸乙酯=5:1-0:1),得到6.7g白色固体。
采用毛细管熔点测定法测量其熔点,为91-93℃。进行核磁表征,其核磁结果与实施例1基本相同。该白色固体为妥洛特罗,经计算产率为46%。
实施例3:合成氯丙那林
向50ml梨形瓶中加入邻氯苯乙酮(309.2mg,2.0mmol)、碘(152.3mg,0.6mmol)和二甲基亚砜(5ml),在120℃的油浴下反应,tlc检测反应,每隔20min检测一次,直至原料完全消失,经乙酸乙酯和饱和食盐水分液萃取,得到2-(2-氯苯基)-2-氧代乙醛。
将制得的2-(2-氯苯基)-2-氧代乙醛转移到50ml梨形瓶中,加入5ml的1,2-二氯乙烷,加入异丙胺(141.8mg),25℃温度下反应2h。向体系中少量多次加入硼氢化钠(90.8mg),0℃温度下反应2h。旋蒸除去溶剂后,通过硅胶柱分离(洗脱剂,石油醚:乙酸乙酯=5:1到0:1),得到氯丙那林,232mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为80-81℃。对该白色固体进行核磁表征。图3和4示出了实施例3制备的白色固体的核磁共振氢谱图和碳谱图,其中,1h-nmr(400mhz,cdcl3):δ7.62(d,j=7.6hz,1h),7.32-7.26(m,2h),7.19(t,j=7.6hz,1h),5.06(dd,j=2.8,8.8hz,1h),3.05(dd,j=3.2,12.4hz,1h),2.84(heptet,j=6.2hz,1h),2.52(dd,j=9.0,11.8hz,1h),1.07(t,j=7hz,3h)。13c-nmr(100mhz,cdcl3):δ140.4,131.7,129.2,128.3,127.3,127.0,68.6,52.4,48.6,23.2,23.0。由此,该白色固体为氯丙那林,经计算产率为54%。
实施例4:合成二氯异丙肾上腺素
向50ml梨形瓶中加入3,4-二氯苯乙酮(378.1mg,2.0mmol)、碘(152.3mg,0.6mmol)和二甲基亚砜(5ml),在120℃的油浴下反应,tlc检测反应,每隔20min检测一次,直至原料完全消失,经乙酸乙酯和饱和食盐水分液萃取,得到2-(3,4-二氯苯基)-2-氧代乙醛。
将制得的2-(3,4-二氯苯基)-2-氧代乙醛转移到50ml梨形瓶中,加入5ml的1,2-二氯乙烷,加入异丙胺(141.8mg),25℃温度下反应2h。向体系中少量多次加入硼氢化钠(90.8mg),0℃温度下反应2h。旋蒸除去溶剂后,通过硅胶柱分离(洗脱剂,石油醚:乙酸乙酯=5:1-0:1),得到328mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为80-82℃。对该白色固体进行核磁表征。图5和6示出了实施例4制备的白色固体的核磁共振氢谱图和碳谱图,其中,1h-nmr(400mhz,cdcl3):δ7.47(d,j=2.0hz,1h),7.40(d,j=8.4hz,1h),7.18(dd,j=2.0,8.4hz,1h),4.60(dd,j=3.6,8.8hz,1h),2.91(dd,j=4.0,12.4hz,1h),2.82(quin,j=6.4hz,1h),2.56(dd,j=8.8,12.4hz,1h),1.08(d,j=4.0hz,3h),1.06(d,j=4.0hz,3h)。13c-nmr(100mhz,cdcl3):δ143.3,132.5,131.2,130.3,127.8,125.1,70.7,54.3,48.7,23.2,23.0。由此,该白色固体为丙肾上腺素,经计算产率为66%。
实施例5:合成索他洛尔
向50ml梨形瓶中加入n-对乙酰基苯基甲磺酰胺(426.5mg,2.0mmol)、碘(152.3mg,0.6mmol)和二甲基亚砜(5ml),在120℃的油浴下反应,tlc检测反应,每隔20min检测一次,直至原料完全消失,经乙酸乙酯和饱和食盐水分液萃取,得到相应的氧代乙醛。
将制得的氧代乙醛转移到50ml梨形瓶中,加入5ml的1,2-二氯乙烷,加入异丙胺(141.8mg),25℃温度下反应2h。向体系中少量多次加入硼氢化钠(90.8mg),0℃温度下反应2h。旋蒸除去溶剂后,通过硅胶柱分离(洗脱剂,石油醚:乙酸乙酯=5:1-0:1),得到245mg黄色油状液体。
对该黄色油状液体进行核磁表征。图7和8示出了实施例5制备的黄色油状液体的核磁共振氢谱图和碳谱图,其中,1h-nmr(400mhz,cdcl3):δ7.32(d,j=8.4,2h),7.18(d,j=8.4,2h),4.66(dd,j=3.2,9.2hz,1h),4.41(m,3h),2.98(s,3h),2.91(dd,j=3.4,12.2hz,1h),2.87(d,j=6.4hz,1h),2.63(dd,j=9.2,12.0hz,1h),1.09(d,j=6.4hz,3h),1.08(d,j=6.0hz,3h)。13c-nmr(100mhz,dmso-d6):δ140.5,137.6,127.3,120.3,71.5,55.2,48.5,40.9,23.1,22.9。由此,该黄色油状液体为索他洛尔,经计算产率为45%。
实施例6:合成2-(叔丁基氨基)-1-苯基乙醇(4a)
2-(叔丁基氨基)-1-苯基乙醇(4a)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的苯乙酮代替邻氯苯乙酮。制得244mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为90-93℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.40-7.33(m,4h),7.30-7.26(m,1h),4.65(dd,j=3.2,8.8hz,1h),2.93(dd,j=3.5,11.9hz,1h),2.62(dd,j=8.9,11.8hz,1h),1.13(s,9h)。13c-nmr(100mhz,cdcl3):δ142.8,128.4,127.4,125.8,72.2,50.6,50.3,29.1。由此,该淡黄色固体为2-(叔丁基氨基)-1-苯基乙醇(4a),经计算产率为63%。
实施例7:合成2-(叔丁基氨基)-1-(对甲苯基)乙醇(4b)
2-(叔丁基氨基)-1-(对甲苯基)乙醇(4b)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对甲基苯乙酮代替邻氯苯乙酮。制得261mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为107-109℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.27(s,2h),7.17-7.15(m,2h),4.62(dd,j=3.5,8.9hz,1h),2.90(dd,j=3.6,11.8hz,1h),2.61(dd,j=9.0,11.8hz,1h),2.34(s,3h),1.12(s,9h)。13c-nmr(100mhz,cdcl3):δ139.9,137.0,129.0,125.7,72.1,50.4,50.3,29.1,21.1。由此,该白色固体为2-(叔丁基氨基)-1-(对甲苯基)乙醇(4b),经计算产率为63%。
实施例8:合成2-(叔丁基氨基)-1-(4-氟苯基)乙醇(4c)
2-(叔丁基氨基)-1-(4-氟苯基)乙醇(4c)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对氟苯乙酮代替邻氯苯乙酮。制得254mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为103-106℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.35(dd,j=5.6,8.5hz,2h),7.03(t,j=8.7hz,2h),4.65(dd,j=3.3,9.0hz,1h),3.31(s,2h),2.92(dd,j=3.4,11.9hz,1h),2.59(dd,j=9.1,11.9hz,1h),1.15(s,9h)。13c-nmr(100mhz,cdcl3):δ162.2(d,1jc-f=243.4hz),138.4,127.4(d,3jc-f=8.1hz),115.2(d,2jc-f=21.2hz),71.4,50.8,50.3,29.0。由此,该白色固体为2-(叔丁基氨基)-1-(4-氟苯基)乙醇(4c),经计算产率为60%。
实施例9:合成2-(叔丁基氨基)-1-(4-氯苯基))乙醇(4d)
2-(叔丁基氨基)-1-(4-氯苯基))乙醇(4d)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对氯苯乙酮代替邻氯苯乙酮。制得232mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为123-126℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.31(s,4h),4.58(dd,j=3.6,8.8hz,1h),2.89(dd,j=3.6,11.9hz,1h),2.54(dd,j=8.8,11.9hz,1h),1.11(s,9h)。13c-nmr(100mhz,cdcl3):δ141.2,133.1,128.5,127.2,71.3,50.9,50.1,29.0。由此,该白色固体为2-(叔丁基氨基)-1-(4-氯苯基))乙醇(4d),经计算产率为51%。
实施例10:合成2-(叔丁基氨基)-1-(4-碘苯基)乙醇(4e)
2-(叔丁基氨基)-1-(4-碘苯基)乙醇(4e)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对碘苯乙酮代替邻氯苯乙酮。制得396mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为121-123℃。对该淡黄色固体进行核磁表征。其中,1hnmr(400mhz,cdcl3):δ7.67(d,j=8.3hz,2h),7.13(d,j=8.2hz,2h),4.57(dd,j=3.6,8.7hz,1h),2.90(dd,j=3.6,12.0hz,1h),2.54(dd,j=8.8,11.9hz,1h),1.12(s,9h)。13cnmr(100mhz,cdcl3):δ142.6,137.4,127.8,92.7,71.5,50.7,50.1,29.1。由此,该淡黄色固体为2-(叔丁基氨基)-1-(4-碘苯基)乙醇(4e),经计算产率为62%。
实施例11:合成2-(叔丁基氨基)-1-(4-(三氟甲基)苯基)乙醇(4f)
2-(叔丁基氨基)-1-(4-(三氟甲基)苯基)乙醇(4f)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对三氟甲基苯乙酮代替邻氯苯乙酮。制得240mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为104-106℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.60(d,j=8.2hz,2h),7.50(d,j=8.2hz,2h),4.71(dd,j=3.2,8.7hz,1h),3.0(dd,j=3.6,12.0hz,1h),2.6(dd,j=8.9,12.0hz,1h),1.14(s,9h)。13c-nmr(100mhz,cdcl3):δ146.9,129.6(d,2jc-f=32.5hz),126.0,124.2(d,1jc-f=270.3hz),125.3(q,3jc-f=3.8hz),71.3,50.9,50.0,28.9。由此,该淡黄色固体为2-(叔丁基氨基)-1-(4-(三氟甲基)苯基)乙醇(4f),经计算产率为46%。
实施例12:合成2-(叔丁基氨基)-1-(4-硝基苯基)乙醇(4g)
2-(叔丁基氨基)-1-(4-硝基苯基)乙醇(4g)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对硝基苯乙酮代替邻氯苯乙酮。制得252mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为134-137℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ8.21(d,j=8.7hz,2h),7.56(d,j=8.6hz,2h),4.74(dd,j=3.6,8.8hz,1h),3.00(dd,j=3.7,12.0hz,1h),2.55(dd,j=8.8,12.0hz,1h),1.14(s,9h)。13c-nmr(100mhz,cdcl3):δ150.5,147.3,126.5,123.6,71.2,50.6,49.9,29.2。由此,该淡黄色固体为2-(叔丁基氨基)-1-(4-硝基苯基)乙醇(4g),经计算产率为53%。
实施例13:合成2-(叔丁基氨基)-1-(2-甲氧基苯基)乙醇(4h)
2-(叔丁基氨基)-1-(2-甲氧基苯基)乙醇(4h)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的邻甲氧基苯乙酮代替邻氯苯乙酮。制得281mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为76-79℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.49(dd,j=1.4,7.5hz,1h),7.23(dd,j=1.2,7.6hz,1h),7.00-6.96(m,1h),6.85(d,j=8.2hz,1h),4.99(dd,j=3.4,8.4hz,1h),3.81(s,3h),2.98(dd,j=3.5,11.8hz,1h),2.60(dd,j=8.4,11.7hz,1h),1.13(s,9h)。13c-nmr(100mhz,cdcl3):δ156.3,131.1,128.1,126.6,120.7,110.2,67.6,55.3,50.4,48.2,28.2。由此,该淡黄色固体为2-(叔丁基氨基)-1-(2-甲氧基苯基)乙醇(4h),经计算产率为63%。
实施例14:合成2-(叔丁基氨基)-1-(2-硝基苯基)乙醇(4i)
2-(叔丁基氨基)-1-(2-硝基苯基)乙醇(4i)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的邻硝基苯乙酮代替邻氯苯乙酮。制得246mg棕色固体。
采用毛细管熔点测定法测量该棕色固体的熔点,为61-63℃。对该棕色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.96-7.90(m,2h),7.67-7.63(m,1h),7.44-7.40(m,1h),5.14(dd,j=3.6,8.4hz,1h),3.21(dd,j=3.7,12.2hz,1h),2.50(dd,j=8.4,12.2hz,1h),1.13(s,9h)。13c-nmr(100mhz,cdcl3):δ148.0,138.9,133.5,128.3,127.9,124.4,67.5,50.8,48.9,29.1。由此,该棕色固体为2-(叔丁基氨基)-1-(2-硝基苯基)乙醇(4i),经计算产率为52%。
实施例15:合成2-(叔丁基氨基)-1-(3-甲氧基苯基)乙醇(4j)
2-(叔丁基氨基)-1-(3-甲氧基苯基)乙醇(4j)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的间甲氧基苯乙酮代替邻氯苯乙酮。制得255mg棕色固体。
采用毛细管熔点测定法测量该棕色固体的熔点,为79-82℃。对该棕色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.28-7.24(m,2h),6.96-6.93(m,2h),7.00-6.96(m,1h),6.83-6.80(m,1h),4.58(dd,j=3.7,8.6hz,1h),3.82(s,3h),2.90(dd,j=3.7,11.8hz,1h),2.60(dd,j=8.6,11.8hz,1h),1.13(s,9h)。13c-nmr(100mhz,cdcl3):δ156.3,131.1,128.1,126.6,120.7,110.2,67.6,55.3,50.4,48.2,28.2。由此,该棕色固体为2-(叔丁基氨基)-1-(3-甲氧基苯基)乙醇(4j),经计算产率为57%。
实施例16:合成2-(叔丁基氨基)-1-(3,4-二甲基苯基)乙醇(4k)
2-(叔丁基氨基)-1-(3,4-二甲基苯基)乙醇(4k)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的3,4-二甲基苯乙酮代替邻氯苯乙酮。制得268mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为78-80℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.40(d,j=7.8hz,1h),7.04(d,j=7.8hz,1h),6.95(s,1h),4.79(dd,j=3.3,9.0hz,1h),2.84(dd,j=3.4,12.0hz,1h),2.52(dd,j=9.0,12.0hz,1h),2.30(d,j=2.5hz,6h),1.11(s,9h)。13c-nmr(100mhz,cdcl3):δ137.9,136.7,134.4,131.1,126.8,125.5,69.2,50.3,48.8,29.2,21.0,19.0。由此,该淡黄色固体为2-(叔丁基氨基)-1-(3,4-二甲基苯基)乙醇(4k),经计算产率为60%。
实施例17:合成2-(叔丁基氨基)-1-(3,4-二氯苯基)乙醇(4l)
2-(叔丁基氨基)-1-(3,4-二氯苯基)乙醇(4l)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的3,4-二氯苯乙酮代替邻氯苯乙酮。制得267mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为118-120℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.48(m,1h),7.42-7.40(m,1h),7.21-7.18(m,1h),4.53(dd,j=3.6,8.6hz,1h),2.90(dd,j=3.7,12.0hz,1h),2.50(dd,j=8.7,12.0,1h),1.10(s,9h);13c-nmr(100mhz,cdcl3):δ143.3,132.5,131.1,130.3,127.8,125.1,70.9,50.5,50.0,29.2。由此,该淡黄色固体为2-(叔丁基氨基)-1-(3,4-二氯苯基)乙醇(4l),经计算产率为51%。
实施例18:合成1-(2-氯苯基)-2-(苯基氨基)乙醇(4m)
1-(2-氯苯基)-2-(苯基氨基)乙醇(4m)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的苯胺代替叔丁胺。制得248mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.65-7.63(m,1h),7.38-7.31(m,2h),7.26-7.18(m,3h),6.77-6.74(m,3h),5.33(dd,j=3.1,9.0hz,1h),3.60(dd,j=3.2,13.4hz,1h),3.48(s,1h),3.14(dd.j=9.0,13.4hz,1h),2.61(s,1h)。13c-nmr(100mhz,cdcl3):δ147.8,139.4,131.9,129.5,129.4,128.9,127.3,127.2,118.3,113.5,69.2,50.1。由此,该油状液体为1-(2-氯苯基)-2-(苯基氨基)乙醇(4m),经计算产率为50%。
实施例19:合成1-(2-氯苯基)-2-(对甲苯基氨基)乙醇(4n)
1-(2-氯苯基)-2-(对甲苯基氨基)乙醇(4n)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的对甲基苯胺代替叔丁胺。制得354mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,dmso-d6):δ7.66-7.64(m,1h),7.41-7.36(m,2h),7.31-7.27(m,1h),6.88(d,j=8.3hz,2h),6.58(d,j=8.4hz,2h),5.62(d,j=4.6hz,1h),5.40(s,1h),5.09-5.05(m,1h),3.29-3.25(m,1h),2.93(dd,j=8.6,13.2hz,1h),2.14(s,3h)。13c-nmr(100mhz,dmso-d6):δ146.8,141.8,131.3,129.8,129.4,129.1,128.5,127.7,124.7,112.9,68.1,50.5,20.5。由此,该油状液体为1-(2-氯苯基)-2-(对甲苯基氨基)乙醇(4n),经计算产率为68%。
实施例20:合成1-(2-氯苯基)-2-((4-甲氧基苯基)氨基)乙醇(4o)
1-(2-氯苯基)-2-((4-甲氧基苯基)氨基)乙醇(4o)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的4-甲氧基苯胺代替叔丁胺。制得324mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为86-88℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.66-7.63(m,1h),7.37-7.31(m,2h),7.24-7.22(m,1h),6.81-6.79(m,2h),6.73-6.71(m,2h),5.31(dd,j=3.1,9.0hz,1h),3.75(s,3h),3.54(dd,j=3.1,13.9hz,1h),3.09(dd,j=9.0,13.3hz,1h)。13c-nmr(100mhz,cdcl3):δ152.8,141.8,139.4,131.8,129.4,128.0,127.3,127.2,115.1,115.0,69.1,55.8,51.2。由此,该白色固体为1-(2-氯苯基)-2-((4-甲氧基苯基)氨基)乙醇(4o),经计算产率为58%。
实施例21:合成1-(2-氯苯基)-2-((4-氟苯基)氨基)乙醇(4p)
1-(2-氯苯基)-2-((4-氟苯基)氨基)乙醇(4p)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的4-氟苯胺代替叔丁胺。制得332mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.62(dd,j=1.6,7.7hz,1h),7.37-7.29(m,2h),7.26-7.22(m,1h),6.91-6.87(m,2h),6.67-6.64(m,2h),5.29(dd,j=3.1,8.9hz,1h),3.51(dd,j=3.2,13.3hz,1h),3.09(dd,j=8.9,13.3hz,1h)。13c-nmr(100mhz,cdcl3):δ156.3(d,1jc-f=234.4hz),144.0,139.3,131.8,129.5,129.3,129.0,127.3,115.8(d,2jc-f=22.2hz),114.5(d,3jc-f=7.4hz),69.1,50.7。由此,该油状液体为1-(2-氯苯基)-2-((4-氟苯基)氨基)乙醇(4p),经计算产率为62%。
实施例22:合成1-(2-氯苯基)-2-((4-氯苯基)氨基)乙醇(4q)
1-(2-氯苯基)-2-((4-氯苯基)氨基)乙醇(4q)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的4-氯苯胺代替叔丁胺。制得454mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,dmso-d6):δ7.65(dd,j=1.5,7.7hz,1h),7.42-7.36(m,2h),7.31-7.30(m,1h),7.09-7.05(m,2h),6.68-6.64(m,2h),5.93(s,1h),5.66(s,1h),5.07(dd,j=2.9,8.2hz,1h),3.27(d,j=12.2hz,1h),2.97(dd,j=8.4,12.3hz,1h)。13c-nmr(100mhz,dmso-d6):δ147.6,141.1,130.9,128.9,128.7,128.5,128.0,127.2,118.8,113.5,67.7,49.6。由此,该油状液体为1-(2-氯苯基)-2-((4-氯苯基)氨基)乙醇(4q),经计算产率为80%。
实施例23:合成1-(2-氯苯基)-2-(邻甲基苯基氨基)乙醇(4r)
1-(2-氯苯基)-2-(邻甲基苯基氨基)乙醇(4r)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的邻甲基苯胺代替叔丁胺。制得350mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.62(dd,j=1.7,7.7hz,1h),7.36-7.20(m,3h),7.14-7.02(m,2h),6.78(d,j=8.0hz,1h),6.71-6.67(m,1h),5.34(dd,j=3.2,8.9hz,1h),3.60(dd,j=3.2,13.2hz,1h),3.16(dd,j=8.9,13.2hz,1h),2.16(s,3h)。13c-nmr(100mhz,cdcl3):δ145.7,139.5,131.9,130.3,129.5,128.9,127.3,127.2,127.1,122.8,117.9,110.6,69.0,49.9,17.6。由此,该油状液体为1-(2-氯苯基)-2-(邻甲基苯基氨基)乙醇(4r),经计算产率为67%。
实施例24:合成1-(2-氯苯基)-2-((2-甲氧基苯基)氨基)乙醇(4s)
1-(2-氯苯基)-2-((2-甲氧基苯基)氨基)乙醇(4s)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的2-甲氧基苯胺代替叔丁胺。制得290mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.62(dd,j=1.5,7.7hz,1h),7.34-7.26(m,2h),7.22-7.18(m,1h),6.89-6.84(m,1h),6.79-6.75(m,2h),6.72-6.68(m,1h),5.31(dd,j=2.9,9.2hz,1h),3.81(s,3h),3.56(dd,j=3.0,13.4hz,1h),3.10(dd,j=9.2,13.4hz,1h)。13c-nmr(100mhz,cdcl3):δ147.2,139.5,137.7,131.8,129.4,128.8,127.4,127.2,121.4,117.4,110.7,109.7,69.1,55.5,50.1。由此,该油状液体为1-(2-氯苯基)-2-((2-甲氧基苯基)氨基)乙醇(4s),经计算产率为52%。
实施例25:合成1-(2-氯苯基)-2-((2-氯苯基)氨基)乙醇(4t)
1-(2-氯苯基)-2-((2-氯苯基)氨基)乙醇(4t)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的2-氯苯胺代替叔丁胺。制得276mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.67(dd,j=1.5,7.7hz,1h),7.38-7.31(m,2h),7.28-7.23(m,2h),7.16-7.12(m,1h),6.84(dd,j=1.1,8.2hz,1h),6.69-6.65(m,1h),5.36(dd,j=3.1,8.8hz,1h),3.62(dd,j=3.2,13.5hz,1h),3.22(dd,j=8.8,13.5hz,1h)。13c-nmr(100mhz,cdcl3):δ143.7,139.1,131.8,129.5,129.3,129.0,127.8,127.4,127.3,119.8,118.0,111.9,69.1,49.6。由此,该油状液体为1-(2-氯苯基)-2-((2-氯苯基)氨基)乙醇(4t),经计算产率为49%。
实施例26:合成1-(2-氯苯基)-2-((3-氯苯基)氨基)乙醇(4u)
1-(2-氯苯基)-2-((3-氯苯基)氨基)乙醇(4u)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的3-氯苯胺代替叔丁胺。制得372mg油状液体。
对该油状液体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.62(dd,j=1.6,7.7hz,1h),7.38-7.30(m,2h),7.25-7.23(m,1h),7.07(dd,j=8.0,14.7hz,1h),6.70(m,2h),6.59(m,1h),5.33(dd,j=3.1,8.8hz,1h),3.54(dd,j=3.1,13.4hz,1h),3.14(dd,j=8.8,13.4hz)。13c-nmr(100mhz,cdcl3):δ149.0,139.1,135.1,131.8,130.3,129.6,129.1,127.3,127.2,118.0,113.2,111.7,69.2,49.7。由此,该油状液体为1-(2-氯苯基)-2-((3-氯苯基)氨基)乙醇(4u),经计算产率为66%。
实施例27:合成1-(2-氯苯基)-2-((2,6-二甲基苯基)氨基)乙醇(4v)
1-(2-氯苯基)-2-((2,6-二甲基苯基)氨基)乙醇(4v)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的2,6-二甲基苯胺代替叔丁胺。制得306mg淡黄色固体。
采用毛细管熔点测定法测量该淡黄色固体的熔点,为78-80℃。对该淡黄色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.60(dd,j=1.4,7.7hz,1h),7.37-7.13(m,3h),6.97(d,j=7.4hz,2h),6.84-6.81(m,1h),5.21(dd,j=2.9,8.6hz,1h),3.33(dd,j=3.0,12.7hz,1h),3.27(s,2h),2.95(dd,j=8.7,12.7hz,1h),2.29(s,6h)。13c-nmr(100mhz,cdcl3):δ144.9,139.6,131.8,130.2,129.4,128.9,128.8,127.3,127.1,122.6,70.3,53.7,18.3。由此,该淡黄色固体为1-(2-氯苯基)-2-((2,6-二甲基苯基)氨基)乙醇(4v),经计算产率为55%。
实施例28:合成1-(2-氯苯基)-2-(异丁基氨基)乙醇(4w)
1-(2-氯苯基)-2-(异丁基氨基)乙醇(4w)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的异丁胺代替叔丁胺。制得262mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为74-76℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.63(d,j=7.7hz,1h),7.32-7.26(m,2h),7.21-7.17(m,1h),5.07(dd,j=3.0,8.8hz,1h),3.03(dd,j=3.2,12.2hz,1h),2.58-2.41(m,3h),1.74(m,1h),0.92(d,j=6.7hz,6h)。13c-nmr(100mhz,cdcl3):δ140.1,131.74,129.2,128.3,127.2,127.0,68.1,57.3,54.9,28.5,20.5。由此,该白色固体为1-(2-氯苯基)-2-(异丁基氨基)乙醇(4w),经计算产率为58%。
实施例29:合成1-(2-氯苯基)-2-(正丁基氨基)乙醇(4x)
1-(2-氯苯基)-2-(正丁基氨基)乙醇(4x)的合成方法与实施例1基本相同,不同之处在于:采用相同物质的量的正丁胺代替叔丁胺。制得310mg白色固体。
采用毛细管熔点测定法测量该白色固体的熔点,为60-62℃。对该白色固体进行核磁表征。其中,1h-nmr(400mhz,cdcl3):δ7.62(d,j=7.6hz,1h),7.32-7.26(m,2h),7.21-7.20(m,1h),5.09(dd,j=2.9,8.7hz,1h),3.03(dd,j=3.2,12.2hz,1h),2.74-2.54(m,3h),1.47(m,2h),1.35(m,2h),0.92(t,j=7.3hz,3h)。13c-nmr(100mhz,cdcl3):δ140.2,131.7,129.2,128.3,127.2,127.0,68.2,54.8,49.0,32.4,20.4,14.0。该白色固体为1-(2-氯苯基)-2-(正丁基氨基)乙醇(4x),经计算产率为68%。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!