一种过表达fimH基因的重组大肠杆菌在发酵生产氨基酸中的应用的制作方法
本发明涉及氨基酸发酵,具体涉及一种过表达fimh基因的重组大肠杆菌在发酵生产氨基酸中的应用。
背景技术:
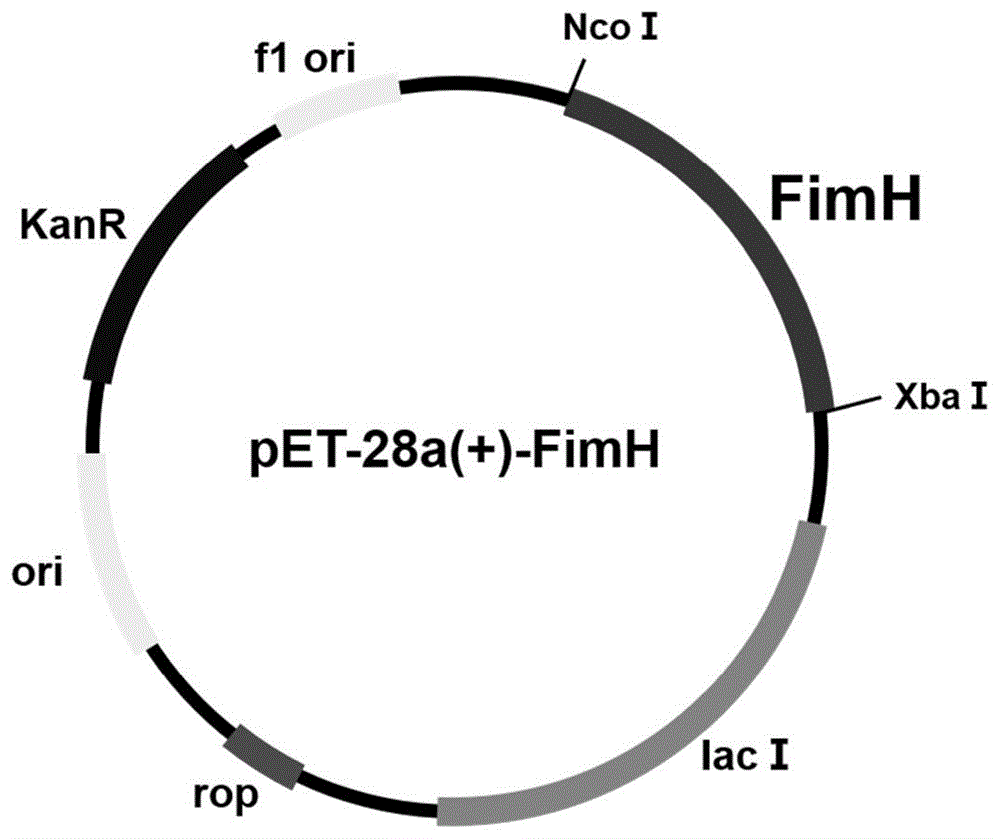
:氨基酸在工业生产中应用十分广泛,例如动物饲料添加剂、人类食物调味品以及化妆品和医疗产品的原料。三羧酸循环中,如柠檬酸等有机酸在食品添加剂、化学制造及医疗产品领域亦有其广泛应用。目前氨基酸和有机酸的生产的主要方法有三种:微生物发酵法、化学合成法以及酶法。微生物发酵法以其具有生产原料来源广泛、成本低、在生产过程中对环境污染较小、操作容易安全、菌种多种多样并且可以进行大规模生产等优势,现已成为氨基酸和有机酸生产的主流方法。随着分子生物学技术的成熟和发展,运用基因工程技术对菌株的氨基酸和有机酸代谢途径进行分子改造,成为当今获得氨基酸和有机酸高产菌株的有效手段。大肠杆菌作为一种最常用基因工程菌,具有生长快速且稳定、代谢通路清晰、成本低和基因编辑工具易获取等特点。虽然利用大肠杆菌生产苏氨酸普遍运用到微生物发酵实验中,但相对于氨基酸和有机酸行业的需求,其速率依然较慢。因此基因工程菌高产氨基酸的改造成为生产应用中的关键。菌毛在大肠杆菌中主要负责细胞的运动,其主要作用是负责细菌细胞之间、细菌与非生物表面的黏附,并且与生物膜的形成和dna的转移等相关联。大肠杆菌i型菌毛是重要的黏附细胞器,该菌毛由fim操纵子编码,由9个基因组成,分别是fima、fimb、fimc、fimd、fime、fimf、fimg、fimh、fims,这些基因是i型菌毛的主要结构单位,是菌毛重要部分。生物膜(biofilm)是一种复杂的细胞群落、由细胞外基质形成了复杂的生物聚集体,具有保证细菌在极端环境下生存的能力。大肠杆菌就可以通过菌毛的运动和黏附逐渐形成不可逆的粘附于非生物或生物表面的生物膜。技术实现要素:发明目的:本发明提供了一种过表达fimh基因的重组大肠杆菌在发酵生产氨基酸中的应用,通过原始菌和过表达菌株的全基因转录组分析,证实了改造fimh基因可以影响氨基酸代谢途径流。技术方案:本发明提供了一种过表达fimh基因的重组大肠杆菌在发酵生产氨基酸中的应用,所述氨基酸为天冬氨酸、精氨酸或谷氨酸。所述过表达fimh基因的重组大肠杆菌的构建方法包括如下步骤:(1)提取原始大肠杆菌的基因组;(2)以步骤(1)提取得到的基因组为模板,采用pcr技术扩增fimh基因;(3)将步骤(2)得到的fimh基因插入pet-28a质粒的ncoⅰ/xbaⅰ酶切位点间,得到携带fimh基因的重组质粒;(4)将步骤(3)得到的重组质粒转化到e.colidh5α的感受态细胞中,从e.colidh5α中提取重组质粒;(5)将步骤(4)提取得到的重组质粒转化到原始大肠杆菌的感受态细胞中,即得过表达fimh基因的重组大肠杆菌。步骤(1)中所述原始大肠杆菌为cibts1688;大肠杆菌cibts1688赠自中国科学院上海生命科学研究院,所述大肠杆菌cibts1688已保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2015233,菌株号为cibts1688,其具体信息已在申请号为2015101990361的发明专利中公开。步骤(2)中所述pcr使用的引物如下:fimh-f:ggataacaattcccctctagaatgaaacgagttattaccctgtttgcfimh-r:gatgatggctgctgcccatggttattgataaacaaaagtcacgcca。发酵条件如下:发酵温度为25-37℃,发酵时间为30-32h。有益效果:本发明借鉴医学上的致病性大肠杆菌形成生物膜的细胞相较于游离的细胞更适应极端环境,在已知fim操纵子调控的fimh基因可以调控大肠杆菌生物膜的形成,通过转录组分析发现了过表达fimh基因后氨基酸代谢通路的变化,为未来过表fimh基因分子改造筛选出其他高产氨基酸的重组菌株提供基础,达到提高产量、发酵速率和糖转化率的目的。附图说明图1为表达质粒pet-28a(+)-fimh的构建流程图;图2为转录组分析流程图;图3为fimh基因的过表与生物膜相关基因的分析图4为fimh基因与氨基酸代谢相关基因的分析。具体实施方式实施例1构建过表达fimh基因的重组大肠杆菌1、目的基因fimh的扩增:以提取的大肠杆菌cibts1688基因组为模板,对基因fimh进行扩增。根据ncbi上escherichiacolistr.k-12substr.mg1655的fimh基因序列通过snapgene软件设计扩增所用的引物,其中,引物包括xbai和ncoi限制性酶切位点,用于后续与质粒pet28a相连。引物合成由江苏省苏州市金唯智公司合成。引物名称及序列:fimh-f:ggataacaattcccctctagaatgaaacgagttattaccctgtttgfimh-r:gatgatggctgctgcccatggttattgataaacaaaagtcacgccapcr反应体系见表1。表1目的基因fimh扩增pcr体系组分体积(μl)生产厂家10×pcrbuffer25μltoyobo公司dntp(150mm)10μltoyobo公司引物fimh-f1.5μl金唯智公司引物fimh-r1.5μl金唯智公司模板(基因组)1.0μlaxygen基因组提取试剂盒kod酶1.0μltoyobo公司无菌水10μl分装成每管25μl。pcr条件:1)变性98℃,2min;2)退火48-56℃,30s;延伸68℃,30s,共35个循环;3)完全延伸68℃,10min。pcr产物经axygen胶回收试剂盒纯化后,用于后续实验连接质粒。2、重组质粒的构建1)pet28a质粒的提取:将带有质粒pet28a的大肠杆菌dh5α甘油菌(购于淼灵质粒平台)接种于5ml的lb液体培养基(含有卡那霉素抗性50μg/ml),37℃培养过夜;用2.0ml离心管收集细胞,10000rpm离心2min,弃上清液;依照corning生命科学有效公司的axyprep质粒dna小量试剂盒说明书中的步骤进行操作,提取质粒pet28a。2)pet28a质粒的线性化:为了将目的基因fimh连接到质粒pet28a上,需要将质粒进行酶切,双酶切反应体系见表2。表2pet28a质粒的酶切体系组分体积(μl)生产厂家0.1%bsa(1g/l)2μltakara公司1*mbuffer2μltakara公司ncoi酶0.5μltakara公司xbal酶0.5μltakara公司质粒pet28a10μl淼灵质粒平台无菌水5μl酶切的条件为37℃,2-3h,酶切反应结束后将酶切产物进行胶回收,用于后续的实验。3)重组质粒的构建:将步骤2)得到的纯化线性化载体与目的基因片段按照vazyme公司ii一步克隆试剂盒的说明书的步骤相连接,得到重组质粒pet28a-fimh。一步克隆反应体系见表3,37℃水浴30min后,立即冰浴5min,-20℃保存。构建重组的表达质粒示意图见图2。表3一步克隆反应体系3、重组质粒的转化和筛选将步骤2得到的重组质粒pet28a-fimh10μl转入到100μl大肠杆菌dh5α感受态细胞中,置于冰上30min,42℃水浴锅90s,立即放在冰上10min,加入900ml的lb培养基,37℃摇床180rpm培养40min,而后取150μl涂布于lb抗性平板(50μg/ml卡那霉素),37℃培养箱培养12h。挑取上述平板单菌落,接种于5ml的lb液体培养基(50μg/ml卡那霉素)中37℃过夜培养后,提质粒pet28a-fimh,经测序无误。测序验证成功后,将质粒pet-28a-fimh按照步骤3转化到原始菌株cibts1688的感受态细胞中,挑取单菌落按步骤2中提取质粒的方法进行测序验证,得到构建好的过表达菌株cibts1688-fimh*。挑取单菌落提质粒测序验证。实施例2构建敲除fimh基因的重组大肠杆菌1、提取敲除质粒pkd46和pkd4:将带有质粒pkd46的大肠杆菌dh5α(购自淼灵质粒平台)甘油菌接种于5ml的lb液体培养基(含有100μg/ml氨苄霉素),30℃培养过夜;用2.0ml离心管收集细胞,10000rpm离心2min,弃上清液;依照corning生命科学有效公司的axyprep质粒dna小量试剂盒说明书中的步骤进行操作,提取质粒pkd46。提取出的质粒于-20℃保存。lb液体培养基(含有100μg/ml氨苄霉素)配方如下:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,氨苄霉素100μg/ml。将带有质粒pkd4的大肠杆菌dh5α(购自淼灵质粒平台)甘油菌接种于5ml的lb液体培养基(含50μg/ml卡那霉素),37℃培养过夜;用2.0ml离心管收集细胞,10000rpm离心2min,弃上清液;依照corning生命科学有效公司的axyprep质粒dna小量试剂盒说明书中的步骤进行操作,提取质粒pkd4。2、制备大肠杆菌cibts1688-pkd46感受态:步骤1)将质粒pkd46转入大肠杆菌cibts1688:将10μl的pkd46质粒加入到大肠杆菌cibts1688的感受态中,冰上预冷10min;加入预冷的电转杯中,电转条件:25μf、200ω、2.5kv;电转完成后立即加入900ml的lb液体培养基中,30℃,摇床180rpm培养1-2h;取100μl培养液涂布lb抗性平板(50μg/ml卡那霉素),30℃培养16h;挑取单菌落,进行菌落pcr验证,并测序。步骤2)将步骤1构建成功的菌株大肠杆菌cibts1688-pkd46接种于lb液体抗性培养基(50μg/ml卡那霉素)中,30℃培养16h;按照1%的比例转接于100ml的lb液体抗性培养基(50μg/ml卡那霉素)中,30℃200rpm培养至od600=0.6左右,并在培养终止前2h加入l-阿拉伯糖,终浓度1mmol/l;将菌液放入4℃、4000rpm条件下离心5min,收集菌体;用预冷的10%甘油离心洗涤3次,浓缩100倍成1ml制成感受态,分装每管100μl,-80℃保存。3、敲除片段的构建:敲除fimh基因的构建采用大肠杆菌经典的red重组技术敲除方法。将目的基因的序列用敲除片段(组成由质粒pkd4上的卡那霉素抗性基因序列和带有目的基因的短同源臂,核苷酸序列如seqidno:1所示)进行替换,从而实现基因敲除的目的。原理示意图见图1。以质粒pkd4模板,设计敲除片段引物,pcr技术扩增带有短同源臂的kan抗性的敲除片段,pcr扩增体系见表4。snapgene软件设计敲除片段引物,引物由苏州金唯智公司合成,引物核苷酸序列如下所示。引物fimh-kan-f:gattagcatcacctatacctacagctgaacccgaagagatgattgtaatggtgtaggctggagctgcttc引物fimh-kan-r:taccagcattagcaatgtcctgtgatttctttattgataaacaaaagtcagccatggtccatatgaatatcctcc。表4敲除片段pcr扩增体系组分体积(μl)生产厂家10×pcrbuffer25μltoyobo公司dntp(150mm)10μltoyobo公司引物fimh-kan-f1.5μl金唯智公司引物fimh—kan-r1.5μl金唯智公司模板(基因组)1.0μlaxygen基因组提取试剂盒kod酶1.0μltoyobo公司无菌水10μl分装成每管25μl。pcr条件:1)变性98℃,2min;2)退火48-56℃,30s;延伸68℃,30s,共35个循环;3)完全延伸68℃,10min。pcr产物经axygen胶回收试剂盒纯化后,用于后续转化实验。4、敲除片段的转化与转化子的筛选:将上述步骤纯化后的敲除片段加入到大肠杆菌cibts1688-pkd46的感受态中,轻微混匀,于冰上放置15min,转入电转杯,电转的条件为25μf、200ω、2.5kv,电转完成后立即加入900ml的lb液体培养基180rpm,37℃培养2h,取500μl涂布于lb抗性平板(50μg/ml卡那霉素)37℃过夜培养,直至长出单菌落。挑取单菌落,进行菌落pcr及测序,fimh基因序列如seqidno:2所示,最终得到目的菌株cibts1688-δfimh。实施例3全基因转录组分析原始菌cibts1688、敲除菌株cibts1688-δfimh和过表达菌株cibts1688-fimh*1、活化:将cibts1688、cibts1688-δfimh和cibts1688-fimh*从-80℃冰箱取出,试管中准备5mllb培养基,接种量30μl,于37℃摇床中培养12h,转速200rpm。2、发酵:将cibts1688、cibts1688-δfimh和cibts1688-fimh*转接于发酵培养基中分别37℃发酵30h后,取其发酵液2ml放入2ml的离心管中,迅速放入提前开机设置至4℃的离心机中12000rpm离心2min,弃上清液,立即将此离心管置于液氮中急速冷冻3min,取出后置于-80℃冰箱待用。每组样品准备三个平行。3、转录组分析实验由武汉菲沙基因信息有限公司进行,参考基因组为大肠杆菌e.colimg1655。具体分析流程见图2。4、数据分析:对不同菌株样本的转录本rpkm(readsperkilobasetranscriptomepermillionmappedreads)密度分布进行比较能从整体上检查不同样本之间的rpkm分布的情况。基因差异表达分析是以阈值为fdr(falsediscoveryrate)≤0.05,每个基因的logfc(foldchange(condition2/condition1)的绝对值>2的标准来确定为差异表达基因。最后,对go和keggpathway进行富集分析,确定氨基酸及有机酸代谢途径的差异变化。对原始大肠杆菌cibts1688和过表达fimh基因大肠杆菌cibts1688-fimh*进行全基因转录组分析,得出的分析数据由热图软件绘制。参与生物膜生物合成相关关键差异基因的表达量显示了这两株菌之间的显著差异,其中因为fimh基因的过表从而影响的其他基因可以分为6个不同的簇,如图3所示,分别为ⅰ型菌毛的黏附素的分泌、鞭毛的组装、curli菌毛的生物合成、糖原的合成和基于ai-2信号分子的群体感应。黏附素的分泌可以更有利于微生物细胞黏附至非生物的表面;鞭毛的组装和curli菌毛的合成促使大肠杆菌菌毛变多;糖原作为生物膜的重要成分,其生物合成也十分重要;当细菌细胞密度达到阈值时,群体感应信号分子ai-2可以激活相关转录因子促进生物膜的形成。参与这些过程的基因在大肠杆菌cibts1688-fimh*中相较于原始菌均有不同程度的上调。综上,过表达fimh基因可以触发了生物膜相关关键基因的调节,从而增强大肠杆菌cibts1688-fimh*生物膜的形成,使其在微生物生产氨基酸的过程中固定化效果增强。实施例4对cibts1688、cibts1688-δfimh和cibts1688-fimh*进行全基因转录组分析,得出的分析数据由热图软件绘制。参与苏氨酸生物合成相关关键差异基因的表达量显示了这两株菌之间的显著差异,如图4所示。经过转录组富集和kegg途径分析,在过表达fimh基因的菌株中,草酰乙酸至天冬氨酸,天冬氨酸至苏氨酸的合成途径中关键基因如aspc、thra、thrb、thrc、lysc和asd等都呈现出上调。实施例51)活化:将cibts1688、cibts1688-δfimh和cibts1688-fimh*从-80℃冰箱取出,试管中准备5mllb培养基,接种量30μl,于37℃摇床中培养12h,转速200rpm。2)发酵:将培养基分装于500ml摇瓶,装液量100ml,接种量5%,摇床转速200rpm,培养温度37℃。糖耗尽即结束发酵,取样检测产物浓度。转录组数据显示,aspc基因编码的天冬氨酸转氨酶相较于原始菌的基因表达上调了1.8倍,该酶可催化草酰乙酸生成l-天冬氨酸,天冬氨酸产量经液相检测得到提高,对比见表5。发酵培养基:发酵培养基:葡萄糖30g/l,酵母粉5g/l,无水磷酸二氢钾2g/l,硫酸铵20g/l,氯化钠0.8g/l,七水合硫酸铁0.2g/l,五水合硫酸锰0.2g/l,七水合硫酸镁0.8g/l,维生素b1200μg/l,碳酸钙15g/l。表5cibts1688、cibts1688-δfimh和cibts1688-fimh*天冬氨酸产量及转录组基因表达量对比实施例6活化和发酵条件同实施例5,糖耗尽即结束发酵,取样检测产物浓度。转录组数据显示,alaa基因编码的谷氨酸丙酮酸转氨酶相较于原始菌的基因表达上调了1.6倍,该酶可催化2-酮戊二酸生成l-谷氨酸,谷氨酸产量经液相检测得到提高,对比见表6。表6cibts1688、cibts1688-δfimh和cibts1688-fimh*谷氨酸产量及转录组基因表达量对比实施例7活化和发酵条件同实施例5,糖耗尽即结束发酵,取样检测产物浓度。转录组数据显示,argf和argi基因编码的鸟氨酸酰甲基转移酶,argh基因编码的精氨琥珀酸裂解酶相较于原始菌的基因表达分别上调了2.5倍、1.0倍和0.6倍,这些酶可催化生成l-精氨酸,最终精氨酸产量经液相检测得到提高,对比见表7。表7cibts1688、cibts1688-δfimh和cibts1688-fimh*精氨酸产量及转录组基因表达量对比序列表<110>南京工业大学<120>一种过表达fimh基因的重组大肠杆菌在发酵生产氨基酸中的应用<160>2<170>siposequencelisting1.0<210>1<211>1572<212>dna<213>人工序列(artificialsequence)<400>1gattagcatcacctatacctacagctgaacccgaagagatgattgtaatggtgtaggctg60gagctgcttcgaagttcctatactttctagagaataggaacttcggaataggaacttcaa120gatcccctcacgctgccgcaagcactcagggcgcaagggctgctaaaggaagcggaacac180gtagaaagccagtccgcagaaacggtgctgaccccggatgaatgtcagctactgggctat240ctggacaagggaaaacgcaagcgcaaagagaaagcaggtagcttgcagtgggcttacatg300gcgatagctagactgggcggttttatggacagcaagcgaaccggaattgccagctggggc360gccctctggtaaggttgggaagccctgcaaagtaaactggatggctttcttgccgccaag420gatctgatggcgcaggggatcaagatctgatcaagagacaggatgaggatcgtttcgcat480gattgaacaagatggattgcacgcaggttctccggccgcttgggtggagaggctattcgg540ctatgactgggcacaacagacaatcggctgctctgatgccgccgtgttccggctgtcagc600gcaggggcgcccggttctttttgtcaagaccgacctgtccggtgccctgaatgaactgca660ggacgaggcagcgcggctatcgtggctggccacgacgggcgttccttgcgcagctgtgct720cgacgttgtcactgaagcgggaagggactggctgctattgggcgaagtgccggggcagga780tctcctgtcatctcaccttgctcctgccgagaaagtatccatcatggctgatgcaatgcg840gcggctgcatacgcttgatccggctacctgcccattcgaccaccaagcgaaacatcgcat900cgagcgagcacgtactcggatggaagccggtcttgtcgatcaggatgatctggacgaaga960gcatcaggggctcgcgccagccgaactgttcgccaggctcaaggcgcgcatgcccgacgg1020cgaggatctcgtcgtgacccatggcgatgcctgcttgccgaatatcatggtggaaaatgg1080ccgcttttctggattcatcgactgtggccggctgggtgtggcggaccgctatcaggacat1140agcgttggctacccgtgatattgctgaagagcttggcggcgaatgggctgaccgcttcct1200cgtgctttacggtatcgccgctcccgattcgcagcgcatcgccttctatcgccttcttga1260cgagttcttctgagcgggactctggggttcgaaatgaccgaccaagcgacgcccaacctg1320ccatcacgagatttcgattccaccgccgccttctatgaaaggttgggcttcggaatcgtt1380ttccgggacgccggctggatgatcctccagcgcggggatctcatgctggagttcttcgcc1440caccccagcttcaaaagcgctctgaagttcctatactttctagagaataggaacttctac1500cagcattagcaatgtcctgtgatttctttattgataaacaaaagtcagccatggtccata1560tgaatatcctcc1572<210>2<211>903<212>dna<213>大肠杆菌(escherichiacoli)<400>2atgaaacgagttattaccctgtttgctgtactgctgatgggctggtcggtaaatgcctgg60tcattcgcctgtaaaaccgccaatggtaccgctatccctattggcggtggcagcgccaat120gtttatgtaaaccttgcgcccgtcgtgaatgtggggcaaaacctggtcgtggatctttcg180acgcaaatcttttgccataacgattatccggaaaccattacagactatgtcacactgcaa240cgaggctcggcttatggcggcgtgttatctaatttttccgggaccgtaaaatatagtggc300agtagctatccatttcctaccaccagcgaaacgccgcgcgttgtttataattcgagaacg360gataagccgtggccggtggcgctttatttgacgcctgtgagcagtgcgggcggggtggcg420attaaagctggctcattaattgccgtgcttattttgcgacagaccaacaactataacagc480gatgatttccagtttgtgtggaatatttacgccaataatgatgtggtggtgcctactggc540ggctgcgatgtttctgctcgtgatgtcaccgttactctgccggactaccctggttcagtg600ccaattcctcttaccgtttattgtgcgaaaagccaaaacctggggtattacctctccggc660acaaccgcagatgcgggcaactcgattttcaccaataccgcgtcgttttcacctgcacag720ggcgtcggcgtacagttgacgcgcaacggtacgattattccagcgaataacacggtatcg780ttaggagcagtagggacttcggcggtgagtctgggattaacggcaaattatgcacgtacc840ggagggcaggtgactgcagggaatgtgcaatcgattattggcgtgacttttgtttatcaa900taa903当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1