一种催化合成阿扎那韦中间体的方法及其应用与流程
本发明涉及医药领域,具体涉及一种催化合成阿扎那韦中间体的方法及其应用。
背景技术:
硫酸阿扎那韦(cas:198904-31-3)是目前世界上主要的抗艾滋病药物,由美国百时美施贵宝公司研制开发,2003年6月首次在美国上市,主要与其他抗逆转录病毒药物联用治疗hiv病毒感染。由于它具有每日仅服用1次,比其他抗hiv病毒感染药物吸收迅速、不良反应少等优势,而且与其它蛋白酶抑制剂相比,阿扎那韦在服药期间不干扰正常的饮食。2003年fda批准上市后,2009年该药全球销售额为52亿美元,排名第70位。随着全球范围内病毒疫情的频繁爆发以及艾滋病防控工作的深入,人们对抗病毒药物的需求不断加大。可以预见的是,该类药物的销售额和排名还会进一步上升。
其合成路线中关键中间体(3s)-3-(叔丁氧羰基)氨基-1-氯-4-苯基-(2r)-丁醇(b)的手性中心有两个,其中之一来自天然苯丙氨酸,而另一个手性中心的合成一直较为困难。针对这一困难,酶法合成该关键中间体表现出显著优势。
然而现有的生物合成阿扎那韦中间体的方法中,存在反应条件要求高、羰基还原酶不能重复利用、反应效率低等问题。
技术实现要素:
本发明所要解决的技术问题是克服现有技术的不足,提供一种稳定性好,重复利用次数多,产物累积浓度高的载体固定化酶,并提供应用该固定化酶制备阿扎那韦中间体的方法。
具体的,本发明的技术方案如下:
本发明一方面公开了一种催化合成阿扎那韦中间体的方法,以(s)-叔丁基(4-氯-3-羰基-1-苯丁基-2-基)氨基甲酸酯为底物,以羰基还原酶nasdr和辅酶为催化剂,在共底物、助溶剂和缓冲液存在的体系中催化合成叔丁基((2s,3r)-4-氯-3-羟基-1-苯丁基-2-基)氨基甲酸酯;所述羰基还原酶固定化于树脂上。
优选的,所述方法包括以下步骤:
s1:将羰基还原酶固定化于树脂上;
s2:将底物(s)-叔丁基(4-氯-3-羰基-1-苯丁基-2-基)氨基甲酸酯、共底物、共固定化酶体系、助溶剂和缓冲液加入到反应器中,反应ph值为8.0-11.0,反应温度为25-30℃,反应3-6小时后即得到叔丁基((2s,3r)-4-氯-3-羟基-1-苯丁基-2-基)氨基甲酸酯。
应该理解,本发明不限于上述步骤,还可以包含其他的步骤,例如在步骤s1之前、步骤s1和s2之间、步骤s2之后,还包含其他额外的步骤,而不超出本发明的保护范围。
更优选的,步骤s1包括:
s11:将树脂在tea缓冲液中浸泡1-2h,接着加入交联剂戊二醛后放置于摇床上,抽滤得到活化的树脂;
s12:将羰基还原酶与活化的树脂混合后摇床上放置10-15h。
应该理解,本发明不限于上述步骤,还可以包含其他的步骤,例如在步骤s11之前、步骤s11和s12之间、步骤s12之后,还包含其他额外的步骤,而不超出本发明的保护范围。
进一步的,在s11中,所述tea缓冲液的ph值为10.5,所述戊二醛的体积分数为1.25%。
进一步的,在s11中,摇床上反应时间为12h,摇床反应温度为30℃。
优选的,所述共底物为异丙醇,所述辅酶为nad/nadh。
更优选的,所述异丙醇和所述底物的质量比为四分之一至三分之一之间。
优选的,所述树脂为seplitelx-1000ha、lkz128或seplitelx-1000nh。
更优选的,所述树脂为seplitelx-1000nh。
本发明第二个方面公开了上述的方法得到的叔丁基((2s,3r)-4-氯-3-羟基-1-苯丁基-2-基)氨基甲酸酯。
本发明第三个方面公开了上述的方法在制备抗艾滋病药物中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,而不超出本发明的构思与保护范围。
本发明相对于现有技术具有如下的显著优点及效果:
本发明与已公开的酶催化制备方法相比,具有更温和的反应温度,更简单反应体系。本发明采用异丙醇作为共底物参与辅酶循环,反应过程中不产生葡萄糖酸副产物,因此不需要对反应进程进行ph控制,反应体系更加简单,也更便于下游的分离纯化。此外,本发明公开了一种稳定性好的树脂载体固定化方法,增加了该酶的温度稳定性和ph稳定性,得到的固定化的羰基还原酶具有可重复利用、产物累积浓度高等优点,有助于降低能耗,节约成本,通过重复利用极大地增加了产物的累积浓度,1l反应体积中投入250g固定化酶,重复使用8批次,共累积产物800g。
附图说明
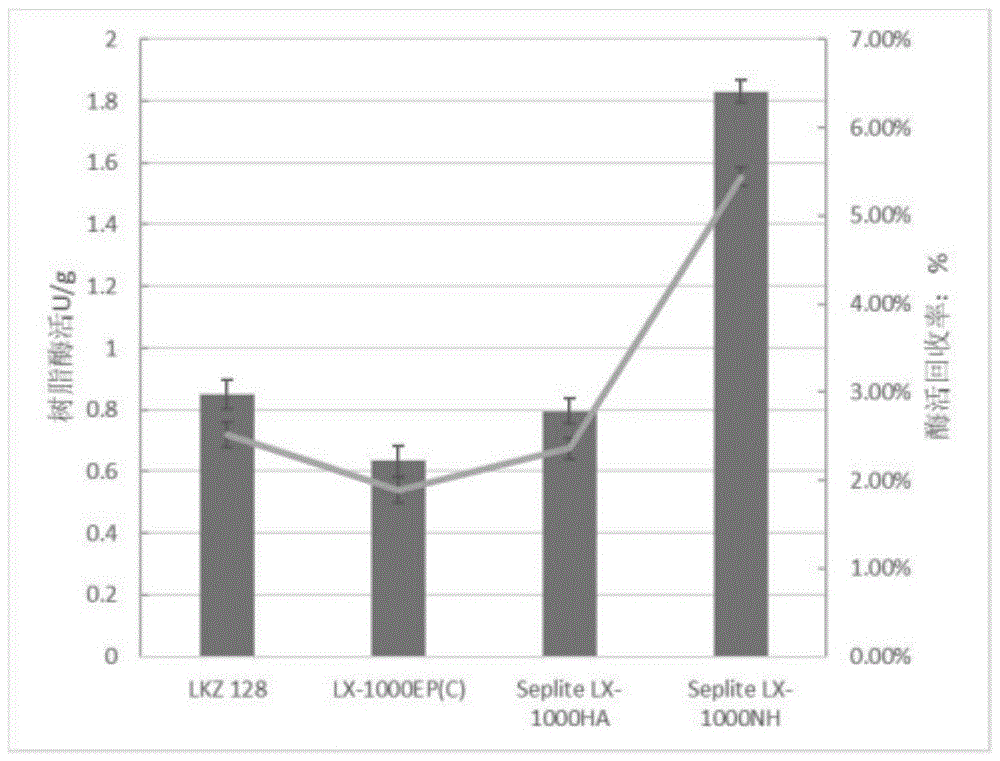
图1为本发明实施例中不同树脂的酶活和酶活回收率示意图,图中:柱形图为不同树脂的酶活,折线图为不同树脂的酶活回收率;
图2为本发明实施例中不同体积分数的戊二醛对树脂交联蛋白活力影响的示意图;
图3为本发明实施例中不同交联时间对树脂交联蛋白活力影响的示意图;
图4为本发明实施例中不同交联温度对树脂交联蛋白活力影响的示意图;
图5为本发明实施例中不同ph值对树脂交联蛋白活力影响的示意图;
图6为本发明实施例中不同粗酶液加入量对固定化酶活力影响的示意图。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行详细描述,但并不因此将本发明限制在所述的实施例范围之中。
下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明所用试剂和原料均市售可得。
实施例1
本实施例公开了一种催化合成阿扎那韦中间体的方法,以(s)-叔丁基(4-氯-3-羰基-1-苯丁基-2-基)氨基甲酸酯为底物,以羰基还原酶nasdr和辅酶为催化剂,在共底物、助溶剂和缓冲液存在的体系中催化合成叔丁基((2s,3r)-4-氯-3-羟基-1-苯丁基-2-基)氨基甲酸酯;所述羰基还原酶固定化于树脂上。
具体包括以下步骤:
s1:将羰基还原酶固定化于树脂上;
s2:将底物(s)-叔丁基(4-氯-3-羰基-1-苯丁基-2-基)氨基甲酸酯、共底物、共固定化酶体系、助溶剂和缓冲液加入到反应器中,反应ph值为8.0-11.0,反应温度为25-30℃,反应3-6小时后即得到叔丁基((2s,3r)-4-氯-3-羟基-1-苯丁基-2-基)氨基甲酸酯。
步骤s1包括:
s11:将树脂在tea缓冲液中浸泡1-2h,接着加入交联剂戊二醛后放置于摇床上,抽滤得到活化的树脂;
s12:将羰基还原酶与活化的树脂混合后摇床上放置10-15h。
在s11中,所述tea缓冲液的ph值为10.5,所述戊二醛的体积分数为1.25%。
在s11中,摇床上反应时间为12h,摇床反应温度为30℃。
所述共底物为异丙醇,所述辅酶为nad/nadh。
所述异丙醇和所述底物的质量比为四分之一至三分之一之间。
所述树脂为seplitelx-1000nh。
实施例2
本实施例公开了一种制备羰基还原酶nasdr的粗酶液的方法,具体包括以下步骤:
一、活化e.coli-nasdr菌
在含有卡那霉素(50μg/ml)的lb固体平板上用分区划线法或稀释法涂布菌液。经37℃、20小时培养,得到活化后的e.coli-nasdr的单菌落。
二、发酵培养e.coli-nasdr菌
(1)将e.coli-nasdr菌单菌落接种至5ml一级种子培养基中,在37℃,220rpm的条件下培养11小时,od600达到0.9-1.2,即为一级种子液。
(2)将5ml一级种子液接种至发酵培养基中(接种量2.5%),在37℃,220rpm的条件下培养2-3小时。待发酵培养基od600达到0.9-1.2,加入400μliptg(异丙基硫代半乳糖苷,浓度为100mmol/l)溶液诱导表达。在25℃,220rpm条件下诱导表达8小时左右即完成表达得到发酵液,终浓度od600约达到3.0-4.0。
三、制备粗酶液
离心发酵液5min,用生理盐水重悬菌体,洗涤一次后,使用ph9.0的0.1m三乙醇胺缓冲液重悬浮菌体,将400ml发酵液浓缩至30ml,在冰水浴中经600w功率的超声破碎仪处理20min即得到羰基还原酶nasdr的粗酶液。
实施例3
本实施例公开了一种树脂的预处理方法,具体步骤如下:
将1g的树脂在ph10.5的tea缓冲液中浸泡1h,去除上清和漂浮的杂质,向树脂加入500ul的25%戊二醛,加入tea缓冲液至终体积为10ml,使戊二醛的体积分数为1.25%。在30℃的条件下,230转摇床上放置4小时,之后用滤纸抽滤得到活化的树脂,将活化的树脂用tea缓冲液冲洗三遍以洗去戊二醛,抽干备用。
实施例4
本实施例对树脂的种类进行优化筛选,所述树脂包括seplitelx-1000ha、lkz128、seplitelx-1000nh和lx-1000ep(c),具体技术方案如下:
将2ml羰基还原酶nasdr的粗酶液分与上述四种树脂混合(所述树脂均为1g),定容至10ml,在30℃条件下,230r/min摇床中放置12h。用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干。比较各树脂的酶活回收率及单位酶活。结果显示seplitelx-1000nh的活力最好(如图1所示)。
本实施例中的酶活测定方法如下:
(1)游离羰基还原酶活性测定方法:于96孔板中加入150ultea缓冲液、20ul异丙醇、20ulnad+(10mmol/l),测340nm处吸光度为起始点。接着于96孔板中加入150ultea缓冲液、20ul异丙醇、20ulnad+(10mmol/l),加入10ul稀释2倍后的粗酶液在30℃条件下220r/min振荡反应1min,立即于酶标仪中测定吸光度。
(2)固定化酶活测定方法:取树脂0.05g,加入0.8mltea缓冲液,0.1ml异丙醇,0.1ml的nad+(10mmol/l)后立即离心,在340nm处测定吸光度作为起始点。取固定化后的树脂0.05g,加入0.8mltea缓冲液,0.1ml异丙醇,0.1ml的nad+(10mmol/l),在30℃条件下,220r/min振荡反应1min,10000转离心30s后在酶标仪上测定340nm处吸光度,测定1min内吸光度的变化。一个酶活单位u定义为:1分钟内产生1μmolnadh所需要的酶量。
实施例5
本实施例对戊二醛的浓度进行优化筛选,具体技术方案如下:
本实验一共分为六组,将1g的树脂在ph10.5的tea缓冲液中浸泡1h,去上清和漂浮的杂质,剩余的树脂加入戊二醛,六组中加入25%的戊二醛,所述戊二醛的体积分别为125ul、250ul、500ul、1ml、1.5ml和2ml,加入tea缓冲液至终体积为10ml,最终戊二醛的体积分数分别为0.3125%、0.625%、1.25%、2.5%、3.75%和5%。在30℃的条件下,230转/min的摇床上放置4小时,之后用滤纸抽滤得到活化的树脂并用tea缓冲液洗三遍洗去戊二醛,抽干备用。
将2ml羰基还原酶nasdr的粗酶液与1g上述树脂混合,定容至10ml,在30℃,230r/min摇床中放置12h,之后用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干,测定活力回收率与固定化酶单位酶活。如图2所示,戊二醛的体积分数为1.25%时,树脂酶活值最高且酶活回收率最高,因此1.25%为戊二醛的最佳体积分数。
实施例6
本实施例对最适交联时间进行优化筛选,具体技术方案如下:
将1g的树脂在ph10.5的tea缓冲液中浸泡1h,去上清和漂浮的杂质,剩余的树脂加入500ul的25%戊二醛,加入tea缓冲液至终体积为10ml,在戊二醛的体积分数为1.25%下,30℃的条件下,在230转/min摇床上放置4小时,之后用滤纸抽滤得到活化的树脂,并用tea缓冲液洗三遍洗去戊二醛,抽干备用。
将2ml羰基还原酶nasdr的粗酶液与1g上述树脂混合,定容至10ml,在30℃,230r/min摇床中分别放置3、9、12、15、18、21和24h,之后用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干,测定活力回收率与固定化酶单位酶活。结果如图3所示,从图3可以得出,最适交联时间为12h。
实施例7
本实施例对最适交联温度进行优化筛选,具体技术方案如下:
将1g的树脂在ph10.5的tea缓冲液中浸泡1h,去上清和漂浮的杂质,剩余的树脂加入500ul的25%戊二醛,加入tea缓冲液至终体积为10ml,在戊二醛的体积分数为1.25%下,在30℃,230转/min的摇床上放置4小时,之后用滤纸抽滤得到活化的树脂并用tea缓冲液洗三遍洗去戊二醛,抽干备用。
将2ml羰基还原酶nasdr的粗酶液与1g上述树脂混合,定容至10ml,分别在25、30、35、40、45℃条件下,230r/min摇床中放置12h,之后用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干,测定活力回收率与固定化酶单位酶活。结果如图4所示,从图4可以得出,最适交联温度为30℃。
实施例8
本实施例对最适交联ph值进行优化筛选,具体技术方案如下:
将1g的树脂分别在ph值为7.5、8.5、9.5、10.5、12和13的tea缓冲液中浸泡1h,去除上清和漂浮的杂质,向树脂加入500ul的25%戊二醛,加入tea缓冲液至终体积为10ml,使戊二醛的体积分数为1.25%。在30℃的条件下,
230转摇床上放置4小时,之后用滤纸抽滤得到活化的树脂,将活化的树脂用tea缓冲液冲洗三遍以洗去戊二醛,抽干备用。
将2ml羰基还原酶nasdr的粗酶液分别与1g上述树脂混合,定容至10ml,在30℃,230r/min摇床中放置12h,之后用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干,测定活力回收率与固定化酶单位酶活。结果如图5所示,从图5可以得出,最适交联ph值为10.5。
实施例8
本实施例对羰基还原酶nasdr的粗酶液和树脂的比例进行优化筛选,具体技术方案如下:
将1g的树脂分别在ph值为10.5的tea缓冲液中浸泡1h,去除上清和漂浮的杂质,向树脂加入500ul的25%戊二醛,加入tea缓冲液至终体积为10ml,使戊二醛的体积分数为1.25%。在30℃的条件下,230转摇床上放置4小时,之后用滤纸抽滤得到活化的树脂,将活化的树脂用tea缓冲液冲洗三遍以洗去戊二醛,抽干备用。
分别将0.5、1、2、3、4和5ml羰基还原酶nasdr的粗酶液与1g上述树脂混合,定容至10ml,在30℃,230r/min摇床中放置12h,之后用滤纸抽滤得到固定化后的树脂并用tea缓冲液洗三遍洗去未固定化的蛋白,抽干,测定活力回收率与固定化酶单位酶活。结果如图6所示,从图6可以得出,粗酶液最适体积为2ml。
实施例9
本实施例研究固定化酶催化100g底物转化重复利用情况,具体如下:
取500g固定化后的树脂,与100g底物、530ml甲苯、30ml异丙醇、40ml10mmol/l的nad和400mltea-hcl缓冲液混合。在35℃,230转/min的摇床反应5小时,4000转/min离心取出上层液体,用hplc的方法检测转化率。沉淀的固定化酶继续用以上反应体系进行反应,如此重复循环利用八次,比较转化率。结果发现,经过8次复用,第八次转化率仍然超过80%。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种丙辛吲哚盐酸盐药物中间体丙辛吲哚的合成方法与制造工艺
- 一种吲哚洛尔药物中间体(一)‑4‑(2‑羟基‑3‑异丙氨基丙氧)吲哚的合成方法与制造工艺
- 依替米贝的中间体及其合成方法与依替米贝的合成方法与制造工艺
- 一种白消安药物中间体1,4‑双甲基磺酸丁二酯的合成方法与制造工艺
- 一种塞利洛尔药物中间体3‑(4‑乙氧基苯基)‑1,1‑二乙基脲的合成方法与制造工艺
- 一种羟基保泰松药物中间体4‑羟基偶氮苯的合成方法与制造工艺
- 一种甲氧卡那霉素药物中间体γ‑氨基‑α‑羟基丁酸的合成方法与制造工艺
- 一种非那西丁药物中间体对硝基苯乙醚的合成方法与制造工艺
- 一种间尼索地平药物中间体乙酰乙酸异丁酯的合成方法与制造工艺
- 一种甲氧苄啶药物中间体3,4,5—三甲氧基苯甲酸甲酯的合成方法与制造工艺