融合多肽及在制备抗抑郁、神经退行性疾病药物中的应用的制作方法
本公开属于生物技术领域,具体涉及一种干扰PDCD4与eIF4A结合的多肽及融合多肽9R-eIF4A-VI作为抗抑郁、及抗神经退行性疾病药物的应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本公开的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
抑郁症是以情绪低落为主要症状的一类精神障碍性疾病。重度患者甚至出现自杀行为,严重威胁人类健康。大量临床研究证据表明小胶质细胞过度活化导致突触可塑性是抑郁症产生的病理学基础,脑源性神经营养因子(BDNF)能够有效调控突触可塑性,修复受损神经元,加强突触间信号传递,缓解抑郁症的病程。找到调控BDNF表达的靶基因对抑郁症的治疗有重要的意义。细胞程序性死亡基因4(programmed cell death 4,PDCD4)是近年来新发现的一种与细胞凋亡相关的基因,是一种新的抑癌基因,随着研究的深入发明人发现PDCD4在多种炎性疾病中发挥重要作用。发明人的前期实验结果表明PDCD4(-/-)小鼠可以有效抵抗慢性应激导致的抑郁症的发生。
Sojima等人从人胶质瘤细胞的cDNA文库中分离出人的PDCD4基因,其研究表明在PDCD4的氨基侧有两个α螺旋结构区域-MA3,分别为164~275区和329~440区。PDCD4通过该功能域与真核细胞翻译起始因子(eukaryotic translation initiation factor 4A,isoform 2,eIF4A)发生结合,从而抑制核糖体复合物的形成和蛋白质的合成。体内实验证实WT慢性应激小鼠模型中,PDCD4在海马区高表达而BDNF表达量明显降低。进一步的研究表明,长期的慢性应激导致PDCD4的磷酸化降解途径被抑制,过多的PDCD4通过与eIF4A结合从而抑制BDNF翻译的起始进而抑制其表达。因此,PDCD4的高表达意味着BDNF含量降低,与此同时,受损神经元难以被及时修复,突触传递效果受阻,加重患者抑郁病情。
多肽作为药物应用较为广泛,具有生理活性强、免疫原性低、疗效高等诸多优点。但众所周知,多肽类药物由于自身的特点,存在诸多缺点,如口服利用率低、酶解性高及半衰期极短等,使其作为药物开发收到诸多限制。
技术实现要素:
针对上述研究情况,发明人认为找到eIF4A与PDCD4结合位点,设计干扰内源PDCD4与eIF4A结合的干扰肽,可以缓解PDCD4对BDNF的抑制作用,同时促进BDNF的表达,是一种治疗抑郁症的新的治疗思路。发明人在上述研究思路的指导下进行了相关研究,对eIF4A与PDCD4结合的结构域进行了筛选,通过免疫共沉淀和免疫印迹验证了本公开筛选的多肽可以在体外高效干扰PDCD4与eIF4A的结合,并促进IIc-BDNF的表达,改善抑郁症状。通过原代神经元细胞及抑郁细胞模型试验表明,该多肽具有良好的稳定性及跨膜效率,可在神经元细胞内保留24h以上,相比传统的多肽药物具有显著优势。
为了实现以上技术目的,本公开提供以下技术方案:
本公开第一方面,提供如SEQ ID NO:4所示氨基酸序列的多肽作为PDCD4与eIF4A结合抑制剂的应用。
所述如SEQ ID NO:4所示氨基酸序列为eIF4A全长序列中一段长度为12个氨基酸的结构域,即eIF4A-VI。经本公开筛选表明,相比其他PDCD4与eIF4A结合的结构域,上述氨基酸序列的多肽能够显著干扰PDCD4与eIF4A的结合,并且促进BDNF的表达,可以作为PDCD4与eIF4A结合抑制剂及神经元细胞修复物质进行应用。
本公开第二方面,提供一种融合多肽,所述融合多肽主要由9R跨膜序列及SEQ ID NO:4所示氨基酸序列连接而成。
本公开提供的融合多肽采用如SEQ ID NO:5所示9R跨膜序列。
优选的,上述融合多肽中,N段为9R跨膜序列,C段为SEQ ID NO:4所示氨基酸序列。
优选的,所述融合多肽具有SEQ ID NO:6所示氨基酸序列,或所述融合多肽为SEQ ID NO:6所示氨基酸序列经取代、缺失和/或增加一个或几个氨基酸衍生的并具有相同功能的多肽。
本公开第三方面,提供编码第二方面所述融合多肽的核苷酸序列,所述核苷酸序列包括由于密码子简并性翻译得到相同氨基酸序列的核苷酸序列。
本公开第四方面,提供SEQ ID NO:4所示氨基酸序列的多肽、第二方面所述融合多肽和/或第三方面所述核苷酸序列在制备抗抑郁药物或治疗神经退行性疾病药物中的应用。
优选的,所述SEQ ID NO:4所示氨基酸序列的多肽或融合多肽作为BDNF激动剂。
进一步优选的,所述SEQ ID NO:4所示氨基酸序列的多肽或融合多肽作为IIc-BDNF激动剂。
本公开第五方面,提供一种抗抑郁药物,该抗抑郁药物包括SEQ ID NO:4所示氨基酸序列的多肽或第二方面所述融合多肽。
优选的,上述抗抑郁药物中,所述融合多肽的浓度为12.5nM以上;进一步优选的,浓度为12.5~50nM。
优选的,所述抗抑郁药物还包括药学上可接受的载体、赋形剂或佐剂。
本公开的有益效果:
1.本公开通过筛选得到了若干eIF4A与PDCD4紧密结合的结构域,发明人计划对eIF4A与PDCD4结合进行干扰从而促进BDNF的表达。对筛选得到的结合位点设计相应的干扰序列,并对所述序列的干扰效果进行检测后筛选得到了如SEQ ID NO:6所示的氨基酸序列,即eIF4A-VI,该序列的多肽能够在体外干扰PDCD4与eIF4A的结合并且可以促进IIc-BDNF的表达。
2.通过免疫印记实验验证,9R-eIF4A-VI浓度达到12.5nM以上时,当游离的PDCD4及IIc-BDNF的含量表达升高,且呈现浓度依赖性,证明该融合多肽可作为药物用于治疗抑郁症状,并且可以通过调整融合多肽的用量实现对治疗效果的调整。
3.本公开还通过免疫荧光方法检测了9R-eIF4A-VI的跨膜效率及稳定性,荧光检测结果表明9R-eIF4A-VI与PDCD4存在明显的共定位情况,证明9R-eIF4A-VI干扰结果良好。并且,相比传统的多肽药物往往伴随利用率低、易降解等问题,9R-eIF4A-VI稳定性良好,可在神经元细胞内保留24h以上,且具有良好的跨膜效率。
4.通过对9R-eIF4A-VI干扰作用机制进行研究,证明该融合多肽对PDCD4的降解诱导作用主要通过溶酶体途径进行,进一步明确了该融合多肽作为药物使用的机制。并且,经本公开研究表明,该融合多肽对原代神经元细胞中IL-10和IL-6的表达无影响,不会引发炎症反应,使用安全。
5.BDNF作为一种脑源性神经营养因子与突触传递、修复受损神经元细胞等多项生理活动相关。本公开提供了eIF4A-VI及9R-eIF4A-VI在干扰PDCD4与eIF4A结合、提高BDNF表达方面的作用,该多肽同样有望应用于神经退行性疾病的治疗,包括阿尔兹海默症、帕金森病、亨廷顿病、肌萎缩性侧索硬化、脊髓小脑共济失调等。
附图说明
构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
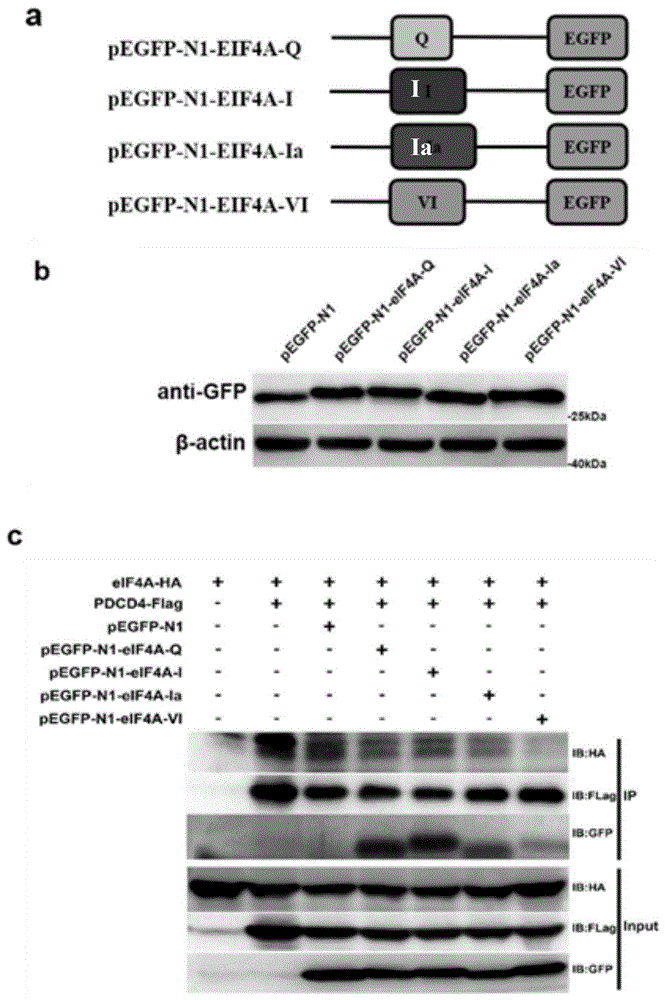
图1为实施例1中对结构域多肽筛选结果图;
其中,图1a为实施例1中筛选后制备的四种融合多肽;
图1b为四种融合多肽与GFP表达为融合蛋白;
图1c为四种融合多肽干扰PDCD4与eIF4A体外结合的条带图;
图1d为四种融合蛋白诱导BDNF表达的条带图。
图2为实施例2中筛选得到融合多肽9R-eIF4A-VI生物活性检测结果图;
其中,图2a为筛选得到融合多肽及对照肽;
图2b为融合多肽上调BDNF表达的条带图;
图2c为融合多肽及对照肽对BDNF的作用条带图;
对照肽序列中对BDNF的诱导作用消失,表明该融合多肽具有特异性;
图2d为不同浓度融合多肽对BDNF表达的诱导作用条带图;
表明融合多肽对BDNF的诱导具有明显的浓度依赖性;
图2e为免疫荧光方式检测融合多肽的跨膜效率及细胞内的稳定性荧光图;
表明该融合多肽在1h内就可以跨过细胞膜进入胞浆,并且可以在细胞内稳定存在24h;
图2f为免疫共沉淀实验检测融合多肽干扰PDCD4与eIF4A的结合的条带图;
图2g为双荧光分子互补实验证明融合多肽干扰PDCD4与eIF4A的结合条带图;
图2h为免疫荧光实验证明融合多肽干扰PDCD4与eIF4A结合的荧光图。
图3为实施例3中9R-eIF4A-VI在神经元细胞中的跨膜效率及稳定性考察结果图;
其中,图3a为融合多肽在小鼠的原代海马神经元中跨膜效率及稳定性荧光图;
图3b为免疫荧光检测小鼠原代神经元细胞中融合多肽和PDCD4荧光图;
图3c为融合多肽上调原代神经元和小胶质细胞中BDNF表达的条带图;
图3d为ELISA检测细胞上清中BDNF、IL-10、IL-6的表达结果图。
图4为实施例4中9R-eIF4A-VI对神经元细胞抑郁模型效果图;
其中,图4a为雷帕霉素上调PDCD4的表达原理图;
图4b为雷帕霉素上调PDCD4的表达从而抑制BDNF、构建细胞抑郁模型条带图;
图4c为融合多肽缓解雷帕霉素对BDNF表达的抑制作用条带图。
图5为实施例5中9R-eIF4A-VI降解机制的研究结果图。
其中,图5a为融合多肽抑制SHSY5Y细胞中PDCD4的表达条带图;
图5b为融合多肽对PDCD4中mRNA表达的影响结果图;
图5c为融合多肽不会引起miRNA-21表达上调结果直方图;
图5d为融合多肽对PDCD4促降解作用不通过蛋白酶体途径进行;
图5e为融合多肽对PDCD4促降解作用主要通过溶酶体途径进行;
图5f为小鼠原代神经元中融合多肽抑制PDCD4表达的条带图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本公开提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,现有技术中公开,PDCD4通过氨基侧有两个α螺旋结构区域-MA3与真核细胞翻译起始因子eIF4A发生结合,从而抑制脑源性神经营养因子表达,加重神经细胞受损及抑郁症状。针对上述研究结果,发明人开发了干扰内源PDCD4与eIF4A的结合的干扰肽应用于抑郁症的治疗。在上述技术思路的指导下,本公开制备得到一种融合多肽9R-eIF4A-VI,N段为9R跨膜序列,C段为筛选所得到的eIF4A-VI结构域。经过免疫印记实验确认,该融合多肽能够有效干扰PDCD4与eIF4A的结合,干扰作用呈现浓度依赖性,并且该多肽具有良好跨膜效率及稳定性,能够在神经元系细胞中保留24h以上,克服了传统多肽药物稳定差、半衰期短的技术缺陷。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例与对比例详细说明本公开的技术方案。
实施例1
在本实施例中,前期实验设计中发明人通过查阅文献筛选到四个eIF4A与PDCD4紧密结合的结构域(eIF4A-Q,eIF4A-I,eIF4A-Ia,eIF4A-VI),其氨基酸序列如表1所示。通过分子克隆的方法发明人构建了含有目的结构域的融合蛋白(图1a图1b)。免疫共沉淀(图1c)结果表明,eIF4A-VI组IB:HA条带显著低于其他结构域,几乎无色,证明eIF4A-VI干扰组的eIF4A与PDCD4几乎不存在相互作用,eIF4A-VI具有良好的干扰效率。同时,免疫印迹实验(图1d)验证了eIF4A-VI可以诱导IIc-BDNF的表达,诱导效果同样显著高于其他结构域多肽,eIF4A-VI同时满足干扰eIF4A与PDCD4的结合及诱导BDNF表达的作用,作为抗抑郁成分及其他神经退行性疾病治疗成分具有良好的开发意义。
表1结构域氨基酸及核苷酸序列
实施例2
结合实施例1的研究结果,本实施例中选择eIF4A-VI进行相应修饰,在N段增加了9R跨膜序列合成了多肽9R-eIF4A-VI。如图2a所示,该融合多肽N段为9R跨膜序列,C段为筛选所得到的eIF4A-VI结构域。9R跨膜序列及9R-eIF4A-VI序列如下表2所示:
表2 9R及9R-eIF4A-VI氨基酸序列
为了检测该融合多肽干扰PDCD4与eIF4A的结合的效果,发明人设计9R-mueIF4A-VI作为对照肽进行试验,该9R-mueIF4A-VI相比9R-eIF4A-VI随机突变了一个位点的氨基酸。(图2b/2c/2d)通过免疫印迹实验证实9R-eIF4A-VI能够促进IIc-BDNF的表达,并且该促进作用呈现浓度依赖性,如图2d所示,随着加样浓度升高,IIc-BDNF的含量表达也随之升高。
本实施例中以如SEQ ID NO:9所示对照肽为例进行说明,氨基酸突变之后的9R-mueIF4A-VI失去了促进作用(图2c),证明该9R-eIF4A-VI具有良好的特异性,该序列中任一氨基酸的替换均难以实现相同的效果。该特异性试验中所使用的氨基酸序列如表3所示:
表3特异性试验中各组氨基酸序列
如图2e所示,向HEK-293细胞加入荧光标记的9R-eIF4A-VI并进行检测,1h左右即可观察到多肽进入细胞,直到24h依然能够观察到细胞的多肽荧光标记。证明了9R-eIF4A-VI具有良好的跨膜效率以及在细胞内的稳定性。(图2f/2g/2h)证明9R-eIF4A-VI可以干扰PDCD4与eIF4A的结合。
实施例3
实施例2已经证实了该9R-eIF4A-VI在HEK-293细胞模型中具有良好的跨膜效果及稳定性,本实施例针对该多肽对神经元细胞的作用进一步研究。
如图3a所示,在原代神经元细胞中发明人同样验证了9R-eIF4A-VI的跨膜效率以及稳定性。如图3b,原代神经元中,荧光观测显示9R-eIF4A-VI与PDCD4存在明显的共定位情况,进一步说明了该多肽序列对PDCD4的特异性干扰。图3C表明在原代神经元中,9R-eIF4A-VI可以促进BDNF的表达。(图3d)通过ELISA的方式检测了原代神经元培养上清中BDNF的表达,实现了发明人设计通过干扰PDCD4与EIF4A的结合,提高BDNF的表达从而加强突触间信号传递,缓解抑郁症状的目的。
同时,发明人还检测了融合多肽干扰后神经元细胞中炎症因子的表达,如图3d所示,9R-eIF4A-VI不会促进IL-10和IL-6的表达升高。证明该多肽不会引起神经元细胞炎症反应,使用较安全。
实施例4
为了进一步证实该融合多肽对抑郁的治疗作用,本实施例制作抑郁细胞模型,并研究9R-eIF4A-VI对抑郁模型的作用。
(图4a/4b)本领域公知,CRS可以抑制mTOR的活性导致PDCD4的降解作用被抑制,过多的PDCD4可以抑制BDNF的表达,(图4b)发明人用原代神经元细胞通过Rapamycin抑制mTOR的活性,构建原代神经元细胞抑郁模型。
(图4c)向构建成功的细胞模型中加入9R-eIF4A-VI,9R-eIF4A-VI可以明显促进BDNF的表达,证明在抑郁状态下,该多肽能够通过诱导抑郁原代神经元细胞中BDNF的表达实现对神经元细胞的修复,纠正抑郁症状。
实施例5
为了对9R-eIF4A-VI作为抗抑郁药物的应用提供机制研究作为支持,本实施例中针对9R-eIF4A-VI的干扰机制进行了初步的研究。
如图5a所示,在SHSY5Y细胞系中发明人加入9R-eIF4A-VI进行刺激,条带结果显示低浓度下PDCD4的表达不会存在明显降低,但是在高浓度(200nM)下PDCD4的表达是明显降低的,具有统计学意义。
如图5b所示,通过RT-PCR的方式检测相关靶点的基因组表达,发明人发现9R-eIF4A-VI不会引起PDCD4mRNA水平的变化。(图5d/5c)发明人通过分别阻断蛋白酶体和溶酶体途径发现9R-eIF4A-VI促进PDCD4的降解主要通过溶酶体途径进行。
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
SEQUENCE LISTING
<110> 山东大学
<120> 融合多肽及在制备抗抑郁、神经退行性疾病药物中的应用
<130>
<160> 9
<170> PatentIn version 3.3
<210> 1
<211> 9
<212> PRT
<213> 人工合成
<400> 1
Gly Phe Glu Lys Pro Ser Ala Ile Gln
1 5
<210> 2
<211> 9
<212> PRT
<213> 人工合成
<400> 2
Ala Gln Ser Gly Thr Gly Lys Thr Ala
1 5
<210> 3
<211> 8
<212> PRT
<213> 人工合成
<400> 3
Pro Thr Arg Glu Leu Ala Gln Gln
1 5
<210> 4
<211> 12
<212> PRT
<213> 人工合成
<400> 4
Tyr Ile His Arg Ile Gly Arg Gly Gly Arg Phe Gly
1 5 10
<210> 5
<211> 10
<212> PRT
<213> 人工合成
<400> 5
Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5 10
<210> 6
<211> 18
<212> PRT
<213> 人工合成
<400> 6
Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg Tyr His Arg Gly Arg Gly
1 5 10 15
Gly Arg
<210> 7
<211> 10
<212> PRT
<213> 人工合成
<400> 7
Biotin Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5 10
<210> 8
<211> 20
<212> PRT
<213> 人工合成
<400> 8
Biotin Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg Tyr His Arg Gly Arg Gly
1 5 10 15
Gly Arg Phe Gly
20
<210> 9
<211> 20
<212> PRT
<213> 人工合成
<400> 9
Biotin Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg Tyr His Arg Gly Gln Gly
1 5 10 15
Gly Arg Phe Gly
20
- 还没有人留言评论。精彩留言会获得点赞!