一种香豆素杂二氟化硼络合物类荧光染料及其应用的制作方法
本发明合成了一种香豆素杂二氟化硼络合物类荧光染料,属于新型荧光染料合成领域。
背景技术:
近年来,有机荧光材料广泛应用于有机发光二极管、太阳能敏化电池、生命医学成像等领域。由于近红外光波长长能量低使其具有对细胞低损伤性低、穿透性强等优点,对近红外光区域有吸收的荧光染料设计的探针可以实现对细胞、组织与活体等实时监控,广泛应用于生物学与生命医学领域。因此设计具有吸收波长长、毒性低且光学性质稳定的近红外荧光染料广泛吸引科研工作者兴趣。通过增加共轭链长度、引入推拉电子基团增加推拉电子能力是使吸收发射红移普遍有效方式,常见近红外染料如菁染料、bodipy染料、苯并噻二唑染料等都是据此设计合成。
香豆素类荧光染料的光物理性质稳定与光化学性质优异,但由于其吸收、发射波长短(400~520nm)等缺陷,限制其应用范围。通过设计和修饰,增大其吸收发射后,可拓展其在生物、医学领域的应用。二氟化硼是缺电子基团,典型的如bodioy类染料,但其stokes位移一般较小(15~30nm)使其受自身激发光影响较大。经研究发现在香豆素的7位碳原子引入供电子基,3或4位引入吸电子基可大大增强体系推拉电子能力,吸收发射波长红移。
技术实现要素:
本发明鉴于对香豆素的研究和二氟化硼缺电子基团的研究,设计合成了一种新型的近红外荧光染料,通过核磁氢谱、核磁碳谱及高分辨质谱进行了表征,其结构通式如式i所示:
所述式i结构通式中,其结构特征为:ar为取代的苯基、稠环基或杂环基,取代苯基具体可为:4-二甲氨基苯基、2-羟基苯基、4-羟基苯基、2,4-二氯苯基、2,5-二甲氧基苯基、4-甲氧基苯基、4-甲基苯基、2,4-二羟基苯基和2-羟基-4-二乙氨基苯基,稠环基具体可为:2-萘基,杂环基具体可为:2-噻吩基。
制备式i所示化合物的方法,具体包括如下步骤:
1)将如式ⅱ所示香豆素和三氟化硼乙醚在有机试剂搅拌反应得到如式ⅲ所示的络合物;
2)将如式ⅲ所示的络合物与不同的芳香醛在乙醇中用碱催化下回流反应,得到结构通式为式i的目标产物;
其中,步骤1)中所述式ⅱ香豆素与三氟化硼乙醚摩尔比为1:1-1:3;有机溶剂具体可为乙酸酐或二氯甲烷;反应时间为1~5小时;反应温度为10~30℃。
步骤2)中所述式ⅲ与醛比例为1:1-5,具体为1:1;碱为哌啶或三乙胺;回流温度为60~90℃,具体为80℃;反应时间2~4小时,具体为3小时;具体醛如下式ⅳ
本发明所提供的化合物是由二氟化硼-β-二羰基六元环为吸电子基,7-二乙氨基香豆素与供电子芳香基做供电子基,具有良好的推拉电子结构,通过光学测试表明,该染料具有光学性质稳定、量子产率高、吸收发射波长长、stokes位移大等优点。该合成方法骤简单、产率高及原料廉价,易于大规模生产,在光电材料领域及荧光探针设计方面有着广阔的应用前景。
【附图说明】
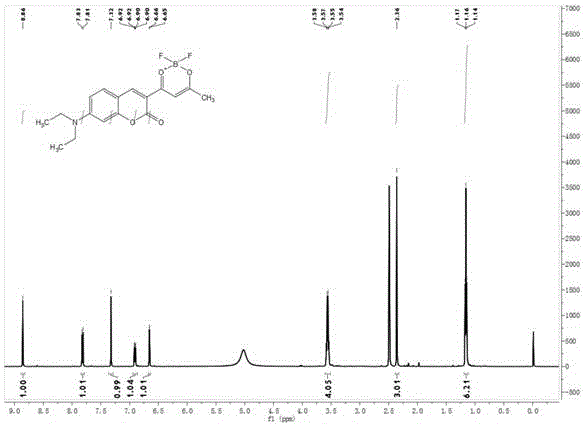
图1为实施例1所制备化合物式ⅲ的核磁氢谱图。
图2为实施例2所制备化合物式ⅵa的核磁氢谱图。
图3为实施例3所制备化合物式ⅵb的核磁氢谱图。
图4为实施例4所制备化合物式ⅵc的核磁氢谱图。
图5为实施例5所制备化合物式ⅵd的核磁氢谱图。
图6为实施例6所制备化合物式ⅵe的核磁氢谱图。
图7为实施例7所制备化合物式ⅵf的核磁氢谱图。
图8为实施例8所制备化合物式ⅵg的核磁氢谱图。
图9为实施例9所制备化合物式ⅵh的核磁氢谱图。
图10为实施例10所制备化合物式ⅵi的核磁氢谱图。
图11为实施例11所制备化合物式ⅵj的核磁氢谱图。
图12为实施例12所制备化合物式ⅵk的核磁氢谱图。
上述所有核磁氢谱图溶剂皆为d6-dmso。
图13为实施例13测得的化合物ⅵa~ⅵk的紫外-可见吸收光谱(浓度为10μmol/l,溶剂为四氢呋喃)。
图14为实施例13测得的化合物ⅵa~ⅵk的归一化荧光发射光谱(浓度为10μmol/l,溶剂为四氢呋喃)。
【具体实施方式】
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例所述的实验方法,如无特殊说明,均属常规方法;所述药品和溶剂,均可从商业途径购买或已有文献合成。
反应通式如下式ⅴ所示,反应后产物如下式ⅵ所示。
【实施例1】
制备式ⅲ化合物:称取6.02g(0.02mol)式ⅱ化合物于100ml干燥的烧瓶,溶于40ml二氯甲烷中,加入三氟化硼乙醚8.52g(0.06mol)。氮气保护下,室温下搅拌2h,有橙红色固体析出,tlc检测反应至反应完全。抽滤后用20ml二氯甲烷洗涤,真空干燥烘干,得5.31g橙红色固体,产率75.9%。1hnmr(500mhz,dmso)δ=8.86(s,1h),7.82(d,j=9.2hz,1h),7.32(s,1h),6.91(dd,j=9.2,2.0hz,1h),6.66(d,j=1.6hz,1h),3.56(q,j=7.0hz,4h),2.36(s,3h),1.16(t,j=7.0hz,6h)。
【实施例2】
制备式ⅵa化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.112g(1mmol)2-噻吩甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌3h,有绿色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.32g绿色固体,产率72.2%。1hnmr(500mhz,dmso)δ8.84(s,1h),8.12(d,j=15.4hz,1h),7.92(d,j=4.8hz,1h),7.84(d,j=9.2hz,1h),7.78(d,j=3.4hz,1h),7.49(s,1h),7.26–7.22(m,1h),6.99(d,j=15.4hz,1h),6.92(d,j=9.2hz,1h),6.68(s,1h),3.57(q,j=6.8hz,4h),1.17(t,j=7.0hz,6h).13cnmr(126mhz,dmso)δ178.3,176.0,159.2,159.0,155.4,148.8,140.2,138.3,134.9,134.2,133.4,129.7,120.9,112.0,109.9,107.4,100.7,96.6,45.4,13.0.hrms(esi):m/z[m+na]+calcdforc22h20bf2nnao4s+:466.1066,found:466.1078.
【实施例3】
制备式ⅵb化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.150g(1mmol)对二甲氨基苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌3h,有灰色色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.34g深蓝固体,产率70.8%。1hnmr(500mhz,dmso)δ8.76(s,1h),7.89(d,j=15.1hz,1h),7.81(d,j=9.0hz,1h),7.75(d,j=8.4hz,2h),7.38(s,1h),6.98(d,j=15.2hz,1h),6.88(d,j=9.1hz,1h),6.77(d,j=8.4hz,2h),6.65(s,1h),3.54(d,j=6.9hz,4h),3.07(s,6h),1.16(t,j=6.8hz,6h).13cnmr(126mhz,cf3cood)δ180.7,169.8,155.2,150.9,145.5,143.4,139.5,137.8,132.5,129.5,127.5,127.3,119.3,116.4,116.1,116.0,115.2,107.0,98.6,51.2,42.7,4.7.hrms(esi):m/z[m+na]+calcdforc26h27bf2n2nao4+:503.1924,found:503.1933.
【实施例4】
制备式ⅵc化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.156g(1mmol)2-萘醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌3h,有棕褐色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.28g棕褐色固体,产率57.5%。1hnmr(500mhz,dmso)δ8.87(s,1h),8.41(s,1h),8.09–8.03(m,2h),8.01–7.93(m,3h),7.85(d,j=8.9hz,1h),7.60(s,3h),7.49(d,j=15.8hz,1h),6.94(d,j=9.5hz,1h),6.69(s,1h),3.58(d,j=7.0hz,4h),1.18(t,j=6.9hz,6h).13cnmr(126mhz,cf3cood)δ181.0,166.6,155.3,150.7,149.0,144.1,137.4,131.7,130.4,129.2,129.0,126.9,124.9,124.9,124.7,123.2,122.7,118.8,116.3,115.2,111.2,108.9,106.8,98.3,51.3,4.9.hrms(esi):m/z[m+na]+calcdforc28h24bf2nnao4+:510.1659,found:510.1669.
【实施例5】
制备式ⅵd化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.122g(1mmol)水杨醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有棕褐色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.31g棕褐色固体,产率68.4%。1hnmr(500mhz,dmso)δ10.60(s,1h),8.84(s,1h),8.18(d,j=15.7hz,1h),7.82(t,j=8.4hz,2h),7.47(s,1h),7.32(t,j=7.6hz,1h),7.25(d,j=15.8hz,1h),6.96(d,j=8.2hz,1h),6.89(dd,j=18.2,8.6hz,2h),6.67(s,1h),3.56(q,j=6.8hz,4h),1.16(t,j=7.0hz,6h).13cnmr(126mhz,dmso)δ179.1,175.9,159.1,159.0,158.4,155.3,148.7,141.0,134.2,133.8,129.6,121.5,121.3,120.2,116.9,111.9,109.8,107.4,100.6,96.6,45.4,12.9.hrms(esi):m/z[m+na]+calcdforc24h22bf2nnao5+:476.1451,found:476.1459.
【实施例6】
制备式ⅵe化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.122g(1mmol)对羟基苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有暗红色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.28g暗红色固体,产率61.8%。1hnmr(500mhz,cdcl3)δ10.39(s,1h),8.82(s,1h),7.88(d,j=15.7hz,1h),7.83(d,j=9.0hz,1h),7.77(d,j=8.0hz,2h),7.46(s,1h),7.11(d,j=15.5hz,1h),6.91(d,j=8.9hz,1h),6.86(d,j=8.0hz,2h),6.67(s,1h),3.57(d,j=6.7hz,4h),1.18(t,j=6.6hz,6h).13cnmr(126mhz,dmso)δ191.3,179.3,175.1,163.7,162.0,159.0,155.1,148.5,146.6,134.0,132.5,126.0,118.8,116.6,116.2,111.8,109.6,107.6,100.4,96.5,45.3,12.9.hrms(esi):m/z[m+na]+calcdforc24h22bf2nnao5+:476.1451,found:476.1458.
【实施例7】
制备式ⅵf化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.174g(1mmol)2,4-二氯苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有紫色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.26g紫色固体,产率51.4%。1hnmr(500mhz,dmso)δ8.88(s,1h),8.15(d,j=8.6hz,1h),8.00(d,j=15.6hz,1h),7.85(d,j=9.2hz,1h),7.79(s,1h),7.58(s,1h),7.56(d,j=8.6hz,1h),7.49(d,j=15.7hz,1h),6.95(d,j=9.2hz,1h),6.70(s,1h),3.59(q,j=6.8hz,4h),1.17(t,j=7.0hz,6h).13cnmr(126mhz,cf3cood)δ180.7,167.9,154.9,150.3,144.5,141.9,137.1,135.3,133.2,128.8,125.6,125.1,124.1,122.9,117.3,115.7,114.8,108.0,106.4,97.9,50.8,4.2.hrms(esi):m/z[m+na]+calcdforc24h20bcl2f2nnao4+:528.0723,found:528.0737.
【实施例8】
制备式ⅵg化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.166g(1mmol)2,5-二甲氧基苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有红褐色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.30g暗红固体,产率60.3%。1hnmr(500mhz,dmso)δ8.84(s,1h),8.13(d,j=15.8hz,1h),7.83(d,j=9.2hz,1h),7.52(s,1h),7.49(s,1h),7.37(d,j=15.8hz,1h),7.07(s,2h),6.92(d,j=8.5hz,1h),6.68(s,1h),3.86(s,3h),3.78(s,3h),3.57(d,j=7.0hz,4h),1.17(t,j=6.9hz,6h).13cnmr(126mhz,dmso)δ178.6,176.3,156.2,155.4,153.7,148.9,147.2,139.3,134.3,122.6,120.7,113.7,112.4,112.0,110.0,109.9,108.0,107.3,101.0,96.6,56.6,56.1,45.4,12.9.hrms(esi):m/z[m+na]+calcdforc26h26bf2nnao6+:520.1713,found:520.1727.
【实施例9】
制备式ⅵh化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.136g(1mmol)4-甲氧基苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有红褐色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.29g暗红固体,产率62.1%。1hnmr(500mhz,dmso)δ8.84(s,1h),7.93–7.82(m,4h),7.49(s,1h),7.21(d,j=15.6hz,1h),7.04(d,j=8.6hz,2h),6.91(d,j=9.3hz,1h),6.68(s,1h),3.83(s,3h),3.57(d,j=7.0hz,4h),1.16(t,j=7.0hz,6h).13cnmr(126mhz,cdcl3)δ180.9,180.4,165.5,160.0,159.4,155.6,150.6,149.2,143.9,129.2,129.1,128.8,128.3,123.2,123.1,116.4,116.4,115.2,110.7,110.7,51.3,50.6,4.7.hrms(esi):m/z[m+na]+calcdforc25h24bf2nnao5+:490.1608,found:490.1609.
【实施例10】
制备式ⅵi化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml乙醇,加入0.136g(1mmol)对甲基苯甲醛,加入0.043g(0.5mmol)哌啶,80℃下回流搅拌2h,有红褐色固体析出,tlc检测反应至反应完全。抽滤后用5ml乙醇洗涤,真空干燥,得0.32g红褐色固体,产率70.9%。1hnmr(500mhz,dmso)δ8.84(s,1h),7.88(d,j=15.7hz,1h),7.83(d,j=9.1hz,1h),7.78(d,j=7.7hz,2h),7.51(s,1h),7.33–7.25(m,3h),6.91(d,j=9.1hz,1h),6.67(s,1h),3.56(d,j=6.9hz,4h),2.35(s,3h),1.16(t,j=6.8hz,6h).13cnmr(126mhz,dmso)δ178.8,176.4,159.2,159.0,155.4,148.9,145.6,142.4,134.3,132.2,130.2,129.9,121.8,112.0,109.9,107.3,100.8,96.6,45.4,21.6,12.9.hrms(esi):m/z[m+na]+calcdforc25h24bf2nnao4+:474.1659,found:474.1665.
【实施例11】
制备式ⅵj化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml二氯甲烷与1ml三乙胺的混合溶剂,加入0.138g(1mmol)2,4-二羟基苯甲醛,室温下搅拌2h,反应液呈现红褐色,tlc检测反应至反应完全。柱层析提纯产物,得0.12g黑绿色固体,产率25.5%。1hnmr(500mhz,dmso)δ10.68(s,1h),10.42(s,1h),8.78(s,1h),8.16(d,j=15.5hz,1h),7.81(d,j=9.0hz,1h),7.68(d,j=8.6hz,1h),7.36(s,1h),7.00(d,j=15.5hz,1h),6.89(d,j=9.2hz,1h),6.66(s,1h),6.39(s,1h),6.33(d,j=8.7hz,1h),3.55(d,j=6.9hz,4h),1.16(t,j=6.9hz,6h).13cnmr(126mhz,dmso)δ179.3,173.3,163.6,160.7,158.6,158.3,154.4,147.6,142.4,133.3,131.5,129.6,116.2,113.5,111.2,109.0,107.5,102.4,99.5,96.0,44.8,12.4.hrms(esi):m/z[m+na]+calcdforc24h22bf2nnao6+:492.1400,found:492.1404.
【实施例12】
制备式ⅵk化合物:称取0.35g(1mmol)式ⅲ化合物于25ml烧瓶,溶于10ml二氯甲烷与1ml三乙胺的混合溶剂,加入0.193g(1mmol)4-二乙胺基水杨醛,80℃下回流搅拌2h,反应液呈现蓝绿色,tlc检测反应至反应完全。柱层析提纯产物,得0.20g黑绿色固体,产率38.2%。1hnmr(500mhz,dmso)δ10.55(s,1h),8.70(s,1h),8.18(d,j=15.0hz,1h),7.78(d,j=9.0hz,1h),7.64(d,j=9.1hz,1h),7.26(s,1h),6.85(d,j=9.1hz,1h),6.80(d,j=15.0hz,1h),6.63(s,1h),6.36(d,j=9.1hz,1h),6.18(s,1h),3.53(dd,j=13.6,6.6hz,4h),3.41(dd,j=13.6,6.6hz,4h),1.14(dd,j=15.3,7.5hz,12h).13cnmr(126mhz,dmso)δ178.3,176.0,159.2,158.9,155.4,148.8,140.2,138.3,134.9,134.2,133.4,129.7,120.9,112.0,109.9,107.4,100.7,96.6,45.4,13.0.hrms(esi):m/z[m+na]+calcdforc28h31bf2n2nao5+:547.2186,found:547.2201.
【实施例13】
用四氢呋喃配制10μmol/l的上述实施例所制备的化合物ⅵa~ⅵk,用紫外-可见光谱仪测试其紫外-可见吸收光谱,最大峰波长范围在540~601nm,用荧光发射光谱仪测试其荧光发射光谱,最大发射峰范围在585~653nm,具体光谱性质如下表ⅰ:
表ⅰ。
- 还没有人留言评论。精彩留言会获得点赞!