一种癌细胞分离系统及方法与流程
本发明涉及癌细胞分离领域,特别是涉及一种癌细胞分离系统及方法。
背景技术:
癌症是一种严重危害人类健康的重大疾病,其发病率和死亡率呈逐年上升的趋势。对于相同来源的细胞,癌变后的细胞比正常细胞更软,更容易产生变形,更易于导致癌的转移;癌变后的细胞和正常细胞的膜电容也有所不同,癌变的细胞具有更大的膜电容。细胞在癌变的过程中,细胞的变形性质以及细胞膜电容就已经发生了变化。处于不同癌变阶段的细胞,其变形能力和细胞膜电容是不同的。这表明通过测量细胞的刚度或者细胞膜电容,原则上可以区分处于不同癌变程度的细胞,这为监控癌症从侵袭前到侵袭的发生发展提供了一种可能。细胞的变形性和细胞膜电容都作为细胞癌变的敏感标志,因此测量细胞刚度和细胞膜电容具有重要的临床意义。
高通量检测病变部位细胞的刚度及细胞膜电容,不仅可以判断病人处于癌症的阶段,并且可以根据细胞刚度和细胞膜电容的不同,对细胞进行分离。基于细胞的变形性特征和细胞膜电容作为分离标志对于癌症的研究和诊断有重大的潜在意义,可进行癌症的分期、复发检测、癌症抗药性的分子分析等。目前,传统的细胞分离技术主要是离心法和过滤。然而,离心和过滤的方法耗费时间长、产率低、需要的样本量大,不适合微量珍贵样品的分析。
技术实现要素:
本发明的目的是提供一种癌细胞分离系统及方法,用以对癌细胞进行快速、可靠的分离。
为实现上述目的,本发明提供了如下方案:
一种癌细胞分离系统,所述系统包括:细胞储液器、注射微泵、聚合物管、癌细胞形变量检测模块、cmos高速摄像机、膜电容检测及分离模块、ccd高速摄像机、计算机以及信号发生器;
所述细胞储液器用于放置的细胞悬浮液,所述注射微泵通过所述聚合物管将所述细胞悬浮液注射至所述癌细胞形变量检测模块;所述癌细胞形变量检测模块用于检测细胞悬浮液中的形变细胞;所述cmos高速摄像机与所述癌细胞形变量检测模块连接,用于获取细胞的形变图像;所述细胞悬浮液通过通道进入所述膜电容检测及分离模块;所述ccd高速摄像机设置在所述膜电容检测及分离模块上方,用于获取细胞的运动图像;所述信号发生器与所述膜电容检测及分离模块连接,用于提供电压;所述计算机分别与所述cmos高速摄像机、所述ccd高速摄像机以及所述信号发生器连接,用于根据所述形变图像计算形变量,以及用于根据所述运动图像和细胞的交越频率计算细胞膜电容;所述计算机还用于将所述形变量与形变量阈值进行比较,将所述细胞膜电容与电容阈值进行比较;所述膜电容检测及分离模块与所述计算机连接,用于根据比较结果对细胞进行分离。
可选的,还包括投影仪,所述投影仪与所述计算机连接,用于将所述计算机设定的光条透射至所述膜电容检测及分离模块。
可选的,还包括led灯,所述led灯设置在所述癌细胞形变量检测模块上方,用于对所述细胞悬浮液进行照射。
可选的,所述癌细胞形变量检测模块包括依次连接的细胞悬浮液注入口、细胞流动微通道以及细胞流出口。
可选的,所述膜电容检测及分离模块包括由上至下依次设置的氧化铟锡玻璃基底、双面胶带以及ito玻璃基板。
可选的,所述膜电容检测及分离模块包括四个出口。
可选的,所述ito玻璃基板具有光电材料涂层,所述涂层包括钼层和氢化非晶硅层。
可选的,所述钼层的厚度为10nm,所述氢化非晶硅层的厚度为1μm。
可选的,所述膜电容检测及分离模块的制备方法包括:
采用酒精清洗顶部ito玻璃基板;
通过准分子激光器在双面胶带中制造微通道的中空结构和五个流入流出通道;
将70nm厚的ito溅射到清洁过的虚拟玻璃,退火处理后将10nm厚的钼金属层溅射到ito层;
通过pecvd工艺在ito玻璃上沉积1μm厚的氢化非晶硅层;
顶层ito玻璃基板通过双面胶带与氧化铟锡玻璃进行组装。
本发明还提供了一种癌细胞分离方法,所述方法应用上述癌细胞分离系统,所述方法包括:
获取细胞悬浮液中细胞的形变图像;
根据所述形变图像计算细胞的形变量;
获取细胞悬浮液中细胞的运动图像以及细胞的交越频率;
根据所述运动图像以及所述交越频率,计算细胞膜电容;
将所述形变量与形变量阈值进行比较,得到第一比较结果;
将所述细胞膜电容与电容阈值进行比较,得到第二比较结果;
根据所述第一比较结果以及所述第二比较结果,对细胞进行分离。
与现有技术相比,本发明具有以下技术效果:本发明快速检测癌细胞的形变量和膜电容,并根据癌细胞与正常细胞形变量和细胞膜电容的不同基于光诱导介电泳微流控芯片将癌细胞从病人样本中分离出来的方法。首先通过癌细胞形变量检测模块,结合细胞在微通道中因受到剪切力的影响发生变形,从而检测到细胞的形变量。其次,结合细胞在微流控芯片中受到介电泳力产生运动,从而检测细胞膜电容。然后,利用光条能够操纵细胞运动的原理诱导细胞向不同的出口流出,从而分离出不同参数的细胞。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例癌细胞分离系统的结构框图;
图2为本发明实施例癌细胞形变量检测模块的示意图;
图3为本发明实施例膜电容检测及分离模块的示意图;
图4为本发明实施例癌细胞分离方法的流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明的目的是是提供一种癌细胞分离系统及方法,用以对癌细胞进行快速、可靠的分离。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
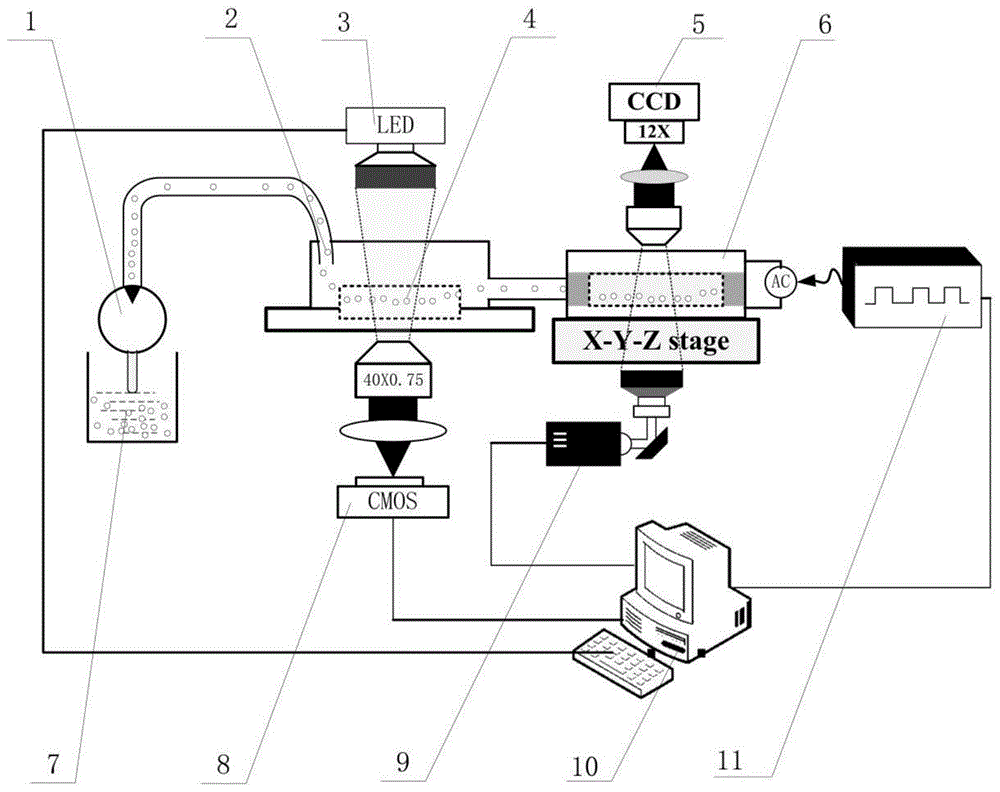
如图1所示,癌细胞分离系统包括:细胞储液器7、注射微泵1、聚合物管2、led灯3、癌细胞形变量检测模块4、cmos高速摄像8、膜电容检测及分离模块6、ccd高速摄像机5、计算机10以及信号发生器11。
所述细胞储液器7用于放置的细胞悬浮液,所述注射微泵1通过所述聚合物管2将所述细胞悬浮液注射至所述癌细胞形变量检测模块4;所述癌细胞形变量检测模块4用于检测细胞悬浮液中的形变细胞;所述cmos高速摄像机8与所述癌细胞形变量检测模块4连接,用于获取细胞的形变图像;所述细胞悬浮液通过通道进入所述膜电容检测及分离模块6;所述ccd高速摄像机5设置在所述膜电容检测及分离模块6上方,用于获取细胞的运动图像;所述信号发生器11与所述膜电容检测及分离模块6连接,用于提供电压;所述计算机10分别与所述cmos高速摄像机8、所述ccd高速摄像机5以及所述信号发生器11连接,用于根据所述形变图像计算形变量,以及用于根据所述运动图像和细胞的交越频率计算细胞膜电容;所述计算机还用于将所述形变量与形变量阈值进行比较,将所述细胞膜电容与电容阈值进行比较;所述膜电容检测及分离模块6与所述计算机10连接,用于根据比较结果对细胞进行分离。
所述led灯3设置在所述癌细胞形变量检测模块4上方,用于对所述细胞悬浮液进行照射。
还包括投影仪9,所述投影仪9与所述计算机11连接,用于将所述计算机11设定的光条透射至所述膜电容检测及分离模块6。计算机上设计好的光条经过投影仪投射至聚光镜,照射到膜电容检测及分离模块形成虚拟电极,产生电场从而操纵细胞运动。
癌细胞形变量的检测,具体如下:
1)设计癌细胞形变量检测模块:优选微通道的横截面为25μm*25μm的正方形,主要是为了保证细胞的尺寸占微通道尺寸的50%-90%,保证同一时间允许通过单个细胞。细胞流过微流体通道收缩部位时,通过剪切应力和压力梯度而发生变形。微流控芯片采用聚二甲基硅氧烷(pdms)材料,通道采用标准光刻技术实现,入口和出口的直径为1.5mm,入口与出口之间的距离为5mm,玻璃基底与pdms微通道通过离子键合在一起。如图2所示,为细胞形变量检测模块,其中的局部放大图为细胞流过微通道的收缩部位时发生形变的示意图。检测芯片包括细胞悬浮液的注入口、细胞流动的微通道、以及细胞流出检测芯片的出口。其中,细胞流动微通道的中间区域为压缩通道,相对于入口和出口处的尺寸较小,以至于细胞能够受到剪切力而变形。
2)由注射微泵提供驱动力,驱使细胞悬浮液在上述设计的癌细胞形变量检测模块的微通道中流动,在流动液体的剪切应力和压力梯度下细胞发生变形。
3)高速摄像机实时捕捉变形细胞的图像,通过计算机预先编写完成的算法获得细胞流过微通道时细胞的轮廓面积以及周长,计算分析变形细胞的变形量。
4)通过光诱导介电泳的方法测量得到细胞的尺寸和形状,通过已有算法处理得到细胞的未变形值,并将该值设定为变形的临界值,作为下一步癌细胞分离的第一个依据。
膜电容检测及分离模块,具体如下:
1)膜电容检测及分离模块6的入口与癌细胞形变量检测模块4的出口通过一个连接通道相连;
2)膜电容检测及分离模块6由顶部氧化铟锡(ito)玻璃基底,具有微制造的微通道(厚度:50μm)的胶带和具有光电导材料涂层(包括10nm厚的钼层和1μm厚的氢化非晶硅层)的底部ito玻璃基板组成。两块玻璃的尺寸参数为25mm*25mm,厚度为500μm。该模块有四个出口,分别为形变量大且膜电容大的出口1、形变量小且膜电容大的出口2、形变量大且膜电容小的出口3、以及形变量小且膜电容小的出口4;
3)膜电容检测及分离模块66和信号发生器11相连,信号发生器11用于提供一定幅值和频率的电压信号;当外加正弦电压10vpp施加于上下玻璃基片的氧化铟锡薄膜表面时,由于氢化非晶硅材料在无光照时的电导率较低,因此,溶液层中几乎无压降,故溶液层中无空间电场产生;当有入射光时,氢化非晶硅层由于吸收光能量而使得明亮区域的电导率显著提升,从而电压会施加于溶液层而产生空间非均匀电场;悬浮于芯片溶液层中的细胞,在入射光诱导形成的空间非均匀电场作用下而被极化,极化的细胞与电场相互作用,产生介电泳力。从而可以利用光条移动诱导细胞运动。
4)设定信号发生器的正弦电压值为10vpp,设定信号发生器的扫频范围(频率从小逐步增大)。并通过已有程序根据细胞在检测区域的运动情况,找到细胞的交越频率,进而计算出细胞膜电容,作为检测细胞膜电容并进行分离的第二个依据。设置一定的电压10v,高电压会导致细胞聚集,低电压电场强度弱,不利于细胞操纵。通过设置信号发生器的扫频范围,即频率从小到大在一定范围内变化,使得细胞先远离光条,再被光条吸引,即高电场到低电场,低电场再到高电场,中间的转折点即是交越频率。
5)如图3所示,设置光条分别于四个出口的微通道区域,当检测到细胞的形变量大、膜电容大时则从出口1流出;当检测到细胞的形变量小、膜电容大时则从出口2流出;当检测到细胞的形变量大、膜电容小时则从出口3流出;当检测到细胞的形变量小、膜电容小时则从出口4流出。
6)癌细胞形变量检测后,对每个细胞都会得到一个具体的形变量数据;细胞形变量检测之后,电脑就会产生一个脉冲信号发送给信号发生器,信号发生器提供电压产生电场,设置一定正弦电压,设置扫频范围,编写程序计算细胞的交越频率和膜电容。再设定一个膜电容的临界值,超过临界值的细胞通过光条诱导操纵引向不同的出口,即可把形变量大且膜电容大、形变量小且膜电容大、形变量大且膜电容小、形变量小且膜电容小四类细胞分离出来。
膜电容检测及分离模块6主要用于检测膜电容的大小并实现分离,光诱导介电泳分离芯片的制备方法,整个制造过程基于准分子激光微加工工艺,使用溅射和等离子体增强化学气相沉积(pecvd)的薄膜技术以及等离子体氧化辅助粘合制成。包括下列步骤:
采用酒精清洗顶部ito玻璃基板;
通过准分子激光器在双面胶带中制造微通道的中空结构和五个流入流出通道;
底部基板是将70nm厚的ito溅射到清洁过的虚拟玻璃,退火处理后将10nm厚的钼金属层溅射到ito层(改善制造的ito玻璃与非晶硅层之间的黏附);
通过pecvd工艺在ito玻璃上沉积1μm厚的氢化非晶硅层;
5)顶层ito玻璃基板,通过双面胶带与底部基板组装。
根据本发明提供的具体实施例,本发明公开了以下技术效果:
1)本发明可以在测量细胞的变形性及细胞膜电容的基础上对癌细胞进行分选,实现癌细胞变形量的检测、膜电容的检测和癌细胞分离的三种功能;
2)本发明检测细胞的变形量和膜电容可以实现高通量,满足临床大量样本分析的需求;对癌细胞进行分选是以其自身的机械特性及电学特性作为依据的,是一种无标记的分离方法;
3)本发明的方法所需的设备简单可靠、操作简便。
如图4所示,本发明还提供了一种癌细胞分离方法,所述方法包括:
步骤401:获取细胞悬浮液中细胞的形变图像;
步骤402:根据所述形变图像计算细胞的形变量;
步骤403:获取细胞悬浮液中细胞的运动图像以及细胞的交越频率;
步骤404:根据所述运动图像以及所述交越频率,计算细胞膜电容;
步骤405:将所述形变量与形变量阈值进行比较,得到第一比较结果;
步骤406:将所述细胞膜电容与电容阈值进行比较,得到第二比较结果;
步骤407:根据所述第一比较结果以及所述第二比较结果,对细胞进行分离。
测量癌细胞变形性和细胞膜电容并对其进行分离的微流控装置及方法具体实现步骤如下:
a.细胞的准备:提前准备好需要检测的细胞样本,样本在115g下离心5min,然后重新悬浮在等渗溶液(5%的葡萄糖+0.2%的牛血清蛋白+去离子水配置成100ml的等渗溶液)中,使得细胞最终的浓度为106cells/ml,每次检测只需100μl细胞悬浮液就满足要求了。在将细胞悬浮液从储液器7吸入1ml的注射微泵1之前,细胞悬浮液要放置在37℃下保持细胞活性。
b.实验前装置的准备:通过用乙醇(70%)和去离子水冲洗来彻底清洁注射器微泵1、聚合物管2以及芯片4、6的通道。在开始测量之前,流量在恒定流速下稳定2min。所有的数据采集都是在细胞形状达到稳定状态的300μm长的收缩部位的后部进行的。cmos高速摄像机8工作参数设置为曝光时间为1μs、工作帧数为4000f.p.s、感兴趣区域为250*80pixels。
c.工作时,注射微泵维持细胞稀释液流速在0.04μl/s。细胞悬浮液在注射微泵1的驱动下通过聚合物管进入形变检测芯片4。微通道收缩部位的变形细胞用脉冲高功率的led3照射,并用cmos高速摄像机8对微通道内变形的细胞进行成像。为了减少细胞通过微通道收缩孔时图像出现模糊,使用脉冲电流控制led对样品进行照明,高速摄像机8的快门触发脉冲以确保同步的图像曝光。
d.将高速摄像机8获得的每一帧图像转换为灰度图。然后根据细胞与背景的程度进行阈值处理,进行canny边缘化提取,获得变形细胞的轮廓。最后计算变形细胞的轮廓面积和周长,确定细胞的形变量。
e.从细胞形变检测芯片4流出的每一个细胞都得到对应的形变量。根据不同细胞系癌变细胞变形量的不同,设定正常细胞和癌变细胞形变量的临界值,作为下一步癌细胞分离的第一个判断依据。
f.当芯片4处检测到样本中细胞的形变量大于分离的临界值时,认定该细胞将从出口1、3流出;反之,细胞将从2、4流出。细胞进入细胞膜电容检测及分离芯片6,信号发生器11提供10v电压,设定扫频范围,此时高速摄像机5记录细胞的运动图像。通过imagej处理,获得细胞的交越频率,然后计算出细胞的膜电容。
g.从细胞膜电容检测及分离芯片6流出的每一个细胞都得到对应的膜电容值。根据不同细胞系癌变细胞膜电容的不同,设定膜电容的临界值,作为下一步癌细胞分离的第二个判断依据。
h.结合两个参数值,当细胞的形变量和膜电容均大于临界值,则通过光条移动诱导细胞从出口1流出;当检测到细胞的形变量小于临界值,而膜电容大于临界值,则从出口2流出;若检测到细胞的形变量大于临界值,而膜电容小于临界值,则从出口3流出;若检测到细胞的形变量和膜电容均小于临界值,则从出口4流出。四个出口流出的细胞即为分离出来的不同参数的癌细胞和正常细胞。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处。综上所述,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!