一种基因工程菌及以D,L-扁桃酸为底物制备L-苯甘氨酸的方法与流程
本发明属于生物工程技术领域,具体涉及一种基因工程菌及以d,l-扁桃酸为底物制备l-苯甘氨酸的方法。
背景技术:
l-苯甘氨酸(l-phenylglycine)又名l-苯基甘氨酸,属于非天然芳香族α-氨基酸,是医药工业中重要的手性砌块和原料。l-苯甘氨酸及其衍生物是合成紫杉醇、氨苄青霉素、头孢氨苄等β-内酰胺类抗生素的关键手性中间体,其中l-邻氯苯甘氨酸更是合成重磅炸弹药物——氯吡格雷的重要中间体。随着化工技术的不断发展,化学合成l-苯甘氨酸的工艺已非常成熟。但是,传统的化学合成中会用到剧毒的氰化物或者强碱,对环境极不友好。此外,化学合成l-苯甘氨酸的对映选择性和产率都较低,增大了后续手性拆分的成本。生物合成与传统的化学合成相比,具有选择性强、反应条件温和、环境友好及对设备要求低等优势,随着环境问题日益突出,绿色、环保的生物合成更受广大研究者的关注。随后也出现了一些利用苯海因酶转化法、d-苯甘氨酸氨基转移酶法和氨基酸脱氢酶法等生物合成苯甘氨酸的报道。然而,它们仍存在一定的缺陷,例如需要硫酸的辅助、催化活性低或需要额外的辅酶循环系统等。因此,目前亟待开发一条转化效率高、对映选择性好、成本低廉并且环境友好的l-苯甘氨酸制备路线。
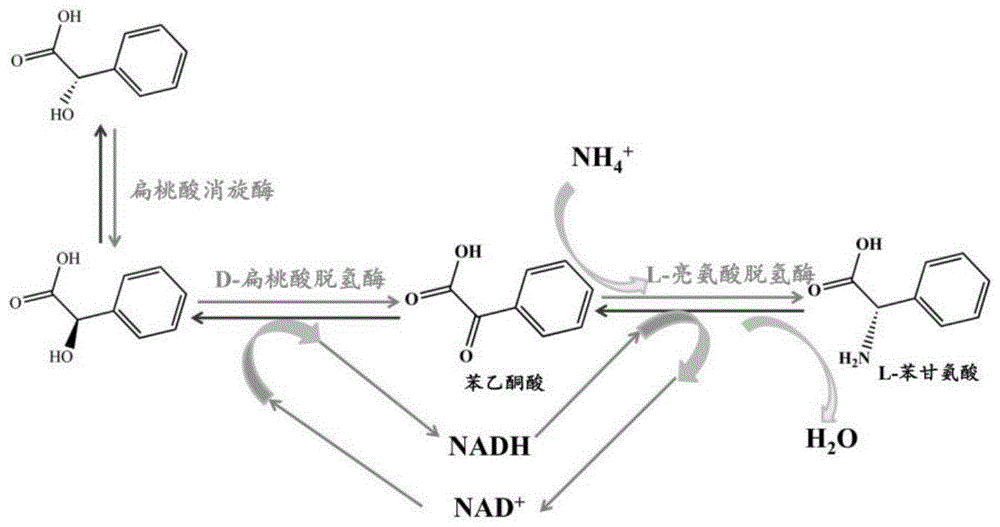
cn108504642公开了一种基因工程复合菌及其在苯乙酮酸生物合成中的应用,该基因工程复合菌包含编码l-乳酸脱氢酶、d-扁桃酸消旋酶和d-扁桃酸脱氢酶的基因,可将外消旋扁桃酸转化为苯乙酮酸(苯乙酮酸可作为生产l-苯甘氨酸的底物)。具体的反应体系为:将外消旋扁桃酸加入上述基因工程复合菌的发酵液中,使扁桃酸的终浓度为1-100mm,维持反应温度为4-50℃,采用hplc监测反应进程,当24h时,外消旋扁桃酸的转化率可达90%以上。其中l-乳酸脱氢酶主要起加快nad+和nadh循环的作用。
cn106119272a公开了一种高效联产l-苯甘氨酸及葡萄糖酸的策略,可采用酶法或全细胞法制备l-苯甘氨酸,其中,全细胞法具体为:将l-亮氨酸脱氢酶和葡萄糖脱氢酶共同在大肠杆菌中过量表达获得重组大肠杆菌,利用ph8.0的100mmpb缓冲液洗涤细胞然后以pb缓冲液等体积悬浮,再加入5%的甘油和4%曲拉通的情况下,投入500mm苯甲酰甲酸、750mm葡萄糖及0.5m的nh4cl,利用添加50%的氨水使转化的ph保持在8.0左右,并控制转化的温度在30℃,制备得到l-苯甘氨酸和葡萄糖酸。实施例11进一步公开了当采用全细胞法制备l-苯甘氨酸时,以500mm苯甲酰甲酸为底物制备得到了45.8g/ll-苯甘氨酸,转化率为60.6%,转化率低。
现有技术中采用生物法,以外消旋扁桃酸为底物制备l-苯甘氨酸时,存在底物转化率低、菌体内nad+和nadh循环效率差的问题。
技术实现要素:
本发明的目的之一在于,提供一种编码扁桃酸消旋酶的基因armr,所述armr基因的核苷酸序列如seqidno:1所示。该armr基因是经密码子优化得到的,相对于优化前,其表达水平明显提高,有助于提高催化d,l-扁桃酸的效率。
本发明的目的之二在于,提供一种编码d-扁桃酸脱氢酶的基因lhdmdh,所述lhdmdh基因的核苷酸序列如seqidno:2所示。该lhdmdh基因是经密码子优化得到的,相对于优化前,其表达水平明显提高。
本发明的目的之三在于,提供一种编码l-亮氨酸脱氢酶的基因esleudh,所述esleudh基因的核苷酸序列如seqidno:3所示。该esleudh基因是经密码子优化得到的,相对于优化前,其表达水平明显提高。
本发明的目的之四在于,提供一种基因工程菌,所述基因工程菌包含如上所述的armr基因、lhdmdh基因和esleudh基因中的任意一种或任意两种或三种。
优选的,所述基因工程菌包含armr基因、lhdmdh基因和esleudh基因,该基因工程菌可同时表达扁桃酸消旋酶、d-扁桃酸脱氢酶和l-亮氨酸脱氢酶,且上述3种酶的表达量均高于相应基因密码子优化前的表达量,有助于将d,l-扁桃酸转化为l-苯甘氨酸。该基因工程菌在将d,l-扁桃酸转化为l-苯甘氨酸时,菌体内nad+和nadh循环效率高,无需添加辅助因子,且d,l-扁桃酸的转化率可达95%以上。
本发明的目的之五在于,提供一种如上所述同时含有armr基因、lhdmdh基因和esleudh基因的基因工程菌的构建方法,包括如下步骤:步骤一、构建重组质粒pet28a-armr,将armr基因连接至pet28a质粒,获得重组质粒pet28a-armr,转化bl21感受态细胞,经卡拉霉素筛选、菌液pcr检测和测序鉴定,获得工程菌bl21/pet28a-armr;
步骤二、构建重组质粒pacycduet-lhdmdh-esleudh,将lhdmdh基因和esleudh基因分别连接至pacycduet质粒,获得重组质粒pacycduet-lhdmdh-esleudh;
步骤三、重组质粒转化入宿主细胞:将所述步骤二制得的重组质粒利用热激转化至大肠杆菌bl21/pet28a-armr感受态细胞中,添加0.4mllb液体培养基在37℃、220rpm下孵育1h后,涂布于含有25μg/ml氯霉素的lb固体平板上,在37℃下培养12~16h,得到单克隆菌落;
步骤四、重组菌的筛选与鉴定:挑取所述单克隆菌落至4ml含有50μg/ml卡拉霉素和氯霉素双抗的lb液体培养基中,在37℃、220rpm下培养1~4h,进行菌液pcr检测和测序鉴定,确认获得所述基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh。
本发明的目的还在于,提供一种以d,l-扁桃酸为底物制备l-苯甘氨酸的方法,具体的技术方案为:在反应体系中加入如上所述包含armr基因、lhdmdh基因和esleudh基因中的任意一种或两种或三种基因的基因工程菌。
优选的,在以d,l-扁桃酸为底物制备l-苯甘氨酸时,反应体系中所述d,l-扁桃酸的终浓度为1-100mm,nh4+的终浓度为1~500mm,控制反应液ph在6~12,反应温度5~50℃。
本发明的有益效果是:本发明的编码扁桃酸消旋酶armr的基因经密码子优化后,基因armr在大肠杆菌中的表达量可达优化前的121%。
本发明的编码d-扁桃酸脱氢酶的基因lhdmdh经密码子优化后,基因lhdmdh在大肠杆菌中的表达量可达优化前的118%。
本发明的编码l-亮氨酸脱氢酶的基因esleudh经密码子优化后,基因esleudh在大肠杆菌的表达量可达优化前的124%。
本发明的基因工程菌表达扁桃酸消旋酶/d-扁桃酸脱氢酶/l-亮氨酸脱氢酶中任意一种或几种的表达量更高,在用于将d,l-扁桃酸转化为l-苯甘氨酸的过程中,对原料/中间产物的催化效果更好。
本发明借助共表达的策略,将课题组挖掘到的高活性的扁桃酸消旋酶、d-扁桃酸脱氢酶和l-亮氨酸脱氢酶经过密码子优化后,借助pet28a质粒及共表达载体pacycduet,构建了能同时高效表达重组扁桃酸消旋酶、d-扁桃酸脱氢酶和l-亮氨酸脱氢酶的基因工程菌。此外,将经诱导表达的工程菌作为催化剂、d,l-扁桃酸为底物,进行了高效、高选择性地合成l-苯甘氨酸的研究。本发明的包含armr基因、lhdmdh基因和esleudh基因的基因工程菌在将d,l-扁桃酸转化为l-苯甘氨酸时,菌体内nad+和nadh循环效率高,无需添加辅助因子,且d,l-扁桃酸的转化率可达95%以上,且反应时间更短。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明的以d,l-扁桃酸为底物制备l-苯甘氨酸的反应原理图;
图2为l-苯甘氨酸的高分辨质谱检测图谱;
图3是d,l-扁桃酸的高分辨质谱检测图谱。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:扁桃酸消旋酶(armr)、d-扁桃酸脱氢酶(lhdmdh)和l-亮氨酸脱氢酶(esleudh)基因的密码子优化及合成。
步骤一、利用在线的密码子优化服务器optimizer(http://genomes.urv.cat/optimizer/),基于escherichiacolik-12菌株的密码子偏爱性,分别对扁桃酸消旋酶(armr,genebank号:nc_011987.1:c165039-163963)、d-扁桃酸脱氢酶(lhdmdh,genebank号:nz_aueh01000018.1:56110-57069)和l-亮氨酸脱氢酶(esleudh,genebank号:nc_010556.1:964613-965737)的基因进行密码子优化,优化后的序列分别如seqidno:1、2和3所示,优化前后的关键参数对比如表1所示。从密码子适应度值和有效密码子数的改变来看,优化后的序列对大肠杆菌e.colibl21具有更好的宿主适应性和表达潜力。
表1各基因密码子优化前后关键参数对比
步骤二、将优化后的序列委托苏州鸿讯生物科技有限公司进行全基因合成。
实施例2:共表达扁桃酸消旋酶(armr)、d-扁桃酸脱氢酶(lhdmdh)和l-亮氨酸脱氢酶(esleudh)基因工程菌的构建及表达分析。
步骤一、构建重组质粒pet28a-armr,将如seqidno:1所示的基因连接至pet28a质粒,获得获得重组质粒pet28a-armr,转化bl21感受态细胞,经卡拉霉素筛选、菌液pcr检测和测序鉴定,获得工程菌bl21/pet28a-armr;
步骤二、构建重组质粒pacycduet-lhdmdh-esleudh,将如seqidno:2和seqidno:3所示的基因分别连接至pacycduet质粒,获得重组质粒pacycduet-lhdmdh-esleudh;
步骤三、重组质粒转化入宿主细胞:将重组质粒acycduet-lhdmdh-esleudh利用热激转化至大肠杆菌bl21/pet28a-armr感受态细胞中,添加0.4mllb液体培养基在37℃、220rpm下孵育1h后,涂布于含有25μg/ml氯霉素的lb固体平板上,在37℃下培养12~16h,得到单克隆菌落;
步骤四、重组菌的筛选与鉴定:挑取所述单克隆菌落至4ml含有50μg/ml卡拉霉素和氯霉素双抗的lb液体培养基中,在37℃、220rpm下培养1~4h,进行菌液pcr检测和测序鉴定,确认获得优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh;
步骤五、表达鉴定:挑选获得的经鉴定的基因工程菌单菌落接种至4ml含有50μg/ml卡拉霉素和氯霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,得到经诱导表达的菌液(发酵液);将上述经诱导表达的菌液装入50ml的离心管中,于8000rpm、4℃离心5min,收集菌体,各用50ml去离子水水洗两次,同样条件下收集菌体。将上述每种菌体用10ml裂解缓冲液(20mmol/ltris-hclph7.9,500mmol/lnacl,1.2114gtris、14.61gnacl,加水400ml,溶解后用盐酸调ph至7.9,定容至500ml)悬浮,50%的占空比,超5s、停5s,冰水浴超声破碎20min。12000rpm、4℃离心15min,收集上清液,sds-page分析目的蛋白的表达形态;在此诱导条件下,3个酶均实现了可溶性表达且均具有相应的催化活性。
对照组:将实施例2中上述步骤一和步骤二中所用到的编码扁桃酸消旋酶、d-扁桃酸脱氢酶和l-亮氨酸脱氢酶的基因分别替换为相应的密码子优化前的基因,其余操作均与上述步骤一到步骤五相同,得到优化前基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh。
实验结果:与未经过密码子优化的对照菌株相比,含有优化后的3种基因的菌株中,相应酶的表达水平均有显著提高,详见下表2。
表2各基因密码子优化前后的表达水平对比
实施例3:全细胞催化的l-苯甘氨酸的生物合成。
将上述基因工程菌(包含密码子优化后的扁桃酸消旋酶基因、d-扁桃酸脱氢酶基因和l-亮氨酸脱氢酶基因)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为1~100mm,添加nh4+至终浓度为1~500mm,控制ph在6~12,维持反应温度5~50℃,反应过程中用hplc法检测l-苯甘氨酸的生成量,待转化率达到90%以上时(反应时间2-20h时,转化率可达90%以上),煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品。
通过本发明基因工程菌的共表达及全细胞催化,d,l-扁桃酸的转化率可以达到95%以上,l-苯甘氨酸的e.e.值可以达到99%以上,具有良好的产业化前景。
实施例4
4.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为50mmol/l,添加nh4+至终浓度为200mmol/l,控制ph=9,维持反应温度30℃,反应35h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.48mmol,转化率96%,l-苯甘氨酸的e.e.值可以达到99%以上。
4.2将4.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述4.1相同,反应20h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.498mmol,转化率99.58%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例5
5.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为100mmol/l,添加nh4+至终浓度为500mmol/l,控制ph=6,维持反应温度40℃,反应45h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.92mmol,转化率92%,l-苯甘氨酸的e.e.值可以达到99%以上。
5.2将5.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述5.1相同,反应18h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.964mmol,转化率96.4%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例6
6.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为1mmol/l,添加nh4+至终浓度为1mmol/l,控制ph=10,维持反应温度20℃,反应10h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.00906mmol,转化率90.6%,l-苯甘氨酸的e.e.值可以达到99%以上。
6.2将6.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述6.1相同,反应2h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.00959mmol,转化率95.9%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例7
7.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为15mmol/l,添加nh4+至终浓度为30mmol/l,控制ph=8,维持反应温度50℃,反应13h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.1402mmol,转化率93.5%,l-苯甘氨酸的e.e.值可以达到99%以上。
7.2将7.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述7.1相同,反应3h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.1457mmol,转化率97.1%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例8
8.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为80mmol/l,添加nh4+至终浓度为300mmol/l,控制ph=7,维持反应温度10℃,反应18h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.7768mmol,转化率97.1%,l-苯甘氨酸的e.e.值可以达到99%以上。
8.2将8.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述8.1相同,反应5h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.7672mmol,转化率95.9%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例9
9.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为30mmol/l,添加nh4+至终浓度为100mmol/l,控制ph=12,维持反应温度5℃,反应30h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.2838mmol,转化率94.6%,l-苯甘氨酸的e.e.值可以达到99%以上。
9.2将9.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述9.1相同,反应17h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.2856mmol,转化率95.2%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例10
10.1将优化前基因工程菌(实施例2对照组制备)单菌落接种至4ml含有氯霉素和卡拉霉素双抗的lb液体培养基中,在37℃、220rpm下培养过夜;将过夜培养的产物用移液器按2%的接种量接种到50ml的lb液体培养基中;然后,置于37℃下、200rpm培养2.5h,最后加入终浓度为0.1~2mmol/l的iptg水溶液,置于16℃下、220rpm培养20h,4℃、8000rpm离心收集菌体;
以上述收集的菌体为催化剂构建10ml的反应体系,将d,l-扁桃酸加入到反应体系中,使底物的终浓度为60mmol/l,添加nh4+至终浓度为400mmol/l,控制ph=7,维持反应温度35℃,反应29h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.5622mmol,转化率93.7%,l-苯甘氨酸的e.e.值可以达到99%以上。
10.2将10.1中的优化前基因工程菌替换为优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh,其余操作均与上述10.1相同,反应15h时,用hplc法检测l-苯甘氨酸的生成量,转化率达到90%以上时,煮沸离心去除蛋白,调节ph至3左右,用乙酸乙酯萃取去除未反应的底物,反应物经减压蒸馏结晶获得l-苯甘氨酸的粗品,然后用硅胶柱进行分离纯化,获得l-苯甘氨酸的纯品0.5778mmol,转化率96.3%,l-苯甘氨酸的e.e.值可以达到99%以上。
实施例4-10对包含本发明的armr基因、lhdmdh基因和esleudh基因的基因工程菌和包含密码子优化前的armr基因、lhdmdh基因和esleudh基因的基因工程菌的催化性能进行了对比,实验结果表明:优化后基因工程菌bl21/pet28a-armr:pacycduet-lhdmdh-esleudh可显著提高催化效率,缩短将d,l-扁桃酸转化为l-苯甘氨酸的时间。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>南阳师范学院
<120>一种基因工程菌及以d,l-扁桃酸为底物制备l-苯甘氨酸的方法
<160>3
<170>siposequencelisting1.0
<210>1
<211>1074
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgatgaagataacagccataaggagtaggcccgtcctagtccccctagagtttcccata60
aggacagccagtggaacagtcagtgccagtcccctagtcctaatagatctatttacagat120
gccggaataataggacatgcctatatatttggatatacacccctaacactacaaccccta180
gtcgccctactagataatctagccggaacaataataggacaaagtgtcgcccccagggcc240
ctagaggagaggctaaggaggagttttaggctactaggatatacaggactactaaggatg300
gccctagccggaatagagatggccgcctgggatgcctttgccaaggagcaaaggatgccc360
ctagtcaggctaataggaggagagcccaggcccatacaagcctatgatagtcatagtatg420
gatggagaggccctagccgtcgagagggccgtcaggagtgccaaggccggatttagggga480
ctaaagacaaagataggatatgccagttttgccgaggagctagccgtcataagggccata540
aggagtgccgtcggaccccaatttgagataatggtcgattataatcaagccctaagtgtc600
cccgaggccataataaggggaagggccctagccgaggagggaataacatggatagaggag660
cccacactacaacatgattatgatggacatggacaaataacaagggccctaacaacaagt720
gtccaaatgggagagaattggtttggacccgaggagatgatgctaagtgtcaaggccgga780
gccagtaatctagccatggtcgatgtcatgaagataggaggagtctgtggatggatgaag840
gccagtgccatagccgagcaacatggactacccctaagtagtcatctatttcaagagata900
agtgtccatctactagccgccagtcccacagcccataggctagagcatatggatatagcc960
ggacccgtcctactacaaggaatgacaatacaagatggatttgccctagccagtgaggag1020
cccggaacaggagtcgcctggagggaggatgccgtcgcccaatttctaatagcc1074
<210>2
<211>957
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgaagatagccatagccggagccggagccatgggaggaaggtttggaagtatgctaagt60
acaacagagaatcccgtcacatttatagatctatgggcccaacatgtccaagccataaat120
gcccatggactactagtccatacagatcatggagatgagagggtccatgtccccgcctat180
ctaccccaagatgtccatggaagttttgatctaatagtcctatttacaaaggccatggga240
atagcccccatgctaacagccctaaagcccgtcataacaccccaaacacatatactagtc300
ctaggaaatggaataggaaatatagagacaataagtaggtttgtccccaaggatcaaata360
atagccggagtcacagtctggagtgccgccctaaatggacccggagagataacaatgaag420
ggagatggaggagtcacactagaggccctaggaagtaatgaggcccccttttttaagcaa480
gtcgtccaagtcctacaagatgccggactaaagcccacagccagtcatgatgtcctagcc540
gccatatggaggaaggccgccctaaatagtgtcctaaatacatattgtacaatactagat600
tgtaatataggagagtttggacaactacccgatcatgatgccatgatagatggagtccta660
agtgagtttagtcaaatagccgccaagcaacatgtccattttgatgccgccgatacaaag720
caactaatagtcgcccaatttcccgatggaaagaatggactacattatcccagtatgcat780
caagatatggccaagggaaggaagacagagatagattttctaaatggatatatagccaag840
gtcggagccagggagcatatagccacacccataaatgccatgctaacagccctagtccat900
agtaaggagaagctaaatgagctacaaagtagtagggagaaggtcgccacacccgtc957
<210>3
<211>1122
<212>dna
<213>人工序列(artificialsequence)
<400>3
atggtcgagacaaatgtcgaggccaggtttagtatatttgagacaatggccatggaggat60
tatgagcaagtcgtcttttgtcatgataaggtcagtggactaaaggccataatagccata120
catgatacaacactaggacccgccctaggaggactaaggatgtggaattatgccagtgat180
gaggaggccctaatagatgccctaaggctagccaagggaatgacatataagaatgccgcc240
gccggactaaatctaggaggaggaaaggccgtcataataggagatgccaagacacaaaag300
agtgaggccctatttagggcctttggaaggtatgtccaaagtctaaatggaaggtatata360
acagccgaggatgtcaatacaacagtcgccgatatggattatatacatatggagacagat420
tttgtcacaggagtcagtcccgcctttggaagtagtggaaatcccagtcccgtcacagcc480
tatggagtctataggggaatgaaggccgccgccaaggaggtctatggaacagatagtcta540
ggaggaaagacagtcgccatacaaggagtcggaaatgtcgcctttaatctatgtaggcat600
ctacatgaggagggagccaagctaatagtcacagatataaatcaagatgccctaaggagg660
gccgaggaggcctttggagccctagtcgtcggacccgatgagatatatagtgtcgatgcc720
gatatatttgccccctgtgccctaggagccacactaaatgatgagacaataccccaacta780
aaggtcaagataatagccggagccgccaataatcaactaaaggaggataggcatggagat840
atgctacaagagaggggaatactatatacacccgattttgtcataaatgccggaggagtc900
ataaatgtcgccgatgagctagatggatataatagggagagggccatgaagaaggtcgag960
ctagtctatgatgccgtcgccaaggtcatagagatagccaagagggatcatctacccaca1020
tatagggccgccgagaagatggccgaggagaggatagccacaatgggaagtgccaggagt1080
caatttctaaggagggataagaatatactaggaagtagggga1122
- 还没有人留言评论。精彩留言会获得点赞!