一种截短的褐藻胶裂解酶Aly7B-CDII基因及其应用的制作方法
本发明属于基因工程技术与蛋白表达领域,具体涉及一种截短的褐藻胶裂解酶基因及其应用。
背景技术:
我国拥有极其丰富的海洋生物资源,尤其是海藻资源。褐藻作为一大藻类资源,由于其细胞壁中富含褐藻胶这一具有独特性质与极大开发价值的多糖,被开发者们所青睐。褐藻胶是一种直链酸性多糖,由β-d-甘露糖醛酸(mannuronic,m)和α-l-古洛糖醛酸(guluronic,g)通过α-1,4-糖苷键结合而成的线性阴离子多糖。在天然状态下,褐藻胶的主要存在状态为水溶性的褐藻酸钠(sodiumalginate)、褐藻酸钾等褐藻酸盐类和水不溶性的褐藻酸(alginicacid)。目前市场上的褐藻酸钠(商品名为海藻酸钠)或其他褐藻酸盐主要是从褐藻中提取获得。研究表明,褐藻多糖根据其高粘度以及凝胶特性等能力,在食品、制药等行业均有广泛应用。降解褐藻多糖所得到的寡糖,在保留多种独特生物活性的同时,还避免了多糖本身具有的溶解度差的问题,具有良好的生物可利用性,具有广阔的开发利用前景。截至现在,已有多种降解褐藻酸钠的可用方法,包括化学降解法、物理降解法和酶降解法。其中,以酸降解为主的化学降解法,具有降解条件难以控制,操作较复杂,耗时长等缺点。物理降解法包括辐射法和超声法等,一般作为辅助方法,并且其不易制得寡糖。而使用相应褐藻胶裂解酶降解褐藻酸钠具有条件温和,得率高,底物与产物特异性强等优点,褐藻胶裂解酶因此越来越多的用于作为降解生产褐藻胶寡糖的工具。另外,褐藻胶裂解酶还具有一些独特的生理及其他领域的应用,如能应用于肺囊肿性纤维化症的治疗、海藻饲料加工及海藻遗传工程等领域的研究(wongtyetal.annualreviewofmicrobiology,2000,54:289-340)。
褐藻胶裂解酶是一类多糖裂解酶,通过β-消去反应分解褐藻胶。根据裂解底物分类,可分为polym专一型(ec4.2.2.3)、polyg专一型(ec4.2.2.11)以及双功能型。另外根据降解模式,可分为内切型与外切型。其分布来源于海洋动植物和多种微生物(包括海洋细菌、土壤细菌和真菌)。截至现在的研究,已经实现通过褐藻胶裂解酶来生产可用于功能性食品的褐藻胶寡糖。因此。为了应对工业化需求,具有独特专一性及高效催化活性的褐藻胶裂解酶是非常具有现实意义的。
技术实现要素:
发明目的:本发明要解决的技术问题是提供一种新型截短的褐藻胶裂解酶aly7b-cdii。
本发明还要解决的技术问题是提供上述褐藻胶裂解酶aly7b-cdii在裂解褐藻胶中的应用。
通过对aly7b全长酶(下称全酶)两个结构域进行截短获得,根据与全酶的性质差别及相应的计算机模拟实验,分析酶中催化域表现出的内在机制。
为解决上述技术问题,本发明采用如下技术方案:
一种截短的褐藻胶裂解酶aly7b-cdii,其氨基酸序列如seqidno.2所示。是由全酶aly7b截取其第二催化域氨基酸序列190-477共288个氨基酸残基,构建重组表达为具有催化活性的aly7b-cdii。上述截短酶aly7b-cdii,其核苷酸序列如seqidno.1所示,为864bp。
上述截短酶aly7b-cdii在分离纯化后在大肠杆菌表达载体内进行表达,获得蛋白分子量为32.51kda。经过比较,在温度与ph等基础酶学性质上,截短酶aly7b-cdii表现出与全酶相近的最适温度,但是在35℃孵育1h后截短酶aly7b-cdii的酶活无影响,而全酶仅保留50%。这表明截短酶aly7b-cdii在敲去另一个截短酶aly7b-cdi结构域后,可能呈现一个更为紧密的蛋白结构,从而保证比全酶更高的热稳定性;并且,截短酶aly7b-cdii表现出更高的最适ph值,以及更为宽泛的ph稳定性范围。在金属离子影响上,截短酶aly7b-cdii与全酶在总体趋势上差别不大,但截短酶在促进作用上表现出更为敏感的作用效果。这可能是由于在没有aly7b-cdi结构域的阻碍作用后,截短酶aly7b-cdii更容易与外部结合影响。在更深入的动力学研究中,全酶针对海藻酸钠表现出比截短酶aly7b-cdii高一倍的比活力,但针对polyg截短酶aly7b-cdii表现出比全酶高的比活力。另外,截短酶aly7b-cdii对polym与polyg的km值比全酶要低,这说明aly7b-cdi的存在可能会阻碍全酶与polym与polyg的亲和力。在产物模式上,全酶以内切形式降解海藻酸钠、polym与polyg生产聚合度2-5的寡糖,而截短酶aly7b-cdii会在此基础上更进一步产生单糖。根据对接结果,截短酶aly7b-cdii催化隧道内的残基y257,q143,h145和r82可分别与亚位点-1,+1,+2和+3中的羧基形成氢键。然后,-1和+1之间的糖苷键被切割并释放单糖。
包含上述截短的褐藻胶裂解酶基因aly7b-cdii的表达载体在本发明的保护范围之内。
包含上述截短的褐藻胶裂解酶基因aly7b-cdii的细胞在本发明的保护范围之内。
一种产褐藻胶裂解酶的基因工程菌的构建方法,包括如下步骤:
(1)将截短的褐藻胶裂解酶基因克隆到表达质粒中,得到重组表达载体;
(2)将重组表达载体转化宿主菌,得到产褐藻胶裂解酶的基因工程菌。
步骤(1)中,所述的质粒为pet21a(+)。
步骤(2)中,所述的宿主菌为大肠杆菌dh5α。
上述截短的褐藻胶裂解酶aly7b-cdii在裂解褐藻酸盐或褐藻多糖制备褐藻胶寡糖中的应用在本发明的保护范围之内。
上述截短的褐藻胶裂解酶基因aly7b-cdii的细胞在发酵制备褐藻胶裂解酶中的应用在本发明的保护范围之内。
有益效果:
本发明的截短酶aly7b-cdii改造于来源海洋弧菌vibriosp.w13内的aly7b(aiy22661.1),通过截取aly7b第二催化域的190-477氨基酸残基重组构建表达。理论分子量为32.64kda。在性质上,截短酶aly7b-cdii表现出优于全酶的热稳定性及相应ph稳定性,且更易被金属离子产生促进作用。对polym及polyg表现出比全酶更高的亲和力,且能将海藻酸钠、polym与polyg三种底物降解产生单糖。可作为相应制备寡糖的工具,在农业、食品及医药等领域进行应用。
附图说明
图1:纯化的aly7b和aly7b-cdii的聚丙烯酰氨凝胶电泳图(sds-page),其中,泳道m为marker、泳道1为(aly7b)、泳道2为(aly7b-cdii)。
图2:温度、ph对于aly7b和aly7b-cdii的活性及稳定性影响曲线(a.最适温度、b.温度稳定性、c.最适ph、d.ph稳定性。)
图3:aly7b(a)和aly7b-cdii(b)的热变性曲线。
图4:褐藻胶裂解酶aly7b和aly7b-cdii降解褐藻胶、polym和polyg产物的薄层色谱(tlc)分析图。(a,c,e分别为aly7b降解褐藻胶、均聚甘露糖醛酸、古罗糖醛酸的产物;b,d,f分别为aly7b-cdii降解褐藻胶、均聚甘露糖醛酸、古罗糖醛酸的产物)
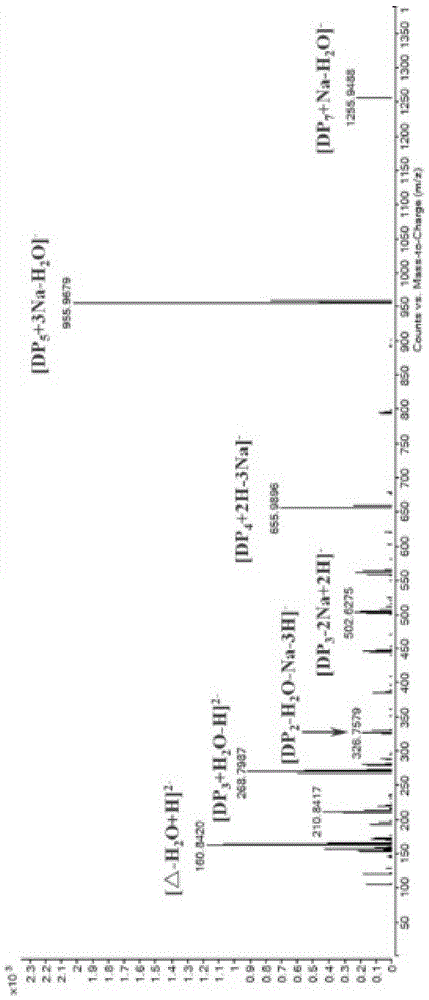
图5:aly7b-cdii酶解褐藻胶48h产物的esi-ms分析图。
图6:aly7b-cdii酶解polym48h产物的esi-ms分析图。
图7:aly7b-cdii酶解polyg48h产物的esi-ms分析图。
图8:aly7b整体结构。
图9:aly7b-cdii和alya序列比对。
图10:aly7b-cdii的计算机分子模拟图,海藻酸四糖(ggmg)与aly7b-cdii隧道状活性位点结合的立体图像,
图11:aly7b-cdii的计算机分子模拟图,负责结合和催化的催化残基图。
图12:不同金属离子对aly7b和aly7b-cdii的影响作用图。
具体实施方式
根据下述实施例,可以更好地理解本发明。实施例所描述的内容仅用于说明本发明。
实施例1:菌株vibriosp.w13的培养与基因组提取
所采用的菌株vibriosp.w13保存于本实验室。使用的培养基的配方为:
lb培养基:胰蛋白胨10g,酵母提取物5g,nacl10g,ph7.0。固体培养基添加1.5%琼脂。高压蒸汽灭菌。
牛肉膏5g、葡萄糖15g、酵母浸粉1.0g、nacl5.0g、mgso4·7h2o0.5g、cacl20.2g、kh2po41.0g、feso4·7h2o0.02g,ph值为7.0。固体培养基添加1.5%的琼脂。
将保藏菌种涂布到固体选择培养上,活化菌落在液体培养基中培养。取4ml已经培养好的菌液,置于2mltube管中,5000g,10min充分离心。弃去上清,用180μl消化液(digestionsolution)将菌体重悬,再加入20μl蛋白酶k,充分混匀后,56℃温育30min。加入20μlrnasea,充分混匀后,室温放置10min。加入200μl裂解液(lysissolution),快速混匀,过程不要超过15s。加入400μl50%(v/v)乙醇溶液,充分混匀。将上述溶液转移至吸附柱中,静置1min,离心6000g,1min,弃废液,将吸附柱转移至一个新的2mltube管中。加入500μlwashbufferi,8000g,1min离心,弃废液。加入500μlwashbufferii,8000g,1min离心,弃废液。重复一次。将空吸附柱12000g,3min离心,将柱内残留液体充分甩干。在吸附柱基质膜中间位置加入200μl洗脱液(elutionbuffer)静置1min,8000g,1min离心,即得基因组。
实施例2:截短酶aly7b-cdii的提取
根据vibriosp.w13基因组中第二催化域基因序列设计如下扩增引物:正向引物(5'-tggaatattgacgattgg-3')和反向引物(5'-atgaagagtgctcaaagcac-3')。以提取的菌株基因组为模板,进行pcr扩增得到截短体aly7b-cdii基因全长序列。pcr条件为:94℃预变性3min,随后以94℃30s、55℃30s、72℃2min进行30个循环,最后在72℃延伸10min。琼脂糖凝胶电泳显示在接近1.0kb处有一条特异性条带,将其从琼脂糖凝胶上切下,采用dna凝胶回收试剂盒进行纯化。
将纯化的dna片段连接到克隆载体peasy-bluntzerocloningvector上,转化大肠杆菌dh5α感受态细胞中,在lb固体培养基(含有氨苄青霉素)中培养后,挑取白色菌落使用扩增引物进行pcr验证。pcr条件为94℃预变性3min,随后以94℃30s、55℃30s、72℃2min进行30个循环,最后在72℃延伸10min。将出现特异性条带所对应的重组菌株大量培养,使用质粒提取试剂盒进行质粒抽提,进行测序分析。结果表明褐藻胶裂解酶基因的全核苷酸序列全长864bp,核苷酸序列如seqidno.1所示;编码288个氨基酸,氨基酸序列如seqidno.2所示,蛋白理论分子量为32.64kda。用phyre2同源建模服务器对褐藻胶裂解酶aly7b与aly7b-cdii的蛋白质三维结构进行同源建模并对其进行比对。最终得到的aly7b-cdii的蛋白质三维结构模型如图7~10所示。seqidno.1:aly7b-cdii编码基因开放阅读框(orf)全长864bp,不含有信号肽序列。seqidno.2:截短体aly7b-cdii为aly7b第二催化域。
实施例3:褐藻胶裂解酶aly7b-cdii重组表达载体构建以及相应表达纯化。
根据截短体aly7b-cdii设计正向引物(5'-tggaatattgacgattgg-3')和反向引物(5'-atgaagagtgctcaaagcac-3')。进行pcr扩增得到截短体aly7b-cdii基因全长序列。pcr条件为:94℃预变性3min,随后以94℃30s、55℃30s、72℃2min进行30个循环,最后在72℃延伸10min。筛选具有氨苄青霉素抗性的转化子,用质粒提取试剂盒抽提阳性转化子质粒,将此重组质粒命名为pet21a-aly7b-cdii。
将重组表达质粒pet21a-aly7b-cdii转化大肠杆菌菌株bl21(de3)(购自美国novagen公司),然后按照该公司提供的操作步骤进行截短体aly7b-cdii诱导表达及纯化。用聚丙烯酰胺凝胶电泳检测截短体aly7b-cdii的纯化情况,结果如图1所示,纯化后的aly7b-cdii在电泳胶上呈现单一条带,且位置与预测的分子量相吻合。
实施例5:褐藻胶裂解酶aly7b-cdii的酶学性质分析。
1、ph和温度对酶活性的影响
将质量浓度为1%褐藻酸钠底物、纯化的aly7b-cdii酶液以及不同ph值的50mm磷酸盐-柠檬酸盐(ph4.0-5.0),50mmnah2po4-na2hpo4(ph6.0-8.0),50mmtris-hcl(ph7.0-9.0)和甘氨酸-naoh(ph9.0-10.0)按5:2:13(体积比)的比例混合后,在35℃反应30分钟,紫外吸收法测酶活力。结果显示aly7b-cdii在ph9.0时达到最大活力,高于全酶aly7b。将质量浓度为1%褐藻酸钠底物与纯化的aly7b-cdii酶液分别在不同温度(25℃~55℃)反应30分钟,按紫外吸收法测酶活力。结果显示aly7b-cdii在35℃时达到最大活力,表明aly7b-cdii的最适反应温度为35℃(如图2-a,b)。
2、ph和温度对酶稳定性的影响
将在不同温度(25℃-50℃)下热处理30min后的aly7b-cdii酶液与质量浓度为1%褐藻酸钠底物溶液按1:9(体积比)的比例混合,然后在最适温度和最适ph下测定剩余酶活,以活力最高的酶液酶活定义为100%相对活力(relativeactivity),结果表明aly7b-cdii在低于40℃的温度下具有较好的热稳定性;将在4℃,不同的ph(ph4-10)预孵育24h后的aly7b-cdii酶液与质量浓度为1%褐藻酸钠底物溶液按1:9(体积比)的比例混合,然后在最适温度和最适ph下测定剩余酶活,以最大活力的酶液酶活定义为100%相对活力(relativeactivity),结果显示在ph6~10的范围内,aly7b-cdii酶活仍保持70%以上,表明aly7b-cdii对ph值耐受范围较广(如图2-c,d)。
将aly7b-cdii酶液在30-45℃进行0-1h不同时间梯度孵育,然后在最适条件下反应30min,将未孵育的酶液的对应酶活力作为100%。根据图3结果,表明aly7b-cdii在35℃孵育1h内保持稳定,表现出比全酶更高的热稳定性。
3、aly7b-cdii的酶活性及动力学
将纯化的aly7b-cdii分别与质量浓度为0.1%的褐藻酸钠、聚甘露糖醛酸片段(polym)和聚古洛糖醛酸片段(polyg)三种不同底物按1:9(体积比)的比例混合,然后在35℃,ph7.0条件下反应。取不同反应时间点的产物测其235nm紫外吸收值,发现随着酶解时间延长,235nm吸收值逐渐增加,根据紫外法测褐藻胶裂解酶的原理(qing-daanetal.processbiochemistry,2008,43:842-847),证实aly7b-cdii保留裂解酶的特性。另外,根据图5~8所示,aly7b-cdii对聚古洛糖醛酸片段、褐藻酸钠和聚甘露糖醛酸片段的降解均具有较好的降解活性,表明aly7b-cdii是一个双功能褐藻胶裂解酶。同时,该酶对于三种不同底物均具有较好的底物亲和力。
表1.截短体aly7b-cdii的底物特异性
表2.截短体aly7b-cdii的及酶动力学
实施例6:金属离子对aly7b-cdii活性的影响
将质量浓度为1%褐藻酸钠底物、纯化的aly7b-cdii酶液混合,同时向反应体系中添加不同的金属离子,添加的离子终浓度为1mm,然后在30℃反应10分钟,按前述的紫外吸收法测酶活力。对照组为不加任何金属离子时aly7b-cdii的活性(设定为100%),结果如图12。实验结果显示,aly7b和aly7b-cdii的活性都可以被mg2+,ca2+和k+活化,并且也可被一些二价离子如mn2+,cu2+和zn2+抑制。然而,相同的离子对aly7b和aly7b-cdii表现出不同程度的激活作用,如na+,k+,ca2+和mg2+。
实施例7:aly7b-cdii及aly7b对三种底物的降解产物的tlc及esi-ms分析。
将质量浓度为1%底物(褐藻酸钠、polym和polyg)、纯化的aly7b-cdii酶液9:1体系进行反应,在0-48h内不同时间取样,灭活除蛋白后将处理样品进行薄层色谱初步分析。结果如图4所示。
三种底物在48h后的产物进行预处理除蛋白和金属离子后,进行电喷雾质谱分析。电喷雾质谱条件为采用负离子模式,离子源电压:4.5kv;鞘气流速:30arb;毛细管温度:275~300℃;管镜电压:250v;扫描范围:150-2000。如图5~7所示。
实施例8:aly7b-cdii的计算机分子模拟分析
根据klebsiellapneumoniaesubsp.的褐藻胶裂解酶alya(pdbid:4ozx)的蛋白3d模型结构,使用phyre2构建aly7b-cdii的同源建模模型。结果以100%置信度通过检验。参考同源建模所得模型,将酶与四糖底物(ggmg)进行分子模拟对接,并以此模拟出截短酶aly7b-cdii催化隧道内的残基y257,q143,h145和r82与亚位点-1,+1,+2和+3中羧基的氢键连接图。结果如图8~11。
序列表
<110>南京工业大学
<120>一种截短的褐藻胶裂解酶aly7b-cdii基因及其应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>864
<212>dna
<213>人工序列(artificialsequence)
<400>1
tggaatattgacgattggaaattaaccattcctgcaagcaaaaatgattggtatggtttt60
ggcggtgacagcgcggctgaattagagcctgagcgttgtaattcaagtaaagatcttctg120
tctaacgaagagagcgtttaccaacgcgagattgatttatcatacttcaatgttattgac180
ggtagcatgcatttccgcgccgatatgggttacggcacgtcaacggccaactccagttac240
atccgttcagaattgcgagagctctacatcagtactaactccccggattgcagcaccagc300
gatgaagagacaagttggtatattgaagatagtcgtaccggtgcaacttcgcatacgcta360
aacgcaacactaagaattaacgaataccctaaaatcgacggtcaattaccaaaagtcgtg420
gtaggccagatacatggttggaaaatcagccaagcactcgtgaagctactttgggaaggt480
gacaataagccagtcagagttattctgaacgataactacaaacttgataacaacaaagac540
tgtactgattgcaacgcattcagcgttaagcttggtacctacgcggtaaacgaagactgg600
caatatacgatccgtgccgataaggaaggactgtttttagcctcctacgatgcagatggc660
agtaatatggtctcgcacacactgaagtggggagaagcatactcagacaccgctaacaac720
aagtcctatactctgactgaaagatgggcgtcgcctgatattgcgttttacttcaaagcc780
ggaatttaccctcagtttaaacctgataatgcatatcgaggagaaatctttgatgtgagc840
tttagtgctttgagcactcttcat864
<210>4
<211>288
<212>prt
<213>人工序列(artificialsequence)
<400>4
trpasnileaspasptrplysleuthrileproalaserlysasnasp
151015
trptyrglypheglyglyaspseralaalagluleugluprogluarg
202530
cysasnserserlysaspleuleuserasnglugluservaltyrgln
354045
arggluileaspleusertyrpheasnvalileaspglysermethis
505560
pheargalaaspmetglytyrglythrserthralaasnsersertyr
65707580
ileargsergluleuarggluleutyrileserthrasnserproasp
859095
cysserthrseraspglugluthrsertrptyrilegluaspserarg
100105110
thrglyalathrserhisthrleuasnalathrleuargileasnglu
115120125
tyrprolysileaspglyglnleuprolysvalvalvalglyglnile
130135140
hisglytrplysileserglnalaleuvallysleuleutrpglugly
145150155160
aspasnlysprovalargvalileleuasnaspasntyrlysleuasp
165170175
asnasnlysaspcysthraspcysasnalapheservallysleugly
180185190
thrtyralavalasngluasptrpglntyrthrileargalaasplys
195200205
gluglyleupheleualasertyraspalaaspglyserasnmetval
210215220
serhisthrleulystrpglyglualatyrseraspthralaasnasn
225230235240
lyssertyrthrleuthrgluargtrpalaserproaspilealaphe
245250255
tyrphelysalaglyiletyrproglnphelysproaspasnalatyr
260265270
argglygluilepheaspvalserpheseralaleuserthrleuhis
275280285
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
tggaatattgacgattgg18
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
atgaagagtgctcaaagcac20
- 还没有人留言评论。精彩留言会获得点赞!