一种苯甲酸衍生物锌配合物及其制备方法和应用与流程
本发明涉及金属配合物领域,具体涉及一种苯甲酸衍生物锌配合物及其制备方法和应用。
背景领域
蛋白酪氨酸磷酸酶(ptps)是细胞内广泛存在的非金属酶类,与蛋白酪氨酸激酶共同调控细胞内酪氨酸的磷酸化水平,在细胞信号传导和调节过程中发挥重要作用。研究表明,ptps活性紊乱能够引起蛋白酪氨酸磷酸化水平异常,从而引起包括癌症、糖尿病、肥胖、免疫紊乱等在内的多种人类疾病。
在一百多种已经被发现的蛋白酪氨酸磷酸酶中,蛋白酪氨酸磷酸酶1b(ptp1b)是第一个被分离纯化出来的由ptpn1基因编码的非受体ptp,研究显示,ptp1b在胰岛素和瘦素信号中起负调节作用,所以当ptp1b过量表达时,胰岛素受体、胰岛素受体底物以及瘦素等大量去磷酸化,使得胰岛素受体不能与胰岛素结合,导致了胰岛素抵抗,从而引发ⅱ型糖尿病。ptp1b基因敲除小鼠实验表明,小鼠对胰岛素的敏感性明显增强,并对肥胖具有一定的抵抗性,所以ptp1b被认为是治疗ⅱ型糖尿病和肥胖的有效靶点,高效、特异、低毒的ptp1b抑制剂也将有望成为潜在的治疗糖尿病和肥胖的候选药物。
考虑到ptps催化活性位点的保守性,某些ptps抑制剂的选择性研究仍具有一定的挑战,对于ptp1b来说,由于另外一种酪氨酸磷酸酶t细胞ptp(tcptp)与其同源性高达80%以上,所以寻找高选择性的ptp1b抑制剂就显得尤为困难,ptp1b抑制剂的选择性也逐渐成为人们研究的热点。
锌作为人体必需的过渡金属元素,基于锌配合物的ptp1b抑制剂相对于目前已进入临床的抗糖尿病钒配合物,其毒副作用明显降低,所以设计合成能够有效且选择性抑制ptp1b活性的锌配合物,将有望开发出高效、特异、低毒的抗疗糖尿病锌配合物药物。
技术实现要素:
本发明的目的在于提供一种苯甲酸衍生物锌配合物及其制备方法,以及将该配合物用作ptp1b抑制剂,进而在制备治疗糖尿病药物中应用。
本发明提供的一种苯甲酸衍生物锌配合物,其分子式为[zn(hl)br2],其中hl为2-(3-(吡啶-2-基)-1h-吡唑-1-基)苯甲酸,结构式为:
本发明提供的苯甲酸衍生物锌配合物的制备方法,制备步骤如下:
(1)将zn(no3)2·6h2o、kbr、2-(3-(吡啶-2-基)-1h-吡唑-1-基)苯甲酸分别溶于甲醇;
(2)将上述三种溶液置于一个反应容器中,60~80℃加热回流4~6h,得无色澄清溶液,过滤,一周后滤液中析出无色块状晶体。
所述的步骤(1)中zn(no3)2·6h2o、kbr、2-(3-(吡啶-2-基)-1h-吡唑-1-基)苯甲酸物质的量比为2:1:1。
所述反应温度优选为70℃加热回流;所述反应时间优选为5h。
本发明制备的锌配合物属于单斜晶系,空间群为p21/n,晶胞参数:
本发明的苯甲酸衍生物锌配合物对ptp1b的半数抑制浓度(ic50)为:0.29μm,对tcptp的半数抑制浓度(ic50)为:1.6μm,对ptp1b活性的抑制具有较好的选择性,并通过荧光光谱分析,推测锌配合物作用于ptp1b的活性位点。
与现有技术相比本发明的有益效果:本发明的锌配合物是过渡金属锌zn(no3)2·6h2o、kbr、苯甲酸配体在加热条件下反应得到,制备的方法简单,产物纯度高,产率高,可达70%。
本发明提供的锌配合物能够有效抑制ptp1b和tcptp活性,且抑制ptp1b活性的能力明显强于tcptp,所以该配合物对ptp1b活性的抑制具有高效性和选择性;本发明的锌配合物也将用作治疗ⅱ型糖尿病的潜在药物候选物。
附图说明
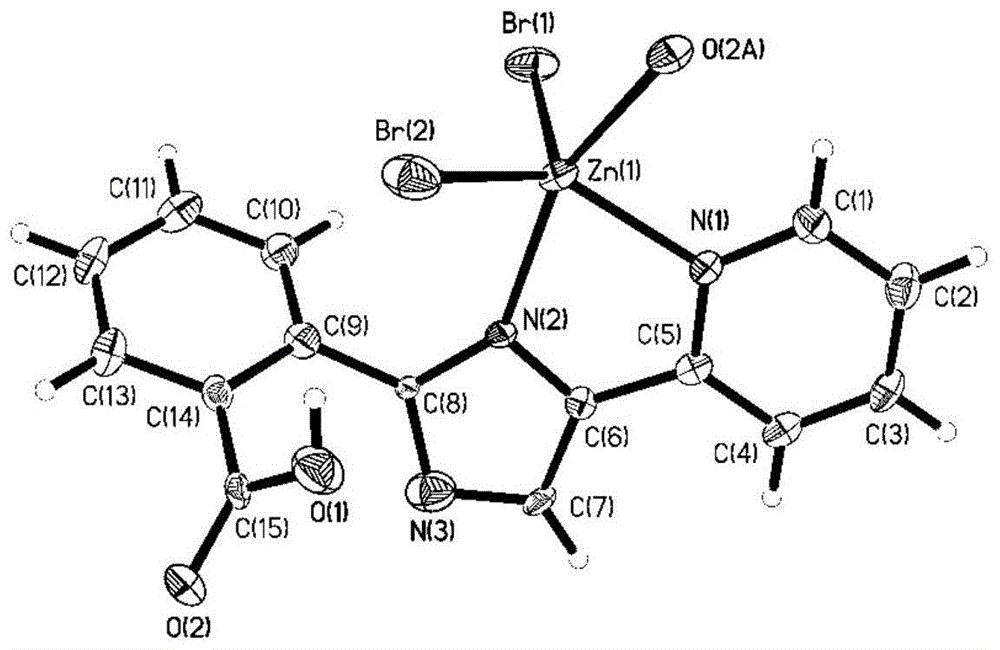
图1本发明锌配合物[zn(hl)br2]的配位环境图
图2本发明锌配合物[zn(hl)br2]的一维链状图
图3本发明锌配合物[zn(hl)br2]抑制ptp1b活性的ic50值测定曲线
图4本发明锌配合物[zn(hl)br2]抑制tcptp活性的ic50值测定曲线
图5本发明锌配合物[zn(hl)br2]对ptp1b的荧光滴定光谱图
图6本发明中依次用na3vo4和配合物[zn(hl)br2]滴定ptp1b的荧光谱图
具体实施方式
实施例1.本发明锌配合物[zn(hl)br2]的制备及晶体培养方法。
称取0.0594gzn(no3)2·6h2o溶于5ml甲醇,0.0238g溶于5ml甲醇,0.0265g(2-(3-(吡啶-2-基)-1h-吡唑-1-基)苯甲酸溶于10ml甲醇,将上述三种溶液置于圆底烧瓶中,70℃加热回流5h,得无色澄清溶液,过滤,一周后滤液在室温下析出无色块状晶体。收集晶体分别用水、甲醇各洗涤三次,真空干燥,产率为70%。元素分析c15h11br2n3o2zn:理论值:c,36.73,h,2.26n,8.57;实验值:c,36.86,h,2.23,n,8.74。
实施例2.本发明配合物[zn(hl)br2]的单晶x-ray衍射试验条件和晶体结构分析。
尝试了各种结晶的方法,通过常温挥发我们得到配合物的单晶。配合物晶体结构的测试是在显微镜下挑选形状规则、比较透明的块状单晶黏于玻璃丝上,用brukerapex-ⅱccd衍射仪在北京同步辐射(bsrf)3w1a线站上进行测试。选用石墨单色器
表1锌配合物的晶体学数据
表2锌配合物的部分主要键长
实施例3.本发明锌配合物对ptp1b和tcptp活性抑制的ic50值测定
ic50测定原理:
蛋白酪氨酸磷酸酶(ptps)能够将其反应底物对硝基苯磷酸二钠盐(pnpp)分解成黄色的对硝基苯酚(pnp),pnp在405nm处有很强的紫外吸收吸收,其摩尔消光系数ε=1.78×104(mol-1·l·cm)-1,在ptps抑制实验中,可通过检测405nm处吸光度值的变化来间接检测酶活性的变化情况。
在本实验中ptps的活性抑制实验均以pnpp为反应底物,在(20mmmops,50mmnacl,ph=7.24)的mops缓冲液中进行,最后用2m的naoh终止反应,将酶标仪所测数据用origin程序拟合即可得到配合物抑制酶的半数抑制浓度ic50值。通过ic50值的大小可以判断抑制剂抑制能力的强弱,ic50值越小,说明抑制剂的抑制效果越好。
ic50值测定的实验步骤:在96孔板中,前三排加入含酶的mops缓冲溶液(50mmnacl,20mmmops,ph=7.24),为了扣除溶液体系本身吸收对测定结果的影响,在第四排中加入不含酶的mops缓冲溶液,作为空白组。然后在第一列中加入10μldmso溶液作为对照组,之后的每一列中,按照浓度递增的顺序依次加入10μl不同浓度的配合物溶液,将96孔板置于水浴锅中,37℃恒温反应30min后,用2μlpnpp启动反应,约半个小时后,96孔板中的溶液变黄,最后加5μlnaoh(2m)终止反应,然后用酶标仪测量反应体系在405nm处的紫外吸光度值,将数据用origin程序拟合处理后,即可得到配合物抑制ptps活性的ic50值,为了尽可能减少实验误差,每个配合物的ic50值测定结果至少重复三次以上,而且每次配合物可用三天,含酶的mops缓冲溶液需要现配现用。实验结果显示,锌配合物[zn(hl)br2]能够有效抑制ptp1b活性,其ic50值为0.29μm(如图3),同时该配合物也能抑制tcptp活性,其ic50值为1.6μm(如图4),比较锌配合物抑制两种酶活性的ic50值大小可以发现,该配合物抑制ptp1b活性的能力约是其抑制tcptp活性能力的6倍,表明该锌配合物对ptp1b的抑制具有较好的选择性。
实施例4.本发明锌配合物对ptp1b的荧光增强作用
蛋白质分子中由于含有酪氨酸和色氨酸残而使其具有天然荧光,当向蛋白溶液中加入一些小分子后,小分子与蛋白分子的结合会影响到蛋白分子微环境的变化,从而引起蛋白分子的荧光变化,可以借助蛋白分子的荧光信号的变化来研究他们的作用模式和机理。所以我们研究了本发明配合物对ptp1b的荧光增强作用。图5所示为扣除了配合物本身的荧光强度之后,配合物滴定ptp1b的荧光光谱图,从图中可以看出随着配合物的浓度逐渐增加,ptp1b在351nm处的荧光强度逐渐增加,直至增加到一定程度后,荧光强度几乎不变,这可能是配合物与ptp1b结合形成的复合物的荧光峰,这个实验结果进一步证明了锌配合物与ptp1b之间的相互作用。
实施例5.本发明锌配合物与ptp1b可能结合位点的研究
众所周知,抑制剂对对酶活性的抑制作用方式有很多种,其中较为常见的就是竞争型抑制,该类抑制剂也称为竞争型抑制剂,它指的是抑制剂与底物在结构上有相似性,与底物竞争性的与酶的活性位点结合,为了证明配合物是否与ptp1b的活性位点结合,如图6所示,首先用钒酸钠滴定ptp1b至荧光强度不变,钒酸钠与ptp1b活性位点完全结合,继续向二者的混合溶液中滴加配合物,发现配合物的加入并没有改变溶液的荧光强度,表明钒酸钠“锁定”ptp1b的活性位点后配合物不能再与ptp1b结合,由此推测出配合物[zn(hl)br2]可能作用于ptp1b的活性位点。
- 还没有人留言评论。精彩留言会获得点赞!