一种用于检测传染性脾肾坏死病毒的数字PCR检测引物及试剂盒的制作方法
本发明属于水生动物病毒检测技术领域,更具体地,涉及传染性脾肾坏死病毒微滴数字pcr检测引物及试剂盒。
背景技术:
传染性脾肾坏死病毒(infectiousspleenandkidneynecrosisvirus,isknv)属于虹彩病毒科(iridoviridae),肿大病毒属(megalocytivirus)。isknv宿主范围广泛,可以感染全世界范围内鲈形目、鳉形目、鲱形目、鲀形目、灯笼鱼目、鲻形目和鲽形目等50多种海水和淡水鱼类。付小哲等通过对33株不同宿主来源的肿大病毒的外膜蛋白进行同源性比对发现肿大病毒可以分为3个型,i型主要感染海水鱼,ii型主要感染淡水鱼,iii型主要感染鲆鲽类。isknv则分为i型和ii型2种基因型。isknv于1998年最早在我国的鳜鱼上发现,现在已经发现其可以感染大口黑鲈、乌鳢、太阳鱼和石斑鱼等多种鱼类。该病的病程短,危害大,死亡率高,对我国的水产养殖业造成巨大的损失。
目前已报道的实验室检测isknv的方法主要包括病毒分离、电镜观察与鉴定、聚合酶链反应(pcr)、间接酶联免疫吸附实验(间接elisa)、荧光定量pcr(qpcr)和环介导等温扩增(lamp)等。传统的分离鉴定方法存在需要昂贵的仪器设备,耗时长等不足。pcr、qpcr和lamp等方法与以前的检测方法相比,虽然具有灵敏度高、特异性强、操作简便等特点,但是上述方法均只能实现定性和半定量的检测,且对低浓度病毒的定量结果较不稳定,无法在病毒低含量样品实现精准检测。
微滴式数字pcr(dropletdigitalpolymerasechainreaction,ddpcr)是20世纪末,vogelstein等提出的一项核酸定量检测新技术。通过将一个样本分成20,000个纳升级的微滴,分配到不同的反应单元,每个单元包含一个或多个拷贝的目标分子(dna模板),本质上将传统定量pcr的一个反应变成20,000个反应,在每个反应单元中分别对目标分子进行pcr扩增,扩增结束后对各个反应单元的荧光信号进行判读,根据泊松分布原理以及阳性微滴的比例,分析软件可计算给出待检靶分子的浓度或拷贝数,大大提高了核酸序列检测的灵敏度和精准度。与传统的定量pcr相比,ddpcr可以不需要对照标准样品和标准曲线来实现绝对定量分析,精确度和灵敏度更佳。将ddpcr技术用于isknv的检测,可以实现快速、准确的对isknv核酸进行绝对定量。
技术实现要素:
本发明的目的在于克服上述现有技术的不足之处而提供一种用于检测传染性脾肾坏死病毒的数字pcr检测引物及试剂盒。采用本发明设计的特异性引物和探针与数字pcr结合的方式来检测传染性脾肾坏死病毒(isknv)。
为实现上述目的,本发明采取的技术方案为:
第一方面本发明提供了一种用于检测传染性脾肾坏死病毒的数字pcr检测引物和特异性探针,所述引物的上游核苷酸序列如seqidno:1所示,其下游核苷酸序列如seqidno:2所示;所述特异性探针的核苷酸序列如seqidno:3所示。
第二方面本发明提供了如上所述的引物和特异性探针在制备用于检测传染性脾肾坏死病毒的试剂盒或检测试剂中的应用。
第三方面本发明提供了一种用于检测传染性脾肾坏死病毒的试剂盒,所述试剂盒包含如上所述的引物和特异性探针。
优选地,所述试剂盒还包括无rna酶的蒸馏水,一步法ddpcr探针法预混液,探针法ddpcr微滴发生油,质控液,阴性对照和阳性对照。
优选地,一步法ddpcr探针法预混液包括:500μl的2×one-stepddpcrsupermixforprobes,分别为50μl的上、下游引物,50μl的特异性探针,300μl的rnase酶蒸馏水,所述一步法ddpcr探针法预混液的总体积为950μl。
优选地,所述上下引物和特异性探针的浓度均为10μm。
优选地,所述阳性对照为含有传染性脾肾坏死病毒基因组的质粒;所述阴性对照为无rna酶蒸馏水。
第四方面本发明提供了如上所述的试剂盒在微滴数字pcr中的应用。
优选地,所述微滴数字pcr反应程序中的退火温度为55-65℃,退火时间为60秒。
优选地,所述微滴数字pcr反应程序中的退火温度为55℃。
本发明的有益效果:本发明采用微滴数字pcr技术检测isknv病毒,其检测的灵敏度高,不用设置标准曲线,根据检测结果可以直接判读样品中isknv的核酸拷贝数,极大的简化了操作步骤。
附图说明
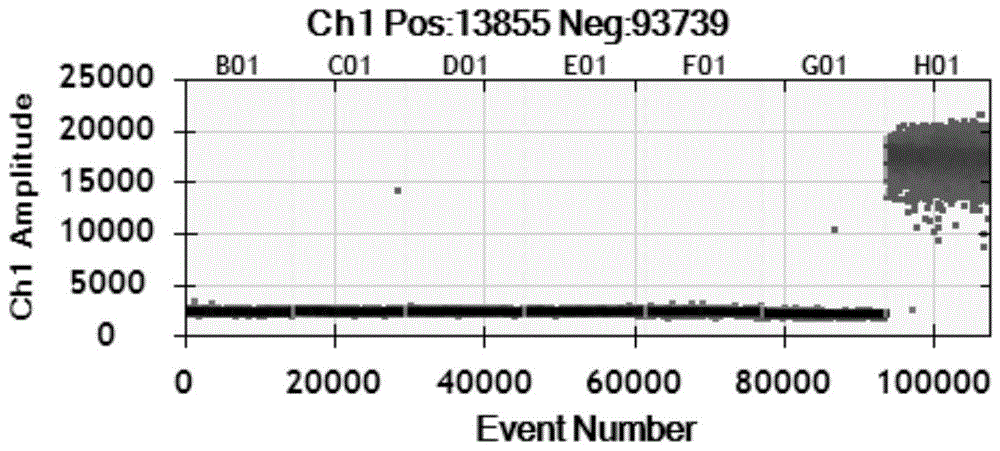
图1为本发明实施例3验证本发明引物和探针的特异性实验结果示意图(其中b01表示:大口黑鲈虹彩病毒(largemouthbassvirus,lmbv)、、;c01表示:石斑鱼虹彩病毒(singaporegrouperiridovirus,sgiv)、;d01表示:蛙病毒(frogvirus3,fv3);e01表示:甲鱼虹彩病毒(soft-shelledtutleiridovirus,stiv);f01表示:鳜鱼蛙虹彩病毒(santee-cooperranaviruses,scriv);g01表示:阴性对照组(无rna酶蒸馏水);h01表示:isknv阳性质粒。
图2为本发明实施例4对检测isknv的数字pcr检测方法的退火温度优化结果示意图(其中a01表示:65℃;b01表示:64.5℃;c01表示:63.3℃;d01表示:61.4℃;e01表示:59℃;f01表示:57℃;g01表示:55.7℃;h01表示55℃。
图3为本发明实施例5验证试剂盒中的引物和特异性探针以及检测方法的灵敏度实验结果示意图(其中a02表示:4×104copies/μl;b02表示:4×103copies/μl;c02表示:4×102copies/μl;d02表示:4×101copies/μl;e02表示:4×100copies/μl;f02表示:阴性对照组(无rna酶蒸馏水))。
具体实施方式
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例及其附图对本发明做进一步的详细描述。
实施例1
本实施例提供一种用于检测isknv的数字pcr检测试剂盒,包括无rna酶的蒸馏水,一步法ddpcr探针法预混液,探针法ddpcr微滴发生油,质控液,阴性对照和阳性对照。
所述一步法ddpcr探针法预混液包括:500μl的2×one-stepddpcrsupermixforprobes,上、下游引物分别为50μl,特异探针为50μl,引物和探针的浓度均为10μm,以及无rnase酶蒸馏水300μl,总体积为950μl。
所述阳性对照为含有传染性脾肾坏死病毒基因组的质粒,阴性对照为无rna酶蒸馏水。
所述引物和探针核苷酸序列分别如下:
isknv-f:caccctggctaacattggca(seqidno:1)
isknv-r:cacaacctcacgctcctcac(seqidno:2)
isknv-probe:fam-acccgcactgaccaacgtgtccgt-mgb(seqidno:3)
实施例2
本实施例提供一种用于检测isknv的数字pcr检测方法,采用实施例1的试剂盒进行检测,具体检测方法包括如下步骤:
(1)提取待测样品的dna,作为pcr反应模板。
(2)配制ddpcr反应液,体积20μl,其配方为:一步法ddpcr探针法预混液18μl(其中包含所述引物、探针和无rnase酶蒸馏水),待测样品dna模板为2μl。
(3)制备微滴,按照液滴发生板上标记位置,分别在样品孔和油位孔加入ddpcr反应液20μl和微滴发生油70μl,然后将固定有微滴发生卡的底座置于微滴发生仪中生成微滴;将液滴生成孔中生成的微滴(一般在42μl左右)以一一对应的方式全部转入96孔板,用热封仪进行封膜,
(4)将封好膜的96孔板转入pcr仪中进行扩增,pcr扩增程序为95℃预变性10min;94℃变性30sec,55℃退火60sec,共40个循环;98℃10min,4℃恒温,结束反应,每步都设置2.5℃/sec的降温速度。
(5)将完成pcr扩增的pcr板放入微滴分析仪中,使用微滴分析仪检测微滴进行读数,分析每管反应体系中发出荧光的微滴数,显示样品中传染性脾肾坏死病毒检测结果。
实施例3
本实施例验证本发明提供的检测引物和探针的特异性,具体操作如下:
利用实施例1所述的试剂盒和实施例2所述的方法,对待测病毒dna进行检测,同时设置阳性对照组(isknv阳性质粒)和阴性对照组(无rna酶蒸馏水),使用的待测病毒包括大口黑鲈虹彩病毒(largemouthbassvirus,lmbv)、石斑鱼虹彩病毒(singaporegrouperiridovirus,sgiv)、蛙病毒(frogvirus3,fv3)、甲鱼虹彩病毒(soft-shelledtutleiridovirus,stiv)、鳜鱼蛙虹彩病毒(santee-cooperranaviruses,scriv)。
实验结果如图1所示,仅阳性对照组(isknv)可检测到信号,其余各组均无信号未阴性,说明该方法的引物和探针具有良好的特异性。
实施例4
本实施例对检测isknv的数字pcr检测方法的退火温度进行了优化,具体操作如下:
利用实施例1所述的试剂盒和实施例2所述的方法,形成微滴,上pcr仪扩增,pcr的扩增程序为:50℃反转录10min;95℃预变性10min;94℃变性30sec,55-65℃退火60sec(仪器自动分布8个温度梯度,分别为65℃、64.5℃、63.3℃、61.4℃、59℃、57℃、55.7℃、55℃),共40个循环;98℃10min结束反应。使用微滴分析仪检测微滴进行读数,分析每管反应体系中发出荧光的微滴数。
实验结果如图2所示,退火温度65℃、64.5℃、63.3℃、61.4℃、59℃、57℃、55.7℃、55℃对应的拷贝数分别为0copies,0copies,88copies,50copies,124copies,128copies,148copies,156copies。因此,根据结果显示选择55℃为本发明的最佳退火温度。
实施例5
本实施例验证了本发明试剂盒中的引物和特异性探针以及检测方法的灵敏度,具体操作如下:
本实验采用isknv阳性质粒进行10倍梯度连续稀释,共设置5个梯度(4×104copies/μl、4×103copies/μl、4×102copies/μl、4×101copies/μl、4×100copies/μl),按照实施例1所述的试剂盒和实施例2所述的方法进行检测。
实验结果如图3所示,本发明建立的ddpcr检测方法最低检出限为1.8copies/μl个拷贝数。
实施例6
采用ddpcr和taqman荧光定量pcr方法分别检测广东省内采集的样品,比较两种方法的检测准确性和灵敏度。结果如表1所示,实验数据结果表明ddpcr检测到15份阳性样品,而taqman荧光定量检测到7份阳性样品,qpcr检测到的阳性样品ddpcr均得到一致的检查结果,但8份ddpcr阳性样品中病毒含量极低,所以导致qpcr无法对样品进行读数,表明ddpcr更具高灵敏度。
表1ddpcr和qpcr样品检测结果
-表示negative
表1的检测结果证明了本发明的试剂盒特异性好、灵敏度高、可直接定量,与其他定量pcr检测方法相比结果更加准确可靠。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>中国水产科学研究院珠江水产研究所
<120>一种用于检测传染性脾肾坏死病毒的数字pcr检测引物及试剂盒
<130>7.4
<160>3
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>合成
<400>1
caccctggctaacattggca20
<210>2
<211>20
<212>dna
<213>合成
<400>2
cacaacctcacgctcctcac20
<210>3
<211>24
<212>dna
<213>合成
<400>3
acccgcactgaccaacgtgtccgt24
- 还没有人留言评论。精彩留言会获得点赞!