一种共轭(E)-3-环烯基丙烯酸酯衍生物的合成方法与流程
本发明属于化合物合成制备领域,具体涉及一种共轭(e)-3-环烯基丙烯酸酯衍生物的合成方法。
背景技术:
通过导向基实现烯烃烯基位c–h活化反应一直是有机合成领域的研究热点。两种不同烯烃之间的交叉偶联所得到的1,3-二烯,不仅是有机合成和天然产物中重要的合成目标,还在功能材料、药物活性化合物的合成中也有较为广泛的应用。因此,从相应的底物出发,构建有效地合成方案对于有机和药物化学领域具有十分重要的意义。
迄今为止,已有一些共轭二烯衍生物的合成方法的文献,其中具有代表性的方法有:
(1)由乙烯基对甲苯磺酸酯和平电子烯烃或苯乙烯衍生物以[pdcl2(cod)]、hbf4p(tbu)3、licl、cy2nme2、溶剂dmf、110℃的条件反应,产率51-99%(angew.chem.int.ed.2006,45,3349-3353);或由芳香、杂芳或烯类底物和烯基、芳基硼试剂在fe(acac)3、dppen、znbr2·tmeda、dcib、溶剂thf且70℃的条件反应,存在z/e构型,收率高达99%(j.am.chem.soc.2014,136,14349-14352);或由丙烯酰胺和溴-3,3,3-三氟丙烯或2-溴-3,3,4,4,4-五氟丁烯以pd(acac)2为催化剂,agotf为氧化剂,140℃,溶剂dmi中反应,分离产率18-62%(org.lett.2017,19,2106-2109),
(2)loh通过苯乙烯类化合物、丙烯酸酯或含烯键的链醇与丙烯酸酯在[pd]/[ru]催化下得到含二烯骨架的丙烯酸酯衍生物,z/e比例可高达99:1,主要是(chem.commun.2012,48,11232–11234),(chem.eur.j.2012,18,13284-13287),(j.am.chem.soc.2015,137,3169-3172),(angew.chem.int.ed.2017,56,5091-5095);song通过烯醇醚与丙烯酸酯或苯乙烯在醋酸钯催化下可得到具有相似骨架的二烯衍生物,用双硅烷作为导向基且反应具有较高的z/e选择性(chem.commun.2015,51,15546-15549);ishii以丙烯酸酯和羧酸乙烯酯在醋酸钯催化下进行氧化偶联反应,产率45-76%(org.lett.2004,6,4623-4625);glorius以α/β取代的丙烯酰胺或烯胺和烯烃在[{rhcp*cl2}]2催化下反应可合1,3-二烯衍生物,产率为37-82%(chem.eur.j.2011,17,7167-7171);zhong以丙烯酰胺和平电子烯烃在[rhcp*cl2]2催化下生成二烯,产率45-90%(org.biomol.chem.2017,15,1236-1244)。
(3)以n-磺酰基烯丙胺与丙烯酸酯以[rhcp*cl2]2为催化剂,乙酸银为氧化剂,100℃,丙酮溶剂中反应即可得到含二烯骨架的丙烯酸酯衍生物,产率49-75%(参见org.biomol.chem.,2013,11,2761-2765);或以两种不同的烯烃在醋酸钯或醋酸钴催化下合成共轭二烯,产率高达97%(j.am.chem.soc.2018,140,5805-5813)。
但上述合成方法仍存在缺陷和不足,主要体现在:
1)上述反应部分烯烃或苯环需要预先官能团化,然后在金属试剂的催化下发生偶联反应得到目标产物,反应过程产生化学计量的副产物,且大多反应在某些条件下存在z/e构型混合物,无原子和步骤经济性,且底物范围很受限制。
2)上述方法中有些反应使用了较为昂贵的金属试剂作为催化剂,且反应时间较长也使得它们的进一步应用受到限制。
因此,有必要对现有合成共轭二烯衍生物的方法进行改进,获得一种高效、经济、反应条件简单且具有高立体选择性的合成1,3-二烯类化合物的方法。
技术实现要素:
有鉴于此,本发明的目的在于提供一种共轭(e)-3-环烯基丙烯酸酯衍生物的合成方法。
为达到上述目的,本发明提供如下技术方案:
1、一种共轭(e)-3-环烯基丙烯酸酯衍生物的合成方法,反应通式如下:
r1为氢、烷基、或者苯并基衍生物;
r2为氢、烷基或者取代苯基;
x为碳或者氮;
n为1、2、3或4;
pa为2-吡啶羰基;
fg为甲氧酰基、乙氧酰基、丁氧酰基、己氧酰基、叔丁氧酰基、环己氧酰基、三氟甲氧酰基、2-羟基乙氧酰基、2-甲氧基乙氧酰基、四氢呋喃-2-甲氧酰基、苄氧酰基、苯氧酰基、二乙基膦酰基、n,,n-二甲基甲酰基或(8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊基[a]菲基;
所述催化剂为醋酸钯、氯化钯或者溴化钯中的任意一种;
所述添加剂为碳酸氢钾、碳酸钾,三乙胺或者碳酸铯中的任意一种;
所述氧化剂为一水合醋酸铜或者碳酸银。
优选的,所述方法具体步骤如下:
首先向反应容器中加入催化剂、添加剂、氧化剂和通式ii的化合物,然后将通式i的化合物溶解在有机溶剂中,溶解后加入所述反应容器中,在空气浴中加热到130℃反应2~16h,反应结束后分离提纯即可。
优选的,通式i的化合物为n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺、n-(2-(环戊-1-烯-1-基)乙基)吡啶酰胺、n-(2-(环庚-1-烯-1-基)乙基)吡啶酰胺、n-(2-(环辛-1-烯-1-基)乙基)吡啶酰胺、n-(2-(4-甲基环己-1-烯-1-基)乙基)吡啶酰胺、n-(2-(4,4-二甲基环己-1-烯-1-基)乙基)吡啶酰胺、n-(2-(4-叔丁基环己-1-烯-1-基)乙基)吡啶酰胺、n-(2-(1,2,3,6-四氢-[1,1’-联苯]-4-基)乙基)吡啶酰胺、n-(2-(4,4-二氟环己-1-烯-1-基)乙基)吡啶酰胺、n-(2-(环己-1-烯-1-基)-1-(3-甲氧基苯基)乙基)吡啶酰胺、n-(2-(1h-吲哚-3-基)乙基)吡啶酰胺或(8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊基[a]菲-3-丙烯酸酯中的任意一种。
优选的,通式ⅱ的化合物为丙烯酸甲酯、丙烯酸乙酯、丙烯酸正丁酯、丙烯酸己酯、丙烯酸叔丁酯、丙烯酸环己酯、丙烯酸三氟乙酯、2-羟基乙基丙烯酸酯、2-甲氧基乙基丙烯酸酯、丙烯酸四氢糠酯、丙烯酸苄酯、丙烯酸苯酯、乙烯基膦酸二乙酯或n,n-二甲基丙烯酰胺中的任意一种。
优选的,通式i的化合物与通式ii的所示化合物的摩尔比为1:1.5~4。
优选的,所述催化剂与通式i的化合物的摩尔比为1:5~10。
优选的,所述添加剂与通式i的化合物的摩尔比为5:2。
优选的,所述氧化剂与通式i的化合物的摩尔比为1:2。
优选的,反应中通式i的化合物与有机溶剂的摩尔体积比为1:2.5~5,mol:l,所述有机溶剂为叔戊醇或者甲苯。
优选的,所述分离提纯具体为:用硅胶柱分离提纯,所述分离提纯时选取体积比为0~8:1的石油醚和乙酸乙酯的混合溶剂作为洗脱剂。
本发明的有益效果在于:
1、本发明公开了一种共轭(e)-3-环烯基丙烯酸酯衍生物的合成方法,使用含有双齿导向基吡啶甲酰氨基的环烯为原料,原料廉价易得,并且不需要对烯烃预先进行官能团化,因此可以减少反应过程中副产物的产生,提交原料的利用率和产物产率;
2、本发明的合成方法中采用“一锅法”,将不同的反应物进行反应,并且反应条件简单,可以降低生产成本,金属催化剂可以通过氧化实现循环使用,具有原子和步骤经济性;
3、通过本发明的合成方法合成的3-环烯基丙烯酸酯衍生物具有较高的立体选择性,且反应最高收率可达80%。
本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
图1为以实施例1为例的本发明合成方法的反应机理。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
实施例1
乙基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-1)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸乙酯44μl(0.40mmol)和0.5ml溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液,空气氛下加热到130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-153mg;产率为80%;淡黄色固体;m.p.82-83℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.6hz,1h),8.17(d,j=7.8hz,1h),8.14(s,1h),7.83(dd,j=7.7,1.5hz,1h),7.80(d,j=15.8hz,1h),7.44–7.34(m,1h),5.77(d,j=15.6hz,1h),4.14(q,j=7.1hz,2h),3.57(q,j=6.8hz,2h),2.62(t,j=7.3hz,2h),2.30–2.25(m,2h),2.20–2.13(m,2h),1.72–1.57(m,4h),1.27(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.69,164.20,149.89,147.94,143.50,141.88,137.16,129.50,125.94,122.05,115.76,60.01,38.40,33.73,31.60,25.39,22.43,22.30,14.27;hrms(esi/tof-q):m/zcalcd.forc19h24n2o3[m+h]+,329.1865;found,329.1859。
实施例2
甲基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-2)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸甲酯36μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-248mg;产率为76%;淡黄色油状;1hnmr(600mhz,cdcl3)δ=8.50(d,j=3.7hz,1h),8.18(d,j=7.7hz,1h),8.14(s,1h),7.85–7.81(m,1h),7.79(d,j=15.6hz,1h),7.42–7.38(m,1h),5.77(d,j=15.6hz,1h),3.68(s,3h),3.57(q,j=6.8hz,2h),2.62(t,j=7.0hz,2h),2.31–2.24(m,2h),2.18–2.13(m,2h),1.70–1.62(m,4h);13cnmr(151mhz,cdcl3)δ=168.13,164.26,149.90,147.98,143.76,142.16,137.20,129.52,126.00,122.10,115.33,51.31,38.43,33.77,31.66,25.39,22.45,22.31;hrms(esi/tof-q):m/zcalcd.forc18h22n2o3[m+h]+,315.1709;found,315.1701。
实施例3
丁基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-3)的制备
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸正丁酯57μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-353mg;产率为75%;淡黄色固体;m.p.83-84℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.1hz,1h),8.17(d,j=7.8hz,1h),8.13(s,1h),7.83(dd,j=7.7,1.6hz,1h),7.80(d,j=15.7hz,1h),7.42–7.38(m,1h),5.78(d,j=15.6hz,1h),4.09(t,j=6.7hz,2h),3.57(q,j=6.7hz,2h),2.62(t,j=7.3hz,2h),2.31–2.24(m,2h),2.21–2.14(m,2h),1.69–1.59(m,6h),1.43–1.34(m,2h),0.94(t,j=7.4hz,3h);13cnmr(151mhz,cdcl3)δ=167.83,164.22,149.91,147.97,143.52,141.88,137.18,129.53,125.97,122.08,115.79,64.01,38.45,33.76,31.64,30.79,25.43,22.47,22.32,19.18,13.71;hrms(esi/tof-q):m/zcalcd.forc21h28n2o3[m+h]+,357.2178;found,357.2171。
实施例4
己基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-4)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸己酯70μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为5:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-455mg;产率为72%;淡黄色固体;m.p.84-85℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.6hz,1h),8.17(d,j=7.7hz,1h),8.13(s,1h),7.83(d,j=7.3hz,1h),7.80(d,j=15.5hz,1h),7.40(dd,j=7.4,4.8hz,1h),5.78(d,j=15.5hz,1h),4.08(t,j=6.8hz,2h),3.57(q,j=6.8hz,2h),2.62(t,j=7.3hz,2h),2.28(t,j=5.8hz,2h),2.17(d,j=5.6hz,2h),1.66–1.62(m,4h),1.40–1.24(m,8h),0.89(t,j=6.7hz,3h);13cnmr(151mhz,cdcl3)δ=167.83,164.22,149.93,147.97,143.50,141.87,137.18,129.53,125.96,122.09,115.81,64.32,38.46,33.76,31.65,31.46,28.69,25.63,25.44,22.52,22.47,22.33,13.95;hrms(esi/tof-q):m/zcalcd.forc23h32n2o3[m+h]+,385.2491;found,385.2486。
实施例5
叔丁基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-5)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸叔丁酯58μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为5:1的石油醚和乙酸乙酯的混合溶剂,即可得化合物iii-550mg;产率为70%;淡黄色固体;m.p.94-95℃;1hnmr(600mhz,cdcl3)δ=8.52(d,j=4.2hz,1h),8.17(d,j=7.8hz,1h),8.14(s,1h),7.84–7.81(m,1h),7.73(d,j=15.5hz,1h),7.42–7.38(m,1h),5.72(d,j=15.5hz,1h),3.56(q,j=6.8hz,2h),2.61(t,j=7.3hz,2h),2.27(t,j=5.0hz,2h),2.17–2.13(m,2h),1.68–1.61(m,4h),1.46(s,9h);13cnmr(151mhz,cdcl3)δ=167.20,164.22,149.92,148.01,142.83,140.96,137.20,129.48,125.97,122.08,117.60,79.86,38.47,33.70,31.60,28.21,25.48,22.50,22.37;hrms(esi/tof-q):m/zcalcd.forc21h28n2o3[m+h]+,357.2178;found,357.2176。
实施例6
环己基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己基-1-烯-1-基)丙烯酸酯(化合物iii-6)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸环己酯63μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为5:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-657mg;产率为75%;黄色固体;m.p.70-71℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.3hz,1h),8.17(d,j=7.8hz,1h),8.13(s,1h),7.83(d,j=7.7hz,1h),7.80(d,j=15.7hz,1h),7.43–7.38(m,1h),5.78(d,j=15.5hz,1h),4.78(td,j=8.8,4.2hz,1h),3.57(q,j=6.9hz,2h),2.62(t,j=7.3hz,2h),2.29–2.26(m,2h),2.19–2.15(m,2h),1.87–1.60(m,10h),1.45–1.34(m,4h);13cnmr(151mhz,cdcl3)δ=167.21,164.22,149.88,148.00,143.27,141.62,137.20,129.56,125.99,122.10,116.39,72.22,38.46,33.75,31.71,31.62,25.46,23.78,22.48,22.35;hrms(esi/tof-q):m/zcalcd.forc23h30n2o3[m+h]+,383.2335;found,383.2335。
实施例7
2,2,2-三氟乙基(e)-3-(2-(2-吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-7)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸三氟乙酯51μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为6:1石油醚和乙酸乙酯的混合溶液,即可得化合物iii-749mg;产率为64%;黄色油状;1hnmr(600mhz,cdcl3)δ=8.49(s,1h),8.17(d,j=7.5hz,1h),8.13(s,1h),7.90(d,j=15.5hz,1h),7.83(t,j=6.8hz,1h),7.43–7.35(m,1h),5.80(d,j=15.5hz,1h),4.47(q,j=8.4hz,2h),3.58(q,j=6.5hz,2h),2.63(t,j=6.4hz,2h),2.33–2.27(m,2h),2.19–2.13(m,2h),1.70–1.61(m,4h);13cnmr(151mhz,cdcl3)δ=165.90,164.25,149.85,147.93,145.76,144.43,137.19,129.54,125.99,125.92,124.08,122.24,122.11,120.40,113.24,60.41,60.17,59.93,59.69,38.38,33.90,31.76,25.36,22.35,22.20;hrms(esi/tof-q):m/zcalcd.forc19h21f3n2o3[m+h]+,383.1583;found,383.1580。
实施例8
2-羟乙基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-8)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、2-羟基乙基丙烯酸酯42μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为1:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-833mg;率为48%;黄色油状;1hnmr(600mhz,cdcl3)δ=8.52(d,j=4.0hz,1h),8.35(s,1h),8.23(d,j=7.8hz,1h),8.14(d,j=15.6hz,1h),7.86(t,j=7.6hz,1h),7.45–7.39(m,1h),5.77(d,j=15.6hz,1h),4.76(s,1h),4.28–4.24(m,2h),3.93(s,2h),3.48(q,j=6.9hz,2h),2.66–2.58(m,2h),2.28–2.22(m,2h),2.19–2.14(m,2h),1.71–1.60(m,4h);13cnmr(151mhz,cdcl3)δ=167.68,165.28,149.51,148.05,143.21,142.56,137.54,129.93,126.27,122.26,115.58,66.58,61.01,39.42,33.85,31.96,25.00,22.49,22.28;hrms(esi/tof-q):m/zcalcd.forc19h24n2o4[m+h]+,345.1814;found,345.1812。
实施例9
2-甲氧基乙基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-9)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、2-甲氧基乙基丙烯酸酯52μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为2:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-950mg;产率为70%;黄色油状;1hnmr(600mhz,cdcl3)δ=8.51(d,j=3.7hz,1h),8.20–8.10(m,2h),7.87–7.79(m,2h),7.40(dd,j=7.7,4.6hz,1h),5.84(d,j=15.5hz,1h),4.26(t,j=4.8hz,2h),3.62(t,j=4.8hz,2h),3.56(q,j=7.0hz,2h),3.40(s,3h),2.62(t,j=7.4hz,2h),2.30–2.25(m,2h),2.17–2.13(m,2h),1.68–1.60(m,4h);13cnmr(151mhz,cdcl3)δ=167.67,164.23,149.90,147.98,143.94,142.45,137.18,129.53,125.98,122.08,115.32,70.61,63.17,58.95,38.47,33.77,31.66,25.41,22.43,22.30;hrms(esi/tof-q):m/zcalcd.forc20h26n2o4[m+h]+,359.1971;found,359.1968。
实施例10
(四氢呋喃-2-基)甲基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-10)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸四氢糠酯59μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为1:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1054mg;产率为70%;黄色固体;m.p.64-65℃;1hnmr(600mhz,cdcl3)δ=8.51(s,1h),8.19–8.11(m,2h),7.87–7.77(m,2h),7.43–7.37(m,1h),5.84(d,j=15.5hz,1h),4.20–4.12(m,2h),4.04(dd,j=10.9,6.4hz,1h),3.90(dd,j=7.0,6.3hz,1h),3.80(q,j=7.2,hz,1h),3.58–3.53(m,2h),2.61(t,j=6.6hz,2h),2.31–2.24(m,2h),2.18–2.12(m,2h),2.00(p,j=6.4hz,1h),1.94–1.87(m,2h),1.64(t,j=7.0hz,5h);13cnmr(151mhz,cdcl3)δ=167.64,164.21,149.85,147.99,143.88,142.37,137.19,129.54,125.99,122.07,115.36,76.64,68.39,66.18,38.46,33.75,31.65,28.03,25.66,25.39,22.42,22.29;hrms(esi/tof-q):m/zcalcd.forc22h28n2o4[m+h]+,385.2127;found,385.2123。
实施例11
苄基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-11)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸苄酯60μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1157mg;产率为73%;黄色固体;m.p.92-93℃;1hnmr(600mhz,cdcl3)δ=8.46(d,j=4.2hz,1h),8.15(d,j=7.8hz,1h),8.13(s,1h),7.86(d,j=15.6hz,1h),7.80(td,j=7.7,1.6hz,1h),7.39–7.34(m,5h),7.33–7.30(m,1h),5.82(d,j=15.5hz,1h),5.15(s,2h),3.56(q,j=6.7hz,2h),2.62(t,j=7.3hz,2h),2.31–2.26(m,2h),2.18–2.12(m,2h),1.67–1.62(m,4h);13cnmr(151mhz,cdcl3)δ=167.55,164.25,149.88,147.97,144.05,142.54,137.18,136.41,129.56,128.51,128.11,128.05,125.98,122.09,115.32,65.90,38.44,33.80,31.67,25.42,22.44,22.30;hrms(esi/tof-q):m/zcalcd.forc24h26n2o3[m+h]+,391.2022;found,391.2017。
实施例12
苯基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-12)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸苯酯55μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的甲苯溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1247mg;产率为63%;黄色固体;m.p.90-91℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.4hz,1h),8.16(d,j=7.8hz,2h),7.98(d,j=15.5hz,1h),7.80(td,j=7.7,1.5hz,1h),7.41–7.34(m,3h),7.21(t,j=7.4hz,1h),7.09–7.06(m,2h),5.95(d,j=15.5hz,1h),3.59(q,j=6.8hz,2h),2.65(t,j=7.2hz,2h),2.32(t,j=5.5hz,2h),2.26–2.20(m,2h),1.73–1.63(m,4h);13cnmr(151mhz,cdcl3)δ=166.07,164.30,150.99,149.81,148.01,145.12,143.79,137.27,129.67,129.25,126.07,125.47,122.16,121.65,114.81,38.45,33.87,31.76,25.45,22.43,22.30;hrms(esi/tof-q):m/zcalcd.forc23h24n2o3[m+h]+,377.1865;found,377.1861。
实施例13
二乙基(e)-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)乙烯基)膦酸二乙酯(化合物iii-13)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、乙烯基膦酸二乙酯61μl(0.40mmol)、和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为乙酸乙酯,即可得化合物iii-1345mg;产率为57%;黄色油状;1hnmr(600mhz,cdcl3)δ=8.54(d,j=4.8hz,1h),8.18(d,j=8.9hz,2h),7.84(t,j=7.8hz,1h),7.63(dd,j=22.8,17.3hz,1h),7.41(t,j=6.1hz,1h),5.59(t,j=18.1hz,1h),4.12–3.95(m,4h),3.56(q,j=7.1hz,2h),2.62(t,j=7.7hz,2h),2.30–2.26(m,2h),2.17–2.13(m,2h),1.69–1.60(m,4h),1.31(t,j=7.1hz,6h);13cnmr(151mhz,cdcl3)δ=164.06,149.74,147.92,145.56,145.51,142.72,137.05,129.54,129.39,125.86,121.88,111.56,110.29,61.38,61.34,38.26,33.40,31.32,24.99,22.25,22.15,16.24,16.20;hrms(esi/tof-q):m/zcalcd.forc20h29n2o4p[m+h]+,393.1943;found,393.1939。
实施例14
(e)-n-(2-(2-(3-(二甲基氨基)-3-氧代丙-1-烯-1-基)环己-1-烯-1-基)乙基)吡啶酰胺(化合物iii-14)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n,n-二甲基丙烯酰胺41μl(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺46mg(0.2mmol)的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所用洗脱剂为体积比为1:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1421mg;产率为32%;黄色油状;1hnmr(600mhz,cdcl3)δ=8.52(d,j=4.2hz,1h),8.21–8.15(m,2h),7.86–7.81(m,1h),7.79(d,j=15.5hz,1h),7.42–7.38(m,1h),6.22(d,j=15.0hz,1h),3.55(q,j=7.0hz,2h),3.06(s,3h),3.02(s,3h),2.63(t,j=7.6hz,2h),2.30–2.26(m,2h),2.23–2.17(m,2h),1.71–1.60(m,4h);13cnmr(151mhz,cdcl3)δ=167.68,164.22,150.02,147.99,141.93,139.82,137.14,129.35,125.88,122.06,114.73,38.66,37.28,35.78,33.76,31.61,25.71,22.56,22.43;hrms(esi/tof-q):m/zcalcd.forc19h25n3o2[m+h]+,328.2025;found,328.2018。
实施例15
(8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊基[a]菲-3-基(e)-3-(2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-15)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、(8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊基[a]菲-3-丙烯酸酯127mg(0.40mmol)和溶有46mg(0.2mmol)n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液1.0ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照8:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为2:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1556mg;产率为51%;淡黄色固体;m.p.198-199℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.0hz,1h),8.19–8.11(m,2h),7.96(d,j=15.5hz,1h),7.85–7.80(m,1h),7.40(dd,j=6.5,4.9hz,1h),7.27(d,j=9.6hz,1h),6.87–6.83(m,1h),6.80(s,1h),5.95(d,j=15.5hz,1h),3.59(q,j=6.8hz,2h),2.94–2.88(m,2h),2.65(t,j=7.0hz,2h),2.51(dd,j=19.0,8.7hz,1h),2.43–2.37(m,1h),2.32–2.28(m,2h),2.25–2.21(m,2h),2.19–1.94(m,5h),1.70–1.45(m,10h),0.92(s,3h);13cnmr(151mhz,cdcl3)δ=220.61,166.28,164.20,149.83,148.80,147.98,144.96,143.58,137.75,137.20,136.99,129.61,126.18,126.00,122.09,121.62,118.81,114.90,50.46,47.91,44.15,38.40,38.04,35.81,33.83,31.72,31.56,29.37,26.35,25.75,25.41,22.39,22.27,21.56,13.81;hrms(esi/tof-q):m/zcalcd.forc35h40n2o4[m+na]+,575.2886;found,575.2881。
实施例16
乙基(e)-3-(2-(2-(吡啶酰胺基)乙基)环戊-1-烯-1-基)丙烯酸酯(化合物iii-16)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸乙酯44μl(0.40mmol)和溶有43mg(0.2mmol)n-(2-(环戊-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1641mg;产率为65%;淡黄色固体;m.p.71-72℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.2hz,1h),8.17(d,j=7.8hz,1h),8.09(s,1h),7.83(t,j=7.6hz,1h),7.58(d,j=15.5hz,1h),7.42–7.38(m,1h),5.71(d,j=15.5hz,1h),4.17(q,j=7.1hz,2h),3.60(q,j=6.8hz,2h),2.68(t,j=7.0hz,2h),2.59(t,j=7.1hz,2h),2.50(t,j=7.1hz,2h),1.94–1.87(m,2h),1.27(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.50,164.23,149.85,148.99,148.00,137.54,137.22,135.33,126.01,122.09,118.02,60.08,37.84,37.46,32.58,29.19,21.59,14.30;hrms(esi/tof-q):m/zcalcd.forc18h22n2o3[m+na]+,337.1528;found,337.1522。
实施例17
乙基(e)-3-(2-(2-(吡啶酰胺基)乙基)环庚-1-烯-1-基)丙烯酸酯(化合物iii-17)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸乙酯44μl(0.40mmol)和溶有49mg(0.2mmol)n-(2-(环庚-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯混合溶液,即可得化合物iii-1737mg;产率为54%;淡黄色固体;m.p.76-77℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.1hz,1h),8.17(d,j=7.8hz,1h),8.12(s,1h),7.82(t,j=7.7hz,1h),7.75(d,j=15.5hz,1h),7.43–7.36(m,1h),5.83(d,j=15.5hz,1h),4.15(q,j=7.1hz,2h),3.57(q,j=6.9hz,2h),2.67(t,j=7.2hz,2h),2.47–2.44(m,2h),2.41–2.36(m,2h),1.80–1.76(m,2h),1.56–1.51(m,2h),1.49–1.42(m,2h),1.27(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.81,164.22,149.91,148.94,147.99,142.27,137.17,136.65,125.97,122.04,116.11,60.05,37.86,35.56,35.05,32.04,28.47,26.14,25.88,14.31;hrms(esi/tof-q):m/zcalcd.forc20h26o2n3[m+h]+,343.2022;found,343.2018。
实施例18
乙基(e)-3-((z)-2-(2-(吡啶酰胺基)乙基)环辛-1-烯-1-基)丙烯酸酯(化合物iii-18)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、丙烯酸乙酯44μl(0.40mmol)和溶有52mg(0.2mmol)n-(2-(环辛-1-烯-1-基)乙基)吡啶酰胺的叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1846mg;产率为65%;淡黄色固体;m.p.86-87℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.1hz,1h),8.18(d,j=7.8hz,2h),7.83(t,j=7.7hz,1h),7.74(d,j=15.6hz,1h),7.42–7.38(m,1h),5.86(d,j=15.6hz,1h),4.15(q,j=7.1hz,2h),3.58(q,j=6.9hz,2h),2.67(t,j=7.4hz,2h),2.49–2.45(m,2h),2.45–2.40(m,2h),1.68–1.62(m,2h),1.58–1.52(m,2h),1.49–1.38(m,4h),1.27(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.84,164.25,149.92,147.98,146.66,141.41,137.18,133.07,125.98,122.09,116.60,60.09,38.51,33.50,33.05,29.72,28.95,26.95,26.45,26.31,14.30;hrms(esi/tof-q):m/zcalcd.forc21h28n2o3[m+h]+,357.2178;found,357.2174。
实施例19
乙基(e)-3-(5-甲基-2-(2-吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-19)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(4-甲基环己-1-烯-1-基)乙基)吡啶酰胺49mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-1938mg;产率为56%;淡黄色固体;m.p.70-71℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.2hz,1h),8.17(d,j=7.8hz,1h),8.13(s,1h),7.83(td,j=7.7,1.4hz,1h),7.79(d,j=15.6hz,1h),7.43–7.38(m,1h),5.79(d,j=15.5hz,1h),4.14(q,j=7.0hz,2h),3.63–3.50(m,2h),2.70–2.54(m,2h),2.35–2.25(m,3h),1.81–1.58(m,4h),1.26(t,j=7.1hz,3h),1.00(d,j=6.3hz,3h);13cnmr(151mhz,cdcl3)δ=167.67,164.19,149.88,147.94,143.06,141.79,137.15,129.12,125.94,122.05,115.82,59.99,38.40,34.02,33.45,31.71,30.53,28.30,21.67,14.27;hrms(esi/tof-q):m/zcalcd.forc20h26n2o3[m+h]+,343.2022;found,343.2027。
实施例20
乙基(e)-3-(5,5-二甲基-2-(2-吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-20)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(4,4-二甲基环己-1-烯-1-基)乙基)吡啶酰胺52mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照5:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为4:1的石油醚和乙酸乙酯混合溶液,即可得化合物iii-2050mg;产率为70%;淡黄色固体;m.p.79-80℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.0hz,1h),8.17(d,j=7.8hz,1h),8.13(s,1h),7.82(td,j=9.2,4.7hz,2h),7.42–7.36(m,1h),5.79(d,j=15.6hz,1h),4.15(q,j=7.1hz,2h),3.58(q,j=6.8hz,,2h),2.64(t,j=7.1hz,2h),2.31(t,j=6.5hz,2h),1.94(s,2h),1.41(t,j=6.4hz,2h),1.27(t,j=7.1hz,3h),0.92(s,6h);13cnmr(151mhz,cdcl3)δ=167.62,164.14,149.83,147.91,142.02,141.97,137.12,128.45,125.92,122.01,115.79,59.97,39.26,38.41,34.92,33.22,29.37,28.55,28.10,14.25;hrms(esi/tof-q):m/zcalcd.forc21h28n2o3[m+h]+,357.2178;found,357.2172。
实施例21
乙基(e)-3-(5-(叔丁基)-2-(2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-21)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(4-叔丁基环己-1-烯-1-基)乙基)吡啶酰胺57mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照5:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-2144mg;产率为57%;淡黄色油状;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.1hz,1h),8.18(d,j=7.8hz,1h),8.13(s,1h),7.84(dd,j=7.7,1.5hz,1h),7.80(d,j=15.8hz,1h),7.43–7.38(m,1h),5.82(d,j=15.5hz,1h),4.15(qd,j=7.1,2.8hz,2h),3.64–3.49(m,2h),2.71–2.56(m,2h),2.42–2.18(m,4h),1.87(dd,j=23.9,11.2hz,3h),1.28(t,j=7.1hz,3h),0.90(s,9h);13cnmr(151mhz,cdcl3)δ=167.71,164.21,149.88,147.96,143.51,142.13,137.19,129.57,125.98,122.08,115.64,60.07,43.85,38.43,33.37,33.05,32.30,27.16,27.09,23.75,14.30;hrms(esi/tof-q):m/zcalcd.forc23h32n2o3[m+h]+,385.2491;found,385.2485。
实施例22
乙基(e)-3-(4-(2-(吡啶酰胺基)乙基)-1,2,5,6-四氢-[1,1’-联苯]-3-基)丙烯酸酯(化合物iii-22)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(1,2,3,6-四氢-[1,1’-联苯]-4-基)乙基)吡啶酰胺61mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照5:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为4:1的石油醚和乙酸乙酯的混合溶液,即可得化合物iii-2238mg;产率为47%;淡黄色固体;m.p.100-101℃;1hnmr(600mhz,cdcl3)δ=8.51(d,j=4.0hz,1h),8.19(d,j=7.8hz,2h),7.82(dd,j=11.7,3.7hz,2h),7.42–7.38(m,1h),7.31(t,j=7.5hz,2h),7.22(dd,j=13.5,7.1hz,3h),5.77(d,j=15.6hz,1h),4.13(q,j=7.0hz,2h),3.61(ddq,j=34.0,13.6,6.8hz,2h),2.83(d,j=10.2hz,1h),2.77–2.70(m,1h),2.67–2.59(m,1h),2.55–2.44(m,3h),2.32–2.19(m,1h),2.00(d,j=12.1hz,1h),1.79(qd,j=12.1,5.7hz,1h),1.25(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.55,164.24,149.85,147.95,146.14,143.04,141.39,137.18,129.25,128.44,126.76,126.24,125.98,122.07,116.21,60.03,39.69,38.37,33.70,33.48,32.04,29.25,14.24;hrms(esi/tof-q):m/zcalcd.forc25h28n2o3[m+h]+,405.2178;found,405.2172。
实施例23
乙基(e)-3-(5,5-二氟-2-(2-(吡啶氨基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-23)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(4,4-二氟环己-1-烯-1-基)乙基)吡啶酰胺53mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,所提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照8:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为6:1的石油醚和乙酸乙酯混合溶剂,即可得化合物iii-2336mg;产率为49%;淡黄色油状;1hnmr(600mhz,cdcl3)δ=8.50(d,j=4.3hz,1h),8.16(d,j=7.8hz,2h),7.86–7.80(m,1h),7.73(d,j=15.6hz,1h),7.41(dd,j=6.9,5.3hz,1h),5.70(d,j=15.6hz,1h),4.16(q,j=7.1hz,2h),3.59(q,j=6.8hz,2h),2.68–2.61(m,4h),2.57(t,j=6.0hz,2h),2.13–2.04(m,2h),1.28(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.02,164.37,149.68,148.00,141.62,140.25,137.26,126.10,125.36,125.33,125.29,124.10,122.52,122.08,120.93,117.12,60.33,38.14,35.04,34.85,34.67,33.11,30.20,30.04,29.88,29.60,29.56,29.53,14.26;hrms(esi/tof-q):m/zcalcd.forc19h22f2n2o3[m+h]+,365.1677;found,365.1671。
实施例24
乙基(e)-3-(2-(2-(3-甲氧基苯基)-2-(吡啶酰胺基)乙基)环己-1-烯-1-基)丙烯酸酯(化合物iii-24)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(环己-1-烯-1-基)-1-(3-甲氧基苯基)乙基)吡啶酰胺67mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应2小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照5:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为4:1的石油醚和乙酸乙酯的混合溶剂,即可得化合物iii-2445mg;产率为52%;淡黄色固体;m.p.99-100℃;1hnmr(600mhz,cdcl3)δ=8.50(d,j=3.7hz,1h),8.45(d,j=7.8hz,1h),8.14(d,j=7.6hz,1h),7.86–7.74(m,2h),7.39(dd,j=7.6,4.7hz1h),7.29–7.20(m,1h),6.97(d,j=7.3hz,1h),6.90(s,1h),6.78(dd,j=8.2,2.6hz,1h),5.67(d,j=15.5hz,1h),5.28(q,j=7.8hz,1h),4.23–4.16(m,2h),3.80(s,3h),3.02(dd,j=13.5,8.1hz,1h),2.75(dd,j=13.6,6.9hz,1h),2.19(t,j=5.2hz,2h),2.07(s,2h),1.60–1.54(m,4h),1.31(t,j=7.1hz,3h);13cnmr(151mhz,cdcl3)δ=167.69,163.53,159.89,149.77,147.99,143.11,142.41,141.97,137.20,130.25,129.71,126.04,122.11,118.79,115.66,112.89,112.38,60.02,55.24,52.92,40.92,31.86,25.51,22.43,22.24,14.35;hrms(esi/tof-q):m/zcalcd.forc26h30n2o4[m+h]+,435.2284;found,435.2281。
实施例25
乙基(e)-3-(3-(2-(吡啶酰胺基)乙基)-1h-吲哚-2-基)丙烯酸酯(化合物iii-25)的制备:
在25ml封管中加入醋酸钯5mg(0.02mmol)、碳酸氢钾50mg(0.50mmol)、乙酸铜(ⅱ)单水合物20mg(0.10mmol)、n-(2-(1h-吲哚-3-基)乙基)吡啶酰胺53mg(0.2mmol)、丙烯酸乙酯44μl(0.40mmol)和叔戊醇溶液0.5ml,空气氛130℃搅拌反应16小时,反应结束后冷却至室温(18~25℃),用乙酸乙酯稀释转移,加少许硅胶并在旋转蒸发仪上旋去溶剂,然后用硅胶柱分离提纯,提纯时洗脱剂为石油醚和乙酸乙酯的组成的混合溶液,其中刚开始洗脱时按照4:1的体积比配制石油醚和乙酸乙酯混合溶液为洗脱剂,然后缓慢加大洗脱剂中乙酸乙酯的含量,直至最后形成体积比为3:1的石油醚和乙酸乙酯的混合溶剂,即可得化合物iii-2518mg;产率为25%;黄色固体;m.p.151-152℃;1hnmr(600mhz,cdcl3)δ=8.46(d,j=4.8hz,1h),8.42(s,1h),8.21(d,j=7.8hz,2h),7.83(td,j=7.6,1.7hz,1h),7.74(d,j=15.9hz,1h),7.70(d,j=7.9hz,1h),7.38(dd,j=7.6,4.8hz,1h),7.34(d,j=8.2hz,1h),7.27(d,j=7.5hz,1h),7.10(t,j=7.5hz,1h),6.15(d,j=15.9hz,1h),4.19(q,j=7.1hz,2h),3.75(q,j=6.8hz,2h),3.23(t,j=7.1hz,2h),1.29(t,j=7.2hz,3h);13cnmr(151mhz,cdcl3)δ=166.95,164.45,149.84,147.97,137.55,137.23,131.78,130.72,128.32,126.03,125.08,122.14,120.21,119.93,119.44,114.89,111.18,60.48,40.35,24.64,14.32;hrms(esi/tof-q):m/zcalcd.forc21h21n3o3[m+na]+,386.1481;found,386.1475。
由以上实施例中的合成结果及其相应化合物的氢谱、碳谱和质谱的测试表面,通过本发明的合成方法可以将通式ⅰ和通式ⅱ的化合物通过“一锅法”反应得到具有高立体选择性和高产率的共轭(e)-3-环烯基丙烯酸酯衍生物。
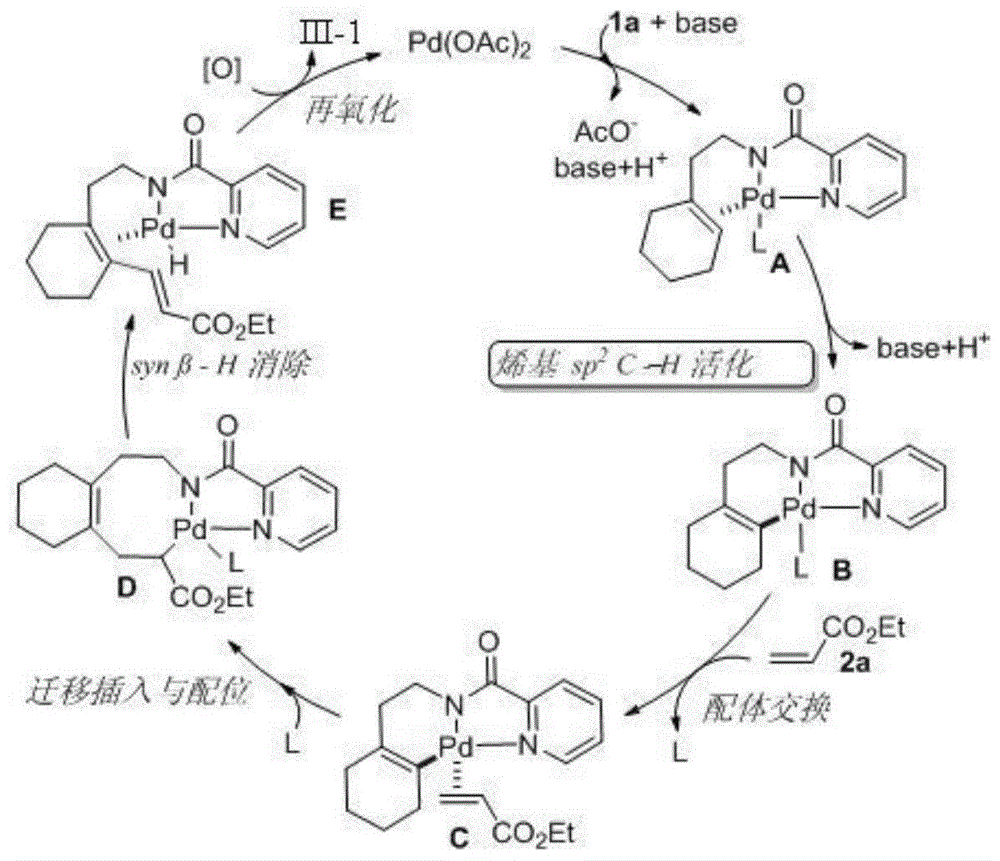
以实施例1中n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺与丙烯酸乙酯的反应为例研究其反应机理,如图1所示,底物n-(2-(环己-1-烯-1-基)乙基)吡啶酰胺1a与催化剂中的金属pd配位得到π-烯烃钯配合物a;然后进行δc(烯基)-h活化以产生六元金属环b;接着缺电子的烯烃(丙烯酸乙酯)与六元金属环b的配体交换以生成中间产物c,然后迁移插入和配位得到中间体d;最后synβ-h消除从而释放产物iii-1;同时钯催化剂先进行β-h消除再经过氧化,从而实现pd(0)/pd(ii)循环。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!