一种仿贻贝的增强型胶黏剂及其制备方法与流程
[0001]
本发明涉及医用生物材料技术领域,具体涉及一种仿贻贝的增强型胶黏剂及其制备方法。
背景技术:
[0002]
上世纪初,人们注意到,海洋贻贝能够在潮湿的环境下,紧紧地吸附在坚硬的岩石、矿物和金属表面。随后,人们对这一自然现象进入了深入研究,海洋贻贝在潮湿环境下的吸附秘密也逐渐被揭开。贻贝主要是靠一种叫贻贝足蛋白的物质黏附到各种坚硬的物质表面,而贻贝蛋白序列中含有大量的独特的3,4-二羟基苯丙氨酸(l-dopa),而l-dopa上的邻苯二酚基团为贻贝在物质表面的持久而强有力的吸附提供了主要贡献。基于多巴胺的邻苯二酚化学,人们合成了大量的邻苯二酚功能材料。
[0003]
研究表明,引入非领苯二酚单体,如带电基团、壳聚糖和尿烷等,具有特异性的功能,可改变普通材料的特性或者“稀释”交联化学。这些高分子的使用越来越普遍,而且已经拓宽到生物医用材料、抗污涂层、自修复材料。
[0004]
邻苯二酚独特强健的界面化学性质为研究者们提供了一种广泛用于生物医药行业的仿生吸附材料设计的简单方法。组织吸附可以简化手术程序和最小化创伤,尤其是与缝合相关的手术。然而,缓慢降解、物质毒性和黏附力低等性质,限制了胶黏剂的可商业化应用。基于多巴胺(dopa)或者邻苯二酚修饰的peg胶黏剂是开发出的最早的合成生物胶黏剂,也是目前最成功的生物胶黏剂之一,已经广泛用于脑膜、肺和心血管等外科手术中,在包括胎盘缝合、无缝伤口包扎和细胞工程中均显示了潜在的应用,这些胶黏剂展现了超强的黏附性能。但peg良好的亲水性,会使peg胶黏剂过度溶胀,机械性能降低,人体中会产生一些并发症。
[0005]
透明质酸(ha)是一种广泛用于多种生物材料的天然糖胺多糖。接枝有dopa的ha被证实具有水下强吸附的优异生物相容性。与传统交联水凝胶相比,ha封装使细胞活性有所提升。然而ha在水中也会过度溶胀,从而降低其机械性能。
技术实现要素:
[0006]
本发明提供了一种仿贻贝的增强型胶黏剂,其特征在于引入三端基使左旋多巴(l-dopa)增多,从而增加了其粘附性,又引入了透明质酸(ha)作为尾端,使机械性能增强,溶胀凝胶快速可逆转变,使性能大大提升。
[0007]
本发明还提供了一种仿贻贝的增强型胶黏剂的制备方法,其特征在于通过引入活性基团溴完成简单的反应,包含以下步骤:首先利用叔丁基二甲基氯硅烷(tbdmscl)在1,8-二氮杂二环十一碳-7-烯(dbu)催化与乙腈溶剂下对dopa中的邻羟基进行保护,利用n-羟基丁二酰亚胺与二环己基碳二亚胺在二氯甲烷溶剂下对二溴异丁酸的羧基进行保护,再加入n,n-二甲基甲酰胺溶液中,冰浴中反应一定时间,然后于室温下反应一定时间。加入n,n-二异丙基乙胺合成dopa引发剂,然后加入三(2-氨基乙基)胺在冰水浴中反应一定时间,再在
室温下反应一定时间,合成三端基多巴胺引发剂,之后在1-乙基-[3-二甲基氨基丙基]碳化二亚胺(edc)的引发下,加入ha合成仿贻贝水凝胶。
[0008]
所述的一种仿贻贝的增强型胶黏剂的制备方法,其特征在于加入n,n-二甲基甲酰胺溶液后,冰浴中反应0.5~4小时,然后于室温下反应0.5~7小时。
[0009]
所述的一种仿贻贝的增强型胶黏剂的制备方法,其特征在于加入三(2-氨基乙基)胺后,冰浴中反应0.5~4小时,然后于室温下反应7~20小时。
[0010]
所述的一种仿贻贝的增强型胶黏剂的制备方法,其特征在于在edc的引发下,加入的ha与三端基多巴胺引发剂的摩尔比为2:1~4:1。
[0011]
与现有技术相比,本发明的有益效果是:本发明提供了一种新型的三多巴胺端基、三透明质酸(ha)尾链的聚合物tri-dopa-ha,通过改变引发剂与单体投料比,合成不同聚合度的仿贻贝增强型水凝胶。通过简单的原子转移自由基聚合(atrp)反应合成胶黏剂,该种类型的复合胶黏剂能够形成快速可逆的溶胶凝胶转变,能够在体内和体外稳定存在,且提高了胶黏效果,减少侵略性细胞转移。
附图说明:
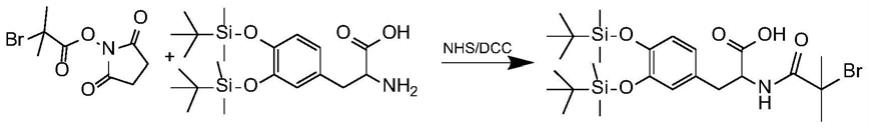
[0012]
图1为实施例一中多巴胺邻苯二羟基的保护方案。
[0013]
图2为实施例一中二溴异丁酸的羧基保护方案。
[0014]
图3为实施例一中多巴胺引发剂的合成方案。
[0015]
图4为实施例一中多巴胺引发剂的羧基保护方案。
[0016]
图5为实施例一中三端基多巴胺引发剂的合成方案。
[0017]
图6为实施例一中三端基多巴胺-透明质酸的合成方案。
具体实施方式
[0018]
现结合实施例,对本发明作了详细描述:
[0019]
实施例一
[0020]
a、左旋多巴的羟基保护
[0021]
合成方案如图1所示,在50ml史莱克瓶中加入左旋多巴,叔丁基二甲基氯硅烷和dbu。抽真空-充氮气三次循环,用注射器将四氢呋喃加入到史莱克瓶中,搅拌。室温反应是小事,停止反应,真空抽滤,除去固体,将所得滤液用旋转蒸发仪蒸干。将蒸干后的黏液加少许二氯甲烷稀释,过硅胶柱提纯,得淡黄色液体。
[0022]
b、2-溴异丁酸羧基的保护
[0023]
合成方案如图2所示,在n2氛围下,将n-羟基丁二酰亚胺加入2-溴异丁酸的15ml二氯甲烷溶液中,搅拌20分钟,在冰水浴下,加入二环己基碳二亚胺。反应混合物在冰水浴下搅拌2小时,再在室温下继续反应24小时,之后旋转蒸发除去溶剂,得到产物。
[0024]
c、多巴胺引发剂的合成与羧基保护
[0025]
合成和羧基保护方案如图3和4所示,在室温n2保护下,将上述合成的a和b加入到n,n-二甲基甲酰胺溶液中。在冰水浴下,将n,n-二异丙基乙胺用注射器逐滴加入混合液中。在冰水浴中反应2小时,再在室温下反应6小时。结束反应后,加入50ml质量分数为3%的盐酸溶液,再用乙酸乙酯萃取三次,合并有机相,再用去离子水洗涤三次,用无水硫酸镁干燥,
在用旋转蒸发仪浓缩。
[0026]
d、三端基dopa合成
[0027]
合成方案如图5所示,为了得到较为纯净的三端基引发剂,在n2保护下,将三(2-氨基乙基)胺迅速加入含有过量的多巴胺引发剂中,加入6ml二氯甲烷溶液中。在冰水浴下,将三乙胺用注射器加入到溶液中。冰水浴下反应1小时后,在室温下持续16小时,停止反应。蒸干二氯甲烷,加入10ml乙酸乙酯,再滴入50ml盐酸溶液(质量分数0.5%),溶液用乙酸乙酯溶液分三次萃取,合并有机相,用无水硫酸镁干燥过夜,再用旋转蒸发仪浓缩。
[0028]
e、三端基多巴胺-透明质酸的合成
[0029]
合成方案如图6所示,在1-乙基-[3-二甲基氨基丙基]碳化二亚胺(edc)的引发下,按ha:三端基多巴胺=3:1的摩尔比加入ha溶液,室温下交联24h后合成仿贻贝水凝胶。
[0030]
实施例二
[0031]
a、左旋多巴的羟基保护
[0032]
在50ml史莱克瓶中加入左旋多巴,叔丁基二甲基氯硅烷和dbu。抽真空-充氮气三次循环,用注射器将四氢呋喃加入到史莱克瓶中,搅拌。室温反应是小事,停止反应,真空抽滤,除去固体,将所得滤液用旋转蒸发仪蒸干。将蒸干后的黏液加少许二氯甲烷稀释,过硅胶柱提纯,得淡黄色液体。
[0033]
b、2-溴异丁酸羧基的保护
[0034]
在n2氛围下,将n-羟基丁二酰亚胺加入2-溴异丁酸的15ml二氯甲烷溶液中,搅拌20分钟,在冰水浴下,加入二环己基碳二亚胺。反应混合物在冰水浴下搅拌2小时,再在室温下继续反应24小时,之后旋转蒸发除去溶剂,得到产物。
[0035]
c、多巴胺引发剂的合成
[0036]
在室温n2保护下,将上述合成的a和b加入到n,n-二甲基甲酰胺溶液中。在冰水浴下,将n,n-二异丙基乙胺用注射器逐滴加入混合液中。在冰水浴中反应1小时,再在室温下反应4小时。结束反应后,加入50ml质量分数为3%的盐酸溶液,再用乙酸乙酯萃取三次,合并有机相,再用去离子水洗涤三次,用无水硫酸镁干燥,在用旋转蒸发仪浓缩。
[0037]
d、三端基dopa合成
[0038]
为了得到较为纯净的三端基引发剂,在n2保护下,将三(2-氨基乙基)胺迅速加入含有过量的多巴胺引发剂中,加入6ml二氯甲烷溶液中。在冰水浴下,将三乙胺用注射器加入到溶液中。冰水浴下反应2小时后,在室温下持续12小时,停止反应。蒸干二氯甲烷,加入10ml乙酸乙酯,再滴入50ml盐酸溶液(质量分数0.5%),溶液用乙酸乙酯溶液分三次萃取,合并有机相,用无水硫酸镁干燥过夜,再用旋转蒸发仪浓缩。
[0039]
e、三端基多巴胺-透明质酸的合成
[0040]
在1-乙基-[3-二甲基氨基丙基]碳化二亚胺(edc)的引发下,按ha:三端基多巴胺=4:1的摩尔比加入ha溶液,室温下交联24h后合成仿贻贝水凝胶。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1