抑制MCM7的siRNA、组合物及其应用的制作方法
抑制mcm7的sirna、组合物及其应用
技术领域
[0001]
本发明属于生物医药领域,特别涉及抑制mcm7的sirna、组合物及其应用。
背景技术:
[0002]
mcm复合体由mcm2~mcm7亚基组成,在细胞内具有解旋酶活性,在dna复制前打开dna双链,参与到dna复制起始(bik tye,annual review of biochemistry,1999)。而且mcm复合体还对细胞增殖、dna损伤修复和细胞周期起到重要的调控作用。
[0003]
小干扰rna(small interfering rna,sirna)是一种长20~25个核苷酸的双链rna,最早在植物的转录后基因沉默现象中发现,公开报道了人工合成的sirna可沉默哺乳动物细胞的特定基因表达(thomas tuschl et al.,nature,2001;thomas tuschl et al.,science,2001;thomas tuschl et al.,cell,2002)。由于sirna可以在基因水平靶向干扰,不需要依赖靶点蛋白的晶体结构。因此科学家们研究了一系列利用sirna进行rna干扰(rna interference,rnai)来抑制靶标基因的表达的方法,从而进行基因功能研究与疾病治疗。
[0004]
由于靶标基因上的不同位点的序列不同而具有不同的二级结构和不同的热动力学特性,因此,不同位点被sirna干扰的可能性和程度会有很大差异。另外,相同sirna在不同种类的细胞中的活性也可能不同。因此,对于任何一个细胞中的任何靶标基因,高活性sirna的设计、测试和获得是一个创造性发明的过程。
[0005]
目前,尚未见有关用于抑制肝癌、胃癌、前列腺癌等癌细胞的mcm7基因的sirna的报道。
技术实现要素:
[0006]
本发明的首要目的在于提供一种抑制mcm7的sirna。
[0007]
本发明的另一目的在于提供上述sirna的应用。
[0008]
本发明的再一目的在于提供一种sirna特异性靶向mcm7基因而预防或治疗肿瘤/癌症的方法。
[0009]
发明人针对mcm7基因设计和测试了许多rna干扰片段,但是大部分sirnas的干扰效率低,无法有效进行后期肿瘤治疗研究。发明人经过探索研究,创造性发明了一些高效的sirna序列,用于干扰mcm7基因。这对于rna干扰的应用至关重要,即靶基因不同位点的sirna作用效果差异很大,可能与sirna二级(元)结构和热动力学性质、碱基分布等因素有关。
[0010]
发明人进一步探索发现,通过改变sirna正义链的一个或多个碱基,使得正义链和反义链构成不完全互补配对,因此改变整个双链rna热动力学性质,提高反义链进入rna干扰复合体蛋白的效率,从而提高了sirna抑制靶标mcm7基因的效率。
[0011]
为达到上述目的,本发明所采取的技术方案是:
[0012]
发明人以mcm7蛋白为靶点设计了sirna。该sirna通过抑制人mcm7基因的表达从而抑制mcm7蛋白的合成,从而阻扰了整个mcm复合体(mcm2-mcm7)的形成,从而抑制dna复制和
细胞增殖来达到肿瘤/癌症预防或治疗的目的。
[0013]
通过sirna对mcm复合体任何一个亚基的表达抑制,可以抑制整个复合体的形成,进而抑制细胞增殖产生抗肿瘤作用。
[0014]
本发明一个方面,提出了sirna,所述sirna可抑制mcm7基因表达,由正义链和反义链组成,其中,所述sirna选自:
[0015]
sirna-1:正义链:5'-ggacuuaauuugugagaau-3';
[0016]
反义链:5'-auucucacaaauugagucc-3';
[0017]
或
[0018]
sirna-2:正义链:5'-ggaagugguaaauaaagau-3';
[0019]
反义链:5'-aucuuuauuuaccacuucc-3';
[0020]
或与所述sirna-1或sirna-2的正义链或反义链序列具有80%以上,或更好地,90%以上同源性,或其碱基可以修饰成为核酸的衍生物,且具有相同功能。
[0021]
进一步的,所述sirna正义链和反义链的3'端需添加两个呈单链悬挂结构的脱氧核糖核苷酸dt或dn。
[0022]
进一步的,所述sirna通过抑制mcm7基因表达而预防或治疗肿瘤/癌症。
[0023]
进一步的,所述肿瘤/癌症选自肝癌、胃癌、前列腺癌、乳腺癌、肺癌、胰腺癌、宫颈癌、子宫内膜癌、大肠癌、肺癌、鼻咽癌、卵巢癌、皮肤癌、食管癌或脑瘤。
[0024]
进一步的,所述肿瘤可因mcm7基因表达被抑制而减慢或停止生长、缩小或消失。
[0025]
进一步的,所述mcm7基因选自人mcm7基因。
[0026]
进一步的,所述的sirna序列,其序列可以在部分位点局部修改,只要不影响其对靶标的结合及抑制。
[0027]
进一步的,所述sirna序列及其局部修改序列,其碱基可以修饰成为核酸的衍生物,只要不影响其对靶标的结合及抑制。
[0028]
本发明的又一个方面,提出了sirna在制备预防或治疗肿瘤/癌症药物或组合物中的应用。
[0029]
进一步的,所述肿瘤/癌症选自肝癌、胃癌、前列腺癌、乳腺癌、肺癌、胰腺癌、宫颈癌、子宫内膜癌、大肠癌、肺癌、鼻咽癌、卵巢癌、皮肤癌、食管癌或脑瘤。
[0030]
进一步的,所述肿瘤/癌症可因mcm7基因表达被抑制而减慢或停止生长、缩小或消失。
[0031]
进一步的,sirna的浓度为5~150nm,优选10~100nm,更优选15~60nm,最优选20~40nm。
[0032]
还可以具有下列附加技术特征:
[0033]
所述sirna可抑制mcm7基因表达,由正义链和反义链组成,
[0034]
其中,所述sirna选自:
[0035]
sirna-1:正义链:5'-ggacuuaauuugugagaau-3';
[0036]
反义链:5'-auucucacaaauugagucc-3';
[0037]
或
[0038]
sirna-2:正义链:5'-ggaagugguaaauaaagau-3';
[0039]
反义链:5'-aucuuuauuuaccacuucc-3';
[0040]
或与所述sirna-1或sirna-2的正义链或反义链序列具有80%以上,或更好地,90%以上同源性,或其碱基可以修饰成为核酸的衍生物,且具有相同功能。
[0041]
进一步的,所述sirna正义链和反义链的3'端需添加两个呈单链悬挂结构的脱氧核糖核苷酸dt或dn。
[0042]
进一步的,所述mcm7基因选自人的mcm7基因。
[0043]
进一步的,sirna可以在部分位点局部修改,只要不影响其对靶标的结合及抑制。
[0044]
进一步的,sirna序列及其局部修改序列,其碱基可以修饰成为核酸的衍生物,只要不影响其对靶标的结合及抑制。
[0045]
本发明的又一个方面,提出了一种预防或治疗肿瘤/癌症的药物或组合物,所述药物或组合物包括:
[0046]
上述任一所述的sirna;
[0047]
或可表达上述任一所述的sirna的表达体系。
[0048]
进一步的,所述肿瘤/癌症选自肝癌、胃癌、前列腺癌、乳腺癌、肺癌、胰腺癌、宫颈癌、子宫内膜癌、大肠癌、肺癌、鼻咽癌、卵巢癌、皮肤癌、食管癌或脑瘤。
[0049]
进一步的sirna的浓度为5~150nm,优选10~100nm,更优选15~60nm,最优选20~40nm。
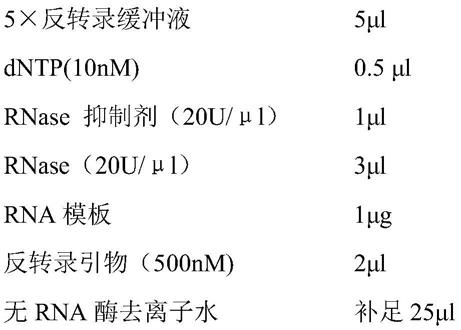
[0050]
进一步的,所述肿瘤可因mcm7基因表达被抑制而减慢或停止生长、缩小或消失。
[0051]
进一步的,上述所述药物或组合物,还包括:
[0052]
药学上可接受的载体;
[0053]
预防或治疗肿瘤的其它活性成分。
[0054]
进一步的,药学上可接受的载体和/或辅料包括但不限于缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理食盐、赋形剂、填充剂、凝结剂与调和剂、界面活性剂、扩散剂、消泡剂。
[0055]
进一步的,所述预防或治疗肿瘤的其他活性成分包括:化疗剂、放疗剂或抗体药物。
[0056]
进一步的,所述药物或组合物的形式适用于:直接裸rna注射法、脂质体包裹rna直接注射法、蛋白或多肽包裹rna直接注射法、金包被rna基因枪轰击法、细菌携带质粒表达rna法或病毒表达rna法。
[0057]
进一步的,所述sirna药物或组合物可以选自固体、液体、凝胶、半流质、气雾任一形式。
[0058]
进一步的,所述mcm7基因选自人的mcm7基因。
[0059]
利用sirna可以有效抑制mcm7基因表达和蛋白的合成,起到治疗肿瘤/癌症的目的。
[0060]
本发明的有益效果是:
[0061]
本发明通过改变sirna-1序列正义链的5’端顺数的第6个碱基,使得正义链和反义链构成不完全互补配对,因此改变整个双链rna热动力学性质,提高反义链进入rna干扰复合体蛋白的效率,从而提高sirna-1抑制靶标mcm7基因的效率。
[0062]
本发明通过提供一种靶向mcm7基因的sirna,与常规基因敲除技术相比,本发明操作简便、试验周期短;在mrna和蛋白水平上,所述sirna对mcm7的抑制效果高达90%以上,抑制效率极高、特异性好;同时能够有效抑制癌症细胞的dna复制、增殖和克隆形成能力,对于
开发新的抗癌基因药物和提高癌症的治疗效果有重要的意义,具有显著的临床应用前景和经济价值。
附图说明
[0063]
图1为mcm7特异性的sirna-1在hepg2和hep3b肝癌细胞mcm7mrna水平的沉默效果。
[0064]
图2的a~c图分别为mcm7特异性的sirna-1在hepg2和hep3b肝癌细胞和sirna-2在hepg2肝癌细胞中mcm7蛋白水平的沉默效果,其中β-actin为内部参照蛋白。
[0065]
图3为sirna-1抑制hepg2肝癌细胞dna复制的edu显阳性的细胞荧光显微镜图,其中图3a、c和e分别是阴性对照组细胞nc转染hepg2肝癌细胞后的edu显阳性的细胞荧光显微镜图、hochst染细胞核dna图、edu显阳性的细胞荧光显微镜图和hochst染细胞核dna图的重叠图;其中图3b、d和f分别是sirna-1转染hepg2肝癌细胞后的edu显阳性的细胞荧光显微镜图、hochst染细胞核dna图、edu显阳性的细胞荧光显微镜图和hochst染细胞核dna图的重叠图。
[0066]
图4为edu掺入显阳性的hepg2细胞比例统计图。
[0067]
图5a~e分别为sirna-1抑制hepg2肝癌细胞、hep3b肝癌细胞、sgc-7907胃癌细胞、pc3前列腺癌细胞和mcf7乳腺癌细胞增殖的生长曲线。
[0068]
图6为sirna抑制各种癌细胞的克隆生成的结果图,图a~e分别为用sirna-1或阴性对照nc转染hepg2肝癌细胞、hep3b肝癌细胞、sgc-7907胃癌细胞、pc3前列腺癌细胞和mcf7乳腺癌细胞后,癌细胞克隆生成的数目对照图。
[0069]
图7为sirna抑制各种癌细胞的克隆生成能力,图a~e分别为用sirna-1或阴性对照nc转染hepg2肝癌细胞、hep3b肝癌细胞、sgc-7907胃癌细胞、pc3前列腺癌细胞和mcf7乳腺癌细胞后,癌细胞的克隆总面积占孔总面积的比例。
具体实施方式
[0070]
下面结合实施例对本发明中的技术方案进行清楚、完整的说明,但并不局限于此。
[0071]
实施例1 sirna设计
[0072]
根据sirna靶序列基本原则,设计、合成人mcm7基因转录本(nm_001278595.1)表达的sirna序列(1条21个核苷酸),即sirna的正义链和反义链,其碱基序列为:
[0073]
sirna-1正义链:5'-ggacuuaauuugugagaaudtdt-3';(seq id no.1)
[0074]
sirna-1反义链:5'-auucucacaaauugaguccdtdt-3'(seq id no.2)。
[0075]
或
[0076]
sirna-2正义链:5'-ggaagugguaaauaaagaudtdt-3'(seq id no.3);
[0077]
sirna-2反义链:5'-aucuuuauuuaccacuuccdtdt-3'(seq id no.4)。
[0078]
阴性对照rna(nc)的碱基序列为:
[0079]
正义链:5'-cucuuagccaauauucgcudtdt-3'(seq id no.5);
[0080]
反义链:5
′-
agcgaauauuggcuaagagdtdt-3'(seq id no.6)。
[0081]
本发明sirna序列和对照rna正义链和反义链的3’端,添加了两个呈单链悬挂结构的脱氧核糖核苷酸(dt或dn),以增强sirna在体内和体外的稳定性,防止被核酸酶降解。
[0082]
本发明sirna序列可以在部分位点局部修改,只要不影响其对靶标的结合及抑制。
[0083]
本发明sirna序列及其局部修改序列,其碱基可以修饰成为核酸的衍生物,只要不影响其对靶标的结合及抑制。
[0084]
实施例2 sirna在细胞中的转染
[0085]
采用脂质体lipofectamine rnaimax作为转染试剂,步骤按照thermo fisher scientific公司的操作规程。采用的细胞系为hepg2和hep3b肝癌细胞系、sgc-7907胃癌细胞系、pc3前列腺癌细胞系和mcf7乳腺癌细胞系。
[0086]
本发明未注明具体条件的实验方法,通常按照常规条件如sambrook等人《分子克隆:实验室指南》(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。
[0087]
转染步骤如下:将上述不同的细胞系分别接种于12孔板中,37℃、5%co2培养过夜,使细胞生长密度达到40~50%。参照lipofectamine rnaimax(thermo fisher scientific)操作规程,将本发明制备的sirna和阴性对照rna(nc)分别转染到不同的细胞系。转染后收集细胞,采用qrt-pcr和蛋白印迹(western blotting)进一步检测sirna的干扰效果。
[0088]
实施例3 sirna抑制mcm7mrna表达检测
[0089]
方法:转染后收集细胞,提取总rna,逆转录后进行实时荧光定量pcr,检测sirna处理癌细胞后mcm7mrna的表达量。
[0090]
将本发明制备的sirna和阴性对照rna(nc)分别转染到肝癌细胞系hepg2,使用同样的方法也转染到肝癌细胞系hep3b,转染24小时后,收集细胞,取适量细胞重新接种于6孔板中,72小时后收集细胞提取总rna。逆转录,并进行实时荧光定量pcr检测mcm7mrna。
[0091]
1.总rna提取
[0092]
(1)分别收集肿瘤细胞至离心管,离心800rpm,3min,弃上清,加入pbs洗涤一次并转移至ep管中;
[0093]
(2)再次离心800rpm,3min,弃上清,加入0.5ml trizol,反复吹打使肿瘤细胞溶解,室温静置5~10min;
[0094]
(3)加入0.2ml氯仿/ml trizol,剧烈振荡混匀15sec,室温静置10min;
[0095]
(4)12000rpm,4℃,离心15min;
[0096]
(5)离心后液体分为三层,从下至上依次为酚/氯仿层、中间蛋白层、上层无色水相,rna存于上层水相中;
[0097]
(6)吸取上层水相至新的ep管中,注意避免将中间蛋白吸出;
[0098]
(7)加入预冷的异丙醇0.5ml/ml trizol,颠倒混匀,室温静置10min;
[0099]
(8)12000rpm,4℃,离心10min;
[0100]
(9)弃上清,用75%乙醇(750μl无水乙醇,250μl depc水现配)洗涤rna沉淀物,12,000rpm,4℃,离心5min;
[0101]
(10)弃上清,超净台中鼓风干燥3分钟左右,rna呈半透明状;
[0102]
(11)加入15~20μl 1
‰
depc水溶解rna沉淀,紫外分光光度计测定浓度及od值,-70℃保存或直接用于反转录反应。
[0103]
2.反转录成cdna
[0104]
高温预变形5min后冰上急冻,反转录反应体系:
[0105][0106]
反应条件:37℃15min,50℃5min,95℃5min,4℃保持。合成的cdna可立即用于下游实验或-20℃冰箱保存。
[0107]
3.荧光定量实时pcr
[0108]
将反转录的cdna样品以适当比例稀释后,使用thunderbrid sybr qpcr mix配置如下pcr反应体系:
[0109][0110]
其中:
[0111]
上游引物序列为5
’-
gtgaaggatcctgcgacaca-3’(seq id no.7);
[0112]
下游引物序列为5
’-
acacgcgttcttttgttccg-3’(seq id no.8);
[0113]
内参上游引物序列为5
’-
acacgcgttcttttgttccg-3’(seq id no.9);
[0114]
内参下游引物序列为5
’-
ggactccatgcccaggaaggaa-3’(seq id no.10)。
[0115]
结果:图1a和b表明,相对于对照组nc,用sirna-1转染癌细胞后,分别有效抑制hepg2、hep3b肝癌细胞中的mcm7mrna表达量,沉默效果达90%以上。
[0116]
实施例4 sirna抑制mcm7蛋白表达检测
[0117]
方法:将本发明制备的sirna和阴性对照rna(nc)分别转染到肝癌细胞系hepg2,使用同样的方法也转染到肝癌细胞系hep3b,转染24小时后,收集细胞,取适量细胞重新接种于12孔板中,72小时后收集细胞做蛋白印迹实验。
[0118]
1、吸去培养基,加入适量2
×
laemmli缓冲液,轻轻摇晃12孔板裂解细胞,收集到pe管中,与pe管架的孔摩擦震碎dna,95℃煮2min;
[0119]
2、将煮沸变性的样品进行聚丙烯酰胺凝胶电泳、western印迹,之后用5%脱脂牛奶对pvdf膜室温封闭0.5小时;
[0120]
3、选用合适的一抗(鼠抗人mcm7单克隆抗体,santa cruz biotechnology),以适当的稀释比例,与pvdf膜4℃孵育过夜;
[0121]
4、次日,tbst洗3遍,每遍10min;
[0122]
5、选用与一抗宿主种属相对应的hrp标记的抗小鼠igg二抗,以适当的稀释比例,与pvdf膜室温孵育1小时;
[0123]
6、tbst洗3遍,每遍10min;
[0124]
7、ecl液显影,检测mcm7蛋白在肿瘤细胞中的表达情况。
[0125]
结果:图2a、b和c显示,相对于对照组nc,用sirna-1转染癌细胞后,可有效抑制hepg2以及hep3b细胞中mcm7蛋白的表达;用sirna-2转染癌细胞后,可有效抑制hepg2细胞中mcm7蛋白的表达;sirna-1和sirna-2的沉默效果均可达90%以上。
[0126]
实施例5 sirna抑制癌细胞dna复制
[0127]
方法:将本发明制备的sirna和阴性对照rna(nc)分别转染到肝癌细胞系hepg2,使用同样的方法也转染到肝癌细胞系hep3b,转染24小时后,收集细胞,取适量细胞重新接种于96孔板中。12小时后,将mimosine试剂添加到细胞中孵育24小时,使细胞同步在g1期和s期交界处。
[0128]
使用新鲜培养基清洗细胞三次,每次间隔三分钟,将细胞从mimosine的抑制中释放出来。添加新鲜培养基培养细胞3.5小时,再加入50mmol/l edu(5-ethynyl-2'-deoxyuridine,一种胸腺嘧核苷类似物)继续培养0.5小时。固定细胞并染色,在荧光显微镜下观察并统计edu掺入显阳性的细胞的比例。
[0129]
结果:图3和图4表明,sirna-1转染癌细胞后,与阴性对照nc相比,edu掺入显阳性的细胞的比例明显减少,表明sirna-1显著抑制了癌细胞的dna复制。
[0130]
所述新鲜培养基采用gibco rpmi 1640。
[0131]
实施例6 sirna抑制癌细胞增殖
[0132]
方法:将本发明制备的sirna和阴性对照rna(nc)分别转染不同的癌细胞系,转染24小时后收集细胞。取适量细胞分为五等分,重新接种于12孔板中,连续计数五天,每天选取一个孔的细胞计数。绘制转染后的细胞生长曲线。
[0133]
结果:如图5结果表明,sirna-1可高效抑制hepg2肝癌细胞、hep3b肝癌细胞、sgc-7907胃癌细胞、pc3前列腺癌细胞和mcf7乳腺癌细胞的增殖。
[0134]
同样的,sirna-2也可高效抑制上述癌细胞的增殖。
[0135]
实施例7 sirna抑制癌细胞克隆生成
[0136]
方法:将本发明制备的sirna和阴性对照rna(nc)分别转染到上述不同的癌细胞系,转染24小时后收集细胞。将细胞接种到6孔板中,细胞密度为0.4
×
103个/孔。培养14天后,用甲醇固定,并使用结晶紫染色。
[0137]
结果:如图6和图7表明,图6a~e中可知,sirna-1转染癌细胞后,与阴性对照nc相比,癌细胞克隆数目显著减少;图7a~e中可知,sirna-1转染癌细胞后,与阴性对照nc相比,克隆总面积占孔总面积的比例减少,以上可说明sirna可高效抑制hepg2肝癌细胞、hep3b肝癌细胞、sgc-7907胃癌细胞、pc3前列腺癌细胞和mcf7乳腺癌细胞的克隆生成能力。
[0138]
实施例8 mcm7sirna应用
[0139]
本发明mcm7sirna在制备预防或治疗肿瘤/癌症药物中的应用,所述癌症选自肝癌、胃癌、前列腺癌、乳腺癌、肺癌、胰腺癌、宫颈癌、子宫内膜癌、大肠癌、肺癌、鼻咽癌、卵巢癌、皮肤癌、食管癌或脑瘤。
[0140]
综上所述,本发明的sirna有效抑制了mcm7基因表达,从而降低了mcm7蛋白的合成,sirna的抑制效果高达90%以上,抑制效率极高、特异性好;同时能够有效抑制癌症细胞的dna复制、增殖和克隆形成能力,对于开发新的抗癌基因药物和提高癌症的治疗效果有重
要的意义,具有显著的临床应用前景和经济价值。
[0141]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 具有抑制纤溶酶活性的重组textilinin-1及其制备方法和应用的制作方法
- 一种新的多肽——人纤溶酶原激活物抑制剂2-27和编码这种多肽的多核苷酸的制作方法
- 作为纤溶酶原激活物抑制剂-1(pai-1)的抑制剂的取代3-羰基-1h-吲哚-1-基乙 ...的制作方法
- 作为纤溶酶原激活物抑制剂 - 1(pa i-1 )的抑制剂的取代二氢吡喃并吲哚-3
- 组织型纤溶酶原激活剂及其片段的亲和肽及其用途的制作方法
- 一种新的多肽——人纤溶酶原激活物抑制剂2-10.12和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人纤溶酶原激活物抑制剂2-13.43和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人纤溶酶原激活物抑制剂2-15.95和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人纤溶酶原激活物抑制剂2-13.31和编码这种多肽的多核苷酸的制作方法
- 编码纤溶酶原激活蛋白的dna的制作方法