金属蛋白酶ADAMTS-7的免疫原性肽段及其在抗动脉粥样硬化及相关疾病的应用的制作方法
金属蛋白酶adamts-7的免疫原性肽段及其在抗动脉粥样硬化及相关疾病的应用
技术领域
1.本发明涉及生物技术和医药领域,具体涉及金属蛋白酶adamts-7的免疫原性肽段及其在抗动脉粥样硬化及相关疾病的应用。
背景技术:
2.冠心病由于其发病率高,死亡率高,严重危害着人类的身体健康,从而被称作为是“人类的第一杀手”。冠心病主要的病因是冠状动脉粥样硬化,其病理过程是由于脂质在血管壁的异常堆积导致血管壁内皮细胞损伤、血管平滑肌细胞增殖与迁移以及炎症细胞的浸润等进而形成向管腔内突出的斑块,斑块的形成导致管腔狭窄与血供不足。
3.对于冠心病的治疗,主要包括他汀类降脂药物治疗和经皮冠状动脉介入治疗(pci)。关于药物治疗,他汀类降脂药物虽然可以减少25%心血管事件,但也会增加新发糖尿病等风险;新出现的依哲迈步或pcsk9单抗等虽然带来了新的希望,但仍是围绕降脂这一策略进行干预。就目前的医疗水平来说,并没有任何的药物能够根治冠心病。亟需寻找新的干预靶点。pci手术是缓解急性心梗的有效手段,但仍存在支架内血栓形成(st)和支架内再狭窄(isr)的风险,这是由于支架损伤内皮细胞进而诱导血管平滑肌细胞的增殖与迁移导致。防治扩张术后再狭窄和血栓形成也亟需新的手段。
4.adamts-7(a disintegrin-like and metalloprotease-7,含i型血小板结合蛋白基序的解聚蛋白样金属蛋白酶)是2004年被克隆的一种新型金属蛋白酶,属于zn
2+
依赖的金属蛋白酶家族。人类含i型血小板结合蛋白基序(tsp)的解聚蛋白样金属蛋白酶(adamts)家族由19个分泌型多结构域锌指金属蛋白酶组成,这些adamts金属蛋白酶能够降解细胞外基质成分(ecm),包括原胶原、蛋白聚糖和软骨寡聚基质蛋白(comp)。adamts蛋白酶在各种组织细胞外基质成分翻转中具有重要作用,这些酶的异常表达通常和炎性病理过程密切相关,例如肿瘤、类风湿性关节炎。
5.目前,还没有与adamts-7相关的有效短肽疫苗的报道。
技术实现要素:
6.本发明所要解决的技术问题是如何获得金属蛋白酶adamts-7的免疫原性肽段,以预防或治疗动脉粥样硬化和/或血管再狭窄。
7.为解决上述技术问题,本发明首先提供了一种短肽,所述短肽为如下ad-a4)中任一种:
8.a1)氨基酸序列为序列表中序列1所示的短肽;
9.a2)氨基酸序列为序列表中序列2所示的短肽;
10.a3)氨基酸序列为序列表中序列3所示的短肽;
11.a4)氨基酸序列为序列表中序列4所示的短肽。
12.具体的,所述短肽为如下a1)或a2):
13.a1)氨基酸序列为序列表中序列1所示的短肽;
14.a2)氨基酸序列为序列表中序列2所示的短肽。
15.更具体的,所述短肽的氨基酸序列为序列表中序列1所示的短肽。
16.上述短肽的应用也在本发明的保护范围之内。
17.本发明上述短肽的应用包括如下b1)-b4)中任一种:
18.b1)在制备预防或治疗动脉粥样硬化的产品中的应用;
19.b2)在制备预防或治疗血管再狭窄的产品中的应用;
20.b3)在制备降低受损动脉的新生内膜面积的产品中的应用;
21.b4)在制备降低受损动脉的内膜面积与中膜面积比的产品中的应用。
22.上述应用,所述产品可以为药物、试剂或疫苗等。
23.本发明进一步提供了上述短肽的偶联物,所述偶联物是由上述短肽和载体蛋白偶联得到的完全抗原。
24.上述偶联物中,所述载体蛋白可为匙孔血蓝素蛋白、重组qβ噬菌体颗粒蛋白、重组牛乳头瘤病毒蛋白、重组乙型肝炎病毒蛋白或破伤风类毒素。
25.上述偶联物中,所述偶联时使用的偶联剂为异双功能交联剂;具体的,所述异双功能交联剂可为smcc、sulfo-smcc或lc-smcc。
26.上述偶联物的应用也在本发明的保护范围之内。
27.本发明上述偶联物的应用包括如下b1)-b4)中任一种:
28.b1)在制备预防或治疗动脉粥样硬化的产品中的应用;
29.b2)在制备预防或治疗血管再狭窄的产品中的应用;
30.b3)在制备降低受损动脉的新生内膜面积的产品中的应用;
31.b4)在制备降低受损动脉的内膜面积与中膜面积比的产品中的应用。
32.上述应用,所述产品可以为药物、试剂或疫苗等。
33.本发明进一步提供了一种预防或治疗动脉粥样硬化和/或预防或治疗血管再狭窄和/或降低受损动脉的新生内膜面积和/或降低受损动脉的新生内膜与新生中膜面积比的疫苗。
34.上述疫苗包括下述a1)-a4)中任一所述的短肽与载体蛋白偶联得到的偶联物:
35.a1)氨基酸序列为序列表中序列1所示的短肽;
36.a2)氨基酸序列为序列表中序列2所示的短肽;
37.a3)氨基酸序列为序列表中序列3所示的短肽;
38.a4)氨基酸序列为序列表中序列4所示的短肽。
39.上述疫苗中,所述蛋白载体可为匙孔血蓝素蛋白(klh)、重组qβ噬菌体颗粒蛋白、重组牛乳头瘤病毒蛋白、重组乙型肝炎病毒蛋白或破伤风类毒素。
40.上述疫苗中,还包括免疫佐剂。
41.上述疫苗中,所述免疫佐剂可为氢氧化铝佐剂、明矾佐剂、弗氏佐剂。
42.上述疫苗在制备预防或治疗动脉粥样硬化和/或预防或治疗血管再狭窄和/或降低受损动脉的新生内膜面积和/或降低受损动脉的新生内膜与新生中膜面积比的产品中的应用也在本发明的保护范围之内。
43.上述应用中,所述产品可为药物或试剂。
44.本发明上述短肽包含第一连接位点,至少能够通过一个共价键与载体蛋白的第二连接位点结合。使用重组qβ噬菌体颗粒蛋白、重组牛乳头瘤病毒蛋白、重组乙型肝炎病毒蛋白、匙孔血蓝素蛋白、破伤风类毒素作为载体蛋白,这些载体蛋白至少具有一个第二连接位点,优选的第二连接位点包括氨基、羧基和巯基,具体选自赖氨酸残基、精氨酸残基、谷氨酸残基、天冬氨酸残基和半胱氨酸残基。使用异双功能交联剂将adamts-7短肽与上述载体蛋白偶联结合,以形成有序、重复的短肽-载体疫苗。短肽被重复并以一定密度展示排列在载体上或者表面,形成高抗原性的阵列展示,利于高效的特异性的抗人和小鼠adamts-7免疫原性肽段抗体的生成,可以有效阻断adamts-7的水解酶功能,显著抑制血管再狭窄小鼠模型的内膜新生,以及高脂喂养小鼠的动脉粥样硬化发生。
45.本发明具有如下有益效果:
46.1、本发明筛选的金属蛋白酶adamts-7的短肽可在野生型的c57bl/6小鼠、apoe-/-小鼠体内引起特异性的免疫应答,产生针对短肽的特异性抗体,该抗体能够与金属蛋白酶adamts-7的催化区域特异性结合,阻断其水解酶的活性。
47.2、本发明制备的疫苗能够显著抑制血管再狭窄小鼠模型(即结扎模型和导丝拉伤模型)的内膜新生,以及高脂喂养小鼠的动脉粥样硬化发生,能用于预防或治疗动脉粥样硬化和/或血管再狭窄。
48.3、本发明疫苗的制备过程中使用的异双功能交联剂具有能够同时连接两种基团的特点,而且不同的基团可以通过两步先后连接上去,操作简单、快速。
附图说明
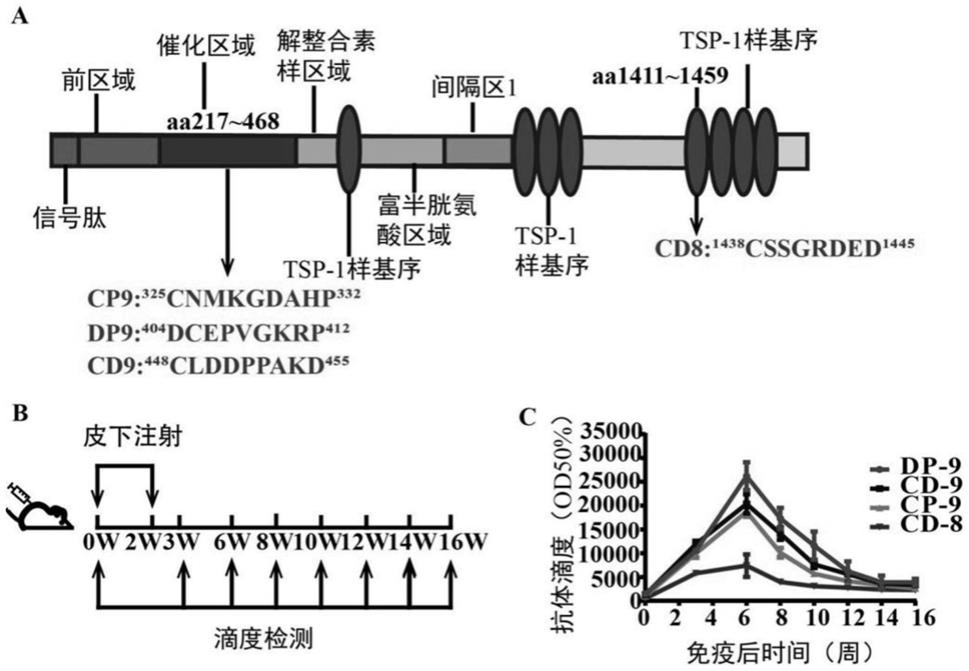
49.图1中a为adamts-7免疫原性肽段的氨基酸序列;b为adamts-7疫苗接种时间和滴度检测时间示意图;c为adamts-7疫苗滴度的检测结果。
50.图2中a为adamts-7疫苗接种时间和滴度检测时间及颈总动脉结扎手术时间示意图;b为adamts-7疫苗滴度的检测结果;c为he染色结果;d为结扎模型小鼠新生内膜面积;e为结扎模型小鼠新生内膜面积与中膜面积比;f为结扎模型小鼠外弹力板周长(即外周长);g为结扎模型小鼠中膜面积。
51.图3中a为adamts-7疫苗接种时间和滴度检测时间及导丝拉伤手术时间示意图;b为adamts-7疫苗滴度的检测结果;c为he染色结果;d为导丝拉伤模型小鼠新生内膜面积;e为导丝拉伤模型小鼠新生内膜面积与中膜面积比;f为导丝拉伤模型小鼠外弹力板周长(即外周长);g为导丝拉伤模型小鼠中膜面积。
52.图4为a为adamts-7疫苗接种时间、滴度检测时间和高脂饮食时间示意图;b为adamts-7疫苗滴度的检测结果;c为小鼠体重的检测结果;d为动脉粥样硬化模型小鼠的斑块面积(从左到右依次为对照组、实验组1和实验组2);e为动脉粥样硬化模型小鼠的斑块面积的统计结果。
具体实施方式
53.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
54.实施例1、adamts-7疫苗的制备及滴度的检测
55.1、金属蛋白酶adamts-7的免疫原性肽段的筛选
56.adamts7主要通过结合并降解comp,从而促进vsmc迁移,促进血管新生内膜形成,本发明将catalytic domain和4tsp-1 like domain选定为筛选短肽的目标区域。将catalytic domain和4 tsp-1like domain的氨基酸序列分别输入iedb b cell epitope prediction的对话框内,根据其预测的评分,在评分较高中,以8、9、10、11、12个氨基酸为单位,选取总体评分较高的短肽,同时将以上2个区域的氨基酸序列输入iedb的对话框内,选择现有的与adamts7相似性最高的crystal structure of adamts4 with inhibitor bound为模型进行表位预测,结合二者结果,并根据adamts7分子human与mouse序列比对结果,以不相差2个以上氨基酸为标准,选定初步的短肽序列。再将筛选出的短肽序列利用pir peptide match及blast等工具与adamts家族的蛋白分子的序列及其他蛋白序列进行比对,尽量选取同源性较低的短肽序列。综合以上原则,筛选出4个免疫原性肽段(4个短肽),结果如图1中a所示,分别为:
57.dp9:dcepvgkrp(序列1)
58.cd9:clddppakd(序列2)
59.cp9:cnmkgdahp(序列3)
60.cd8:cssgrded(序列4)。
61.2、偶联物的制备使用异双功能交联剂sulfo-smcc(购自thermofisher,货号22122)将4个免疫原性肽段分别与匙孔血蓝素蛋白(klh)进行偶联,其步骤如下:(1)称取sulfo-smcc试剂2mg,400ul纯水完全溶解后加入至20mg klh(10mg/ml)中,混匀,室温放置30分钟,得到活化的载体;(2)将活化的载体加入至100k的tff浓缩柱(merck-millipore)中,添加50mm pbs(含1mm edta,ph 7.2),5000g离心3次,脱去游离的sulfo-smcc,得到纯化的载体;(3)称取短肽(dp9、cd9、cp9或cd8)约5mg,50mm pbs(含1mm edta,ph 7.2)1ml充分溶解加入纯化的载体中,室温反应1小时,每隔20分钟轻轻振荡一次,得到疫苗混合物;(4)将疫苗混合物加入至100k的tff浓缩柱,5000g离心3次,脱去游离的未反应的相应短肽。
62.通过上述偶联反应最终得到4种偶联物干粉:klh-cp9(cp9和klh偶联得到的偶联物)、klh-dp9(dp9和klh偶联得到的偶联物)、klh-cd9(cd9和klh偶联得到的偶联物)、klh-cd8(cd8和klh偶联得到的偶联物)。
63.3、滴度的检测
64.实验小鼠为雄性6周龄c57bl/6小鼠(购自北京大学医学部动物部),共40只,体重21-23g,随机分为5组,每组8只,分别为实验组1、实验组2、实验组3、实验组4和对照组。
65.将步骤2得到的4种偶联物干粉分别溶于无菌生理盐水中,得到4种浓度均为1mg/ml的偶联物溶液。将4种偶联物溶液分别与氢氧化铝佐剂(购自heart,货号bf040)均以体积比为10∶1进行混合,得到4种疫苗,即疫苗cp-9、疫苗dp-9、疫苗cd-9和疫苗cd-8,分别采用皮下3-4点注射的方式注射给实验组1、实验组2、实验组3、实验组4的小鼠;将klh溶于无菌生理盐水中,得到浓度为1mg/ml的klh溶液,将klh溶液与氢氧化铝佐剂(购自heart,货号bf040)以体积比为10∶1进行混合,得到klh混合液,采用皮下3-4点注射的方式注射给对照组的小鼠。实验组1-4中每只小鼠的注射剂量按照偶联物计为50ug,对照组中每只小鼠的注射剂量按照klh计为50ug。如图1中b所示,共注射两次,6周龄时进行第一次疫苗注射(记为
第0周,即0w),鼠尾取血进行第一次滴度,第2周进行第二次疫苗注射,第3、6、8、10、12、14、16周鼠尾取血进行滴度检测,滴度检测结果如图1中c所示,从图中可以看出4种疫苗免疫小鼠后,能够产生持续12周以上的抗体滴度。
66.上述疫苗滴度的检测方法如下:(1)在包被过的酶标板的每孔内加入100ul不同被比稀释度的实验组1-4的小鼠血清,并加入对照组的小鼠血清样品,37
°
孵育1.5小时;(2)pbst洗涤5次拍干,加入100ul稀释后的hrp标记的二抗,37
°
孵育0.5小时;(3)pbst洗涤5次拍干,每孔加入100ul tmb(购自biolegend,货号421106),待对照孔刚要变蓝时,每孔加100ul稀盐酸终止,酶标仪上读取a
450
吸收值,计算实验组1-4小鼠血清读数大于对照组小鼠血清读数2.1倍的最大稀释倍数。其中,包被过的酶标板有4种,分别为包被抗原是bsa-cp9的酶标板、包被抗原是bsa-dp9的酶标板、包被抗原是bsa-cd9的酶标板、包被抗原是bsa-cd8的酶标板。bsa-cp9、bsa-dp9、bsa-cd9、bsa-cd8是按照步骤2的偶联方法将短肽(cp9、dp9、cd9或cd8)与牛血清白蛋白(bsa)进行偶联得到的偶联物。酶标板的包被方法如下:(1)用ph9.6的碳酸盐包被缓冲液溶解包被抗原,使包被抗原浓度为15ug/ml,加100ul/孔到96孔酶标板(购自biolegend,货号423501),4
°
放置过夜;(2)第二天弃去包被液后拍干,每孔加入120ul 1%bsa(购自solarbio,货号a8020-100)37
°
封闭1.5小时,倒掉拍干。
67.实施例2、疫苗dp-9和疫苗cd-9抑制结扎模型造成的新生内膜形成
68.1、免疫后小鼠左颈总结扎模型的建立
69.实验小鼠为雄性6周龄c57bl/6小鼠(购自北京大学医学部动物部),共40只,体重21-23g,随机分为5组,每组8只,分别为实验组1、实验组2、实验组3、实验组4和对照组。
70.将实施例1中步骤2得到的4种偶联物干粉(klh-cp9、klh-dp9、klh-cd9、klh-cd8)分别溶于无菌生理盐水中,得到4种浓度均为1mg/ml的偶联物溶液。将4种偶联物溶液分别与氢氧化铝佐剂(购自heart,货号bf040)均以体积比为10∶1进行混合,得到4种疫苗,即疫苗cp-9、疫苗dp-9、疫苗cd-9和疫苗cd-8,分别采用皮下3-4点注射的方式注射给实验组1、实验组2、实验组3、实验组4的小鼠;将klh溶于无菌生理盐水中,得到浓度为1mg/ml的klh溶液,将klh溶液与氢氧化铝佐剂(购自heart,货号bf040)以体积比为10∶1进行混合,得到klh混合液,采用皮下3-4点注射的方式注射给对照组的小鼠。实验组1-4中每只小鼠的注射剂量按照偶联物计为50ug,对照组中每只小鼠的注射剂量按照klh计为50ug。如图2中a所示,6周龄时进行第一次疫苗注射(记为第0周,即0w),鼠尾取血进行第一次滴度和体重测量,第2周进行第二次疫苗注射,第3周鼠尾取血进行第二次滴度,其中,滴度的检测方法同实施例1。如图2中b所示,第3周引起免疫反应后的小鼠准备进行左颈总动脉结扎实验(即造模):实验前,腹腔注射1%戊巴比妥钠150ul,6-0缝合线(购自harveybio,货号fx-6-0),在靠近颈总动脉分叉处进行结扎。造模四周后(即第7周),鼠尾取血进行第三次滴度检测。疫苗滴度结果如图2中b所示,从图中可以看出在4种疫苗免疫小鼠3周及7周后,均能产生较高的抗体滴度。
71.2、抑制新生内膜
72.在造模四周后,进行固定取材:4%多聚甲醛固定过夜后包埋于oct(购自美国樱花,货号4583))胶中,-80℃保存用于后续冰冻切片。冰冻切片从结扎处开始保留200um、350um、500um、1mm、1.5mm和2mm六个位置的切片,每张切片7um,然后进行he染色,每组小鼠的染色结果如图2中c所示,计算新生内膜面积与中膜面积比、外弹力板周长和中膜面积4个
指标,如图2中d、e、f和g所示,利用image pro plus软件统计得到:颈总动脉结扎小鼠在注射疫苗dp-9(图中以“dp-9”表示)和cd-9(图中以“cd-9”表示)后比对照组(图中以“klh”表示)小鼠的血管新生内膜面积及内膜面积与中膜面积比显著降低,同时注射cp-9(图中以“cp-9”表示)和cd-8(图中以“cd-8”表示)疫苗小鼠的血管新生内膜面积及内膜面积与中膜面积比与对照组(图中以“klh”表示)相比没有统计学差异。因此,疫苗dp-9和疫苗cd-9在抑制结扎模型造成的新生内膜形成具有显著的效果。
73.实施例3、疫苗dp-9和疫苗cd-9抑制导丝拉伤模型造成的新生内膜形成
74.1、免疫后小鼠导丝拉伤模型的建立
75.实验小鼠为雄性6周龄c57bl/6小鼠(购自北京大学医学部动物部),共30只,体重21-23g,随机分为5组,每组6只,分别为实验组1、实验组2、实验组3、实验组4和对照组。
76.将实施例1中步骤2得到的4种偶联物干粉(klh-cp9、klh-dp9、klh-cd9、klh-cd8)分别溶于无菌生理盐水中,得到4种浓度均为1mg/ml的偶联物溶液。将4种偶联物溶液分别与氢氧化铝佐剂(购自heart,货号bf040)均以体积比为10∶1进行混合,得到4种疫苗,即疫苗cp-9、疫苗dp-9、疫苗cd-9和疫苗cd-8,分别采用皮下3-4点注射的方式注射给实验组1、实验组2、实验组3、实验组4的小鼠;将klh溶于无菌生理盐水中,得到浓度为1mg/ml的klh溶液,将klh溶液与氢氧化铝佐剂(购自heart,货号bf040)以体积比为10∶1进行混合,得到klh混合液,采用皮下3-4点注射的方式注射给对照组的小鼠。实验组1-4中每只小鼠的注射剂量按照偶联物计为50ug,对照组中每只小鼠的注射剂量按照klh计为50ug。如图3中a所示,6周龄时进行第一次疫苗注射(记为第0周,即0w),鼠尾取血进行第一次滴度和体重测量,第2周进行第二次疫苗注射,第3周鼠尾取血进行第二次滴度,其中,滴度的检测方法同实施例1。如图3中b所示,引起免疫反应后的小鼠准备进行左颈总动脉导丝拉伤实验(即造模):实验前,腹腔注射1%戊巴比妥钠150ul,消毒颈部皮肤后,行颈部前正中切口,结扎颈外动脉,用血管夹暂时阻断境内动脉和颈总动脉血流。用显微维纳斯剪在靠近颈外动脉远心端结扎处剪一斜口,插入直径为0.38mm的金属导丝,旋转进退5次摩擦血管壁,造成颈总动脉损伤。退出导丝,结扎动脉切开的近心端,缝合皮肤。在造模四周后(即第7周),鼠尾取血进行第三次滴度检测。疫苗滴度结果如图3中b所示,从图中可以看出疫苗cp-9与dp-9免疫小鼠后能产生较高抗体滴度。
77.2、抑制新生内膜
78.在造模四周后,进行固定取材:4%多聚甲醛固定过夜后包埋于oct(购自美国樱花,货号4583)胶中,-80℃保存用于后续冰冻切片。冰冻切片从结扎处开始保留200um、350um、500um、1mm、1.5mm和2mm六个位置的切片,每张切片7um,然后进行he染色,每组小鼠的染色结果如图3中c所示,计算新生内膜面积内膜面积与中膜面积比、外弹力板周长和中膜面积4个指标,如图3中d、e、f和g所示,,利用image pro plus软件统计得到颈总动脉导丝拉伤小鼠在注射疫苗dp-9(图中以“dp-9”表示)和cd-9(图中以“cd-9”表示)后比对照组(图中以“klh”表示)小鼠的新生内膜面积及内膜面积与中膜面积比显著降低。因此,疫苗dp-9和疫苗cd-9在抑制导丝拉伤模型造成的新生内膜形成具有显著的效果。
79.实施例4、疫苗dp-9抑制ldlr-/-小鼠高脂喂养诱导的动脉粥样硬化的形成
80.1、动脉粥样硬化模型的建立。
81.实验小鼠为8周龄ldlr-/-雄性小鼠(购自北京大学医学部动物部),共18只,体重
23-25g,随机分为3组,每组6只,分别为实验组1、实验组2和对照组。
82.将实施例1中步骤2得到的2种偶联物干粉(klh-dp9、klh-cd9)分别溶于无菌生理盐水中,得到2种浓度均为1mg/ml的偶联物溶液。将2种偶联物溶液分别与氢氧化铝佐剂(购自heart,货号bf040)均以体积比为10∶1进行混合,得到2种疫苗,即疫苗dp-9、疫苗cd-9,分别采用皮下3-4点注射的方式注射给实验组1、实验组2的小鼠;将klh溶于无菌生理盐水中,得到浓度为1mg/ml的klh溶液,将klh溶液与氢氧化铝佐剂(购自heart,货号bf040)以体积比为10∶1进行混合,得到klh混合液,采用皮下3-4点注射的方式注射给对照组的小鼠。实验组1和实验组2中每只小鼠的注射剂量按照偶联物计为50ug,对照组中每只小鼠的注射剂量按照klh计为50ug。如图4中a所示,8周龄时进行第一次疫苗注射(记为第0周,即0w),分别于第2、4、12、15周进行疫苗注射,从第4周持续到第18周,进行致动脉粥样硬化饮食(即高脂饮食,饲料购自research diets,货号:d12108c,其主要组分的含量为1.25%胆固醇,40kcal%脂肪)。并于第3、9、13、18周进行疫苗滴度检测和体重检测,其中,滴度的检测方法同实施例1。如图4中b和c所示,结果说明了疫苗cd-9与dp-9免疫小鼠后能够产生较高抗体滴度,并且在第18周依旧能检测到较高抗体滴度。
83.2、抑制动脉粥样硬化的形成
84.在显微镜下,利用显微器械剥离出小鼠整根血管,之后放置于4%多聚甲醛固定6h,后放于60%异丙醇静泡5min,然后避光条件下油红o染色30min,之后在60%异丙醇液体里洗去肤色,后继续在显微镜下剥下外膜脂肪,剥干净后用显微剪刀将血管纵向抛开,后重复相同的步骤,60%异丙醇静泡5min,然后避光条件下油红o染色30min,之后在60%异丙醇液体里洗去肤色。最后将染色好的血管固定于板子上面,得到大体图,如图4中d所示,对照组、实验组1、实验组2均有动脉粥样硬化斑块形成。利用image pro plus软件统计斑块面积,以对照组(图中以“klh”表示)的斑块面积为1,计算实验组2(图中以“cd-9”表示)和实验组1(图中以“dp-9”表示)的相对斑块面积,结果表明:与对照组(图中以“klh”表示)比,实验组1(图中以“dp-9”表示)相对斑块面积显著减少(p<0.001),实验组2(图中以“cd-9”表示)相对斑块面积没有差异(p>0.05),表明疫苗dp-9显著抑制动脉粥样硬化斑块的形成,疫苗cd-9与对照组klh相比没有明显差异。
85.本发明采用以下统计学方法进行分析:(1)正态分布的连续随机变量采用平均值
±
标准误表示(mean
±
sem);(2)成对数据均采用配对t检验(双侧检验);(3)非成对数据采用成组t检验(双侧检验);(4)进行多组间单因素结果比较时,采用单因素方差分析,进一步进行组间两两比较时采用student-newman-keuls检验;(5)进行多组间双因素结果比较时,采用双因素方差分析,进一步进行组间两两比较时采用bonferroni检验。
86.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1