一种稀有鮈鲫鳔细胞系及其培养方法和诱导转化方法与流程
1.本发明涉及细胞生物学技术领域,更具体的说是涉及一种稀有鮈鲫鳔细胞系及其培养方法和诱导转化方法。
背景技术:
2.稀有鮈鲫(gobiocypris rarus)属鲤科鮈鲫属,是中国特有种类,主要分布于四川省长江上游。稀有鮈鲫具有个体小(成鱼30mm
‑
80mm)、能够适应较大温度范围(0
‑
30℃)条件下生长、性成熟及生命周期期短、繁殖季节长、产卵频率高、产卵量大、卵透明便于观察、对环境污染物敏感等特性,这些特性使稀有鮈鲫成为水生态毒理学良好的受试生物,被推荐作为中国本土的供试生物在水生态毒性检测中使用。
3.但是,目前稀有鮈鲫仅局限于在水生态毒性检测中使用,并未见其在水产动物细胞转化研究中应用的报道。
4.因此,为了扩大稀有鮈鲫的应用领域,使其能广泛应用于生物实验中,提供一种新的稀有鮈鲫细胞系及其培养方法是本领域技术人员亟需解决的问题;并且,为将其应用于水产动物细胞转化研究,提供一种稀有鮈鲫鳔细胞系的诱导转化方法同样是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一种稀有鮈鲫鳔细胞系及其培养方法和诱导转化方法,为稀有鮈鲫在水产动物转化研究方面应用提供的基础,能够扩大其在生物实验中的应用。
6.为了实现上述目的,本发明采用如下技术方案:
7.一种稀有鮈鲫鳔细胞系,保藏编号为cctcc no:c2019243。
8.具体的,其分类命名为稀有鮈鲫鳔细胞系grsb,于2019年9月26日保存在中国典型培养物保藏中心、并证明存活,保藏登记编号为cctcc no: c2019243,保藏地址为中国.武汉.武汉大学。
9.上述优选技术方案的有益效果是:本发明公开一种稀有鮈鲫鳔细胞系可以进行长时间的传代培养,可以广泛应用于生物实验中。
10.本发明还提供了一种如上所述的稀有鮈鲫鳔细胞系的培养方法,具体包括如下步骤:
11.(1)稀有鮈鲫鳔细胞的原代培养
12.取健康稀有鮈鲫的鳔组织,剪碎后进行消化处理,然后采用第一完全培养液进行原代培养,得到原代培养细胞;
13.(2)稀有鮈鲫鳔细胞的传代培养
14.取所述原代培养细胞进行消化处理,收集得到悬浮细胞接种于第二完全培养液进行传代培养,得到传代培养细胞即为所述稀有鮈鲫鳔细胞系;
15.(3)细胞的冻存与复苏
16.取所述传代培养细胞进行消化处理,离心分离后得到的沉淀物与冻存保护液混合,先初步冷藏,再投入液氮中长期冻存;
17.冻存结束后先融化处理,然后离心分离,得到的沉淀物加入至第二完全培养液清洗后,再次进行离心分离,收集得到细胞接种于第二完全培养液中培养。
18.上述优选技术方案的有益效果是:本发明公开的稀有鮈鲫鳔细胞系的培养方法从健康稀有鮈鲫的鳔组织中提取稀有鮈鲫鳔细胞,经过原代培养和传代培养得到稀有鮈鲫鳔细胞系(保藏编号为cctcc no:c2019243),其可以进行长时间的传代培养,从而可以广泛应用于实验中;经过冻存后能够长期保存,冻存后经过复苏能够重获生物活性,可以继续进行传代培养。
19.优选的,所述第一完全培养液包括如下体积百分比的组分:20%的胎牛血清、1%三抗抗生素溶液和79%的m199培养液;
20.所述第二完全培养液包括如下体积百分比的组分:10%的胎牛血清和90%的m199培养液。
21.优选的,所述三抗抗生素溶液包括100u/ml青霉素、100μg/ml链霉素、 0.25μg/ml两性霉素b,三抗抗生素溶液采用gibco,usa品牌的产品。
22.上述优选技术方案的有益效果是:本发明公开的完全培养基能够为细胞原代培养和传代培养提供充足的营养物质,适合稀有鮈鲫鳔细胞培养。
23.优选的,步骤(1)具体包括如下步骤:
24.(11)将鲜活健康的稀有鮈鲫于75%酒精中浸泡1~2min,然后置于超净台中无菌取下鳔组织、并去除鳔组织表面膜成分,接着用pbs缓冲液漂洗2~3遍后置于保存培养液中保存;
25.(12)取出所述鳔组织剪成1mm2大小的组织块后与pbs缓冲液混合,然后进行离心分离,弃去上清液,收集得到沉淀物重复进行与pbs缓冲液混合、离心分离和弃去上清液的操作,得到预处理组织块;
26.(13)向所述预处理组织块中按照1:(5
‑
10)体积比加入ⅱ型胶原酶溶液进行第一消化处理,其中第一消化处理的温度为37℃、时间为20
‑
30min;然后离心分离弃去上清液;接着加入第一完全培养液再次进行离心分离弃去上清液,收集得鳔细胞;
27.(14)用第一完全培养液悬浮所述鳔细胞至细胞密度大于2x105个/ml,然后接种于培养瓶中于27℃条件下培养,至细胞长满培养瓶底后用吸管吸除培养后溶液,并用pbs缓冲液清洗2次,得到原代培养细胞。
28.上述优选技术方案的有益效果是:本发明公开的原代培养过程从鲜活健康的稀有鮈鲫中提取鳔细胞,然后经过原代培养使细胞生长稳定,从而可以获得原代培养细胞。
29.优选的,步骤(11)中所述保存培养液中包括如下体积百分比的组分: 5%的胎牛血清和95%的m199培养液。
30.优选的,步骤(12)中向1mm2大小的所述组织块中加入5ml的pbs缓冲液,所述离心分离的转速为1000rpm,时间为3min。
31.上述优选技术方案的有益效果是:经过低速离心分离可去除取样过程中的血细胞,从而有利于分离得到鳔细胞。
32.优选的,步骤(13)中所述ⅱ型胶原酶溶液的浓度为0.1mg/ml;所述离心分离的转
速为1000rpm,时间为5min。
33.优选的,步骤(2)具体包括如下步骤:
34.(21)向所述原代培养细胞中加入0.25%胰酶
‑
edta溶液进行第二消化处理,待消化至细胞变圆后用吸管吸除第二消化处理溶液,所述第二消化处理的温度为20
‑
26℃、时间为30s
‑
1min;然后,加入第二完全培养液培养基终止消化,得到第二消化处理细胞;
35.(22)取所述第二消化处理细胞,用吸管轻吹后收集悬浮细胞,将所述悬浮细胞以1:2的比例接种于培养瓶内,加入第二完全培养液,在27℃条件下培养至稀有鮈鲫鳔细胞长成单层,得到传代培养细胞;
36.(23)取所述传代培养细胞重复步骤(21)~(22)。
37.上述优选技术方案的有益效果是:按照本发明公开的传代培养方法进行传代,细胞生长迅速,形态稳定。
38.优选的,所述0.25%胰酶
‑
edta溶液包括如下体积百分比组分:0.25%的胰蛋白酶、0.1%的edta和余量pbs溶液。
39.优选的,步骤(22)中1:2的比例是指按照1:2的比例进行传代;所述培养瓶底壁为25cm2,所述第二完全培养液的体积为5ml。
40.优选的,步骤(3)具体包括如下步骤:
41.(31)取步骤(2)处于对数生长期、细胞密度大于90%的传代培养细胞加入0.25%胰酶
‑
edta溶液进行第二消化处理,待消化至细胞变圆后用吸管吸除第三消化处理溶液,并加入新鲜培养基终止消化,得到第二消化处理细胞;
42.(32)取步骤(31)中所述第三消化处理细胞进行离心分离,去除上清液,得到的沉淀物加入冻存保护液按照5
×
106个/ml比例将细胞重悬;然后注入冻存管中,再将所述冻存管置于程序降温盒中,于
‑
80℃下初步冷藏 16
‑
24h;最后投入液氮中长期保存;
43.(33)将液氮中冻存的细胞在37
‑
40℃水浴条件下融化,然后离心、去除上清液,得到的沉淀物加入完全培养液中重悬,再次离心分离、去除上清液,收集得到稀有鮈鲫鳔细胞接种于培养液中,在27℃下培养16~2424h后更换培养液继续培养,得到复苏的稀有鮈鲫鳔细胞。
44.上述优选技术方案的有益效果是:本发明公开的细胞的冻存与复苏方法可以长时间冻存细胞,且细胞复苏后可在4h内贴壁,16
‑
24h长满瓶底,增殖速度快。
45.优选的,所述0.25%胰酶
‑
edta溶液包括如下体积百分比组分:0.25%的胰蛋白酶、0.1%的edta和余量pbs溶液;所述第二消化处理的温度为 20
‑
26℃;所述离心处理的转速为1000rpm,时间为5min。
46.优选的,所述冻存保护液包括如下体积百分比的组分:20%的胎牛血清、 10%的二甲基亚砜和70%的m199培养液。
47.本发明还提供了一种如上所述的稀有鮈鲫鳔细胞系的诱导转化方法,具体包括如下步骤:
48.(a)配制n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍溶液
49.先将n
‑
甲基
‑
n
’‑
硝基
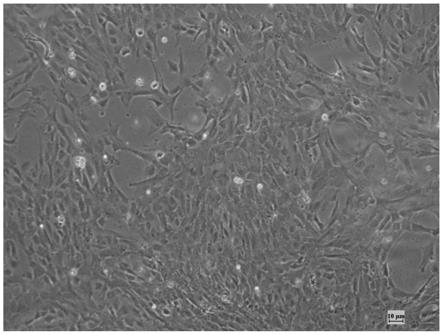
‑
n
‑
亚硝基胍溶于去离子水中配成的母液,然后由母液配制成n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液;
50.(b)n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍诱导稀有鮈鲫鳔细胞
51.将第2~10代如权利要求1所述的稀有鮈鲫鳔细胞先先加入第一完全培养液,在27℃下培养16
‑
24h;然后加入所述n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液进行诱导培养,得到诱导后细胞;
52.(c)低血清培养
53.取所述诱导后细胞加入a培养液培养,然后采用b培养液培养,观察细胞出现转化灶的情况,得到诱导转化的稀有鮈鲫鳔细胞系。
54.上述优选技术方案的有益效果是:本发明使用n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍(n
‑
methyl
‑
n
‑
nitroso
‑
n'
‑
nitroguanidine,mnng)对稀有鮈鲫鳔细胞系进行转化,操作简单有效,可为水产动物细胞转化提供参考依据。
55.优选的,步骤(a)中所述母液浓度为10mg/ml;所述n
‑
甲基
‑
n
’‑
硝基
ꢀ‑
n
‑
亚硝基胍细胞培养液浓度为1~11μg/ml;步骤(b)中所述第一完全培养液包括如下体积百分比的组分:20%的胎牛血清、1%三抗抗生素溶液和79%的m199培养液,所述诱导培养的温度为27℃,时间为24
‑
48h。
56.优选的,所述n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液浓度为1μg/ml、 3μg/ml、5μg/ml、7μg/ml、9μg/ml或11μg/ml。
57.优选的,步骤(c)中所述清洗是采用hbss溶液洗1~3次;
58.所述a培养液包括如下体积百分比组分:20%的胎牛血清和80%的m199 培养液,所述a培养液培养的温度为27℃、时间为2~3周;
59.所述b培养液包括如下体积百分比的组分:5%的胎牛血清和95%的m199 培养液,所述b培养液培养的温度为27℃,时间为30
‑
50d。
60.n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍(n
‑
methyl
‑
n
‑
nitroso
‑
n'
‑
nitroguanidine, mnng)是一种基因毒性诱变剂,通过饮食、呼吸或皮肤接触产生诱发突变和致癌作用。但是,亚硝胺类化学致癌剂对于细胞毒性和致癌性的机制目前尚不清楚。本发明主要从形态、染色体方面对亚硝胺类物质mnng诱导稀有鮈鲫鳔细胞系的转化进行研究,为亚硝胺类化学物质诱导水产动物细胞突变作用提供依据。
61.经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种稀有鮈鲫鳔细胞系及其培养方法和诱导转化方法,具有如下有益效果:
62.(1)本发明公开的稀有鮈鲫鳔细胞系可以进行长时间的传代培养,可广泛应用于实验中,具有特殊的实用价值;
63.(2)本发明公开的稀有鮈鲫鳔细胞系培养方法,具体操作简单,从鲜活健康的稀有鮈鲫中提取得到稀有鮈鲫鳔细胞,经过原代培养和传代培养得到稳定的稀有鮈鲫表细胞系,并且公开了对稀有鮈鲫表细胞系进行冻存和复苏的方法,从而方便在实验中应用;
64.(3)本发明公开的稀有鮈鲫鳔细胞系的诱导转化方法具体操作简单,通过n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍诱导培养,能够实现稀有鮈鲫鳔细胞系进行转化,为亚硝胺类化学物质诱导水产动物细胞突变作用提供依据。
附图说明
65.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本
发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
66.图1附图为本发明实施例1提供的稀有鮈鲫鳔细胞原代培养的细胞形态观察。
67.图2附图为本发明实施例1提供的稀有鮈鲫鳔细胞传代培养的第50代细胞形态观察。
68.图3附图为本发明实施例1提供的不同培养基培养稀有鮈鲫鳔细胞的生长曲线图;
69.图4附图为本发明实施例1提供的不同浓度胎牛血清(fbs)培养稀有鮈鲫鳔细胞的生长曲线图;
70.图5附图为本发明实施例1提供的温度培养稀有鮈鲫鳔细胞的生长曲线图;
71.图6为正常稀有鮈鲫鳔细胞的细胞形态;
72.图7为对比例1经过1μg/ml mnng诱导培养得到的的稀有鮈鲫鳔细胞的细胞形态;
73.图8为实施例2经过3μg/ml mnng诱导培养的稀有鮈鲫鳔细胞的细胞形态;
74.图9为实施例3经过5μg/ml mnng诱导培养的稀有鮈鲫鳔细胞的细胞形态;
75.图10为实施例4经过7μg/ml mnng诱导培养的稀有鮈鲫鳔细胞的细胞形态;
76.图11为实施例5经过9μg/ml mnng诱导培养的的稀有鮈鲫鳔细胞的细胞形态;
77.图12附图为本发明提供的mnng转化前后稀有鮈鲫鳔细胞的染色体分析图。
具体实施方式
78.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
79.实施例1
80.本发明实施例1公开了一种稀有鮈鲫鳔细胞系,保藏编号为cctcc no: c2019243。
81.具体的,其分类命名为稀有鮈鲫鳔细胞系grsb,于2019年9月26日保存在中国典型培养物保藏中心、并证明存活,保藏登记编号为cctcc no: c2019243,保藏地址为中国.武汉.武汉大学。
82.本发明实施例1还提供了一种如上述的稀有鮈鲫鳔细胞系的培养方法,具体包括如下步骤:
83.(1)稀有鮈鲫鳔细胞的原代培养
84.(11)将鲜活健康的稀有鮈鲫于75%酒精中浸泡1~2min,然后置于超净台中无菌取下鳔组织、并去除鳔组织表面膜成分,接着用pbs缓冲液漂洗 2~3遍后置于保存培养液中保存;第一培养液中包括5%的胎牛血清和m199 培养液;保存培养液中包括如下体积百分比的组分:5%的胎牛血清和95%的 m199培养液;
85.(12)取出鳔组织剪成1mm2大小的组织块,加入5ml的pbs缓冲液至 15ml离心管,然后进行离心分离,弃去上清液,收集得到沉淀物重复进行与 pbs缓冲液混合、离心分离和弃去上清液的操作,得到预处理组织块;其中,离心分离的转速为1000rpm,时间为3min;
86.(13)所述预处理组织块中按照1:(5
‑
10)体积比加入ⅱ型胶原酶溶液进行第一消化处理,其中第一消化处理的温度为37℃、时间为20
‑
30min;然后离心分离弃去上清液;接
着加入第一完全培养液再次进行离心分离弃去上清液,收集得鳔细胞;ⅱ型胶原酶溶液的浓度为0.1mg/ml;所述离心分离的转速为 1000rpm,时间为5min;
87.(14)用第一完全培养液悬浮所述鳔细胞至细胞密度大于2x105个/ml,然后接种于培养瓶中于27℃条件下培养,至细胞长满培养瓶底后用吸管吸除培养后溶液,并用pbs缓冲液清洗2次,得到原代培养细胞。
88.(2)稀有鮈鲫鳔细胞的传代培养
89.(21)向原代培养细胞中加入0.25%胰酶
‑
edta溶液进行第二消化处理,待消化至细胞变圆后用吸管吸除第二消化处理溶液,并加入第二完全培养基终止消化,得到第二消化处理细胞;0.25%胰酶
‑
edta溶液包括如下体积百分比组分:0.25%的胰蛋白酶、0.1%的edta和余量pbs溶液;
90.(22)取第二消化处理细胞,用吸管轻吹后收集悬浮细胞,将悬浮细胞以1:2的比例接种于培养瓶内,加入第二完全培养液至5ml/瓶,在27℃条件下培养至稀有鮈鲫鳔细胞长成单层,得到传代培养细胞;1:2的比例是指按照1:2的比例进行传代;培养瓶底壁为25cm2,第二完全培养液的体积为5ml;
91.(23)取传代培养细胞重复步骤(21)~(22)。
92.(3)细胞的冻存与复苏
93.(31)取步骤(2)处于对数生长期、细胞密度大于90%的传代培养细胞 (细胞密度约为2
×
106/ml)加入0.25%胰酶
‑
edta溶液进行第二消化处理,待消化至细胞变圆后用吸管吸除第二消化处理溶液,并加入新鲜培养基终止消化,得到第二消化处理细胞;0.25%胰酶
‑
edta溶液包括如下体积百分比组分:0.25%的胰蛋白酶、0.1%的edta和余量pbs溶液;第二消化处理的温度为20
‑
26℃、时间为30s
‑
1min;
94.(32)取步骤(31)中第二消化处理细胞进行离心分离,去除上清液,得到的沉淀物(约含1
×
107个细胞)加入2ml冻存保护液按照5
×
106个/ml 比例将细胞重悬;然后注入冻存管中,再将冻存管置于程序降温盒中,于
‑
80℃下初步冷藏过夜;最后投入液氮中长期保存;离心分离的转速为1000rpm,时间为5min,冻存保护液为20%fbs、10%dmso和70%的m199培养液;
95.(33)冻存结束后先在37
‑
40℃水浴条件下融化,然后离心分离、去除上清液,得到的沉淀物加入第二完全清洗,再次离心分离、去除上清液,收集得到稀有鮈鲫鳔细胞接种于第二完全培养液中,在27℃下培养16
‑
24h后换液继续培养,得到复苏的稀有鮈鲫鳔细胞。
96.其中,第一完全培养液包括如下体积百分比的组分:20%的胎牛血清、1%三抗抗生素溶液和79%的m199培养液;三抗抗生素溶液包括100u/ml青霉素、100μg/ml链霉素、0.25μg/ml两性霉素b,三抗抗生素溶液采用 gibco,usa品牌的产品。
97.第二完全培养液包括如下体积百分比的组分:10%的胎牛血清和90%的 m199培养液。
98.其中,m199培养液ph值为7.2~7.4。
99.采用本发明实施例1公开的方法培养稀有鮈鲫鳔细胞系,可以传代至60 代,传代比率为1:3或1:4。
100.结果验证
101.一、取实施例1步骤(1)得到的原代培养的稀有鮈鲫鳔细胞进行细胞形态观察,结
果如说明书附图1所示。
102.二、取实施例1步骤(2)得到的传代培养的稀有鮈鲫细胞进行细胞形态观察,结果如说明书附图1所示。
103.三、培养条件验证
104.1、验证稀有鮈鲫鳔细胞的培养基
105.(1)实验对象
106.对照组1~4:分别选择dmem、m199、mem、l
‑
15四种细胞培养液,并添加体积浓度为10%的fbs制备细胞培养液。
107.(2)实验方法
108.调整细胞密度为5
×
104ml
‑1,四种培养基各按2.5ml/孔的量接种于6孔板,于27℃的培养箱中培养。每1d从每个实验组里取出3孔细胞,用 trypsin
‑
edta消化法收集细胞并计数,共培养7d,连续计数7次,绘制其生长曲线,结果如说明书附图3所示。
109.2、验证稀有鮈鲫鳔细胞培养过程中血清浓度
110.(1)实验分组
111.实验组1~4:向m199细胞培养液中加入fbs,分别配制成fbs体积浓度为5%、10%、15%、20%的细胞培养液。
112.(2)实验方法
113.调整细胞密度为5
×
104ml
‑1,四种血清浓度培养基各按2.5ml/孔的量接种于6孔板,于27℃的培养箱中培养。每1d从每个实验组里取出3孔细胞,用trypsin
‑
edta消化法收集细胞并计数,共培养7d,连续计数7次,绘制其生长曲线,结果如说明书附图4所示。
114.3、稀有鮈鲫鳔细胞培养过程中的培养温度
115.(1)实验分组
116.选择15℃、22℃、27℃、32℃四个不同培养温度
117.(2)实验方法
118.使用添加10%fbs的dmem培养液,调整细胞密度为5
×
104ml
‑
1,细胞悬液按2.5ml/孔的量接种于6孔板并置于于四个不同培养温度培养箱里。每1d从每个实验组里取出3孔细胞,用trypsin
‑
edta消化法收集细胞并计数,共培养7d,连续计数7次,绘制其生长曲线,结果如说明书附图5所示。
119.由图3可知,鮈鲫鳔细胞系在含胎牛血清10%的m199培养基中,27℃生长,增殖最好。
120.实施例2~5
121.本发明实施例2~5还提供了一种如实施例1公开的稀有鮈鲫鳔细胞系的诱导转化方法,具体包括如下步骤:
122.(a)配制n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍(mnng)溶液
123.先将n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍溶于去离子水中配成10mg/ml的母液,然后由母液配制成浓度为1~9μg/ml的n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液,具体浓度如下表1所示;
124.(b)n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍诱导稀有鮈鲫鳔细胞
125.将实施例1中传代培养至第5代的稀有鮈鲫鳔细胞培养至指数增生期,然后加入n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液在27℃条件下培养24
‑
48h,得到诱导培养细胞;
126.(c)低血清培养
127.取所述诱导培养细胞分离除去诱导培养后溶液,采用hbss溶液洗1~3 次,清洗后加入高血清培养液在27℃条件下培养2~3周,高血清培养液包括 20%的胎牛血清和m199培养液;
128.然后采用低血清培养液培养,得到诱导转化的稀有鮈鲫鳔细胞系,其中,低血清培养液包括5%胎牛血清。
129.对比例1
130.仅将实施例2~5步骤(a)中由母液的n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液浓度替换为1μg/ml,其他技术参数与实施例2~5相同。
131.对比例1
132.仅将实施例2~5步骤(a)中由母液的n
‑
甲基
‑
n
’‑
硝基
‑
n
‑
亚硝基胍细胞培养液浓度替换为11μg/ml,其他技术参数与实施例2~5相同。
133.结果验证
134.一、对实施例2~5转化培养结果进行观察,得到诱导后稀有鮈鲫鳔细胞产生的转化灶数目如下表1所示。
135.表1
[0136] mnng浓度转化灶数目实施例23μg/ml+++实施例35μg/ml++++实施例47μg/ml+++++实施例59μg/ml+对比例11μg/ml
‑
对比例211μg/ml
‑
[0137]
注:+代表出现转化灶,+越多代表转化数目越多;
‑
代表无转化灶
[0138]
由上述结果可以得知,用mnng处理过的细胞于10
‑
30d后在正常细胞之间,可产生数量不等的转化灶。对比例1中诱导浓度为1μg/ml的mnng培养基诱导细胞无转化灶形成;对比例2中诱导浓度为11μg/ml的mnng培养基诱导细胞,由于浓度过高导致细胞全部死亡。诱导浓度为3
‑
9μg/ml的 mnng诱导稀有鮈鲫鳔细胞,均可出现转化灶,不同浓度的mnng诱导细胞产生的转化灶数量不同,转化灶由密集的重叠细胞组成。转化灶的大小不等,小者由几十或几百个细胞构成,大者肉眼可见。
[0139]
二、观察mnng转化前后稀有鮈鲫鳔细胞的细胞形态
[0140]
采用高倍镜对实施例2~5步骤(b)中第5代稀有鮈鲫鳔细胞培养至指数增长期进行观察,结果如说明书附图6所示;
[0141]
采用高倍镜分别对对比例1、实施例2~5步骤(c)得到的诱导转化后稀有鮈鲫鳔细胞系进行观察,结果如图7~11所示。
[0142]
图6~11中结果显示:
[0143]
图6为正常稀有鮈鲫鳔细胞;
[0144]
图7为对比例1经过1μg/ml mnng诱导培养得到的的稀有鮈鲫鳔细胞;
[0145]
图8为实施例2经过3μg/ml mnng诱导培养的稀有鮈鲫鳔细胞;
[0146]
图9为实施例3经过5μg/ml mnng诱导培养的稀有鮈鲫鳔细胞;
[0147]
图10为实施例4经过7μg/ml mnng诱导培养的稀有鮈鲫鳔细胞;
[0148]
图11为实施例5经过9μg/ml mnng诱导培养的的稀有鮈鲫鳔细胞。
[0149]
三、转化细胞染色体分析
[0150]
(1)实验分组
[0151]
空白对照组:实施例2~5步骤(b)中采用的第5代稀有鮈鲫鳔细胞培养至指数增长期;
[0152]
对照组:对比例1步骤(c)得到的诱导转化后稀有鮈鲫鳔细胞
[0153]
实验组:实施例2~5步骤(c)得到的诱导转化后稀有鮈鲫鳔细胞。
[0154]
(2)实验方法
[0155]
分别取空白对照组、对照组和实验组的稀有鮈鲫鳔细胞加入终浓度为 8
‑
20μg/ml的秋水仙素,27℃处理4h
‑
8h后收集细胞,用0.075mol/l的kcl 低渗处理25min,加入1ml预冷的卡诺固定液,1000r/min离心5min去上清后,用预冷的卡诺固定液固定3次,每次15min。
[0156]
采用冷滴片法滴片,干燥后,用5%的giemsa染色25min。
[0157]
镜检,分别选择100个分裂相进行核型分析和统计,进行染色体分析,结果如图12所示。
[0158]
(3)实验结果
[0159]
图12a中正常稀有鮈鲫鳔细胞染色体众数2n=50;
[0160]
图12b中1μg/ml mnng诱导的稀有鮈鲫鳔细胞染色体众数2n=50;
[0161]
图12c中3μg/ml mnng诱导的稀有鮈鲫鳔细胞染色体众数2n=54;
[0162]
图12d中5μg/ml mnng诱导的稀有鮈鲫鳔细胞染色体众数2n=72;
[0163]
图12e中7μg/ml mnng诱导的稀有鮈鲫鳔细胞染色体众数2n=66;
[0164]
图12f中9μg/ml mnng诱导的稀有鮈鲫鳔细胞染色体2n=96;
[0165]
由上述结果可知,3
‑
9μg/ml的mnng诱导的稀有鮈鲫鳔细胞均发生了转化,细胞突变。
[0166]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
[0167]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1