用于肺炎支原体的CRISPR检测引物组及其用途的制作方法
本发明涉及基于crispr技术的基因检测技术领域,特别是涉及一种用于肺炎支原体的crispr检测引物组及其用途。
背景技术:
肺炎支原体感染(mycoplasmapneumoniainfection)广泛存在于世界各地,感染通过患者咳嗽时喷出的飞沫实现人际传播,约80%的患者会出现明显的临床表现,通常表现为咽炎、气管支气管炎、反应性气道疾病/喘息或非特异性上呼吸道综合征。肺炎支原体的潜伏周期为2~4周,因此特定的人群感染会持续长达数周。肺炎支原体疾病通常发生在军事基地、寄宿学校和夏令营等人口密集的场所,儿童的家族内感染率为84%,而成人为41%,感染往往呈地方性而没有季节性,每4~7年发生一次散发性流行。
肺炎支原体(mycoplasmapneumonia)是儿童与成人社区获得性呼吸系统疾病的主要原因。它通常被认为是一种细胞外病原体,通过其末端顶部复杂的终端细胞器附着于纤毛呼吸上皮细胞,细胞粘附由聚集于细胞器且能够相互作用的黏附素和辅助蛋白所介导,在细胞外附着后对宿主的呼吸组织造成损伤。
口咽、鼻咽和肺部标本都可用于诊断肺炎支原体肺炎,其它体液如脑脊液可用于诊断肺炎支原体肺外感染。目前临床上难以通过患者的临床表现来区分肺炎支原体肺炎和其它类型的社区获得性肺炎,非微生物实验室检查和胸部影像学检查也同样不能够区分。此外,由于缺乏细胞壁,革兰氏染色无法看到肺炎支原体。历史上采用过冷凝集滴度检测,但其结果不具有特异性,目前也不再推荐使用该方法诊断肺炎支原体。目前,培养是诊断肺炎支原体感染的金标准方法,但是需要特殊的培养基,而且确定结果需要1~2周,常常很难从临床标本中分离出来,因此很少进行,不建议用于常规诊断。血清学的诊断方法是通过检测配对(急性期和缓解期)血清样本中的肺炎支原体的igm和igg抗体来确诊,酶联免疫分析是推荐的血清学检测方法。市场上已经有血清学方法如颗粒凝集(pa),补体结合(cf),和快速诊断诸如
重组酶-聚合酶扩增(rpa)是一种快速兴起的恒温扩增技术,通过能结合单链核酸(寡核苷酸引物)的重组酶、单链dna结合蛋白(ssb)和具有链置换功能的dna聚合酶,在室温(最佳反应温度为37℃)下即可获得可检测级别的扩增核酸。但是,原理上其单级扩增反应的本质并未改变,相较于目前市场上多数的实时定量pcr(qpcr)检测方式,并不能有实质性的灵敏度提升。
技术实现要素:
基于此,有必要针对上述问题,提供一种用于肺炎支原体的crispr检测引物组及其用途,采用该引物组以crispr技术检测肺炎支原体,缩短了对于肺炎感染源的检测时间,可在60min内完成检测。
一种用于肺炎支原体的crispr检测引物组,包括扩增引物对和crrna;所述扩增引物对用于扩增肺炎支原体如seqidno.1所示序列;所述crrna包括锚定序列和向导序列,所述锚定序列与cas蛋白特异性识别,所述向导序列与所述seqidno.1序列中的靶向序列片段相匹配。
上述引物组可应用于crispr-cas系统中,其检测原理为:cas蛋白在向导rna的引导下,靶向目标序列后启动其自身的“附带切割”活性,如果同时在体系中加入荧光报告分子(常用的报告分子是一段寡核苷酸序列,一端带有一个发光基团,一端带有一个淬灭基团,正常情况下由于淬灭作用,完整的报告分子不会被检测到,当寡核苷酸分子被水解后,游离的荧光信号可以被检测到),借用cas酶附带切割活性,可以实现待检序列信息向荧光信号的转化。并且通过rpa与crispr-cas的偶联,能够实现“序列扩增”(rpa完成)加上“酶促级联”(cas酶完成)的两级放大,从而超越qpcr这种单级扩增的灵敏度。
本发明人针对肺炎支原体的保守序列进行设计,从而将crispr技术应用于检测肺炎支原体中,与传统检测方法相比,缩短了肺炎感染源的检测时间,可在60min内完成检测。
在其中一个实施例中,所述扩增引物对选自:seqidno.2-3所示序列的引物对1,seqidno.4-5所示序列的引物对2,seqidno.6-7所示序列的引物对3,seqidno.8-9所示序列的引物对4,seqidno.10-11所示序列的引物对5;所述锚定序列针对cas13a蛋白设计,所述crrna选自:seqidno.12或seqidno.14所示序列。
在其中一个实施例中,所述扩增引物对选自:引物对1,所述crrna选自:seqidno.12所示序列。在crispr检测技术中,crrna和扩增引物的组合性能对检测效果影响非常大,crrna和扩增引物设计时需要考虑引物常规设计要点的同时,还要考虑引物扩增片段范围是否有合适的可用于crrna设计的序列,目前常用的引物设计指引难以根据常规参数要求设计出较好的crrna和扩增引物组合,更多时候需要在经验和实验尝试的基础上进行手动调整设计。发明人在前期研究基础上,经过多番筛选和比对,发现以上述crrna和扩增引物对组合,具有较好的检测效果。
在其中一个实施例中,所述扩增引物对的工作浓度为0.1~0.6μmol/l,优选0.3~0.5μmol/l,所述crrna的工作浓度为20~200nmol/l,优选30~50nmol/l。本发明人在实践中发现,在实用上述引物组检测肺炎支原体时,使用的引物浓度对检测效果有较大的影响,如引物浓度不适合,会出现灵敏度降低或特异性不好的问题,采用上述工作浓度的引物组具有较好的灵敏度和特异性。
可以理解的,上述工作浓度指引物序列在反应体系中的浓度,而对于该引物组在制备、保存和运输中的浓度,可根据具体要求调整,仅需确保在反应体系中保持上述浓度,即可达到较好的检测效果。
本发明还公开了上述的用于肺炎支原体的crispr检测引物组在开发和/或制备具有肺炎支原体感染诊断和/或预后评估用途的产品中的应用。
可以理解的,上述产品可以是试剂盒,也可以是一体化检测设备等。
本发明还公开了一种用于检测肺炎支原体的试剂盒,包括上述的用于肺炎支原体的crispr检测引物组。
在其中一个实施例中,该试剂盒还包括cas蛋白,信号报告探针和rna聚合酶。所述cas蛋白可来源于cas12a,如lbcas12a、ascas12a和fncas12a等,也可来源于cas13a,如lshcas13a、lbucas13a和lwcas13a等,但需根据不同来源蛋白调整其锚定序列和其它试剂成分。
信号报告探针又称信号报告试剂,其特点为在序列的5’标记荧光报告基团,3’标记淬灭基团。信号报告试剂的阳性信号有多种选择,包括荧光、吸光值、显色反应等,但信号报告的条件都是基于cas蛋白的酶活性。具体信号报告探针的选择可根据其它试剂进行调整选择。
本发明还公开了一种非诊断治疗目的肺炎支原体检测方法,包括以下步骤:
样本提取:取待测样本,提取其中dna;
rpa扩增:以上述的扩增引物,通过rpa方法扩增上述提取得到的待测样本dna,得扩增产物;
crispr反应检测:取上述扩增产物,加入信号报告探针、cas13a蛋白、rna聚合酶和上述的crrna,进行crispr反应检测,读取检测信号,即得。
上述检测步骤均在恒温条件完成,无需复杂的温度改变,从而摆脱了对q-pcr仪等精密仪器的依赖,具有较为广阔的应用前景。
在其中一个实施例中,所述cas13a蛋白为lwcas13a蛋白。
在其中一个实施例中,所述rna聚合酶为t7rna聚合酶。
与现有技术相比,本发明具有以下有益效果:
本发明的一种用于肺炎支原体的crispr检测引物组,采用该引物组以crispr技术检测肺炎支原体,缩短了肺炎支原体的检测时间,可在60min内完成检测。并且,本发明通过筛选得到了特定的序列组合作为引物组进行检测,同时对检测条件进行了筛选,通过该引物组合条件检测肺炎支原体,具有灵敏性高、特异性强的优势,其检测限可达30copies,且在特异性实验中仅有肺炎支原体dna能够被特异性检出,符合临床检测要求。
并且采用该引物组对肺炎支原体进行crispr检测,无需复杂的温度改变,从而摆脱了对qpcr仪等复杂变温扩增仪器的依赖,使得crispr-cas技术在肺炎支原体的即时诊断方面具有广阔的应用前景。
附图说明
图1为实施例2中引物的筛选结果图;
图2为实施例2中crrna的筛选结果图;
图3为实施例3中检测限结果图;
图4为实施例4中不同浓度引物对灵敏度结果图;
图5为实施例4中不同浓度crrna灵敏度结果图;
图6为实施例5中特异性实验结果图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
以下实施例所用原料,除特别说明外,均为市售购得。
实施例1
肺炎支原体crispr检测引物序列的设计。
1、靶标序列选定。
发明人在前期研究基础上,经过多番筛选和比对,肺炎支原体基因组中特异且无高频snp位点的p1基因序列区域作为肺炎支原体的检测目标序列。seqidno.1序列如下:
5’-tgatctcgccaacgctcccattaagcggagcgaggagtcgggtcagtccgtccaactcaaggcggacgattttggtactgccctttccagttcgggatcaggcggcaactccaatcccggttcccccaccccctgaaggccgtggcttgcgactgagcaaattcacaaggacctccccaaatgatccgcctcgatcctgattctgtacgatgcgccttatgcgcgcaaccgtaccgccattgaccgcgttgatcacttggatcccaaggccatgaccgcgaactatccgcccagttgaagaacgcccaagtgaaaccaccacggtttgtgggactg-3’(seqidno.1)。
以下实施例中的标准待检样本为插入了上述肺炎支原体p1基因序列的质粒(艾基生物技术有限公司合成)。
2、扩增引物对和crrna的设计。
针对上述保守序列,设计多条crrna和相应的扩增引物对进行对比,下表列出部分示例性引物序列,其中rpa扩增引物序列带有相应的t7启动子。
表1.基于cas13a的crrna和扩增引物对
实施例2
1、rpa扩增引物的扩增效率筛选。
为了筛选cas13a的rpa扩增引物,以上述实施例1中插入了上述肺炎支原体p1基因序列的质粒作为标准待检样本,按照常规方法提取得到标准待检样本dna组(即肺炎支原体基因组dna),筛选引物包括上述引物对1、引物对2、引物对3、引物对4、引物对5,其中模板浓度为1000copies/μl。
1.1方法。
通过rpa对靶序列进行扩增,同时以depc处理、不含杂质rna、dna和蛋白质的水为阴性参照,选用常规试剂,按照以下操作进行:
1)rpa扩增
rpa反应体系为50μl:其中包括rpa上游引物0.5-2.5μl(浓度10μm),rpa下游引物0.5-2.5μl(浓度10μm),rpa酶预混液41.5μl,醋酸镁0.5-2μl(浓度280mm),待测样本基因组dna5μl。
上述rpa酶预混液中含有:磷酸肌酸(浓度20-80mm)、肌酸激酶(浓度50-150mm)、dntps(浓度100-300μm)、atp(浓度20-80mm)、dtt(浓度1-10mm)、醋酸钾(浓度50-200mm)、重组酶uxsx(50-300ng/μl)、uxsy(10-100ng/μl)、单链结合蛋白(200-1000ng/μl)、bsu聚合酶(10-100ng/μl)。
反应条件:恒温37℃反应10-30min。
2)t7转录和crispr反应体系
反应体系:上述rpa扩增产物(25μl),lwcas13a蛋白1μl(浓度1-5μm),crrna-1为1μl(浓度1-5μm),t7rnapolymerasemix0.2-2μl,ntpmix1-10μl,信号报告探针1μl(浓度1-10μm)。
反应条件:37℃反应10-30min,每1min读取fam荧光值。
本实施例中阳性信号为荧光信号(选用来自生工生物工程(上海)股份有限公司的rnasealert),rna探针的序列特点为:fam-uuuuuuuuuuuuuu-bhq1。即在反应体系中加入一条两端分别连接荧光物质和淬灭剂的rna,当cas13a蛋白在crrna的帮助下,识别具有靶向序列的靶向rna后,被激活的cas13a酶可以降解该带有信号的rna,从而释放荧光信号,实现检测。
1.2结果
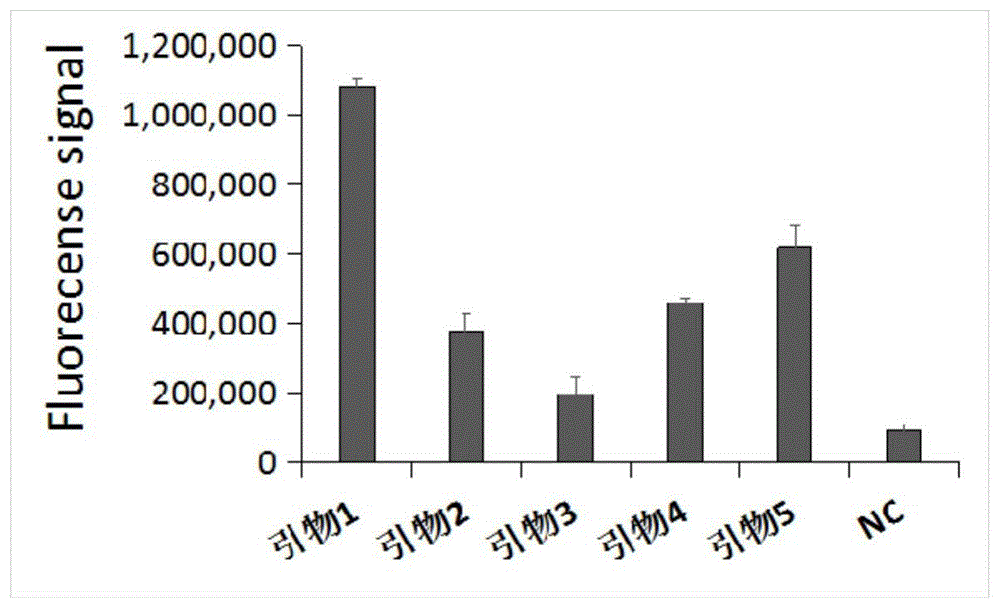
使用abi7500荧光检测仪,对上表1中引物对1-5所示的引物对组合进行了检测筛选,最终选出一组扩增效率好的引物对1,筛选结果如图1所示,图中纵坐标为荧光信号强度。
结果表示,采用引物对1具有最佳的扩增效率。
2、crrna优化
2.1方法
本实验中从靶标序列内设计多条crrna进行优化、筛选。根据上述肺炎支原体的保守序列设计了包括表1所列多条特异性crrna。并以最佳引物对1配合rpa筛选最佳crrna。以两步法进行rpa扩增和crispr反应检测,具体如下:
按照常规方法提取得到标准待检样本dna组,通过rpa对靶序列进行扩增,同时以depc处理、不含杂质rna、dna和蛋白质的水为阴性参照,选用常规试剂,按照以下操作进行:
1)rpa扩增体系:
rpa反应体系为50μl:其中包括rpa上游引物0.5-2.5μl(浓度10μm),rpa下游引物0.5-2.5μl(浓度10μm),rpa酶预混液41.5μl,醋酸镁0.5-2μl(浓度280mm),待测样本基因组dna5μl。
上述rpa酶预混液中含有:磷酸肌酸(浓度20-80mm)、肌酸激酶(浓度50-150mm)、dntps(浓度100-300μm)、atp(浓度20-80mm)、dtt(浓度1-10mm)、醋酸钾(浓度50-200mm)、重组酶uxsx(50-300ng/μl)、uxsy(10-100ng/μl)、单链结合蛋白(200-1000ng/μl)、bsu聚合酶(10-100ng/μl)。
反应条件:恒温37℃反应10-30min。
2)t7转录和crispr反应体系:
反应体系:上述rpa扩增产物(25μl),lwcas13a蛋白1μl(浓度1-5μm),crrna1μl(浓度1-5μm),t7rnapolymerasemix0.2-2μl,ntpmix1-10μl,信号报告探针1μl(浓度1-10μm)。
反应条件:37℃反应10-30min,每1min读取fam荧光值。
2.2结果
使用abi7500荧光检测仪,对上表1中crrna进行检测筛选,结果如图2所示,图中纵坐标为荧光信号强度,显示最佳crrna为crrna-1。
本实施例中,以插入了上述肺炎支原体p1基因序列的质粒dna为模板对不同引物及crrna进行了检测筛选,最终选出一组扩增效率高,特异性强的引物与crrna组合,用于肺炎支原体的检测,序列分别为:seqidno:12所示的crrna-1、seqidno:2和seqidno:3所示的rpa扩增引物对1。
实施例3
本实施例基于rpa扩增、t7体外转录和cas13a进行灵敏度检测。
以插入了上述肺炎支原体p1基因序列的质粒dna为模板,并计算稀释为3000copies/μl、300copies/μl、30copies/μl、3copies/μl、0copy/μl共5个梯度作为灵敏度检测的模板。
1、方法。
参照上述实施例2中的方法,进行rpa扩增后,再进行t7转录和crispr反应。
2、结果。
使用abi7500荧光检测仪,对扩增产物进行荧光检测。其中,结果如图3所示,表示采用crrna-1的检测限为30copies。
实施例4
本实施例对引物组的使用浓度进行考察。
1、rpa引物浓度考察
rpa引物终浓度选用上游引物和下游引物对,配制浓度分别为0.1μm,0.2μm,0.3μm,0.4μm,0.5μm,0.6μm,配合crrna浓度50nm,以插入了上述肺炎支原体p1基因序列的质粒dna为模板,并计算稀释为3000copies/μl、300copies/μl、30copies/μl、3copies/μl、0copy/μl共5个梯度作为灵敏度检测的模板。
1.1方法。
参照上述实施例2中的方法,进行rpa扩增后,再进行t7转录和crispr反应。
1.2结果。
使用abi7500荧光检测仪,对扩增产物进行荧光检测。其中,结果如图4所示,表示rpa引物终浓度在0.4μm时,检测灵敏度达30copies,其余引物浓度的检测灵敏度都在300copies或以上。
2、crrna浓度考察
crrna终浓度选用20nm、30nm、40nm、50nm、60nm,配合上述最优的引物浓度0.4μm,以插入了上述肺炎支原体p1基因序列的质粒dna为模板,并计算稀释为3000copies/μl、300copies/μl、30copies/μl、3copies/μl、0copy/μl共5个梯度作为灵敏度检测的模板。
2.1方法。
参照上述实施例2中的方法,进行rpa扩增后,再进行t7转录和crispr反应。
2.2结果。
使用abi7500荧光检测仪,对扩增产物进行荧光检测。其中,结果如图5所示,表示crrna终浓度在40nm时,检测灵敏度达30copies,其余crrna浓度的检测灵敏度都在300copies或以上。
实施例5
本实施例基于rpa扩增、t7体外转录联合cas13a,检测肺炎支原体的特异性验证。
以肺炎支原体dna、肺炎链球菌dna、百日咳博德特氏杆菌dna、化脓性链球菌dna、霍氏博德特氏杆菌dna、耶氏肺孢子虫dna、大肠杆菌dna、结核分枝杆菌dna、金黄色葡萄球菌dna、b-族链球菌dna、酵母dna、黄曲霉dna作为检测模板各样本稀释至104copies/μl,以无核酸酶水代替模板dna作为阴性质控,测试该检测的特异性。
1、方法。
模板dna的准备:
肺炎支原体dna、肺炎链球菌dna、百日咳博德特氏杆菌dna、化脓性链球菌dna、霍氏博德特氏杆菌dna、耶氏肺孢子虫dna、大肠杆菌dna、结核分枝杆菌dna、金黄色葡萄球菌dna、b-族链球菌dna、酵母dna、黄曲霉dna均是通过各自核酸提取试剂盒提取,并通过nanodropone/onec微量核酸浓度测定仪来测定,并分别计算并稀释为104copies/μl。
rpa扩增体系:
参照上述实施例2中的方法,进行rpa扩增后,再进行t7转录和crispr反应。
2、结果
使用abi7500荧光检测仪,对扩增产物进行荧光检测。实验结果如图6显示,只有肺炎支原体dna能够被特异性检出,其它样本没有明显信号。
表明本实施例基于rpa扩增、t7体外转录联合cas13a检测肺炎支原体具有较好的特异性。
实施例6
一、一种用于检测肺炎支原体的试剂盒,包括:
(1)rpa扩增体系:
rpa扩增引物对1:
正向:5’-taatacgactcactataggggacgattttggtactgccctttccagttc-3’(seqidno:2),浓度为10μm;
反向:5’-ataaggcgcatcgtacagaatcaggatcgag-3’(seqidno:3),浓度为10μm;
rpa酶预混液:磷酸肌酸(浓度20-80mm)、肌酸激酶(浓度50-150mm)、dntps(浓度100-300μm)、atp(浓度20-80mm)、dtt(浓度1-10mm)、醋酸钾(浓度50-200mm)、重组酶uxsx(50-300ng/μl)、uxsy(10-100ng/μl)、单链结合蛋白(200-1000ng/μl)、bsu聚合酶(10-100ng/μl);
醋酸镁:浓度280mm。
(2)crispr反应体系:
crrna-1:5’-ggggauuuagacuaccccaaaaacgaaggggacuaaaacuccuugugaauuugcucagucgcaagcc-3’(seqidno:12),浓度为1-5μm;
lwcas13a蛋白:浓度为1-5μm;
t7rnapolymerasemix:(neb,highyieldrnasynthesiskit);
ntpmix1-10μl:(neb,highyieldrnasynthesiskit)
信号报告探针:5’-6-fam-uuuuuuuuuuuuuu-bhq1-3’,浓度为1-10μm。
二、采用上述试剂盒进行肺炎支原体的检测方法
(1)检测样本的dna提取
检测样本可以是肺炎支原体,也可以是临床样本(主要包括组织样本、痰液、脑脊液、胸腹水、尿液、脓液、血液样本等)或是其它科研实验样本。
(2)通过rpa技术对病原体核酸进行扩增
以上述rpa扩增进行扩展,扩增程序为:恒温37℃反应15-30min。
(3)t7转录和crispr反应
以上述crispr反应体系进行反应,反应条件为:37℃反应10-30min,每1min读取fam荧光值。
(4)结果分析:
上述检测过程中,由于在反应体系中加入两端分别连接荧光物质和淬灭剂的信号报告探针,当cas13a蛋白在crrna的帮助下,识别具有靶向序列的靶向rna后,被激活的cas13a酶可以降解该带有信号的rna,从而释放荧光信号,实现检测。
使用abi7500荧光检测仪,得到的累积荧光值作为信号强度,按照以下标准进行分析判定:
阴性判断标准:荧光量小于或等于阴性对照荧光量的2倍。
阳性判断标准:荧光量大于阴性对照荧光量的2倍。
其中,阴性对照组为每个实验组对应设置的以加入同时以depc处理水(生工生物工程(上海)股份有限公司)的阴性信号组。
实施例7
以上述实施例6的试剂盒进行临床样品的检测,其中rpa扩增引物终浓度为0.4μm,crrna终浓度为40nm。
以上述实施例6中的试剂盒及一步法检测60例临床疑似肺炎支原体感染的临床样本,样本提取核酸后分别进行本检测方法检测及一代测序检测。
其中一代测序方法为双脱氧链终止法(sanger),测序目标序列仍然选择肺炎支原体p1基因序列。
选用的引物对为:
mpsequencingf:ccattaagcggagcgaggagtc(seqidno.15)
mpsequencingr:ccaggtgaggttgccaatgttg(seqidno.16)
按照常规方法进行测序。
结果如下表所示。
表2不同方法对临床样品检测结果
注:a表示qpcr验证结果为阳性,与本案方法检测结果一致;b表示qpcr验证结果为阴性,与本案方法检测结果一致。
上述结果显示,有2例样本本案方法检测结果为阴性,一代测序结果为阳性,经qpcr复核,此2例样本检测结果为阴性,与本案方法检测结果一致。另外有4例样本本案检测结果为阳性,一代测序结果为阴性,经qpcr复核,其中2例检测结果为阳性,与本案方法检测结果一致,另外2例检测结果为阴性。经分析,这是由于两种方法在方法学上的差异导致的不一致,本案方案同时rpa扩增技术和cas技术进行两级信号放大,检测灵敏度或优于pcr技术。
上述结果说明本发明检测方法与一代测序具有较高的检测效果一致性。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110>广州微远基因科技有限公司
<120>用于肺炎支原体的crispr检测引物组及其用途
<160>16
<170>siposequencelisting1.0
<210>1
<211>336
<212>dna
<213>肺炎支原体(mycoplasmapneumonia)
<400>1
tgatctcgccaacgctcccattaagcggagcgaggagtcgggtcagtccgtccaactcaa60
ggcggacgattttggtactgccctttccagttcgggatcaggcggcaactccaatcccgg120
ttcccccaccccctgaaggccgtggcttgcgactgagcaaattcacaaggacctccccaa180
atgatccgcctcgatcctgattctgtacgatgcgccttatgcgcgcaaccgtaccgccat240
tgaccgcgttgatcacttggatcccaaggccatgaccgcgaactatccgcccagttgaag300
aacgcccaagtgaaaccaccacggtttgtgggactg336
<210>2
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>2
taatacgactcactataggggacgattttggtactgccctttccagttc49
<210>3
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>3
ataaggcgcatcgtacagaatcaggatcgag31
<210>4
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>4
taatacgactcactatagggtgatctcgccaacgctcccattaagcgga49
<210>5
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>5
cataaggcgcatcgtacagaatcaggatcgag32
<210>6
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>6
taatacgactcactatagggattttggtactgccctttccagttcgggat50
<210>7
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>7
cgcataaggcgcatcgtacagaatcaggatcg32
<210>8
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>8
taatacgactcactataggggtccaactcaaggcggacgattttggtac49
<210>9
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>9
cgcataaggcgcatcgtacagaatcaggatcg32
<210>10
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>10
taatacgactcactatagggtgatctcgccaacgctcccattaagcgga49
<210>11
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>11
actaaggcgcatcgtacagaatcaggatcgag32
<210>12
<211>67
<212>dna/rna
<213>人工序列(artificialsequence)
<400>12
ggggauuuagacuaccccaaaaacgaaggggacuaaaacuccuugugaauuugcucaguc60
gcaagcc67
<210>13
<211>67
<212>dna/rna
<213>人工序列(artificialsequence)
<400>13
ggggauuuagacuaccccaaaaacgaaggggacuaaaacccuucagggggugggggaacc60
gggauug67
<210>14
<211>67
<212>dna/rna
<213>人工序列(artificialsequence)
<400>14
ggggauuuagacuaccccaaaaacgaaggggacuaaaacauuuggggagguccuugugaa60
uuugcuc67
<210>15
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>15
ccattaagcggagcgaggagtc22
<210>16
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>16
ccaggtgaggttgccaatgttg22
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺