一株乳酸胁迫抗性提高的大肠杆菌的制作方法
本发明涉及一株乳酸胁迫抗性提高的大肠杆菌,属于微生物工程技术领域。
背景技术:
大肠杆菌是原核生物中一种重要的宿主菌。这类细菌在自然界分布极为广泛,具有丰富的物种多样性。它们不仅是研究生化、遗传、分子生物学和基因工程的理想材料,在理论上具有重要的学术价值,而且在工业、农牧业、食品和医药等与人类生活密切相关的重要领域应用价值也极高。
目前,已有多种高价值的有机酸生物发酵方法成功应用,其中也有人尝试以大肠杆菌为宿主来表达,但是常常存在酸胁迫的问题。
乳酸的学名为α-羟基丙酸,分子式为c2h5ocooh,是一种天然存在的有机酸。d-乳酸主要应用于聚乳酸材料的加工制造以及手性药物和农药中间体的合成。高光学纯度d-乳酸(97%以上)作为一个手性中心是多种手性物质的前体,是重要的手性中间体与有机合成原料,广泛应用于制药、高效低毒农药及除草剂、化妆品等领域的手性合成。同时其最主要应用于生物塑料聚乳酸的原料。在大肠杆菌中,d-乳酸通过丙酮酸代谢途径产生,野生型大肠杆菌菌株就具有固有的乳酸生成途径,可通过乳酸脱氢酶(ldha)将丙酮酸转化为乳酸,不需要额外引入异源ldha来产生乳酸。但是大肠杆菌本身存在对有机酸耐受性不高的限制发展因素,大肠杆菌适应生长环境为中性,可乳酸生产环境的ph值适宜在ph5.5以上,但约50g·l-1的有机酸即会使环境ph降低至ph2.0左右,这对大肠杆菌的生长是一种考验。
对于酸胁迫,为维持大肠杆菌发酵生产目的蛋白的稳定性并提高生产效率,过去,工业上常常通过在大肠杆菌发酵的过程中添加外源中和剂来维持ph处于稳定的范围,例如,通过添加碱性物质(碳酸钙)来控制发酵环境的ph值。然而,碱性物质的添加往往会导致副产物的积累,而副产物中形成的盐类会再次导致细胞处于高渗的环境,从而造成渗透压胁迫的产生,再次影响菌体的生长与代谢。
目前,提高大肠杆菌的乳酸、乙酸等酸胁迫抗性的方法则主要有:(1)诱变育种,该方法具有简便、类型繁多等特点,但工作量大、效率低是其主要缺点,且诱变后的菌种容易退化;(2)代谢工程策略,目前利用代谢工程策略提高大肠杆菌环境胁迫的方法主要包括构建新的代谢途径、拓展已有代谢途径和削弱已有代谢途径,但是,此方法存在成本高、成功率低的问题。
因此,急需找到一种新的效果优异、遗传稳定性好、成本低、成功率高、操作简单的可提高大肠杆菌酸胁迫性的方法。
技术实现要素:
本发明的第一个目的是提供一株大肠杆菌(escherichiacoli),已于2019年9月2日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2019676,保藏地址为中国武汉,武汉大学。
本发明的第二个目的是提供含有上述大肠杆菌的微生物制剂。
在本发明的一种实施方式中,所述微生物制剂中含有活菌数≥106cfu/g的大肠杆菌干菌体。
在本发明的一种实施方式中,所述微生物制剂中含有活菌数≥106cfu/ml的大肠杆菌湿菌体。
本发明的第三个目的是提供一种增强大肠杆菌酸胁迫抗性的方法,是以上述大肠杆菌为宿主。
在本发明的一种实施方式中,所述酸胁迫是乳酸胁迫。
本发明的第四个目的是提供上述大肠杆菌在食品领域中的应用。
本发明的第五个目的是提供上述大肠杆菌在制药领域中的应用。
本发明的第六个目的是提供上述大肠杆菌在化妆品领域中的应用。
本发明的第七个目的是提供上述大肠杆菌在生产生物塑料领域中的应用。
有益效果:
本发明提供了一株d-乳酸胁迫抗性提高的大肠杆菌及其筛选方法。本发明成功筛选到了一株可广泛应用于制备食品、药品、饲料以及化学品的大肠杆菌,筛选得到的菌株escherichiacolidla3胁迫4h后,存活率较出发菌株提高了249.0倍。
附图说明
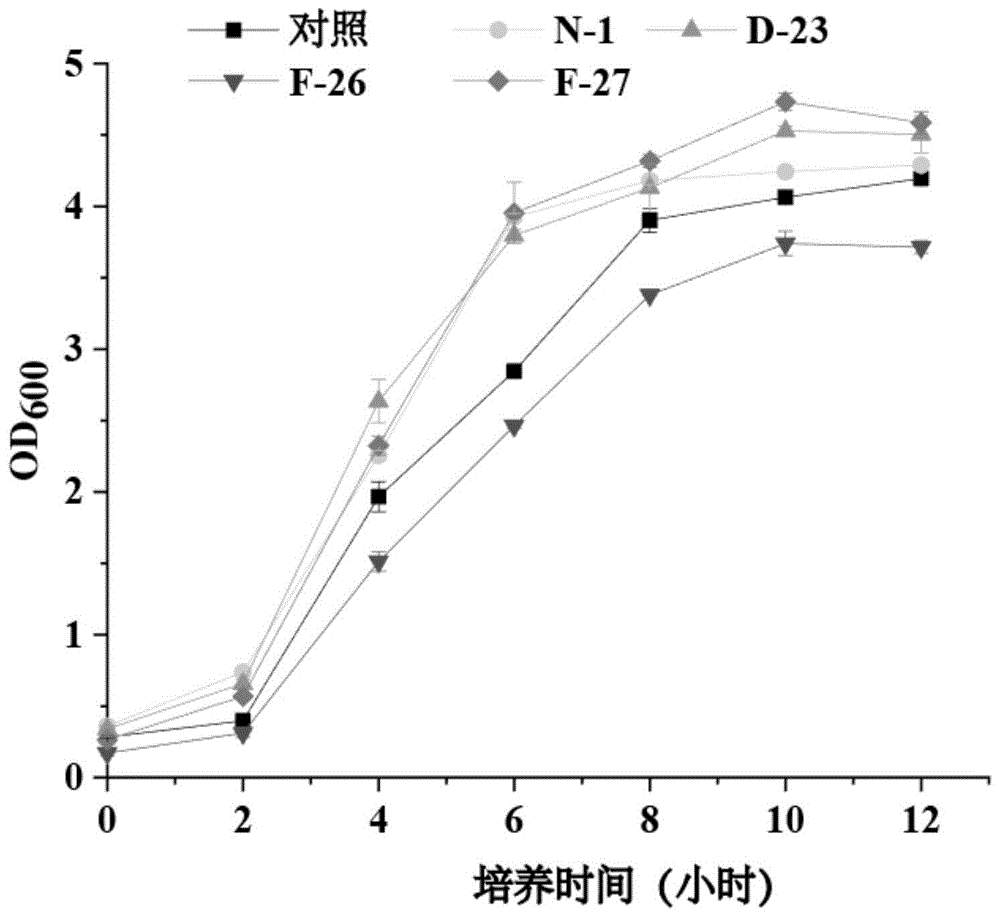
图1:驯化菌株和对照菌株在正常生长条件下的生长曲线图。
图2:驯化菌株和对照菌株在初始胁迫条件3.4g/ld-乳酸条件下的生长曲线图。
图3:驯化菌株和对照菌株在胁迫条件4.2g/ld-乳酸条件下的生长曲线图。
图4:驯化菌株和对照菌株在5.6g/ld-乳酸胁迫条件下的胞内atp浓度的测定。
图5:驯化菌株和对照菌株在5.6g/ld-乳酸胁迫耐受性试验的存活率图。
生物材料保藏
一株大肠杆菌(escherichiacoli),分类命名为escherichiacolidla3,已于2019年9月2日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2019676,保藏地址为中国武汉,武汉大学。
具体实施方式
下述实施例中涉及的培养基如下:
lb平板:蛋白胨(英国oxoid公司)1%(m/v)、酵母粉(oxoid)0.5%(m/v)、氯化钠1%(m/v)及2%(m/v)琼脂条。
lb液体培养基:蛋白胨(英国oxoid公司)1%(m/v)、酵母粉(oxoid)0.5%(m/v)、氯化钠1%(m/v)。
5×m9盐溶液:七水合磷酸氢二钠6.4%(m/v)、磷酸二氢钾1.5%(m/v)、氯化钠0.25%(m/v)及氯化铵0.5%(m/v)。
m9液体培养基:1m的硫酸镁溶液0.2%(v/v)、1m的氯化钙溶液0.01%(v/v)、50%的葡萄糖0.8%(v/v)及5×m9盐溶液20%(v/v),用0.3m的氯化钠溶液定容至1000ml。
实施例1:耐受较高乳酸浓度大肠杆菌的适应性进化
以菌株e.colik12mg1655为出发菌株,同时做四个平行样,在m9培养基中37℃培养5小时至菌体生长对数中期;以4%(v/v)的接种比例将培养5h后的菌株转接至含3.4g/ld-乳酸的m9培养基中,放在37℃摇床中转速220rpm培养至od为0.9-1.1,观察并记录到达该od值的生长时间;再次以4%(v/v)的接种比例将培养至od为0.9-1.1的菌株转接至同样乳酸浓度的m9培养基中,依次继续转接,直到在该d-乳酸浓度下的生长速率与在正常无乳酸的m9培养基条件下一致或相差不多,再转至下一浓度,以此类推至含d-乳酸浓度3.6g/l、3.8g/l、3.9g/l、4.0g/l、4.1g/l和4.2g/l培养基逐级转接。将最终筛选得到的菌株分别在lb平板上涂布分离单菌落,并将单菌落挑选至已添加含4.2g/l乳酸的m9培养基的96孔板中,并放入孔板摇床中37℃培养12-18h,选出生长速率最快的单菌落,分别标记为e.colin-1、e.colid-23、e.colif-26及e.colif-27。
实施例2:驯化菌株和出发菌株在正常条件下的生长情况
具体步骤如下:
(1)将菌株e.colik12mg1655(对照)和实施例1得到的菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27分别接种于lb液体培养基中进行活化,放在37℃摇床中220rpm培养过夜;
(2)分别以2%(v/v)的接种量将上述(1)中得到的种子液转接至lb液体培养基中,放在37℃摇床中220rpm培养;
(3)在(2)的培养过程中,每隔2小时取样,测定600nm波长下的od值,绘制生长曲线(绘制得到的生长曲线如图1)。
结果如图1所示,经生长性能试验分析,培养12h后,较对照菌株(od600=4.19)而言,e.colin-1生长速率增长42.2%,最终od值增长2.2%;e.colid-23生长速率增长30.9%,最终od增长7.3%,e.colif-26生长速率下降4.2%,最终od下降11.4%;e.colif-27生长速率增长49.2%,最终od增长9.3%。
实施例3:驯化菌株和出发菌株在初始胁迫条件3.4g/ld-乳酸条件下的生长情况
具体步骤如下:
(1)将菌株e.colik12mg1655(对照)和实施例1得到的菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27分别接种于m9液体培养基中进行活化,放在37℃摇床中220rpm培养过夜;
(2)分别以2%(v/v)的接种量将上述(1)中得到的种子液转接至含3.4g/ld-乳酸的m9液体培养基中,放在37℃摇床中220rpm培养;
(3)在(2)的培养过程中,每隔2小时取样,测定600nm波长下的od值,绘制生长曲线(绘制得到的生长曲线如图2)。
结果如图2所示,经生长性能试验分析,培养16h后,较对照菌株(od600=0.94),e.colin-1、e.colid-23、e.colif-26及e.colif-27可生长至od值1.2-1.4之间,较对照菌株高了0.4-0.6。
实施例4:驯化菌株和出发菌株在最终胁迫条件4.2g/ld-乳酸条件下的生长情况
具体步骤如下:
(1)将菌株e.colik12mg1655(对照)和实施例1得到的菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27分别接种于m9液体培养基中进行活化,放在37℃摇床中220rpm培养过夜;
(2)分别以2%(v/v)的接种量将上述(1)中得到的种子液转接至含4.2g/ld-乳酸的m9液体培养基中,放在37℃摇床中220rpm培养;
(3)在(2)的培养过程中,每隔2小时取样,测定600nm波长下的od值,绘制生长曲线(绘制得到的生长曲线如图3)。
结果如图3所示,经生长性能试验分析,较对照而言,对照菌株在该培养条件下已不生长,e.colin-1、e.colid-23、e.colif-26及e.colif-27可生长至od0.8-1.3之间。
实施例5:驯化菌株在5.6g/ld-乳酸胁迫耐受性试验
具体步骤如下:
(1)将菌株e.colik12mg1655(对照)和实施例1得到的菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27分别接种于m9液体培养基中进行活化,放在37℃摇床中220rpm培养过夜;
(2)分别以2%(v/v)的接种量将上述(1)中得到的种子液转接至新鲜的m9液体培养基中,37℃摇床中220rpm培养;
(3)收集(2)中培养至对数生长中期的菌体,离心(6000×g)5min,经0.85%的pbs缓冲液洗涤两次后重悬于等体积的新鲜的含5.6g/ld-乳酸的m9液体培养基中,胁迫不同时间。胁迫后的菌悬液洗涤两次后重悬于等体积的生理盐水中,取10μl重悬液,稀释不同梯度点种于lb平板上测定活菌数和存活率。
结果如图4和表1所示,经耐受性实验分析,胁迫4h后,菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27存活率为对照的53.3、249.0、1.75、4.63倍,驯化菌株对酸胁迫的耐受性提高。以效果最好的驯化株e.colid-23进行菌株保藏,保藏编号为大肠杆菌cctccno:m2019676。
表1驯化菌株和对照菌株在5.6g/l乳酸胁迫耐受性试验的存活率
实施例6:驯化菌株在5.6g/ld-乳酸胁迫条件下的胞内atp浓度的测定
具体步骤如下:
取对数生长中期的细胞按照实施例5步骤(3)的方法(5.6g/ld-乳酸)胁迫不同的时间取样,迅速转移到液氮中阻止代谢(5min),取出后离心(10000×g,4℃)10min并收集菌体。胞内atp含量的测定使用碧云天的atp测定试剂盒进行测定。atp含量表示为nmol/mg胞内蛋白。
经胞内atp浓度的分析,由于多数酸胁迫过程需要消耗能量,如h+-atpase可通过消耗胞内的atp将质子泵出胞外,从而维持胞内ph的动态平衡。因此实验进一步研究了过表达abc转运蛋白对胞内atp水平的影响。
如图5所示,驯化株在初始状态的atp值均高于对照菌株,随着胁迫时间的延长,除菌株e.colif-26外,其余3株驯化株可以保持比对照菌株更高的胞内atp浓度,如胁迫3h后,菌株e.colin-1、e.colid-23、e.colif-26及e.colif-27的atp浓度为对照的2.12、1.69、0.22、1.33倍,以维持细胞的生理活性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!