猪5-氨基酮戊酸合成酶1基因作为猪产仔数性状的遗传标记及其应用的制作方法
本发明涉及一种猪5-氨基酮戊酸合成酶1基因作为猪产仔数性状的遗传标记及其应用。
背景技术:
猪的繁殖性能是衡量其生产力的重要标准,从遗传和综合经济效益的高度出发产仔数是繁殖性状中最重要的性状。但是产仔数性状的低遗传力以及限性表达,使得采用常规技术对该性状的遗传改良几乎不可能。随着标记辅助选择的应用与主基因的鉴定和候选基因的筛选工作的研究结果发现,利用基因选种能加倍提高遗传力低的性状、限性性状的遗传改良速度,迄今为止,对猪控制产仔数性状的候选基因有一些报道,但其遗传效应还不明确,能真正应用于育种生产的分子标记更是屈指可数。
5-氨基酮戊酸合成酶1基因的英文为5-aminolevulinatesynthase1,英文缩写为alas1,以下简称为alas1基因。
alas1基因,它属于α-氧基胺合成酶家族。有研究发现,在alas1基因的5’侧翼序列存在两个camp应答元件(cre)识别序列,camp调节信号转导通路在卵巢卵泡发育和黄体化过程中起到主要作用,并可诱导alas1基因的表达。随着研究的深入,du等还发现在alas1基因5’侧翼区存在雌激素受体(er)结合位点,有个-853c>t突变位点位于er结合位点中,将带有-853c>t突变位点的重组er结合位点的质粒与雌激素受体亚型(erα)共转染于hepg2细胞,分析发现erα可以提高alas1基因的转录活性。还有研究者们发现,alas1基因还在卵巢中参与调节与排卵过程有关的线粒体细胞色素p450及类固醇代谢及类固醇激素的产生。此外,lawrence等(2002)在小鼠卵巢中注射hcg(0h-39h)后发现,在注射1h-2h后都可达到显著性表达。随后,在注射人绒毛膜促性腺激素(hcg)12h后即卵巢卵泡开始破裂时,alas1基因的表达量迅速下降到未注射hcg时的表达水平。而通过原位杂交的方法分析该结果时,发现在注射hcg后的黄体期还可检测到alas1基因的表达。从以上的结果可以看出,alas1基因在早期排卵过程中在卵泡组织中上调表达,并且可能参与卵泡黄体化过程。
目前,由于猪的alas1基因5’侧翼区遗传多态性尚无研究报道,本发明发现了猪alas1基因5’侧翼区snp位点,分析了其与猪产仔数性状的关系,找到了与猪产仔数相关的分子标记,并建立了快速检测方法。
技术实现要素:
本发明要解决的技术问题是提供一种与猪产仔数性状相关的遗传标记。
本发明要解决的另外一个技术问题是提供一种用于检测上述遗传标记的引物对。
本发明还要解决的一个技术问题是提供一种与猪产仔数性状相关的遗传标记的检测方法。
本发明另外要解决的技术问题是提供一种与猪产仔数性状相关的遗传标记的应用。
对于遗传标记,本发明采用的技术方案是,一种与猪产仔数性状相关的遗传标记,该遗传标记的核苷酸序列如seqidno.1所示,具体序列为:
5'-gcatccacccactggtccccgagcrtgaagggccctttcagatctgaaaaccaacagaaagaaaatttaggaagccacaaataagcggcttataataaataacatggttcctagtcagattcattaaccactgcaccacaacaggaactccgtgctgtacctttaaagtgcttctccattcaggacaagagaccaacccttccttctttcttgacactttcttcctttagcttaaggagtactcctctctggttttcctggtgctccttttcaggctcctttgctagctcctcctcccctgctaagctgctaaattgtgcctctaggcttgggccttggcttttttatcttctctgaatgatctcatccagacacatggctcttatcaccatctattaactgaagagctcccaaatttatatctctgattttgacctctcccc-3';
上述序列中26位碱基处的r是t或c,该突变导致猪5-氨基酮戊酸合成酶1基因5’侧翼区多态性。
对于遗传标记的引物对,本发明采用的技术方案是,引物对如seqidno.2和seqidno.3所示,具体序列为:
正向引物f:5'-ggtgatgtgagaggtgtc-3';
反向引物r:5'-ctaaaggaagaaagtgtc-3'。
对于遗传标记的检测方法,本发明采用的技术方案是,包括以下步骤:
(1)设计新的扩增引物,引物序列如seqidno.2和seqidno.3所示,具体序列为:
正向引物f:5'-ggtgatgtgagaggtgtc-3';
反向引物r:5'-ctaaaggaagaaagtgtc-3';
(2)用上述引物对猪基因组dna进行pcr扩增;
其中:
pcr反应体系为25μl,其中pcr2*taqmix12.5μl,10mmol/μl的引物各0.5μl,dna模板1μl(dna约100ng),加ddh2o至25μl;
pcr反应条件为第1步95℃变性5min;第2步95℃变性30s;第3步54.7℃复性30s;第4步72℃延伸30s;重复第2至第4步35个循环,之后再72℃延伸10min,最后降温至4℃保存;
(3)pcr扩增产物用浓度为1.5%的琼脂糖凝胶电泳,核酸染料染色,凝胶成像系统中观察,可见到片段大小为330bp的清晰条带;
(4)pcr产物用saci内切酶酶切,反应体系为:10×buffer1μl,saci酶0.20μl(20u/μl),加pcr产物至10μl;37℃反应8-12h;然后,酶切产物在2%琼脂糖凝胶中电泳,核酸染料染色,凝胶成像系统中观察:
当多态位点为cc基因型时,pcr产物经saci消化后产生2个片段即202bp+128bp,记为等位基因c;
当多态位点为tt基因型时,pcr产物经saci消化后产生1个片段即330bp,记作等位基因t。
对于遗传标记的应用,本发明采用的技术方案是,遗传标记在选留高繁殖力种母猪方面的应用。
作为优选,上述遗传标记在猪群体中表现为cc型或tc型母猪具有较高的产仔数,c等位基因为优势等位基因,通过在选育过程中提高c等位基因频率能够增加群体的产仔数。
本发明还包括上述遗传标记的引物对在选留高繁殖力种母猪方面的应用。
本发明的有益效果是:
1、首次发现了猪alas1基因5’侧翼序列的突变位点,且该分子标记不受猪个体的年龄、猪种等限制;
2、首次发现猪alas1基因5’侧翼序列的多态性与猪产仔数存在着显著或者极显著相关;
3、首次建立了猪alas1基因5’侧翼序列的突变位点的检测方法,且该检测方法操作简便、快速、准确,可用于对高繁殖力的种母猪的选留,甚至在猪刚出生时就可准确地进行选留,而常规育种方法要经过大量的生产性能测定和后裔测定,并且要继代选育5个世代以上才能达到需要的效果,大大缩短了世代间隔,加快选择进程,从而节约了生产成本,提高了生产效益。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明。
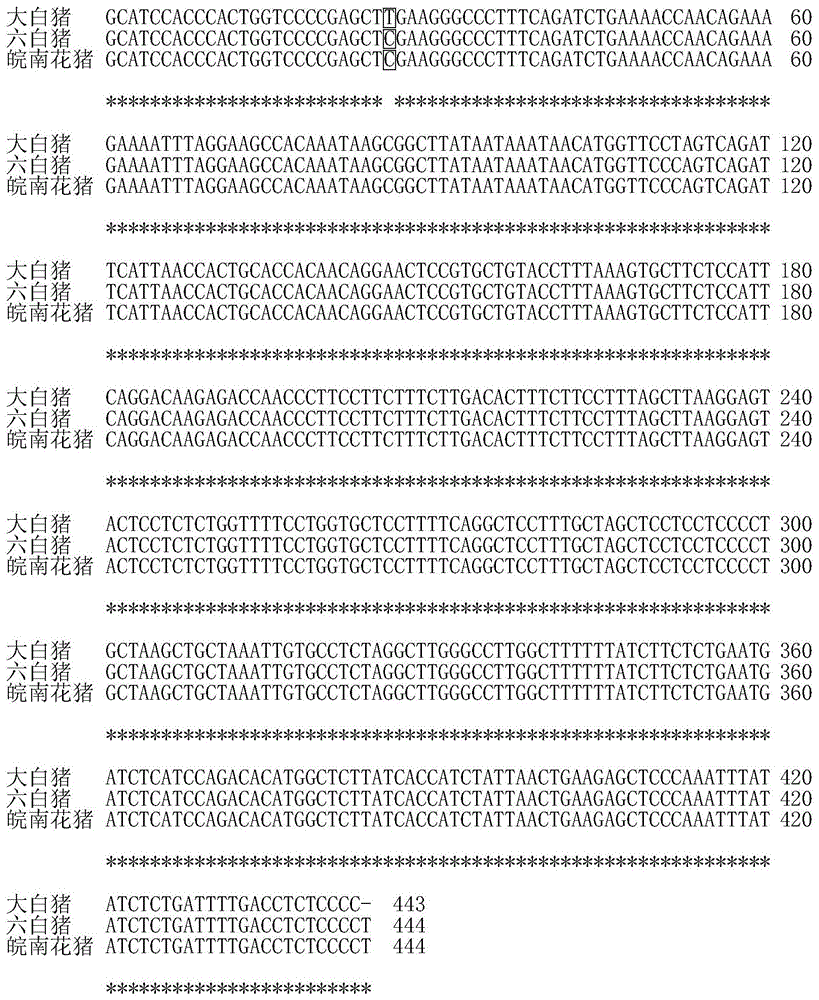
图1是本发明实施例大白猪与六白猪、皖南花猪alas1基因5’侧翼区序列比对。
图2是本发明实施例的猪alas1基因saci酶切分型结果。
具体实施方式
为了实现alas1基因5’侧翼区突变体(snp)的检测,本实施例发现了猪alas1基因5’侧翼区snp位点,分析了其与猪产仔数性状的关系,找到了与猪产仔数相关的分子标记,建立了快速检测方法。
1、采集耳组织样及基因组dna提取
采集地方猪种(皖南黑猪、皖南花猪、六白猪、淮猪)和引进猪种(长白猪、大白猪、杜洛克猪)及淮猪新品系ⅱ的耳组织并提取其dna,然后放入-20℃冰箱保存待用。
2、猪alas1基因5'侧翼序列片段的获得
采用clontech公司的universalgenomewalkertm2.0基因组步移试剂盒构建了四个基因组步移库。
根据猪alas1基因第一外显子序列,设计两条特异的pcr引物,分别为gp1和gp2。以构建的四个相应的基因组步移库为模板,gp1和ap1(adaptorprimer1,试剂盒提供)配对进行第一轮pcr反应。稀释第一轮pcr反应产物50倍作为第二轮pcr反应的模板,引物gp2与ap2(nestedadaptorprimer2,试剂盒提供)组合进行巢式pcr扩增。扩增结果电泳检测,第一轮pcr反应产物没有明显的条带;第二轮pcr产物中,经pvuii消化后的基因组为模板扩增出约883bp的片段,切下目的条带,克隆测序;根据第一次步移得到的alas1基因的部分启动子序列,设计了一对嵌套特异引物gp3、gp4及gp5、gp6对alas1基因分别进行第二次、第三次步移。其中第二次步移是用引物gp3与ap1组合进行第一轮pcr,gp4和ap2组合进行第二轮pcr扩增。在第二轮产物中,经stui消化后的基因组为模板扩增出约811bp的片段,;第三次步移是用引物gp5与ap1组合进行第一轮pcr,gp6和ap2组合进行第二轮pcr扩增。在第二轮产物中,经stui消化后的基因组为模板扩增出约906bp的片段,切下目的条带,克隆测序。将三次基因组步移所得到的序列拼接起来,得到猪alas1基因部分启动子序列1859bbp。
将所获得的猪alas1基因序列1859bbp提交http://genes.mit.edu/genscan.html网站在线预测猪alas1基因的转录起始位点。预测结果显示,猪alas1基因转录起始位点位于1724bp处。
利用软件primerpremier5.0对alas1基因第一外显子及所获得的5'侧翼序列设计如seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8和seqidno.9所示的引物,上述各引物的具体序列如下:
gp1:5’-tcatcttagggcagttttgggcatag-3’
gp2:5’-cctgaggcactcgggataagaatggg-3’
gp3:5’-cagataagacaccttggcacagaccc-3’
gp4:5’-acactgtcattcatccaagcagagag-3’
gp5:5’-gggttaggggagaggtcaaaatcaga-3’
gp6:5’-attcagagaagataaaaaagccaagg-3’
用上述引物分别进行三次步移(gp1、gp2;gp3、gp4;gp5、gp6),每次步移要进行两轮pcr扩增,其中第一轮pcr扩增以1ul四个步移库中进行,第二轮pcr扩增以第一轮pcr扩增产物稀释50倍后各取1μl进行pcr扩增。第一轮pcr反应体系为25μl,其中10×advantage2pcrbuffer2.5μl,dntp(10mmeach)0.5μl,ap1(10μm)0.5μl,adwantage2polymerasemix(50×)0.5μl,四个步移库1μl,gp1/gp3/gp50.5μl,加ddh2o至25μl。pcr反应条件为第1步94℃25s,第2步72℃3min重复第1步至第2步7个循环,第3步94℃25s,第4步67℃3min,重复第3步至第4步32个循环,之后再67℃延伸7min,最后降温至4℃保存;第二轮pcr反应体系为25μl,其中10×advantage2pcrbuffer2.5μl,dntp(10mmeach)0.5μl,ap1(10μm)0.5μl,adwantage2polymerasemix(50×)0.5μl,稀释50倍后产物各取1μl,gp2/gp4/gp60.5μl,加ddh2o至25μl。pcr反应条件为第1步94℃25s,第2步72℃3min重复第1步至第2步5个循环,第3步94℃25s,第4步67℃3min,重复第3步至第4步20个循环,之后再67℃延伸7min,最后降温至4℃保存。
3、猪alas1基因多态位点的筛选
选择中国地方猪品种“皖南花猪”和“六白猪”和引进猪品种“大白猪”为试验材料,利用所获得的alas1基因的5’侧翼序列,设计如seqidno.10和seqidno.11所示的引物,上述引物的具体序列如下:
正向引物f:5'-aggactggttctgtatgt-3'
反向引物r:5'-aggggagaggtcaaaatc-3'
用上述引物在皖南花猪、六白猪、大白猪基因组dna进行pcr扩增,pcr反应体系为25μl,其中pcr2*taqmix12.5μl,10mmol/μl的引物各0.5μl,dna模板1μl(dna约100ng),加ddh2o至25μl。pcr反应条件为第1步95℃变性5min;第2步95℃变性30s;第3步62.5℃复性30s;第4步72℃延伸40s;重复第2至第4步35个循环,之后再72℃延伸10min,最后降温至4℃保存。
对上述3个猪种的pcr产物,每个猪种分别选3个,各取8μlpcr产物,混池成一个样本。将pcr产物编号,配上相应的引物(每对引物20μl),送生工生物工程(上海)股份有限公司测序。上述扩增片段486bp,序列经dnaman软件进行序列比对,其中位于该片段26位碱基处(即位于猪alas1基因全序列的5’侧翼-1132bp处)有t/c碱基突变(见图1),该突变引起saci酶切位点gagct^c的变化。
4、猪alas1基因5’侧翼区多态性pcr-rflp检测方法建立
为了快速方便的检测猪alas1基因5’侧翼区多态性,针对发现的多态位点设计新的扩增引物,引物序列如seqidno.2和seqidno.3所示,具体序列如下:
正向引物f:5'-ggtgatgtgagaggtgtc-3'
反向引物r:5'-ctaaaggaagaaagtgtc-3'
用该引物对皖南黑猪、皖南花猪、六白猪、淮猪、长白猪、大白猪、杜洛克猪及淮猪新品系ⅱ猪等基因组dna进行pcr扩增,pcr反应体系为25μl,其中pcr2*taqmix12.5μl,10mmol/μl的引物各0.5μl,dna模板1μl(dna约100ng),加ddh2o至25μl。pcr反应条件为第1步95℃变性5min;第2步95℃变性30s;第3步54.7℃复性30s;第4步72℃延伸30s;重复第2至第4步35个循环,之后再72℃延伸10min,最后降温至4℃保存。
pcr扩增产物用浓度为1.5%的琼脂糖凝胶电泳,核酸染料染色,凝胶成像系统中观察,可见到片段大小为330bp的清晰条带。该pcr产物用saci内切酶酶切,反应体系为:10×buffer1μl,saci酶0.20μl(20u/μl),加pcr产物至10μl。37℃反应8-12h。然后,酶切产物在2%琼脂糖凝胶中电泳,核酸染料染色,凝胶成像系统中观察(见图2)。多态位点为cc基因型时,pcr产物经saci消化后产生2个片段(202bp+128bp),记为等位基因c;当多态位点为tt基因型时,pcr产物经saci消化后产生1个片段(330bp),记作等位基因t。由此建立了该snp位点多态性检测的pcr-rflp技术。
5、本发明筛选的遗传标记在不同猪群中的多态性检测
采用上述中建立的pcr-rflp技术,对皖南黑猪、皖南花猪、六白猪、淮猪、长白猪、大白猪、杜洛克猪及淮猪新品系ⅱ猪群体检测猪alas1基因5’上游-1132bp的pcr-saci-rflp多态性分布频率,检测结果如表1所示。
表1alas1基因pcr-saci-rflp基因型频率和等位基因频率分布
由表1可见,alas1基因saci酶切位点在所检测的8个猪群中,皖南黑猪、皖南花猪、六白猪和淮猪群中c等位基因占优势,在长白猪、大白猪、杜洛克猪和淮猪新品系ⅱ猪群中t等位基因占优势,并且进行卡方检验,表现为哈代-温伯格平衡。由此看出,该snp位点中,地方猪种皖南黑猪、皖南花猪、六白猪和淮猪与引进猪品种长白猪、大白猪、杜洛克猪及淮猪新品系ⅱ猪群中基因型和等位基因频率差异明显。
6、在不同猪群中进行alas1基因多态性与猪产仔数性状的关联分析
应用基因效应统计分析模型1,采用sas统计软件的glm程序在与淮猪、长白猪、大白猪及淮猪新品系ⅱ群体中进行猪alas1基因pcr-saci-rflp多态位点与繁殖性状的关联分析。统计结果显示,在4个群体中,所有胎次产仔数都呈现cc>tc>tt的趋势。其中,在淮猪和大白猪群体中,cc型个体与tc型个体的所有胎次产仔数分别都显著高于tt型个体(p<0.05);在长白猪群体中,cc型个体所有胎次产仔数显著高于tt型个体(p<0.05),tc型个体的所有胎次产仔数极显著高于tt型个体(p<0.01);在淮猪新品系ⅱ猪群体中,tc型个体所有胎次产仔数显著高于tt型个体(p<0.05),cc型个体的所有胎次产仔数极显著高于tt型个体(p<0.01)(表2)。在四个猪群体中都表现为cc型和tc型母猪具有较高的产仔数,c等位基因为优势等位基因。说明选育过程中提高c等位基因频率可以增加群体的产仔数。
表2alas1基因pcr-saci-rflp基因型与淮猪、长白猪、大白猪和淮猪新品系ⅱ部分繁殖性状的统计分析表
注:以上数值为最小二乘均值±标准误;同行上标为不同小写字母表示差异显著(p<0.05),为不同大写字母表示差异极显著(p<0.01)
以上所述的本发明实施方式,并不构成对本发明保护范围的限定。任何在本发明的精神和原则之内所作的修改、等同替换和改进等,均应包含在本发明的权利要求保护范围之内。
序列表
<110>安徽省农业科学院畜牧兽医研究所
<120>猪5-氨基酮戊酸合成酶1基因作为猪产仔数性状的遗传标记及其应用
<160>11
<170>siposequencelisting1.0
<210>1
<211>443
<212>dna
<213>猪(susscrofa)
<400>1
gcatccacccactggtccccgagcrtgaagggccctttcagatctgaaaaccaacagaaa60
gaaaatttaggaagccacaaataagcggcttataataaataacatggttcctagtcagat120
tcattaaccactgcaccacaacaggaactccgtgctgtacctttaaagtgcttctccatt180
caggacaagagaccaacccttccttctttcttgacactttcttcctttagcttaaggagt240
actcctctctggttttcctggtgctccttttcaggctcctttgctagctcctcctcccct300
gctaagctgctaaattgtgcctctaggcttgggccttggcttttttatcttctctgaatg360
atctcatccagacacatggctcttatcaccatctattaactgaagagctcccaaatttat420
atctctgattttgacctctcccc443
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggtgatgtgagaggtgtc18
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctaaaggaagaaagtgtc18
<210>4
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>4
tcatcttagggcagttttgggcatag26
<210>5
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>5
cctgaggcactcgggataagaatggg26
<210>6
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>6
cagataagacaccttggcacagaccc26
<210>7
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>7
acactgtcattcatccaagcagagag26
<210>8
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>8
gggttaggggagaggtcaaaatcaga26
<210>9
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>9
attcagagaagataaaaaagccaagg26
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
aggactggttctgtatgt18
<210>11
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>11
aggggagaggtcaaaatc18
- 还没有人留言评论。精彩留言会获得点赞!