一种新型的动物快动眼睡眠行为障碍模型的制备方法
本发明涉及医学和生物技术领域。具体而言,本发明涉及基于胱天蛋白酶3介导的脑桥被盖背外侧下核神经元高度选择性凋亡的动物快动眼睡眠行为障碍模型的制备方法。
背景技术:
20世纪50年代法国科学家micheljouvet在世界上首次发现了一种前所未知的睡眠状态,因其与清醒时极类似的脑电频率和眼球快速移动的特点而被命名为异相睡眠(paradoxicalsleep)或快动眼睡眠(rapideyemovementsleep,rem)[1]。在此后的机械毁损实验中发现破坏脑桥被盖特定区域可诱导实验动物rem睡眠期出现极类似于梦境演绎样行为(dream-enactmentbehavior)[2]。由此,micheljouvet做出推测:完整的脑桥被盖(intactpontinetegmentum)是rem睡眠发生和其间肌张力松弛状态维持的前提条件[2]。基于jouvet的推断,为在动物上模拟出类似的rem睡眠期梦境演绎行为和阐明该行为发生的病理生理学基础,此后经过数代睡眠科学家的不懈努力,人们对于该“脑桥被盖rem睡眠调节区”的认识不断加深,历经吻侧脑桥网状核(nucleusreticularispontisoralis,rpo)[3]、脑桥抑制区(pontineinhibitoryarea,pia)[4]、ɑ外周核(peri-ɑnucleus,peri-ɑ)[5,6]等不同的称谓最终将该目标核团定位于脑桥被盖背外侧下区并命名为:脑桥被盖背外侧下核(sld)[7,8]。在此基础上,研究人员通过进一步深入研究确定了该核团的神经元类型为谷氨酸能神经元[9]并且证实其与延髓腹侧正中部位的腹侧巨细胞网状核(giv)存在上下游纤维联结支配关系[10]。然而,在对“脑桥被盖背外侧下核(sld)”漫长的探索过程中,研究人员先后采用了机械破坏、电凝毁损[2-4]及神经毒素诱导清除[11]的方法;但是,这种单纯清除毁损的方法仅能说明破坏的“因”导致了行为的“果”,并不能阐明其内在的行为发生与病生机制的关系,也会引入诸多伴随而来的混杂因素,因而在现实应用中存在较大的局限性。
随着脑桥被盖背外侧下核(sld)概念的提出、该核团神经元类型及上下游纤维联结支配关系的阐明,人们对rbd行为的研究从最初的脑区水平逐步过度到对相关责任核团及相关功能性神经元的操控水平。在此基础上,有研究证实通过诱导rem睡眠调控关键核团中功能神经元的相关受体、转运体基因沉默或剪切[12-15]的方式可在小鼠上模拟出rbd样表型,从而为本发明方案中的精准化诱导神经元凋亡提供了实验证据支持。
然而,现有的rbd动物模型构建方法仍存在很大的缺陷:1.早期使用的机械毁损和神经毒素清除会不可避免地破坏周边的脑区和核团,引入很多不可预测的混杂因素;2.后来使用的针对rem睡眠调控环路上关键受体、转运体的基因沉默或基因剪切,虽可选择性地靶向操纵特定的神经元类型,但仍未能靶向那些特异性调控rem睡眠期肌张力松弛的神经元,由此必然波及周边毗邻的诸多睡眠-觉醒调控核团,因而仍然存在较大的局限性。
参考文献
1.jouvetm.paradoxicalsleep-astudyofitsnatureandmechanisms[m]//progressinbrainresearch.elsevier,1965,18:20-62.
2.rousselb,pujoljf,jouvetm.effetsdeslésionsdutegmentumpontiquesurlesétatsdesommeilchezlerat[j].arch.ital.biol.,1976,114:188-209.
3.carlig,zanchettia.astudyofpontinelesionssuppressingdeepsleepinthecat[j].archivesitaliennesdebiologie,1965.
4.hendricksjc,morrisonar,manngl.differentbehaviorsduringparadoxicalsleepwithoutatoniadependonpontinelesionsite[j].brainresearch,1982,239(1):81-105.
5.sakaik,luppiph,salvertd,etal.localizationofcholinergicneuronsinthecatlowerbrainstem[j].comptesrendusdel′academiedessciences.serieiii,sciencesdelavie,1986,303(8):317-324.
6.ledouxl,sastrejp,budac,etal.alterationsinc-fosexpressionafterdifferentexperimentalproceduresofsleepdeprivationinthecat[j].brainresearch,1996,735(1):108-118.
7.boissardr,gervasonid,schmidtmh,etal.theratponto-medullarynetworkresponsibleforparadoxicalsleeponsetandmaintenance:acombinedmicroinjectionandfunctionalneuroanatomicalstudy[j].europeanjournalofneuroscience,2002,16(10):1959-1973.
8.fortp,bassetticl,luppiph.alternatingvigilancestates:newinsightsregardingneuronalnetworksandmechanisms[j].europeanjournalofneuroscience,2009,29(9):1741-1753.
9.clémento,sapine,béroda,etal.evidencethatneuronsofthesublaterodorsaltegmentalnucleustriggeringparadoxical(rem)sleepareglutamatergic[j].sleep,2011,34(4):419-423.
10.luppiph,clémento,sapine,etal.theneuronalnetworkresponsibleforparadoxicalsleepanditsdysfunctionscausingnarcolepsyandrapideyemovement(rem)behaviordisorder[j].sleepmedicinereviews,2011,15(3):153-163.
11.luj,shermand,devorm,etal.aputativeflip–flopswitchforcontrolofremsleep[j].nature,2006,441(7093):589.
12.brookspl,peeverjh.impairedgabaandglycinetransmissiontriggerscardinalfeaturesofrapideyemovementsleepbehaviordisorderinmice[j].journalofneuroscience,2011,31(19):7111-7121.
13.krenzerm,anacletc,vetrivelanr,etal.brainstemandspinalcordcircuitryregulatingremsleepandmuscleatonia[j].plosone,2011,6(10):e24998.
14.valenciagarcias,libourelpa,lazarusm,etal.geneticinactivationofglutamateneuronsintheratsublaterodorsaltegmentalnucleusrecapitulatesremsleepbehaviourdisorder[j].brain,2016,140(2):414-428.
15.valenciagarcias,brischouxf,clémento,etal.ventromedialmedullainhibitoryneuroninactivationinducesremsleepwithoutatoniaandremsleepbehaviordisorder[j].naturecommunications,2018,9.
技术实现要素:
为弥补现有rbd动物模型构建方案中的种种缺陷与不足,本发明意在设计一种高度选择性凋亡(例如,通过胱天蛋白酶3(caspase3))sld核团中与下游存在纤维联结支配关系且特异性调控rem睡眠期肌张力松弛的神经元从而诱导动物出现rbd样行为的模型构建方案。事实上,正是此类与下游存在纤维联结支配关系的神经元在rem睡眠期间的活动才使得外周骨骼肌保持张力松弛状态,避免出现梦境演绎行为。当此类神经元遭受病理损害致其功能障碍或丢失时,生物体将表现出rbd样的梦境演绎行为。
在一些实施方案中,本发明涵盖下述各项所述的技术方案。
项目1.一种选择性凋亡非人受试对象的sld核团中与下游有纤维联结支配关系的神经元的方法,该方法包括:
1)向受试对象的giv核团立体定向注射逆向转运载体,所述逆向转运载体可从giv出发逆向转运到sld核团中并表达一种生色标记和cre重组酶,所述生色标记可标记出sld核团中与下游有纤维联结关系的神经元;
2)向所述经标记的sld核团定向注射cre依赖性表达可引起神经元凋亡因子的载体,从而选择性凋亡sld核团中与下游有纤维联结关系的神经元,其中所述giv核团位于sld下游。
项目2.项目1所述的方法,其中所述逆向转运载体包括病毒载体,例如腺相关病毒载体、慢病毒载体、腺病毒载体、逆转录病毒载体,例如腺相关病毒(aav)载体,例如重组腺相关病毒(raav)载体,例如aav2-retro,raav2-retro。
项目3.项目1-2任一项所述的方法,其中所述cre依赖性表达可引起神经元凋亡因子的载体是腺相关病毒载体、慢病毒载体、腺病毒载体、逆转录病毒载体,例如腺相关病毒(aav)载体。
项目4.项目1-3任一项所述的方法,其中所述生色标记酶标记,例如荧光素酶,荧光素,辣根过氧化物酶,碱性磷酸酶,β-半乳糖苷酶,葡糖淀粉酶,溶菌酶,糖类氧化酶,葡萄糖氧化酶,半乳糖氧化酶,和葡萄糖-6-磷酸脱氢酶,荧光标记,例如荧光蛋白,例如深蓝色荧光蛋白如sirius、蓝色荧光蛋白如ebfp、azurite、ebfp2、tagbfp、青色荧光蛋白如ecfp、cerulean、cypet、mturquoise、mtfp1(teal)、midoriishi-cyan、绿色荧光蛋白如gfp、ukg、egfp、emerald、superfolder、黄色荧光蛋白如yfp、sfyfp、eyfp、venus、citrine、ypet、phiyfp、橙色荧光蛋白如mhoneydew、mbanana、mko、mkoκ、morange、morange2、红色荧光蛋白如tagrfp、tagrfp158t、mruby、mcherry、深红色荧光蛋白如katushka、mkate、mkate2、mplum、e2-crimson、mneptune、tag657、eqfp650、eqfp670、近红外荧光蛋白如mifp,细菌光敏色素蛋白如bphp、藻胆蛋白如藻红蛋白cpe、藻红蓝蛋白pec、藻蓝蛋白cpc、变藻蓝蛋白apc,生物素/抗生物素蛋白,离子指示剂。
项目5.项目1-4任一项所述的方法,其中引起神经元凋亡的因子包括神经毒素,干扰rna,fas受体,apaf-1,和胱天蛋白酶家族的酶,优选胱天蛋白酶3。
项目6.项目1-5任一项所述的方法,其中所述逆向转运载体是aav2/retro-cre-egfp,所述cre依赖性表达可引起神经元凋亡因子的载体是aav-dio-caspase3。
项目7.项目1-6任一项所述的方法,其中所述非人受试对象包括非人哺乳动物,例如非人灵长类动物,例如啮齿动物,例如猴、马、牛、犬、猫、小鼠、大鼠和猪。
项目8.一种用于选择性凋亡sld核团中与下游有纤维联结支配关系的神经元的试剂盒,其包含项目1-6中任一项定义的逆向转运载体和cre依赖性表达引起神经元凋亡的因子的载体。
项目9.项目8所述的试剂盒,其还包括:注射工具和/或试剂。
项目10.一种快动眼睡眠行为障碍(rbd)动物模型的制备方法,其包括提供项目1-6任一项的方法制备选择性凋亡非人动物的sld核团中与下游有纤维联结支配关系且特异性调控rem期肌张力松弛的神经元,从而制备出快动眼睡眠行为障碍动物模型。
项目11.项目1-6中任一项定义的逆向转运载体和cre依赖性表达引起神经元凋亡的因子的载体在制备选择性凋亡非人动物的sld核团中与下游有纤维联结支配关系且特异性调控rem期肌张力松弛的神经元或快动眼睡眠行为障碍动物模型中的应用。
在一些实施方案中,本发明提供本文描述的逆向转运载体和cre依赖性表达引起神经元凋亡因子的载体在制备动物模型和/或用于选择性凋亡sld核团中与下游有纤维联结支配关系的神经元的试剂盒中的用途。
在一些实施方案中,所述试剂盒包括容器和在容器上或与容器一起的标签或包装说明书。在一些实施方案中,适合的容器包括,例如,瓶子、小瓶、注射器等。所述容器可以由各种材料如玻璃或塑料制成。容器装有组合物,所述组合物是单独地或与可有效用于选择性凋亡sld核团中与下游有纤维联结支配关系的神经元的另一种试剂或组合物结合。组合物中至少一种试剂是本文的载体。此外,所述试剂盒可以包含:(a)其中包含组合物的第一容器,其中所述组合物包含逆向转运载体;和(b)其中包含组合物的第二容器,其中所述组合物包含cre依赖性表达引起神经元凋亡的因子的载体和(c)其它相关试剂。本发明的试剂盒还可以包括包装说明书,所述包装说明书指明所述组合物可以用于制备动物模型和/或选择性凋亡sld核团中与下游有纤维联结支配关系的神经元。所述试剂盒还可以包括第三或第四容器,所述第三或第四容器包含缓冲剂,如注射用水,磷酸盐缓冲盐水,葡萄糖溶液,还可以包括其他材料,如其他缓冲剂、稀释剂、滤器、针头和注射器。
附图说明
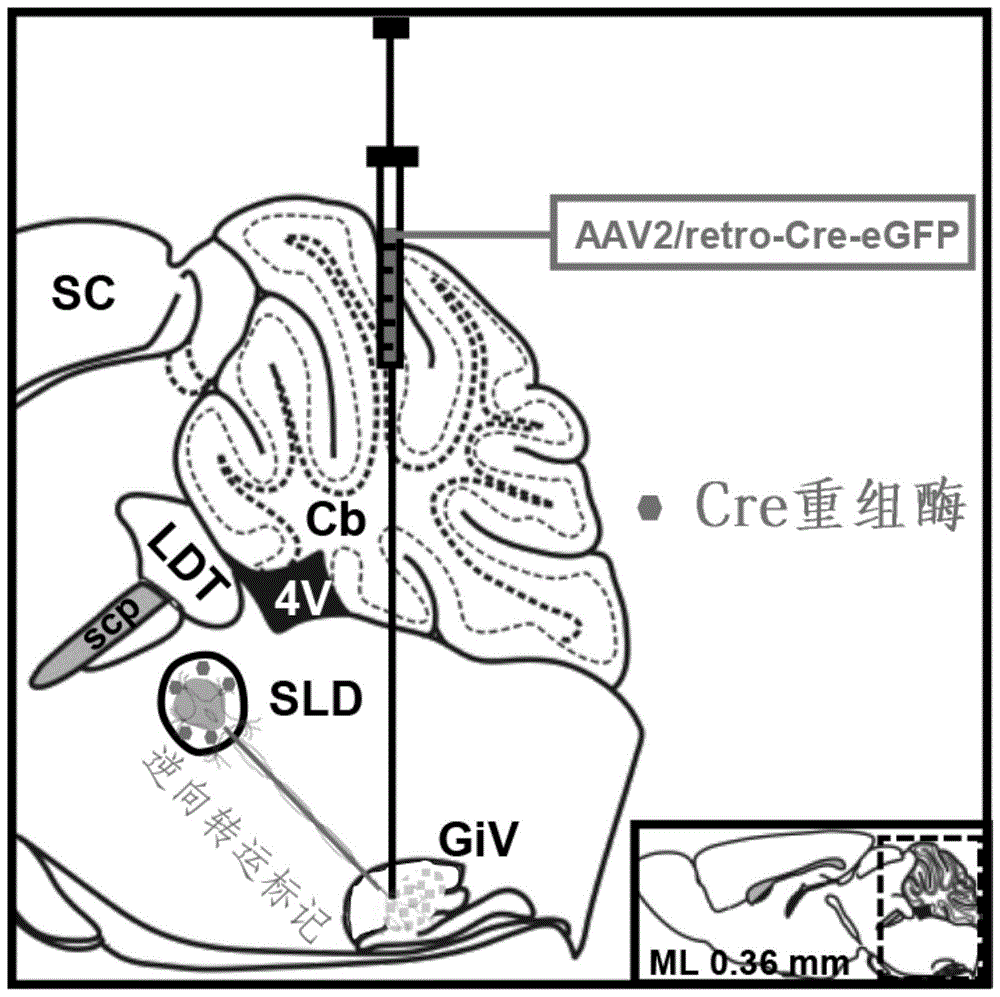
图1.giv核团注射逆向转运病毒载体逆标与之有纤维联结关系的sld核团神经元示意图(注:sc-下丘,ldt-脑桥被盖背外侧核,4v-第4脑室,cb-小脑,scp-小脑上脚,下同)。
图2.sld核团注射cre依赖性表达胱天蛋白酶3的腺病毒载体选择性凋亡与giv核团有纤维联结关系的神经元示意图。
图3.多导睡眠记录(psg)及sld核团组织病理学实验示意图(注:mov-三叉神经运动核)。
图4.双侧giv核团注射逆向转运腺病毒载体aav2/retro-cre-egfp病毒感染范围局限于双侧giv核团范围内,可见上游sld核团投射而来的gfp阳性轴突末梢。
图5.双侧sld核团注射cre依赖性表达胱天蛋白酶3的腺病毒载体aav-dio-caspase3。
图6.对照组和实验(胱天蛋白酶3)组小鼠睡眠时相及rem期脑电、肌电波形图对比。
图7.对照组和实验(胱天蛋白酶3)组小鼠睡眠结构参数及平均肌电强度对比。
图8.对照组和实验(胱天蛋白酶3)组小鼠脑桥被盖sld核团neun阳性神经元计数。
具体实施方式
以下对本发明的具体实施方式进行详细说明,所描述的各个具体实施方式不是限制性的,并且可以相互组合。
本发明的技术方案可分为四部分:1.从giv逆标与之有纤维联结关系的sld核团神经元;2.sld核团中逆标神经元的高度选择性凋亡;3.视频-多导睡眠记录及睡眠数据分析;4.rbd表型的组织病理学验证。具体分述如下:
1.从giv逆标与之有纤维联结关系的sld核团神经元
向sld下游核团giv立体定向注射可表达cre重组酶的腺病毒载体aav2-retro-cre-egfp,利用其逆向转运特性从而选择性标记与下游giv核团有纤维联结关系的sld核团神经元并使之表达cre重组酶(图1)。
2.高度选择性凋亡sld核团中cre阳性逆标神经元
向sld核团立体定向注射cre依赖性表达胱天蛋白酶3的腺病毒载体aav-dio-caspase3,借助于胱天蛋白酶3的促凋亡作用从而高度选择性清除sld核团中cre阳性逆标神经元(图2)。
3.视频-多导睡眠记录及睡眠数据分析
睡眠记录前1周埋置电极,恢复7天后开始视频-多导睡眠记录,持续记录7天后解除设备进行睡眠数据分析,结合同步记录视频观察小鼠在rem睡眠期的肌电及行为变化判读rbd行为(图3)。
4.rbd表型的组织病理学验证
睡眠记录结束后麻醉小鼠,灌流固定后取脑、包埋、切片,挑选脑桥被盖层面做neun组织化学染色,观察各层面sld区域神经元丢失情况并进行定量分析(图3)。
根据上述规划的技术方案,以下结合附图和具体的实施方案对本发明做进一步的说明:
实验1.从giv逆标与之有纤维联结关系的sld核团神经元
1.材料及主要试剂
c57bl/6j小鼠购自中国科学院实验动物资源平台;可表达cre重组酶的逆向转运病毒载体aav2/retro-cre-egfp购自上海泰儿图生物(货号:s0231)
2.实验方法
选取8-10周龄c57bl/6j小鼠(体重18-22g),随机分为两组,分别以1%戊巴比妥钠腹腔注射麻醉(80ml/kg)后头部备皮固定于立体定位注射仪(rwd,瑞沃德)上,调整前后囟高度一致后使用微量注射气泵(wpi,世界精密仪器)分别向双侧giv核团(坐标-ap:-6.72mm,ml:±0.25mm,dv:-5.60mm)缓慢泵入可表达cre重组酶的逆向转运病毒载体(aav2/retro-cre-egfp)70nl,注射完毕停针10min后缓慢退针,生物胶封闭颅骨钻孔、缝皮后送回恢复笼,注意术后保温促进苏醒。
3.实验结果
下位延髓(ap:-6.72mm)层面荧光切片可见双侧giv核团区域密集绿色荧光点,是为逆向转运荧光病毒感染的轴突截面(图4);脑桥被盖层面(ap:-5.20mm)sld核团区域可见点状绿色荧光聚集区,是为逆向荧光病毒标记的与下游giv核团存在纤维联结的sld核团神经元聚集部位,脑桥被盖sld核团内可见从下游giv核团逆标的gfp阳性神经元,aav-dio-caspase3病毒载体注射入双侧sld核团(图5)。
实验2.高度选择性凋亡sld核团中cre阳性逆标神经元
1.材料及主要试剂
c57bl/6j小鼠购自中国科学院实验动物资源平台;cre依赖性表达胱天蛋白酶3的腺病毒载体-aav-dio-caspase3及相应病毒稀释液购自上海泰儿图生物(货号:s0236)
2.实验方法
将实验1中已接受aav2/retro-cre-egfp逆转运病毒注射的实验组小鼠恢复10天后以1%戊巴比妥钠腹腔注射麻醉(80ml/kg)后头部备皮固定于立体定位注射仪(rwd,瑞沃德)上,调整前后囟高度一致后使用微量注射气泵(wpi,世界精密仪器)分别向双侧sld核团(坐标-ap:-5.20mm,ml:±0.75mm,dv:-4.10mm)缓慢泵入cre依赖性表达胱天蛋白酶3的腺病毒载体(aav-dio-caspase3)100nl,注射完毕停针10min后缓慢退针。对照组小鼠按照同样的流程注射相同体积的病毒稀释液。术后生物胶封闭颅骨钻孔、缝皮后送回恢复笼,注意术后保温促进苏醒。
3.实验结果
如图5所示,cre依赖性表达胱天蛋白酶3的腺病毒载体注射入脑桥被盖层面(ap:-5.20mm)gfp阳性的sld核团逆标神经元聚集区,诱导该区域神经元发生病理性凋亡(图5)。
实验3.视频-多导睡眠记录及睡眠数据分析
1.实验材料及仪器设备
骨科胶水、牙科水泥购自上海玉研仪器;排针、排线等电极制备原材料购自铭泰鑫电子;数据采集软件spike2购自英国ced公司;睡眠数据解析软件sleepsign购自日本kisseicomtec公司。
2.实验方法
(1)eeg/emg记录电极埋置
将实验2中已接受aav-dio-caspase3注射的实验组和对照组小鼠恢复7天后以1%戊巴比妥钠腹腔注射麻醉(80ml/kg)后固定于立体定向注射仪(瑞沃德生命科技)上,备皮、切开、分离后分别在右侧额叶(ap/ml:+1.50/-0.80mm)和顶叶皮层(ap/ml:+1.50/-1.00mm)钻孔后埋置eeg记录电极螺丝,深度以紧贴硬脑膜表面为宜,emg记录电极则插入颈下斜方肌,然后以牙科水泥固定电极于颅骨表面,缝皮后送回恢复笼,注意术后保温促进苏醒。
(2)视频-多导睡眠记录
睡眠记录电极埋置术后恢复7天,将实验组和对照组小鼠转移至记录笼连接睡眠记录设备适应3天后开始记录,睡眠记录时开启视频监测系统同步录像记录小鼠在睡眠-觉醒时段内的行为。
(2)睡眠数据及rbd行为分析
睡眠记录结束后导出数据,使用sleepsign软件解析小鼠在清醒(wake,w)、慢波睡眠(slowwavesleep,sws)及快动眼睡眠(rem,r)的状态的累积量、百分比、时相转换、脑电频谱分布及肌电强度变化情况并进行组间定量分析对比。对照同步记录视频,重点观察小鼠在rem睡眠期间的肌电强度变化、有无异常行为表现并对肌电进行量化分析。
3.实验结果
视频-多导睡眠记录分析提示:相比于对照组小鼠(图6,a),胱天蛋白酶3组小鼠rem期肌电活跃,基线增高,频发高幅肌电发放(图6,b);同步视频监测发现小鼠在此期表现出剧烈的弹跳、前冲动作,极类似于临床rbd病人表现出的梦境演绎行为。与对照组小鼠(a)相比,胱天蛋白酶3实验组小鼠(b)rem睡眠期出现肌电基线增高,簇状肌电发放(箭头示),伴rem期(r)频繁运动事件(m)。
对实验和对照组小鼠24小时内睡眠结构参数的分析显示:实验组小鼠rem睡眠片段数目增多(图7,a),平均rem睡眠片段持续时间缩短(图7,b),伴运动行为的rem睡眠片段百分比增多(图7,c),以上研究结果表明胱天蛋白酶3处理诱导出现的频发rbd样行为导致小鼠rem睡眠结构紊乱,呈现片段化趋势。
肌电定量分析显示:与对照组相比,胱天蛋白酶3处理组小鼠rem睡眠期平均肌电强度显著大于慢波睡眠期,差异具有统计学意义(图7,d),这也与同步视频监测观察到的实验组小鼠rem睡眠期出现的频繁肢体活动现象相一致。统计学方法:对照组vs胱天蛋白酶3组参数比较使用非配对t检验;emgswsvsemgrem参数比较使用配对t检验;*p<0.05;**p<0.01;***p<0.001;n.s.,无统计学差异。
实验4.rbd表型的组织病理学验证
1.材料及主要试剂
pbs缓冲液(1×)购自上海生工(货号:e607008);多聚甲醛粉剂购自sigma-aldrich(货号:158127);neun一抗购自abcam公司(货号:ab104224);生物素化马抗小鼠二抗购自vectorlaboratories公司(货号:ba-2000);dab组化显色试剂盒套装购自vectorlaboratories公司(货号:sk-4100/pk-6100)。
2.实验方法
(1)麻醉、灌流、固定、组织切片
视频-多导睡眠记录结束后,解除记录设备,充分麻醉后经心脏依次泵入4℃pbs缓冲液和4%多聚甲醛固定液(4℃预冷),取脑经蔗糖梯度脱水后oct胶包埋速冻,冰冻切片机(leica)连续切片。
(2)免疫组化染色
挑选脑桥被盖层面切片,经3%h2o2封闭内源性过氧化物酶后,neun一抗4℃孵育24h,对应生物素化二抗室温孵育2h后以dab法显色,待目标信号出现后入pbs及时终止反应。
(3)sld核团neun阳性神经元定量分析
从吻侧至尾侧等间距选取代表性脑桥被盖层面切片,定位脑桥被盖sld核团计数neun阳性神经元,分别计数实验及对照组小鼠sld核团内neun阳性神经元数目并进行统计分析。
3.实验结果
相较于对照组(图8a),胱天蛋白酶3组小鼠sld核团neun阳性神经元计数显著下降(图8b),差异具有统计学意义(图8c)。与对照组小鼠(a)相比,胱天蛋白酶3实验组小鼠(b)sld核团neun阳性神经元显著减少,差异具有统计学意义(c)。统计学方法:对照组vs胱天蛋白酶组参数比较使用非配对t检验;****p<0.0001。该发现可为上述胱天蛋白酶3组小鼠表现出的rbd样行为提供组织病理层面的佐证。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!