一种橘色双冠丽鱼黑色素细胞分离和培养方法与流程
本发明属于水产动物技术领域,特别涉及一种橘色双冠丽鱼黑色素细胞分离和培养方法。
背景技术:
动物色素细胞是动物体色形成研究的重要载体。因此,能否成功提取、分离和体外培养色素细胞是探究动物体色基因生物学功能的基础,也是了解鱼类体色形成和体色变异分子机理的前提。1982年eisinger等研究者使用0.25%胰酶消化处理人包皮后,再添加十四烷酰佛波醇乙酸酯(tpa)、霍乱毒素(ct),首次提取、分离和体外培养了人黑色素细胞。tamura通过人胚胎提取物和tpa成功从小鼠皮肤获得黑色素细胞。白瑞采用dispaseii酶和0.02%胰酶/edta两步消化处理提取和培养羊驼皮肤黑色素细胞。田颖刚以dmem为培养基,采用胰蛋白酶、胶原酶i和中性蛋白酶消化并进行细胞产量和贴壁情况评估,添加tpa、碱性成纤维细胞生长因子(bfgf)、胎牛血清(fbs)获得更具细胞产量和细胞活力的乌骨鸡皮肤黑色素细胞。鲍加荣以k-sfm为培养基,加入tpa、bfe和begf等培养液,获得了接近生理状态的狐黑色素细胞。现有技术中,研究学者成功从哺乳动物如人、小鼠、羊驼和狐等皮肤分离和培养黑色素细胞,但难以从鱼体体表中提取分离色素细胞,目前还未见确切的鱼类某种色素细胞的单独分离培养相关报道。
研究学者通常使用不同消化酶对鳞片组织进行消化处理,消化酶一般采用dispaseii酶、胶原酶i、中性蛋白酶和胰蛋白酶等处理,其中dispaseii酶相对来说对皮肤组织消化不太全面,多应用于研究哺乳动物眼睛黄色素细胞分离培养中;中性蛋白酶虽能选择性作用于纤维蛋白、黏连蛋白和iv型胶原,破环板桥里的结构,但对于桥粒结构作用却很少,因此也不能将表皮完全分散;胶原酶i能作用于结缔组织中的胶原蛋白,对细胞间质产生消化作用,且对细胞本身影响不大,能使细胞保持高活力;胰蛋白酶能水解细胞间质中的蛋白质,破环细胞间的半桥粒和桥粒结构,从而使细胞分散,但其对细胞本身有损伤。但是鱼类与哺乳动物的色素细胞不同,鱼类色素细胞难以分离。
根据现有需要,开发一种橘色双冠丽鱼黑色素细胞分离和培养方法成为亟需解决的问题。
技术实现要素:
本发明的首要目的在于提供一种橘色双冠丽鱼黑色素细胞的分离方法。
本发明第一个方面,提出了一种橘色双冠丽鱼黑色素细胞的分离方法。根据本发明的实施例,该构建方法为:将双冠丽鱼鱼尾鳍、皮肤、鳞片放入胰蛋白酶中进行消化,收集细胞,再放入胶原酶中进行消化,加入不同浓度percoll试剂,收集细胞进行原代培养和传代培养即可获得橘色双冠丽鱼黑色素细胞。发明人发现,只用胰蛋白酶消化鱼体表组织的时候,延长消化时间即过夜处理(超过6h),鱼体表组织依然消化不完全,表现为剪碎后转入25um气孔尼龙网过滤分裂组织,并且增加离心时间所获得细胞液体较清澈,镜检里面所含细胞少量;且通过percoll试剂低速离心分离后,镜检所得细胞亦少量;最后进行原代培养时,镜检色素细胞增殖、生长慢。为了取得进一步的效果,发明人进行了优化,惊奇地发现,通过用含有牛血蛋白、胶原酶i、dnasei、以及大豆胰蛋白酶抑制剂的胶原酶溶液进行二次消化,色素细胞得到密度增大了2-3倍、原代培养时增殖、成长速度快了1倍。解决了只用胰蛋白酶溶液处理而导致表皮细胞等去除不完全影响提取到的色素细胞的细胞高密度和活力的问题。
根据本发明的实施例,包括以下步骤:
1)组织消化:将双冠丽鱼鱼尾鳍、皮肤、鳞片放入胰蛋白酶消化,收集细胞,再加入胶原酶中消化,收集消化后的细胞;再依次加入55%percoll试剂、45%percoll试剂、35%percoll试剂,离心收集最上层细胞;
2)原代培养:将上步收集的细胞加入kc1细胞培养基制成细胞悬液,进行原代培养;
3)传代培养:当原代培养细胞铺满培养瓶底80~90%时,去培养液,胰蛋白酶消化,消化后去酶液,加入kc培养基纯化细胞,当细胞铺满培养瓶底80~90%时,加入mc2培养基将细胞重悬进行传代培养。
根据本发明的实施例,所述双冠丽鱼鱼尾鳍、皮肤、鳞片为剪碎的鱼尾鳍、皮肤、鳞片。
根据本发明的实施例,步骤1)所述胰蛋白酶消化温度为25℃~28℃,消化时间为6~8h。
根据本发明的实施例,步骤1)所述胶原酶溶液含有牛血蛋白、胶原酶i、dnasei、以及大豆胰蛋白酶抑制剂。
根据本发明的实施例,步骤1)所述胶原酶消化温度为25℃~28℃,消化时间为12~15h。
根据本发明的实施例,步骤1)依次加入的55%percoll试剂、45%percoll试剂、35%percoll试剂体积为2~3ml。
根据本发明的实施例,步骤2)kc1细胞培养基含有k-sfm培养基,10~11%胎牛血清,10~12ng/mltpa,20~22ng/mlbfgf,1~2%双抗。
根据本发明的实施例,步骤3)kc培养基含有k-sfm培养基,5~8%胎牛血清,10~12ng/mltpa。
根据本发明的实施例,步骤3)mc2培养基含有dmem培养基,20~22%胎牛血清,1~2ng/mltpa,20~22ng/mlbfgf,1~2%双抗。
本发明第二个方面,提出了橘色双冠丽鱼黑色素细胞系在培养鱼类色素细胞中的应用。根据本发明的实施例,所述橘色双冠丽鱼黑色素细胞系的构建方法为前面任一所述的方法;所述鱼类为橘色双冠丽鱼。
本发明的有益效果是:
(1)本发明针对橘色双冠丽鱼黑色素细胞,选用了胰蛋白酶和胶原酶i共同处理,用胰蛋白酶预消化鱼体表组织,去除表皮细胞,再用胶原酶i配制的胶原酶溶液进行二次处理,结合不同滴度浓度的percoll分层,获得活力较高的色素细胞。已经成功传代10代,细胞可以维持良好的生长状态,而且可冻存和复苏。
(2)通过透射电镜观察黑色素细胞,细胞内部的喋呤体和类胡萝卜素囊泡完整,细胞内部结构完整,色素细胞结构完整,就要有很好的生物学功能,为利用体外培养的黑色素细胞研究鱼类体色形成的分子机理,为鱼类体色分子育种提供技术支持和奠定理论基础。
附图说明
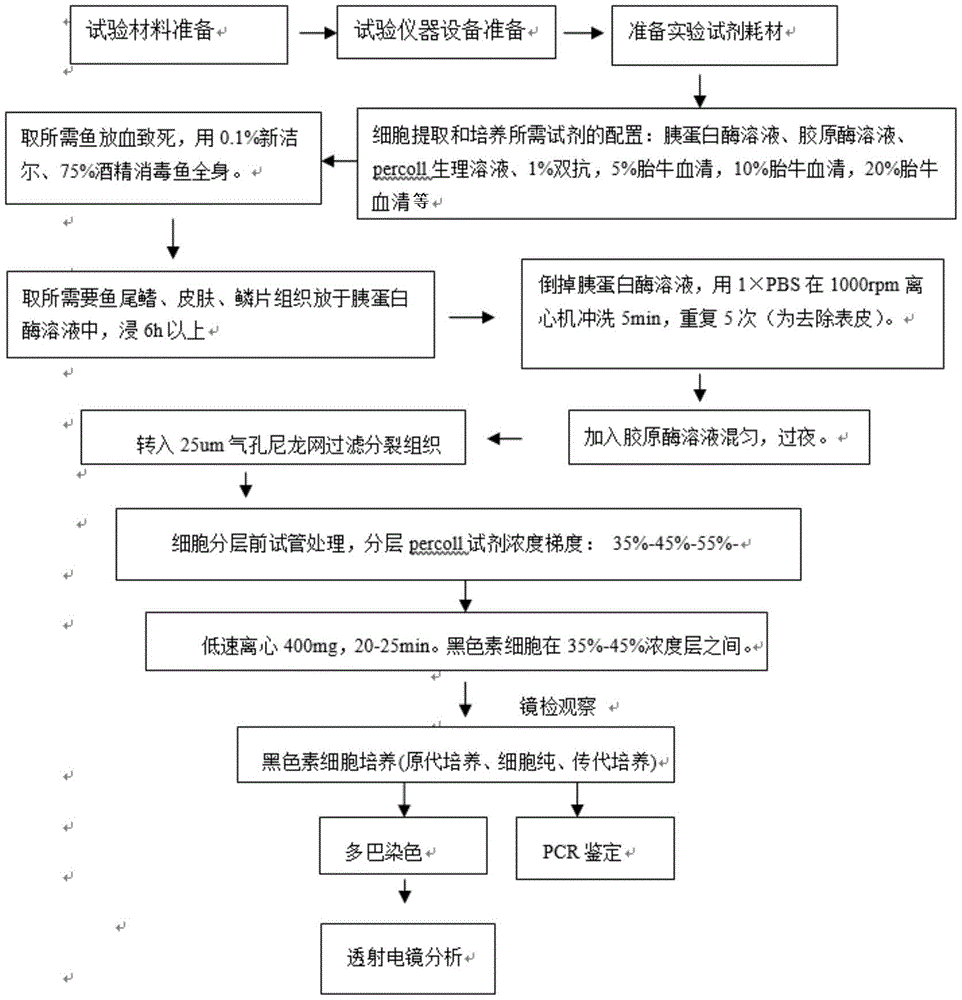
图1是本发明流程图;
图2是本发明实施例细胞培养液,其中a图为黑色素细胞提取混合液图,b图为黑色素细胞分层分离图;
图3是黑色素细胞内部结构的电镜图,比例尺为1000nm;
图4为色素基因tyr、edrb和mc1r电泳图;图中如t1、t2为tyr基因的两组平行;e1、e2为edrb基因的两组平行;m1、m2为mc1r基因的两组平行。
图5是黑色素细胞dopa染色图,a为dopa染色前,b为dopa染色后。
具体实施方式
采用percoll试剂将色素细胞分层,以k-sfm和dmem为不同阶段培养基,并加入tpa(十四烷酰佛波醇乙酸酯)、bfgf(碱性成纤维细胞生长因子)、等培养液,成功进行细胞的纯化培养、原代培养和传代培养(传10代)。本试验采用k-sfm角朊细胞培养基为原代培养和细胞纯化培养,以dmem培养基为最终传代培养。
k-sfm培养基更有利于羊驼毛囊干细胞增殖,培养出的细胞数量多,增殖快、克隆生成能力更强。而且k-sfm能抑制成纤维细胞和角朊细胞的生长,利于细胞纯化。相比本试验在细胞培养基各阶段两种培养基代培使用来说,可能会避免只使用dmem一种培养基时细胞纯化效果不佳和细胞增殖缓慢的问题。
本试验中,细胞原代培养、纯化和传代培养不同阶段的培养基,添加计量不同的tpa、bfgf、胎牛血清、双抗等作为细胞培养液。
tpa是一种促癌因子,能够对不同的细胞产生选择性性毒性作用,在色素细胞培养过程中,适量的tpa能促进色素细胞自身分泌一些特定的生长因子,能抑制成纤维细胞及角质形成细胞的生长和粘附,避免污染并使色素细胞快速增值,从而获得纯化的色素细胞。发明人不使用tpa发现,色素细胞会被污染,会在培养基内生长和粘附这许多成纤维细胞及角质形成细胞,且色素细胞增殖缓慢,通过自然纯化难得到单一色素细胞。因此在细胞原代培养和细胞时用量较大,而传代培养时细胞已经被纯化,此时只需将细胞正常传代增殖即可故减少用量。
bfgf是重要的促有丝分裂因子,也是形态发生和分化的诱导因子,具有很强的促细胞分裂增殖活性,能促进组织再生。发明人不使用bfgf发现,色素细胞会增殖、生长减慢,需要延长培养时间。因此在细胞原代培养和传代培养时用量较大,而细胞纯化时因以纯化单一细胞为主,不需要加强细胞分裂增殖活性,故不添加。
双抗就是青链霉素混合液,在细胞培养时起到抑制细菌生长、避免细胞污染的作用,在细胞原代培养和传代培养时使用。
胎牛血清含有丰富的细胞生长必须的营养成份,是动物细胞的体外培养的天然培养基,在细胞传代时达最大用量,可为细胞增殖提供充值营养物;而细胞纯化时用量在5%即可,增大用量对纯化效果不明显。一般的,细胞培养,想要目的细胞生长速度、密度达到优良,需在提取、原代、纯化、传代培养各个环节都需要不停镜检观察,必须通过改变以上添加生长因子等的计量、处理时间和细胞培养处理方式等方法相结合。同时运用显微镜观察比较提取的色素细胞形态与在鳞片上直接观察到的色素细胞形状大小基本一致;用透射电镜观察比较提取的色素细胞和传代培养第3代外观形态和细胞超微形态结构情况,可观察到其内部的喋呤体和类胡萝卜素囊泡,细胞结构完整;取第10代生长旺盛的色素细胞进行色素基因mc1r、tyr和ednrb的pcr检测,结果显示扩增条带特异性良好,说明获得的黑色素细胞保持着较好的生物学活性。建立该鱼体体表黑色素细胞提取、分离和培养方法。
下面结合实施例对本发明中的技术方案进行清楚、完整的说明,但并不局限于此。
试验对象
橘色双冠丽鱼,采自珠江水产研究所观赏鱼基地。健硕无伤的黑色和亮黄色阶段的鱼进行暂养,日常投喂,正常光照,控制适宜的养殖水温(23℃-28℃)和充足的溶氧。
试验试剂
k-sfm培养基、dmembasic(1×)培养基、bfgf(碱性成纤维细胞生长因子)、大豆胰蛋白抑制剂均购自赛默飞尔苏州仪器有限公司(gibco)。
胰蛋白酶(typsin1:250forbiochemistry)、edta(乙二胺四乙酸)、tpa、dnasei(脱氧核糖核酸酶i)、99%胎牛血清(fbs)、胶原酶i(collagei)、dmso(二甲基亚砜)均购自sigma公司;左旋多巴l-dopa(mce,美国);牛血清蛋白、percoll溶液(invitrogen公司);新洁尔灭(利尔康,山东);pbs缓冲液、ssc杂交缓冲液(海利克思,上海);depc水(碧云天,河南)。
rna提取试剂盒totalrnakitⅱ(omega);反转录试剂盒primescripttmⅱ1ststrandcdnasynthesiskit(takara);双抗原液(青霉素100u/ml、链霉素100ug/ml)购自中国医学院生物医学工程研究所。
胰蛋白酶溶液:2.5mg/ml胰蛋白酶,1.2mg/ml牛血清蛋白,1mm1mol/ledta。以配制100ml胰蛋白酶溶液为例,100ml胰蛋白酶溶液中加入0.25g胰蛋白酶,0.12g牛血清蛋白,0.029g。
胶原酶溶液:0.1mg/ml胶原酶i,0.1mg/mldnasei,0.1mg/ml大豆胰蛋白酶抑制剂,1.2mg/ml牛血蛋白。以配制100ml胶原酶溶液为例,100ml胶原酶溶液中加入0.12g牛血蛋白、0.01g胶原酶i、0.01gdnasei、0.01g大豆胰蛋白酶抑制剂。
percoll生理溶液:1份8.5%nacl,9份percoll原溶液。
tpa母液(0.05mg/ml):5mgtpa加100ml水。
bfgf母液(1ug/ml):10ugbfgf加100ml水。
kc1(用于细胞原代培养):k-sfm培养基,10%胎牛血清,10ng/mltpa,20ng/mlbfgf,1%双抗。
kc(用于细胞纯化培养):k-sfm培养基,5%胎牛血清,10ng/mltpa。
mc2(用于传代和长期培养):dmem培养基,20%胎牛血清,1ng/mltpa,20ng/mlbfgf,1%双抗。mc2培养基可抑制成纤维细胞和角朊细胞的生长。
细胞冻存液:二甲基亚砜、胎牛血清和培养基(dmem)以体积比为1:2:7进行混合制得。
实施例1
预先准备:取橘色双冠丽鱼的鱼鳃放血致死,0.1%新洁尔灭洗鱼体3次,再用75%酒精消毒鱼全身。
1)取鱼尾鳍、皮肤、鳞片组织放于胰蛋白酶中,混匀,浸6~8h;
2)弃胰蛋白酶溶液,加入pbs,1000rpm离心冲洗5min,重复5次,去除表皮;
3)剪碎组织至1mm3,移到装有置10ml胶原酶的置50ml离心管混匀,过夜(12~15h);
4)将组织用25μm气孔尼龙网过滤,静置5min,800rpm离心8min,过滤,得细胞样品;
5)胎牛血清湿润管壁,先加入2ml高浓度percoll试剂,再加入2ml中间浓度percoll试剂,再加入2ml低浓度percoll试剂,最后加入2ml细胞样品;分层percoll试剂浓度梯度:55%-45%-35%
6)400mg离心20~25min,黑色素细胞在45%-35%percoll两层之间;
7)观察细胞分层结果,镜检观察细胞分层结果。
图1为本发明的流程图。图2a~b发现,提取所得色素细胞溶液为灰黑色,通过percoll试剂分层后,黑色素细胞分布在45%-35%percoll两层之间。
取percoll分层所获得的黑色素细胞溶液进行镜检观察,另外,取橘色双冠丽鱼黑色阶段的鱼鳞片进行黑色素细胞形态观察,通过两者进行的色素细胞形态对比,检查提取的色素细胞形态是否正常。
实施例2色素细胞培养
(1)原代培养
将色素细胞重悬于kc1细胞培养基中,吹打均匀,取一滴接种于装有5mlkc1培养基的25ml不透气培养瓶中,置于28℃培养箱中培养。培养箱中放一杯水以保证培养箱内的湿度。
(2)细胞纯化
观察原代细胞生长情况,3h观察一次。当原代细胞铺满90%时,更换成kc培养基。取一滴接种于装有5mlkc1培养基的25ml不透气培养瓶中,置于28℃培养箱中培养,获得纯化的色素细胞。
(3)传代培养
当纯化的色素细胞铺满培养瓶底90%时,用mc2培养基进行细胞传代培养。取一滴接种于装有5mlkc1培养基的25ml不透气培养瓶中,置于28℃培养箱中培养,对2~3代细胞进行形态学观察。
色素细胞培养的冻存与复苏
(1)细胞的冻存
取第2-3代生长旺盛的橘色双冠丽鱼黑色素细胞进行冻存,1000r/min离心5min,倒上清液,加1~2ml细胞冻存液悬浮,轻轻混匀。吸取适量细胞于1.5ml冻存管中,于4℃静置1h,再于-20℃静置2-4h,最后置于-80℃过夜,然后直接放入液氮中长期保存。(一个培养瓶里的细胞只装入1个冻存管,-80℃可保存半年,液氮中可保存10年以下)。
(2)细胞的复苏
细胞复苏时,从液氮中取出所需细胞冻存管,立即置于28℃水浴锅中,不停摇晃使细胞快速融化。1000r/min离心5min,弃冻存液,加入到新配培养基悬浮细胞后,置28℃培养箱中培养。
对本发明提取的黑色素细胞做进一步的效果检测。
多巴染色
为了鉴定色素细胞活性和生长情况,使用黑色素细胞的dopa染色法,进行细胞爬片。分别取第3代生长旺盛的两种色素细胞细胞,加入4%多聚甲醛固定10min,用1×pbs洗涤3次,加入配制好的0.1%dopa溶液,孵育4h,中间2h时换液一次。
结果:图5为黑色素细胞dopa染色图,a为dopa染色前,b为dopa染色后。在显微镜下对黑素细胞染色前、后形态进行观察,染色后的黑色素细胞为黑色或灰色斑点状,形态和颜色保持良好,即l-dopa染色呈阳性。
透射电镜分析
取样和固定:取第3代生长旺盛的橘色双冠丽鱼黑色素细胞15ml,1000r/min离心3min,弃上清液,加1.5ml4%戊二醛固定,保存于4℃。送至中山大学电镜中心制样,在jem-1400plus型透射电子显微镜(日本hitachi)下观察拍照,分析色素细胞的形态结构。
从图3可知,电镜下可观察大量黑色素小体聚集,细胞内部结构完整。可判断黑色素细胞生长良好。
pcr鉴定
根据genbank数据库公开的橘色双冠丽鱼及其同源物种的mc1r(登录号2078989)、edrb(登录号:ab178934.1)、tyr(登录号:ku308394)三个基因序列,使用primer6.0引物设计软件进行pcr引物设计(如下),引物由艾基公司合成。
取第10代生长旺盛的黑色素细胞,使用rna提取试剂盒totalrnakitⅱ(omega)提取rna,再使用反转录试剂盒primescripttmⅱ1ststrandcdnasynthesiskit(takara)合成得到cdna。
以黑色素细胞合成的cdna为模板,分别对3对引物进行pcr扩增,电泳检测扩增情况。
引物的核苷酸序列如下:
mc1r-f:gcatcctcttcatcgtgtatca(seqidno.1);
mc1r-r:tatcacttatggcttgttttatc(seqidno.2);
edrb-f:ttgacaggtatcgtgccg(seqidno.3);
edrb-r:ccagtcctttgccgattt(seqidno.4);
tyr-f:ttgtttcagccagttccc(seqidno.5);
tyr-r:aaccaaacctgcattcgc(seqidno.6)。
mc1r的pcr产物长度520bp;edrb的pcr产物长度650bp;tyr的pcr产物长度250bp。
图4显示,经过本发明分离培养的第10代黑色素细胞素细胞,mc1r、tyr和ednrb基因扩增条带特异性良好,说明本发明分离培养的黑色素细胞保持着较好的生物学活性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>中国水产科学研究院珠江水产研究所
<120>一种橘色双冠丽鱼黑色素细胞分离和培养方法
<130>
<160>6
<170>patentinversion3.5
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
gcatcctcttcatcgtgtatca22
<210>2
<211>23
<212>dna
<213>人工序列
<400>2
tatcacttatggcttgttttatc23
<210>3
<211>18
<212>dna
<213>人工序列
<400>3
ttgacaggtatcgtgccg18
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
ccagtcctttgccgattt18
<210>5
<211>18
<212>dna
<213>人工序列
<400>5
ttgtttcagccagttccc18
<210>6
<211>18
<212>dna
<213>人工序列
<400>6
aaccaaacctgcattcgc18
- 还没有人留言评论。精彩留言会获得点赞!