牛诺如病毒的实时荧光定量RT-PCR检测方法与流程
本发明属于分子生物学技术领域,具体涉及一种牛诺如病毒的实时荧光定量rt-pcr检测方法。
背景技术:
犊牛腹泻是临床上一种常见的综合症,影响犊牛健康,进而影响优质畜产品生产,给养牛业造成严重的危害,其病因复杂,其中病毒感染是引起腹泻的重要原因。据报道,除了牛冠状病毒(bovinecoronavirus,bcov)、牛轮状病毒(bovinerotavirus,brov)和牛病毒性腹泻病毒(bovineviraldiarrheavirus,bvdv)等常见的可以导致犊牛腹泻的病毒外,牛诺如病毒(bovinenorovirus,bnov)、牛环曲病毒(bovinetorovirus,btov)和牛纽布病毒(bovinenebovirus,bnev)等新发病毒在犊牛腹泻病原谱中也越来越备受关注。
诺如病毒(norovirus,nov)属于杯状病毒科、诺如病毒属的单股正链rna病毒,是人和动物胃肠道疾病的重要病原之一。nov基因组全长7.3~7.7kb,由3个开放阅读框(openreadframes,orfs)组成,orf1编码非结构蛋白,orf2编码主要衣壳蛋白(vp1),orf3编码次要结构蛋白(vp2)。nov共有7个基因群(gi~gvii),bnov属于基因群giii。在过去,基于vp1基因序列,bnovgiii可分为giii.1和giii.2,代表性毒株分别为bo/jena/1980/de(序列号:aj011099)和bo/newbury2/1976/uk(序列号:af097917)。近年来,根据双重命名系统(基于rdrp和vp1基因序列),bnovgiii又可分为giii.p1_giii.1,giii.p2_giii.2,giii.p1_giii.2和giii.p2_giii.1。
bnov是确定的犊牛腹泻病原,已在包括我国在内的19个国家检出。尽管目前仍无bnov的分离培养体系,但在排除其他病原的只含bnov腹泻粪便经无菌处理后感染新生无菌小牛,可引起急性、间歇性、持续性腹泻,伴有嗜睡症状,并可长期通过粪便排毒;但组织病理学检查未见明显的病变。此外,病原流行病学资料也表明bnov与犊牛腹泻紧密相关,因此,bnov已成为一种公认的犊牛腹泻致病原。因为rdrp在杯状病毒的复制中起关键作用,其3’端相对保守,常作为分子检测靶点。荧光定量pcr检测方法是国际公认检测病毒的黄金标准,然而,当前国内还没有专门针对bnov的快速诊断方法,迫切需要一种bnov的早期快速诊断方法。
技术实现要素:
针对目前还没有专门针对bnov的快速诊断方法,本发明提供一种基于bnov的靶向rdrp基因,建立了检测bnov的荧光定量rt-pcr方法,为犊牛腹泻的病原诊断及分子流行病学调查提供了一种快速的检测方法。
本发明解决其技术问题所采用的方案是:提供一种用于对牛诺如病毒进行实时荧光定量rt-pcr检测的特异性引物对,所述引物对是根据牛诺如病毒的靶向rdrp基因设计得到,所述引物序列为:
f:5’-gctacacagcggcgcttaa-3’
r:5’-gggagttcgaccacatgttc-3’。
本发明还提供一种牛诺如病毒实时荧光定量rt-pcr检测方法,包括以下步骤:
步骤一、样本采集:采集腹泻犊牛的粪便样本;
步骤二、引物设计与合成:根据牛诺如病毒的靶向rdrp基因设计一对特异性引物,所述引物序列为:
f:5’-gctacacagcggcgcttaa-3’
r:5’-gggagttcgaccacatgttc-3’。
步骤三、提取bnov病毒株的rna,反转录得cdna,以cdna为模板,用步骤二设计的特异性引物进行pcr扩增,扩增产物凝胶电泳鉴定、纯化。
步骤四、制备重组质粒标准品:取纯化后的pcr扩增产物克隆于pmd18-t载体,转化至jm109感受态细胞中,提取重组质粒,测序鉴定,测序正确的重组质粒作为标准品。
步骤五、确定反应体系及反应条件:反应体系:2×tipgreenqpcrsupermix10μl,50×passivereferencedye0.4μl,上、下游引物各0.4μl,模板1μl,ddh2o补充至20μl;反应条件:94℃30s;94℃5s,60℃34s,共40个循环。
步骤六、建立标准曲线:将重组质粒标准品进行10倍倍比稀释,得到109~101copies/μl等9个稀释度的标准品模板,按照步骤五确定的反应体系及反应条件进行扩增,以起始模板浓度的对数为横坐标,以循环中的ct值为纵坐标,建立标准曲线。
步骤七、通过敏感性、特异性和重复性实验验证方法的可行性,并对粪便样品进行检测。
上述的一种牛诺如病毒实时荧光定量rt-pcr检测方法,步骤三中所述bnov病毒株为bo/hn-1/2018/china毒株,ncbi登录号为mn122335。
上述的一种牛诺如病毒实时荧光定量rt-pcr检测方法,步骤六中建立的标准曲线为y=-3.36x+38.151,相关系数r2=0.997。
上述的一种牛诺如病毒实时荧光定量rt-pcr检测方法,牛诺如病毒实时荧光定量rt-pcr检测方法对bnov检出的最低拷贝数为22.4copies/μl。
上述的一种牛诺如病毒实时荧光定量rt-pcr检测方法,所述牛诺如病毒实时荧光定量rt-pcr检测方法的ct值的变异系数小于2%。
本发明的有益效果:本发明根据bnov的靶向rdrp基因设计出特异性较好的引物对,并根据该引物对成功建立了检测bnovreal-timert-pcr方法,该方法线性关系好,扩增效率高,灵敏性高,是常规rt-pcr方法的1000倍;特异性强,仅对bnov具有良好的扩增曲线,其他病原及阴性对照均无特异性扩增;重复性好,组内ct值变异系数(cv)在0.40%~0.50%之间,组间ct值cv在0.70%~1.30%之间,均小于2.0%;检出率明显高于常规rt-pcr,保障了bnov检测结果的准确性和检出效率,为bnov的防控和流行病学调查提供了有力的技术手段。
附图说明
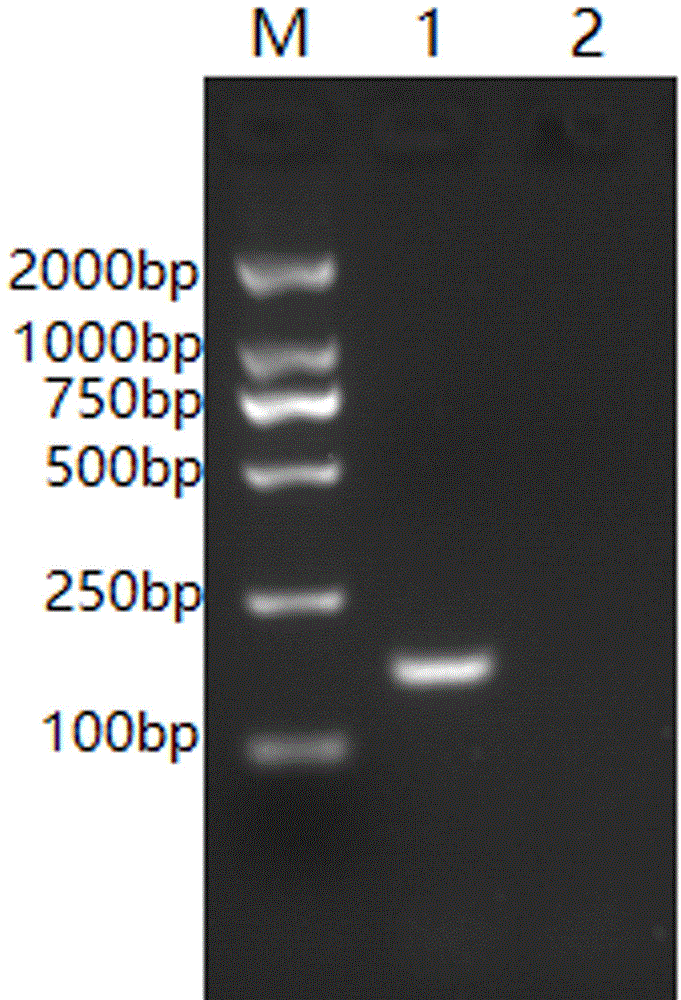
图1为本发明目的基因pcr扩增电泳图;其中:泳道m为2000dnamarker;泳道1为阳性样品;泳道2为阴性对照。
图2为荧光定量rt-pcr方法的熔解曲线;其中:泳道1为pmd18t-bnov-rdrp;泳道2为阴性对照。
图3为本发明方法引物浓度优化结果;其中:泳道1为100nmol/l;泳道2为150nmol/l;泳道3为200nmol/l;泳道4为250nmol/l;泳道5为300nmol/l;泳道6为350nmol/l。
图4为本发明方法模板用量优化结果;其中泳道1-6分别为0.5、1、1.5、2、3、4μl。
图5为本发明荧光定量rt-pcr方法的标准曲线。
图6为本发明荧光定量rt-pcr的敏感性测定结果;其中泳道1-10分别为2.24×109~2.24×100copies/μl;n为阴性对照。
图7为常规rt-pcr敏感性实验结果。
图8为本发明荧光定量rt-pcr的特异性检测;其中泳道1为重组质粒pmd18t-bnov-rdrp,2.24×108copies/μl;泳道2-8分别为btov、bastv、bcov、brov、bvdv、bkov、bnev;泳道9为ddh2o。
具体实施方式
下面结合附图和实施例对本发明进一步说明。
所用病毒株及被检材料:
牛诺如病毒(bovinenorovirus,bnov)、牛环曲病毒(bovinetorovirus,btov)、牛冠状病毒(bovinecoronavirus,bcov)、牛星状病毒(bovineastrovirus,bastv)、牛轮状病毒(bovinerotavirus,brov)、牛病毒性腹泻病毒(bovineviraldiarrheavirus,bvdv)、牛嵴病毒(bovinekobuvirus,bkov)和牛纽布病毒(bovinenebovirus,bnev)阳性样品,均由河南省农业科学院畜牧兽医研究所实验室收集并鉴定保存。
221份腹泻犊牛的粪便样本,于2017年9月至2019年5月在河南部分地区的牛场采集,样本均采于4月龄以下的腹泻犊牛。
主要试剂及仪器:
minibestviralrna/dnaextractionkit(9766),primescripttmii1ststrandcdnasynthesiskit(6210a),pmd18-tvectorcloningkit(6011),e.colijm109competentcells(9052),2×premixtaq(r004a),dl2000dnamarker(3427a),minibestagarosegeldnaextractionkit(9762)等为takara公司产品;质粒小提试剂盒plasmidminikit(d6943),为omega公司产品;2×tipgreenqpcrsupermix(aq131-02),为北京全式金生物技术有限公司产品。荧光定量pcr仪(7500fast),美国abi公司;高速冷冻离心机(5424r),德国eppendorf公司;常规pcr仪(tp600),日本takara公司;超微量紫外\可见分光光度计(nanodrop2000),美国thermoforma公司;凝胶成像分析仪(wd-9413b),中国北京六一生物科技有限公司。
实施例1:
一、引物设计及合成
利用mega7.0软件分析比对genebank中公布的bnovrdrp基因核苷酸序列,并结合实验室现有的bnovrdrp基因序列,采用oligo6.0软件设计1对特异性引物,引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。
表1本发明rdrp基因的引物序列
二、提取待测样品总核酸
将221份粪便样品分别用pbs按1:10(w:v)混悬,反复冻融3次后,漩涡震荡,4℃8000r/min离心5min,收获上清,-80℃保存用于后续实验;参照提取试剂盒提取病毒rna,-80℃保存病毒rna;cdna的反转录参照逆转录试剂盒,-20℃保存。
三、制备重组质粒标准品
以bo/hn-1/2018/china毒株(ncbi登录号:mn122335)的cdna为模板,使用步骤一中设计的引物进行pcr扩增,反应体系为25μl:包括2×premixtaq12.5μl,上、下游引物各1.0μl(10μmol/l),模板2.0μl,ddh2o补足25μl;扩增程序为:94℃5min;94℃30s,57℃30s,72℃30s,30个循环;72℃5min。
pcr扩增产物经1.5%琼脂糖凝胶电泳鉴定,电泳结果如图1所示,可以看出利用本发明设计的引物从bo/hn-1/2018/china毒株的cdna中扩增出约150bp的片段。然后用dna胶回收试剂盒回收目的片段,取纯化后的pcr产物克隆于pmd18-t载体,转化至jm109感受态细胞中,后涂在含有氨苄青霉素钠的lb琼脂平板上,37℃培养,挑取单菌落扩大培养,提取重组质粒,送生工生物工程(上海)股份有限公司进行测序,测序结果表明目的片段长度为163bp,大小与预期结果相符;经检索,与genebank上的基因序列完全匹配,为bnovrdrp基因的特异性序列。
选取正确的重组质粒作为反应模板及质粒标准品,将其命名为pmd18t-bnov-rdrp。用超微量紫外\可见分光光度计测定重组质粒的浓度,计算拷贝数(拷贝数=质粒浓度×10-9×6.02×1023/(660×质粒总长度))。测得浓度为70.0ng/μl,纯度为1.823,计算得出重组质粒拷贝数为2.24×1010copies/μl。
四、建立实时荧光定量rt-pcr熔解曲线
以重组质粒pmd18t-bnov-rdrp为模板,按照tipgreenqpcr试剂盒提供的反应体系进行扩增,反应体系supermix(2×)10μl,roxreferencedye(50×)0.4μl,上、下游引物各0.4μl(10μmol/l),模板1μl,ddh2o补充至20μl;扩增条件为预变性94℃30s;94℃5s,60℃34s,共40个循环。扩增后继续做熔解曲线,95℃15s,60℃1min;95℃30s,60℃15s,95℃continuous,结果见图2。
由图2可以看出,重组质粒pmd18t-bnov-rdrp经扩增后,扩增产物在tm值为87℃处出现单一波峰,无引物二聚体和非特异性扩增峰,说明本发明设计的引物具有特异性。
实施例2:牛诺如病毒实时荧光定量rt-pcr检测方法的建立
一、实时荧光定量rt-pcr反应条件的优化
(1)退火温度的确定
以重组质粒pmd18t-bnov-rdrp为模板,采用20μl的反应体系,退火温度设置57、58、59、60、61、62℃共6个温度梯度,对不同退火温度下ct值的大小进行比较,按照qpcr试剂盒提供的反应体系,即supermix(2×)10μl,roxreferencedye(50×)0.4μl,上、下游引物各0.4μl(10μmol/l),模板1μl,ddh2o补充至20μl,优化退火温度。结果显示退火温度为60℃时,ct值最小,说明退火温度为60℃时扩增效率最高。
(2)引物用量的确定
选取100、150、200、250、300、350nmol/l等6个不同浓度的上、下游引物,按照试剂盒提供的反应体系进行扩增,分别计算ct值和δrn值。循环条件为:预变性94℃30s;94℃5s,60℃34s,共40个循环,结果见图3。由图3可以看出,上、下游引物为200nmol/l时,重组质粒的扩增效率最高,故上、下游引物的最佳浓度为200nmol/l。
(3)模板用量的确定
通过对0.5、1、1.5、2、3、4μl等6个不同用量的模板,按照试剂盒提供的反应体系,循环条件为:预变性94℃30s;94℃5s,60℃34s,共40个循环,得到扩增曲线,分别计算ct值和δrn值,结果见图4。由图4可知,随着模板用量的逐渐增大,荧光强度增加变化不大,ct值变化也不显著,故选取模板用量为1μl。
通过对退火温度、引物浓度和模板浓度等条件的优化,反应体系最终确定为:总体积为20μl,其中2×tipgreenqpcrsupermix10μl,50×passivereferencedye0.4μl,上、下游引物各0.4μl,模板1μl,ddh2o补充至20μl。反应条件:94℃30s;94℃5s,60℃34s,共40个循环。
二、建立标准曲线
将重组质粒进行10倍倍比稀释,得到109~101copies/μl等9个稀释度的标准品模板,按照步骤一优化的方法进行扩增,确定线性范围,以起始模板浓度的对数为横坐标,以循环中的ct值为纵坐标,建立标准曲线,结果见图5。由图5可知,依照优化后的反应体系及条件,所建立的方法在重组质粒浓度为2.24×102~2.24×108copies/μl之间呈现良好的线性关系,回归方程为y=-3.36x+38.151,相关系数r2=0.997,扩增效率是98.44%,说明该方法线性关系良好、扩增效率好。
三、敏感性试验
将重组质粒进行10倍倍比稀释后作为模板,同时用等量nuclease-freewater作阴性对照,每个稀释度做3个重复,根据已建立的荧光定量rt-pcr方法进行扩增,观察扩增曲线确定质粒的最低拷贝数,结果见图6。同时对相同样品进行常规rt-pcr扩增,并比较2种检测方法的敏感性,结果见图7。
由图6和图7可知,本发明荧光定量rt-pcr方法所能检出的最低拷贝数为22.4copies/μl;而常规常规rt-pcr最低检出bnov的拷贝数为2.24×104copies/μl,可见本发明荧光定量rt-pcr方法是常规rt-pcr方法敏感性的1000倍,说明本发明方法的敏感性较高。
四、特异性检测
用本发明建立的荧光定量rt-pcr方法对btov、bastv、bcov、brov、bvdv、bkov、bnev的cdna及重组质粒pmd18t-bnov-rdrp进行检测,并用等量nuclease-freewater代替模板作阴性对照,来验证所建方法的特异性,结果见图8。
由图8可以看出,本发明建立的方法仅对bnov具有良好的扩增曲线,其他病原及阴性对照均无特异性扩增。
五、重复性分析
以2.24×107~2.24×104copies/μl4个稀释度的重组质粒pmd18t-bnov-rdrp为模板,分别进行3次重复扩增,同时设阴性对照,计算ct值的标准差(s)和变异系数(cv),验证实时荧光定量pcr方法的重复性,结果见表2。
表2荧光定量pcr的重复性
由表2可以看出,组内ct值变异系数(cv)在0.40%~0.50%之间,组间ct值cv在0.70%~1.30%之间,均小于2.0%,表明该方法具有良好的可重复性。
六、临床样品检测
使用本发明建立的实时荧光定量rt-pcr方法和常规rt-pcr方法分别对221份粪便样本进行检测,检测结果见表3。
表3临床样品的检测结果
注:*p<0.05,两组数据差异显著。
由表3可以看出,采用本发明的方法在221例样本中bnov的阳性样本数为25,阳性检出率为11.31%(25/221),采样场的阳性率为100%(14/14);并对检出的全部阳性样品进行测序,均证实为bnov的目的基因片段,且检出的阳性样品包括了常规rt-pcr检出的所有阳性样品;而采用常规rt-pcr的检出率为9.95%(22/221),明显低于本发明方法的检出率,说明采用本发明的方法准确性较高。
以上所述仅为本发明的较佳实施例,并不限制本发明,凡在本发明的精神和原则范围内所做的任何修改、等同替换和改进,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 高灵敏监测POPs的转荧光蛋白基因鱼的制作与应用的制造方法与工艺
- 一种收发一体式开放光路大气检测系统的制造方法与工艺
- 一种用于鉴别西红花的荧光PCR检测引物组、试剂盒及检测方法和应用与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种具有蓝色荧光的手性有机染料分子及其制备方法与应用与流程
- 一种基于直接竞争荧光免疫法定量检测叶酸功能化二氧化硅靶向纳米药物载体的方法与流程
- 螯合剂的定量方法及螯合剂定量系统与流程
- 一种棒状杆菌属细菌和克氏棒状杆菌多重荧光定量PCR引物、探针、试剂盒和检测方法与流程
- 一种染料定量输送装置的制造方法
- 一种基于半阈值追踪算法的荧光分子断层成像重建方法与流程