用于鉴别16种猪病病原冻干微芯片、试剂盒及方法与流程
本发明涉及病毒的分子生物学检测技术领域,特别是涉及一种用于鉴别16种猪病病原冻干微芯片、试剂盒及方法。
背景技术:
我国是农业畜牧业大国,猪类养殖以规模化集约化养殖为主,高密度的养殖方式也使得猪类的传染性疾病难以预防,且问题日益显著。而且多种病原同时感染,导致检测及预防疾病发生也十分困难。
猪类常见的传染性疾病病原有猪口蹄疫病毒(foot-and-mouthdiseasevirus,fmdv)、猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)、猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tegv)、猪冠状病毒(porcinecoronavirus,dcv)、猪乙型脑炎病毒(japaneseencephalitisvirus,jev)、猪肺炎支原体(mycoplasmahyopneumoniae,mhp)、猪轮状病毒(porcinerotavirus,prtv)、猪瘟病毒(classicalswinefevervirus,csfv)、猪流感病毒(swineinfluenzavirus,siv)、猪细小病毒(porcineparvovirus,ppv)、猪圆环病毒(porcinecircovirus,pcv)、猪伪狂犬病毒(porcinepseudorabiesvirus,prv)、猪胸膜肺炎放线杆菌(actinobacilluspleuropneumoniae,app)、猪链球菌(streptococcussuis,ss)、副猪嗜血杆菌(haemophilusparasuis,hps)、猪衣原体(swinechlamydiosis,sc)。近年来,虽然各国科学家已对猪病及各类病原进行了多方面的研究。目前对猪病病原的检测所采用的方法我国在近几年时间内相继建立了病原的分离纯化培养鉴定、间接酶联免疫吸附试验(elisa)等血清学检测技术以及分子检测技术(rt-pcr)。病毒分离操作烦琐,耗时长,漏检率高;elisa方法相对简便,快速,但对于微量或杂质较多的样品,其特异性和灵敏度较低,可能造成漏诊或误诊。pcr作为一种新型的分子生物学技术,自诞生以来,由于其特异性、敏感性高,能在短时间内通过基因扩增得到大量的目的片段,克服了传统的猪病原检测技术包括病毒分离鉴定试验周期长的缺点,为猪病原早期快速检测提供了敏感、快速、实用的检测方法,使之成为目前猪病病原检测的重要手段之一。但普通pcr仍存在操作繁琐、检测时间长且易污染等弊端。所以目前市场急需快速、准确、灵敏度高,且便携,能现场操作的同时检测和鉴别上述16种猪病的集成试剂产品。可以为我国猪病的防制提供先进、有效的早期快速检测技术和监测手段的同时,也为猪病防制争取到极为宝贵的快速反应时间。
技术实现要素:
基于本领域的上述需求,本发明的目的在于提供一种用于鉴别16种猪病病原冻干微芯片及试剂盒,使其能够快速、有效地对猪病病原进行检测,准确性、特异性和敏感性高,重复性好。
为实现上述目的,本发明采用如下技术方案:
用于鉴别16种猪病病原冻干微芯片,其特征在于,用于鉴别16种猪病病原的荧光pcr反应体系通过冻干被固定在所述微芯片上;
所述荧光pcr反应液包括:下述引物和探针:
fmdv-f:5’-ggccgagaccacaaatgtg-3’;
fmdv-r:5’-tcggccttgccatgtgtaa-3’;
fmdv-taqman:5’-agggatgggtctgctt-3’;
pedv-f:5’-gcaaatacattggcagcataacc-3’;
pedv-r:5’-tgctggtgaggatggtctttc-3’;
pedv-taqman:5’-atgcaattagctgtacagtgt-3’;
tegv-f:5’-tggtgagcccttgcaaatg-3’;
tegv-r:5’-cagttacaacaacccgcaatttt-3’;
tegv-taqman:5’-taatagcaccttcagcagaat-3’;
dcv-f:5’-agccacccaccaaaccaa-3’;
dcv-r:5’-tgggtttagcagactggtcttgt-3’;
dcv-taqman:5’-aggacaagaagcctgac-3’;
jev-f:5’-cgcggaccaggcattc-3’;
jev-r:5’-gaactctccccatgtgtttgga-3’;
jev-taqman:5’-aagcgaagcaggagat-3’;
mhp-f:5’-tgaccgtcttaactcgccaaat-3’;
mhp-r:5’-ggcggtagggaattaaaactattg-3’;
mhp-taqman:5’-cgcaagtcttgataaaa-3’;
prtv-f:5’-tttgtttacattgactactgggatgat-3’;
prtv-r:5’-agcagcaagtgaccgaacatatac-3’;
prtv-taqman:5’-acaagcattcagaaaca-3’;
csfv-f:5’-tttgcgtggcaggttcct-3’;
csfv-r:5’-aatgatgccaaatacctcctactga-3’;
csfv-taqman:5’-aaagtcacagcacttaat-3’;
siv-f:5’-ccgaaatcgcgcagaga-3’;
siv-r:5’-catgagagcctcaagatctgtgtt-3’;
siv-taqman:5’-tgaagatgtctttgctggaa-3’;
ppv-f:5’-gcagctaacacaagaaaaggttatcac-3’;
ppv-r:5’-cctgagctggcctaattgct-3’;
ppv-taqman:5’-taatagctacacagaagcaa-3’;
pcv-f:5’-tgagcgggaaaatgcagaa-3’;
pcv-r:5’-ccaggtggccccacaa-3’;
pcv-taqman:5’-tggaagacgaatgtacacg-3’;
prv-f:5’-cgtcgtgagcagcatgat-3’;
prv-r:5’-ccatgatgaccagcacgat-3’;
prv-taqman:5’-catcgggatcctggc-3’;
app-f:5’-ggtaccggtcttaggtatcattgaa-3’;
app-r:5’-cttcgtggtgaccgcaattt-3’;
app-taqman:5’-cgtgcatatctgcc-3’;
ss-f:5’-ttcgaagcaacgcgaagaa-3’;
ss-r:5’-cccatctctagggcggtcat-3’;
ss-taqman:5’-ccaggtcttgacatcc-3’;
hps-f:5’-gcggcaggcttaacacatg-3’;
hps-r:5’-cgtcagcaaagaaagcaagct-3’;
hps-taqman:5’-tcgaacggtagcaggga-3’;
sc-f:5’-cacagtccgttgtcgagcttta-3’;
sc-r:5’-gcggctctagcaccaacac-3’;
sc-taqman:5’-cagatactgcctttgctt-3’。
所述荧光pcr反应体系还包括:taq酶、反转录酶、海藻糖、tris-cl、dntp、mg2+;
优先地,所述猪口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌和猪衣原体的taqman探针的5`端标记有荧光报告基团;3`端标记有荧光淬灭基团。
所述荧光pcr反应体系包括:上游引物0.4μm;下游引物0.4μm;taqman探针0.4μm;dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm,模板5ng/μl其余为灭菌去离子水;
优选地,所述模板选自16种猪病病原的cdna、待测样品cdna和灭菌去离子水,分别用于做为阳性对照、样本检测体系和阴性对照;
更优选地,所述微芯片冻干前每个加样孔中的荧光pcr反应体系的上游引物、下游引物和taqman探针分别包括16种猪病病原中的2种猪病病原的引物组和taqman探针,且所述阳性对照的荧光pcr反应体系的模板分别为16种猪病病原中的2种猪病病原的cdna混合物;16种猪病病原中,下述每组中的2种猪病病原的引物对和taqman探针以及用于阳性对照的模板的cdna混合物需放入微芯片上的同一个加样孔中:口蹄疫病毒和猪流行性腹泻病毒;猪传染性胃肠炎病毒和猪冠状病毒;猪乙型脑炎病毒和猪肺炎支原体;猪轮状病毒和猪瘟病毒;猪流感病毒和猪细小病毒;猪圆环病毒和猪伪狂犬病毒;猪胸膜肺炎放线杆菌和猪链球菌;副猪嗜血杆菌和猪衣原体。
优先地,所述口蹄疫病毒、猪传染性胃肠炎病毒、猪乙型脑炎病毒、猪轮状病毒、猪流感病毒、猪圆环病毒、猪胸膜肺炎放线杆菌和副猪嗜血杆菌的taqman探针的5`端标记的荧光报告基团为fam荧光报告基团;
所述猪流行性腹泻病毒、猪冠状病毒、猪肺炎支原体、猪瘟病毒、猪细小病毒、猪伪狂犬病毒、猪链球菌和猪衣原体的taqman探针的5`端标记的荧光报告基团为rox荧光报告基团;
所述猪口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌和猪衣原体的taqman探针3`端标记的荧光淬灭基团为mgb淬灭基团。
所述微芯片上设置有若干个加样孔;所述荧光pcr反应体系通过冻干被固定在所述加样孔内;
优选地,所述微芯片上的加样孔为24个;所述微芯片的结构与pcr仪的加样板结构相适配。
所述冻干包括如下步骤:将装有所述荧光pcr反应体系的微芯片置于-80℃冷冻1h后再进行设备冻干;
优选地,所述设备冻干包括:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
用于鉴别16种猪病病原的试剂盒,包括所述的冻干微芯片。
所述试剂盒,还包括:稀释液,10×稀释液使用无核酸酶水稀释成2×稀释液用于滴入冻干微芯片的加样孔中,再将冻干微芯片置于荧光pcr仪上进行荧光pcr扩增。
所述试剂盒,还包括:矿物油,封闭所述冻干微芯片上的加样孔;
用于鉴别16种猪病病原的方法,其特征在于,采用所述的冻干微芯片,和/或,所述的试剂盒对待测样品进行荧光pcr扩增。
在冻干微芯片的加样孔中加入待测样品及稀释液后,将冻干微芯片置于荧光pcr仪上进行所述荧光pcr扩增;
优选地,所述稀释液为10×buffer;
进一步优选地,所述荧光pcr扩增的反应程序为:50℃10min;95℃1min;以95℃5s,60℃15s为1个循环,进行40个循环,每个循环的延伸结束时进行荧光信号检测。
本发明提供一种16种猪病病原荧光冻干微芯片pcr检测试剂盒,包括pcr冻干微芯片,所述pcr冻干微芯片包括具有如下核苷酸序列的引物和taqman探针:
fmdv-f:5’-ggccgagaccacaaatgtg-3’;
fmdv-r:5’-tcggccttgccatgtgtaa-3’;
fmdv-taqman:5’-agggatgggtctgctt-3’;
pedv-f:5’-gcaaatacattggcagcataacc-3’;
pedv-r:5’-tgctggtgaggatggtctttc-3’;
pedv-taqman:5’-atgcaattagctgtacagtgt-3’;
tegv-f:5’-tggtgagcccttgcaaatg-3’;
tegv-r:5’-cagttacaacaacccgcaatttt-3’;
tegv-taqman:5’-taatagcaccttcagcagaat-3’;
dcv-f:5’-agccacccaccaaaccaa-3’;
dcv-r:5’-tgggtttagcagactggtcttgt-3’;
dcv-taqman:5’-aggacaagaagcctgac-3’;
jev-f:5’-cgcggaccaggcattc-3’;
jev-r:5’-gaactctccccatgtgtttgga-3’;
jev-taqman:5’-aagcgaagcaggagat-3’;
mhp-f:5’-tgaccgtcttaactcgccaaat-3’;
mhp-r:5’-ggcggtagggaattaaaactattg-3’;
mhp-taqman:5’-cgcaagtcttgataaaa-3’;
prtv-f:5’-tttgtttacattgactactgggatgat-3’;
prtv-r:5’-agcagcaagtgaccgaacatatac-3’;
prtv-taqman:5’-acaagcattcagaaaca-3’;
csfv-f:5’-tttgcgtggcaggttcct-3’;
csfv-r:5’-aatgatgccaaatacctcctactga-3’;
csfv-taqman:5’-aaagtcacagcacttaat-3’;
siv-f:5’-ccgaaatcgcgcagaga-3’;
siv-r:5’-catgagagcctcaagatctgtgtt-3’;
siv-taqman:5’-tgaagatgtctttgctggaa-3’;
ppv-f:5’-gcagctaacacaagaaaaggttatcac-3’;
ppv-r:5’-cctgagctggcctaattgct-3’;
ppv-taqman:5’-taatagctacacagaagcaa-3’;
pcv-f:5’-tgagcgggaaaatgcagaa-3’;
pcv-r:5’-ccaggtggccccacaa-3’;
pcv-taqman:5’-tggaagacgaatgtacacg-3’;
prv-f:5’-cgtcgtgagcagcatgat-3’;
prv-r:5’-ccatgatgaccagcacgat-3’;
prv-taqman:5’-catcgggatcctggc-3’;
app-f:5’-ggtaccggtcttaggtatcattgaa-3’;
app-r:5’-cttcgtggtgaccgcaattt-3’;
app-taqman:5’-cgtgcatatctgcc-3’;
ss-f:5’-ttcgaagcaacgcgaagaa-3’;
ss-r:5’-cccatctctagggcggtcat-3’;
ss-taqman:5’-ccaggtcttgacatcc-3’;
hps-f:5’-gcggcaggcttaacacatg-3’;
hps-r:5’-cgtcagcaaagaaagcaagct-3’;
hps-taqman:5’-tcgaacggtagcaggga-3’;
sc-f:5’-cacagtccgttgtcgagcttta-3’;
sc-r:5’-gcggctctagcaccaacac-3’;
sc-taqman:5’-cagatactgcctttgctt-3’。
作为进一步地改进,所述taqman探针的核苷酸序列的3'端标记mgb荧光淬灭基团。
所述口蹄疫病毒、猪传染性胃肠炎病毒、猪乙型脑炎病毒、猪轮状病毒、猪流感病毒、猪圆环病毒、猪胸膜肺炎放线杆菌和副猪嗜血杆菌的taqman探针的5`端标记的荧光报告基团为fam荧光报告基团;猪流行性腹泻病毒、猪冠状病毒、猪肺炎支原体、猪瘟病毒、猪细小病毒、猪伪狂犬病毒、猪链球菌和猪衣原体检测taqman探针的核苷酸序列的5'端标记rox荧光报告基团。
所述冻干微芯片试剂还包括dna聚合酶、反转录酶、dntp、mg2+、海藻糖、tris-cl。
所述荧光定量pcr的ariaysb冻干微芯片的整个冻干微芯片上样孔为24个,将上述荧光pcr反应体系分为8组,分别包含猪口蹄疫病毒和猪流行性腹泻病毒2种引物探针,猪传染性胃肠炎病毒和猪冠状病毒2种引物探针,猪乙型脑炎病毒和猪肺炎支原体2种引物探针,猪轮状病毒和猪瘟病毒2种引物探针,猪流感病毒和猪细小病毒2种引物探针,猪圆环病毒和猪伪狂犬病毒2种引物探针,猪胸膜肺炎放线杆菌和猪链球菌2种引物探针,副猪嗜血杆菌和猪衣原体2种引物探针。
所述冻干微芯片分为阳性对照孔,样本孔和阴性对照孔。其中,阳性对照孔还包括样品dna/cdna。
所述阳性对照为口蹄疫病毒和猪流行性腹泻病毒基因组cdna混合物;猪传染性胃肠炎病毒基因组cdna和猪冠状病毒基因组dna混合物;猪乙型脑炎病毒基因组cdna和猪肺炎支原体基因组dna混合物;猪轮状病毒和猪瘟病毒基因组cdna混合物;猪流感病毒基因组cdna和猪细小病毒基因组dna混合物;猪圆环病毒和猪伪狂犬病毒基因组dna混合物;猪胸膜肺炎放线杆菌和猪链球菌基因组dna混合物;副猪嗜血杆菌和猪衣原体基因组dna混合物。
所述每个微芯片孔总体积为2μl。
所述荧光定量pcr的冻干微芯片先于-80℃冷冻1h。设备冻干条件为:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
所述常规试剂包括矿物油、稀释液、无核酸酶水在内的商品化分子试剂;
所述商品化稀释液为10×buffer,使用无核酸酶水稀释为2×buffer和1×buffer。
所述冻干微芯片荧光定量pcr的2μl反应体系包括:荧光定量pcr冻干阳性对照孔和阴性对照孔,1×buffer稀释液2μl;荧光定量pcr冻干样本孔,2×buffer稀释液1μl,检测样品dna/rna1μl。
所述16种猪病病原冻干微芯片荧光rt-pcr检测试剂盒,其特征在于,采用所述的引物、和/或、所述的试剂盒对待测样品进行检测。
所述检测指冻干微芯片荧光定量pcr检测;本发明冻干前采用的荧光pcr反应体系包括如下成分:阳性对照孔2种上游引物各0.4μm;2种下游引物各0.4μm;2种taqman探针各0.4μm;dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm,阳性对照5ng/μl;余量为灭菌去离子水,每孔体积为2μl;样本孔和阴性对照孔包含2种上游引物各0.4μm;2种下游引物各0.4μm;2种taqman探针各0.4μm;dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm;余量为灭菌去离子水,每孔体积为2μl;
所述冻干微芯片荧光rt-pcr反应条件为:50℃10min,为第一步循环;95℃1min,为第二步循环;95℃5s,60℃15s,为第三步,40个循环,所述第三步每个循环的延伸结束时进行荧光信号检测。
由于采用上述技术方案,本发明至少具有以下优点:
(1)本发明根据国内已发现的猪口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体病原保守基因设计引物,合成特异性引物及taqman-mgb探针,采用荧光定量pcr方法可同时快速灵敏地检测16种猪病病原,且准确性、特异性和敏感性高,重复性好。
(2)本发明一方面采用了高拷贝的靶基因,一方面采用taqman-mgb探针荧光定量pcr检测法,使得利用taqman-mgb探针法荧光定量pcr检测的灵敏度约是普通pcr的100倍。
(3)由于采用定量检测技术-taqman-mgb荧光定量pcr(real-timepcr),该方法(real-timepcr)具有单管封闭操作防污染、自动化程度高、特异性强、可实时监控等优点,有效地解决了传统方法只能终点检测的局限。
(4)冻干微芯片技术相对于目前使用的荧光pcr检测技术,反应体系更小,仅2μl,常规的反应体系为20-25μl,所以微芯片技术可以节省rt-pcr扩增试剂以及样品的用量。
(5)冻干微芯片较小的反应体系可以保证在pcr扩增过程中体系受热更加均匀,升降温速率更快。升温速率(10-12℃/s)相比目前采用的荧光pcr检测系统升降温速率(3-5℃/s)快。荧光pcr整个过程(包括加样)可在40分钟内完成,计算机自动报告结果,无需电泳及其他后续的工作,即方便了操作又减少了污染。
(6)冻干微芯片可进行常温保存和运输,避免试剂反复冻融,检测结果更稳定。
(7)将阳性对照和阴性对照与反应试剂一起冻干于微芯片中,检测样本时只需加入稀释液和待检样本即可,无需添加阴性对照和阳性对照。程序为固定设置程序,无需设置,调用软件已有程序即可检测,进一步缩短了检测时间。
本发明采用的实时荧光定量pcr技术(real-timepcr),是指在pcr反应体系中加入荧光基团,利用荧光信号累积实时监测整个pcr进程,最后通过标准曲线对未知模板进行定量分析的方法。
本发明采用的微芯片是由硅胶或者铝盘形成的带有由保护膜覆盖的微反应器(微反应器的体积和质量取决于微芯片的类型)的反应区域。微芯片的反应区有一层矿物油覆盖。试剂穿过一层矿物油通过手动或者自动的带枪头的移液器注入至微反应器上,可避免检测样本的交叉污染和反应体系蒸发。
本发明将pcr反应试剂及阳性对照和阴性对照冻干在微芯片上,上样时仅需添加样本孔。结合taqman探针荧光定量pcr技术,核酸的分析是微芯片在热循环期间同时读取在每个反应器上由pcr产物产生的荧光信号。本发明采用的微芯片技术不同于目前常用的塑料pcr管作为载体盛载pcr反应体系进行pcr扩增,而是采用金属载体微芯片,反应体系及样本直接加到金属载体上进行pcr扩增。金属载体热传导效率和升降温速率更快,可大幅度缩短反应程序时间。具有反应体系小、自动化程度高、反应时间短、特异性强、敏感性高、重复性强、反应试剂不需低温保存、可进行定量检测及微芯片操作污染可能性小等特点。本发明产品可在反应条件一致的情况下快速鉴定并可区分16种猪病病原,操作简单,从样本处理到结果分析可在1个小时内完成。
综上,由于采用了以上技术方案,本发明通过设计特异性引物和探针并优化微芯片冻干条件,发展了能够快速、有效地检测16种猪病病原的微芯片荧光定量pcr的反应体系,同时制备了基于该方法的检测试剂盒。本发明通过大量实验验证,本发明的引物探针/试剂盒/检测方法比常规方法准确性更高、特异性优良,同时最低检出限可达10tcid50/ml,说明敏感性非常高,同时所述检测试剂盒批间变异系数在0.25%-1.95%之间,说明重复性良好。
附图说明
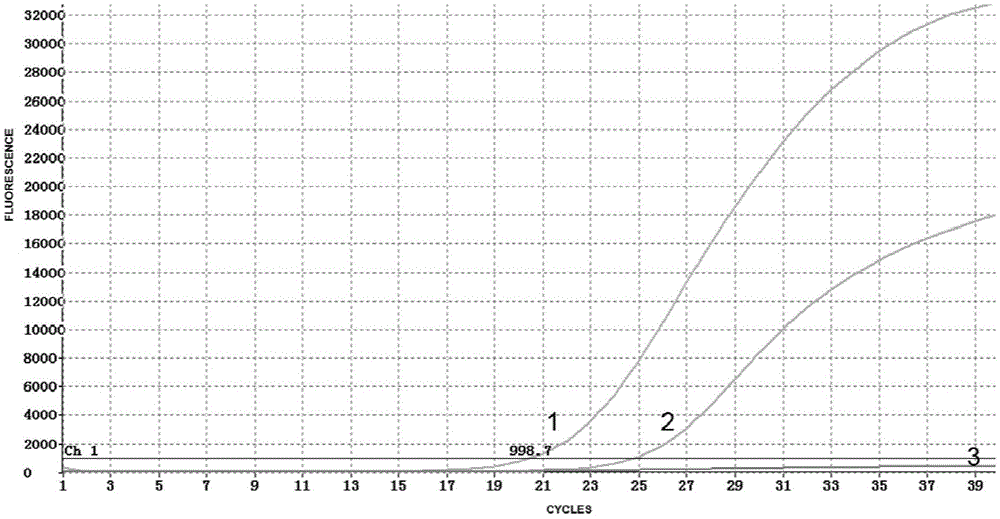
图1是16种猪病病原冻干微芯片对猪口蹄疫病毒的特异性检测。图中,1:猪口蹄疫病毒阳性对照;2:猪口蹄疫病毒样本核酸;3:猪口蹄疫病毒阴性对照。
图2是16种猪病病原冻干微芯片对猪口蹄疫病毒的特异性检测。图中,1:猪口蹄疫病毒阳性对照;2:猪流行性腹泻病毒样本核酸;3:猪口蹄疫病毒阴性对照。
图3是16种猪病病原冻干微芯片对猪口蹄疫病毒的特异性检测。图中,1:猪口蹄疫病毒阳性对照;2:猪传染性胃肠炎病毒;3:猪冠状病毒;4:猪乙型脑炎病毒;5:猪肺炎支原体;6:猪轮状病毒;7:猪瘟病毒;8:猪流感病毒;9:猪细小病毒;10:猪圆环病毒;11:猪伪狂犬病毒;12:猪胸膜肺炎放线杆菌;13:猪链球菌;14:副猪嗜血杆菌;15:猪衣原体;16:猪蓝耳病毒;17:猪口蹄疫病毒阴性对照。
图4是16种猪病病原冻干微芯片对猪流行性腹泻病毒的特异性检测。图中,1:猪流行性腹泻病毒阳性对照;2:猪流行性腹泻病毒样本核酸;3:猪流行性腹泻病毒阴性对照。
图5是16种猪病病原冻干微芯片对猪流行性腹泻病毒的特异性检测。图中,1:猪流行性腹泻病毒阳性对照;2:猪口蹄疫病毒样本核酸;3:猪流行性腹泻病毒阴性对照。
图6是16种猪病病原冻干微芯片对猪口蹄疫病毒的特异性检测。图中,1:猪流行性腹泻病毒阳性对照;2:猪传染性胃肠炎病毒;3:猪冠状病毒;4:猪乙型脑炎病毒;5:猪肺炎支原体;6:猪轮状病毒;7:猪瘟病毒;8:猪流感病毒;9:猪细小病毒;10:猪圆环病毒;11:猪伪狂犬病毒;12:猪胸膜肺炎放线杆菌;13:猪链球菌;14:副猪嗜血杆菌;15:猪衣原体;16:猪蓝耳病毒;17:猪流行性腹泻病毒阴性对照。
图7是冻干微芯片荧光rt-pcr试剂检测猪口蹄疫病毒敏感性结果。图中,a:1×106tcid50/ml;b:1×105tcid50/ml;c:1×104tcid50/ml;d:1×103tcid50/ml;e:1×102tcid50/ml;f:1×101tcid50/ml;g:1×100tcid50/ml;h:无核酸酶水。
图8是常规荧光rt-pcr试剂检测猪口蹄疫病毒敏感性结果。图中,a:1×106tcid50/ml;b:1×105tcid50/ml;c:1×104tcid50/ml;d:1×103tcid50/ml;e:1×102tcid50/ml;f:1×101tcid50/ml;g:1×10°tcid50/ml;h:无核酸酶水。
图9是冻干微芯片荧光rt-pcr试剂检测猪口蹄疫病毒标准曲线结果。
图10是常规荧光rt-pcr试剂检测猪口蹄疫病毒标准曲线结果。
具体实施方式
为了能够更清楚了解本发明的技术手段,以下结合附图与具体实施方式对本发明作进一步的详细说明。除非特别指明,以下实施例中所用的试剂均为分析纯级试剂,且可从正规渠道商购获得。
生物材料的来源或记载出处
本发明实验例使用的猪流行性腹泻病毒、猪轮状病毒、猪瘟病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒灭活毒株由国家动物疫控保存,猪口蹄疫病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪流感病毒灭活毒株,猪肺炎支原体、猪衣原体灭活病原体及猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌灭活细菌菌株由北京亿森宝生物科技有限公司保存,本发明所使用的所有毒株、菌株、支原体、衣原体均可商购获得。
第1组实施例:本发明的冻干微芯片
本组实施例提供一种用于鉴别16种猪病病原冻干微芯片,其特征在于,用于鉴别16种猪病病原的荧光pcr反应体系通过冻干被固定在所述微芯片上;
所述荧光pcr反应液包括:下述引物和探针:fmdv-f:5’-ggccgagaccacaaatgtg-3’;
fmdv-r:5’-tcggccttgccatgtgtaa-3’;
fmdv-taqman:5’-agggatgggtctgctt-3’;
pedv-f:5’-gcaaatacattggcagcataacc-3’;
pedv-r:5’-tgctggtgaggatggtctttc-3’;
pedv-taqman:5’-atgcaattagctgtacagtgt-3’;
tegv-f:5’-tggtgagcccttgcaaatg-3’;
tegv-r:5’-cagttacaacaacccgcaatttt-3’;
tegv-taqman:5’-taatagcaccttcagcagaat-3’;
dcv-f:5’-agccacccaccaaaccaa-3’;
dcv-r:5’-tgggtttagcagactggtcttgt-3’;
dcv-taqman:5’-aggacaagaagcctgac-3’;
jev-f:5’-cgcggaccaggcattc-3’;
jev-r:5’-gaactctccccatgtgtttgga-3’;
jev-taqman:5’-aagcgaagcaggagat-3’;
mhp-f:5’-tgaccgtcttaactcgccaaat-3’;
mhp-r:5’-ggcggtagggaattaaaactattg-3’;
mhp-taqman:5’-cgcaagtcttgataaaa-3’;
prtv-f:5’-tttgtttacattgactactgggatgat-3’;
prtv-r:5’-agcagcaagtgaccgaacatatac-3’;
prtv-taqman:5’-acaagcattcagaaaca-3’;
csfv-f:5’-tttgcgtggcaggttcct-3’;
csfv-r:5’-aatgatgccaaatacctcctactga-3’;
csfv-taqman:5’-aaagtcacagcacttaat-3’;
siv-f:5’-ccgaaatcgcgcagaga-3’;
siv-r:5’-catgagagcctcaagatctgtgtt-3’;
siv-taqman:5’-tgaagatgtctttgctggaa-3’;
ppv-f:5’-gcagctaacacaagaaaaggttatcac-3’;
ppv-r:5’-cctgagctggcctaattgct-3’;
ppv-taqman:5’-taatagctacacagaagcaa-3’;
pcv-f:5’-tgagcgggaaaatgcagaa-3’;
pcv-r:5’-ccaggtggccccacaa-3’;
pcv-taqman:5’-tggaagacgaatgtacacg-3’;
prv-f:5’-cgtcgtgagcagcatgat-3’;
prv-r:5’-ccatgatgaccagcacgat-3’;
prv-taqman:5’-catcgggatcctggc-3’;
app-f:5’-ggtaccggtcttaggtatcattgaa-3’;
app-r:5’-cttcgtggtgaccgcaattt-3’;
app-taqman:5’-cgtgcatatctgcc-3’;
ss-f:5’-ttcgaagcaacgcgaagaa-3’;
ss-r:5’-cccatctctagggcggtcat-3’;
ss-taqman:5’-ccaggtcttgacatcc-3’;
hps-f:5’-gcggcaggcttaacacatg-3’;
hps-r:5’-cgtcagcaaagaaagcaagct-3’;
hps-taqman:5’-tcgaacggtagcaggga-3’;
sc-f:5’-cacagtccgttgtcgagcttta-3’;
sc-r:5’-gcggctctagcaccaacac-3’;
sc-taqman:5’-cagatactgcctttgctt-3’。
在具体的实施例中,所述荧光pcr反应体系还包括:taq酶、反转录酶、海藻糖、tris-cl、dntp、mg2+;
优先地,所述16种猪病病原的taqman探针的5`端标记有荧光报告基团;3`端标记有荧光淬灭基团。
在更具体的实施例中,所述荧光pcr反应体系分为8组,分别为:猪口蹄疫病毒和猪流行性腹泻病毒,猪传染性胃肠炎病毒和猪冠状病毒,猪乙型脑炎病毒和猪肺炎支原体,猪轮状病毒和猪瘟病毒,猪流感病毒和猪细小病毒,猪圆环病毒和猪伪狂犬病毒,猪胸膜肺炎放线杆菌和猪链球菌,副猪嗜血杆菌和猪衣原体。每组荧光pcr反应体系包括:阳性对照荧光pcr反应体系、样本反应体系和阴性对照反应体系。上述阳性对照荧光pcr反应体系包含上游引物(2种)0.4μm;下游引物(2种)0.4μm;taqman探针0.4μm(2种);dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm,阳性对照5ng/μl,其余为灭菌去离子水,总体积为2μl;样本反应体系和阴性对照反应体系包含上游引物(2种)0.4μm;下游引物(2种)0.4μm;taqman探针0.4μm(2种);dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm,其余为灭菌去离子水,总体积为2μl;
所述阳性对照为分别为口蹄疫病毒和猪流行性腹泻病毒基因组cdna混合物;猪传染性胃肠炎病毒基因组cdna和猪冠状病毒基因组dna混合物;猪乙型脑炎病毒基因组cdna和猪肺炎支原体基因组dna混合物;猪轮状病毒和猪瘟病毒基因组cdna混合物;猪流感病毒基因组cdna和猪细小病毒基因组dna混合物;猪圆环病毒和猪伪狂犬病毒基因组dna混合物;猪胸膜肺炎放线杆菌和猪链球菌基因组dna混合物;副猪嗜血杆菌和猪衣原体基因组dna混合物。
上述这些成分的终浓度,既是冻干前荧光pcr反应体系的终浓度,也是冻干后,上样时,阳性对照和阴性对照孔每孔加入1×buffer2μl;样本孔需将2×buffer和核酸提取物按1:1混合后,样本孔每孔加入2μl。
优先地,所述口蹄疫病毒、猪传染性胃肠炎病毒、猪乙型脑炎病毒、猪轮状病毒、猪流感病毒、猪圆环病毒、猪胸膜肺炎放线杆菌和副猪嗜血杆菌的taqman探针的5`端标记的荧光报告基团为fam荧光报告基团;
所述猪流行性腹泻病毒、猪冠状病毒、猪肺炎支原体、猪瘟病毒、猪细小病毒、猪伪狂犬病毒、猪链球菌和猪衣原体的taqman探针的5`端标记的荧光报告基团为rox荧光报告基团;
所述猪口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌和猪衣原体的taqman探针3`端标记的荧光淬灭基团为mgb淬灭基团。
在一些实施例中,所述微芯片上设置有若干个加样孔;所述微芯片的结构与pcr仪的加样板结构相适配。所述微芯片的结构类似于一块pcr板,但本发明的微芯片是无盖的,需使用矿物油进行加样孔的封闭,在加样时候不容易串孔,不容易污染。因此不会出现pcr体系流动溢出或者串孔污染现象。
在另一些实施例中,所述冻干包括如下步骤:将装有所述荧光pcr反应体系的微芯片置于-80℃冷冻1h后再进行设备冻干;
将装有所述荧光pcr反应体系的微芯片先置于-80℃冷冻1h的目的是预冷冻,使第一步预冻阶段时,体系能保持固体状态,并且这一步还可以缩短干燥时间。
设备冻干指的是在专门的冻干设备中通过设定设备的工作条件来进行冻干;优选地,所述冻干设备指真空冷冻干燥机。
优选地,所述设备冻干包括:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
所述隔板温度指冷冻干燥机内的托盘隔板的温度,需要在所述托盘隔板上放置装有所述荧光pcr反应体系的微芯片;预冻阶段这一步的作用在于使荧光pcr反应体系能保持固体状态。“对设备抽真空,保持冷冻干燥1h”这一步的主要目的是真空冷冻干燥机,需要把内部空气抽干,使固体中的水分升华,从而达到冻干效果。接下来的2步“将隔板温度升至-25℃保持1h”和“将隔板温度升至37℃并保持2h”均为了保持干燥升华过程;最后“将隔板降至25℃并保持1h”的作用是将冻干成品在25℃并保持稳定,至此,基本完成了整个冻干过程。
上述“设备冻干”过程是本发明针对装有所述荧光pcr反应体系的微芯片独创的一套冻干工艺。由于冻干试剂共晶点不同,需要进行分别测定,而且干燥过程中的升温时间、干燥时间中的干燥时间需要进行优化。冻干试剂里面的组分对共晶点的影响都需要调整试剂组分浓度来摸索。特别是反应体系里的酶,在常温长时间放置,酶的活性是会降低的,需要加入保护剂和稳定剂组分,例如海藻糖5μm;tris-cl5mm,而且其浓度对pcr反应是否有抑制需要通过实验验证和调整,才能保证冻干微芯片用来进行荧光pcr检测时获得本发明记载的优良的高灵敏度、高重复性、高准确性、高特异性等优异效果。另外,还需要同时兼顾冻干工艺冻干后使用稀释液的复溶效果,这也需要经过调整冻干工艺的才能使冻干微芯片的达到最终的本发明的检测方法获得的高灵敏度、高重复性、高准确性、高特异性等优异效果。
本领域技术人员可根据本发明的公开,人工合成所述引物,将它们用来定性或定量检测16种猪病病原,能获得如本发明所述的预期效果,因此任何基于商业目的合成的引物,并将其放入标有“检测16种猪病病原”用途的商品包装盒内的行为,或采用上述序列的引物用于商业检测16种猪病病原的行为,均落入本发明请求保护的范围。
第2组实施例:本发明的试剂盒
本组实施例提供一种用于鉴别16种猪病病原的试剂盒,包括第1组实施例任一项所述的冻干微芯片。
所述稀释液具体为pcr10×buffer,具体成分不含mg2+,含500mmkcl,100mmtris-hcl,0.1%明胶,该稀释液可商购获得。使用无核酸酶水稀释后,用于滴入冻干微芯片的加样孔中,再将冻干微芯片置于荧光pcr仪上进行荧光pcr扩增。
在更进一步的实施例中,所述试剂盒还包括:矿物油,用于对所述微芯片上的加样孔进行封闭,由于体系非常微量,不封油很容易风干,封油相当于盖住pcr管的管盖,使样本不容易污染。
在具体的实施例中,所述探针的核苷酸序列的3'端标记mgb淬灭基团,5'端标记fam或rox荧光报告基团。上述“mgb”、“fam”和“rox”基团均为本领域常见的荧光基团,本领域技术人员还可以选用其它本领域常见的荧光淬灭基团和荧光报告基团来替换本文的“mgb”、“fam”和“rox”,例如,常见的荧光淬灭基团还包括:bhq-1、bhq-2、dabcyl2;常见的荧光报告基团还可以选自:tet、hex、5-tamra、texasred-x、cy3(tyetm563)、cy5(tyetm665)、joe。
在进一步的实施例中,所述试剂盒还包括用于进行荧光定量pcr检测的ariaysb微芯片及常规试剂。
所述冻干微芯片试剂还包括dna聚合酶、反转录酶、dntp、mg2+、海藻糖、tris-cl。
在优选的实施例中,所述常规试剂包括dna聚合酶、反转录酶、dntp、mg2+、海藻糖、tris-cl;和/或,包括所述矿物油、稀释液、双蒸水在内的商品化分子试剂;
在进一步优选的实施例中,所述商品化稀释液为10×buffer(不含mg2+),使用无核酸酶水稀释为2×buffer和1×buffer。本领域商品化的dna聚合酶、反转录酶、dntp、10×buffer还有多种,本领域技术人员可以选用其它品牌和其它类型的分子试剂。
第3组实施例:本发明的检测方法
本组实施例提供一种用于鉴别高致病性16种猪病病原的冻干微芯片荧光rt-pcr检测方法。本组所有实施例都具有如下特征:所述方法包括:采用第1组实施例任一所述的冻干微芯片,和/或,第2组实施例任一所述的试剂盒对待测样品进行荧光pcr扩增。
在一些实施例中,在冻干微芯片的加样孔中加入待测样品及稀释液后,将冻干微芯片置于荧光pcr仪上进行所述荧光pcr扩增;
优选地,所述稀释液1×buffer阳性对照和阴性对照孔加入量为2μl。稀释液2×buffer与核酸提取物按1:1混合,加入量为2μl;
进一步优选地,所述荧光pcr扩增的反应程序为:50℃10min;95℃1min;以95℃5s,60℃15s为1个循环,进行40个循环,每个循环的延伸结束时进行荧光信号检测。
在一些实施例中,所述检测指荧光定量pcr检测;所述16种猪病病原的冻干微芯片包括:上游引物0.4μm;下游引物0.4μm;taqman探针0.4μm;dna聚合酶0.5u/μl;反转录酶0.5u/μl;dntp0.3mm;mg2+3mm;海藻糖5μm;tris-cl5mm;若为阳性对照孔有5ng/μl相应病原dna或cdna;余量为灭菌去离子水,总体积为2μl。
所述荧光定量pcr的冻干微芯片的整个冻干微芯片上样孔为24个,将上述荧光pcr反应体系分为8组,分别包含猪口蹄疫病毒和猪流行性腹泻病毒2种引物探针,猪传染性胃肠炎病毒和猪冠状病毒2种引物探针,猪乙型脑炎病毒和猪肺炎支原体2种引物探针,猪轮状病毒和猪瘟病毒2种引物探针,猪流感病毒和猪细小病毒2种引物探针,猪圆环病毒和猪伪狂犬病毒2种引物探针,猪胸膜肺炎放线杆菌和猪链球菌2种引物探针,副猪嗜血杆菌和猪衣原体2种引物探针。
所述冻干微芯片分为阳性对照孔,样本孔和阴性对照孔。其中,阳性对照孔还包括样品dna/cdna。
所述每个微芯片孔总体积为2μl。
在一些实施例中,所述冻干条件为荧光定量pcr的冻干微芯片先于-80℃冷冻1h。设备冻干条件为:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
在进一步的实施例中,所述荧光定量pcr的反应程序包括:50℃10min,为第一步循环;95℃1min,为第二步循环;95℃5s,60℃15s,为第三步40个循环,所述第三步每个循环的延伸结束时进行荧光信号检测。
实验例116种猪病病原冻干微芯片荧光rt-pcr检测试剂盒特异性验证
1、设计引物和taqman-mgb探针
根据国内已发现的猪口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体病原保守基因设计多对引物和探针。经过比对筛选,最终各确定一组最佳引物和一条taqman-mgb探针。
fmdv-f:5’-ggccgagaccacaaatgtg-3’;
fmdv-r:5’-tcggccttgccatgtgtaa-3’;
fmdv-taqman:5’-agggatgggtctgctt-3’;
pedv-f:5’-gcaaatacattggcagcataacc-3’;
pedv-r:5’-tgctggtgaggatggtctttc-3’;
pedv-taqman:5’-atgcaattagctgtacagtgt-3’;
tegv-f:5’-tggtgagcccttgcaaatg-3’;
tegv-r:5’-cagttacaacaacccgcaatttt-3’;
tegv-taqman:5’-taatagcaccttcagcagaat-3’;
dcv-f:5’-agccacccaccaaaccaa-3’;
dcv-r:5’-tgggtttagcagactggtcttgt-3’;
dcv-taqman:5’-aggacaagaagcctgac-3’;
jev-f:5’-cgcggaccaggcattc-3’;
jev-r:5’-gaactctccccatgtgtttgga-3’;
jev-taqman:5’-aagcgaagcaggagat-3’;
mhp-f:5’-tgaccgtcttaactcgccaaat-3’;
mhp-r:5’-ggcggtagggaattaaaactattg-3’;
mhp-taqman:5’-cgcaagtcttgataaaa-3’;
prtv-f:5’-tttgtttacattgactactgggatgat-3’;
prtv-r:5’-agcagcaagtgaccgaacatatac-3’;
prtv-taqman:5’-acaagcattcagaaaca-3’;
csfv-f:5’-tttgcgtggcaggttcct-3’;
csfv-r:5’-aatgatgccaaatacctcctactga-3’;
csfv-taqman:5’-aaagtcacagcacttaat-3’;
siv-f:5’-ccgaaatcgcgcagaga-3’;
siv-r:5’-catgagagcctcaagatctgtgtt-3’;
siv-taqman:5’-tgaagatgtctttgctggaa-3’;
ppv-f:5’-gcagctaacacaagaaaaggttatcac-3’;
ppv-r:5’-cctgagctggcctaattgct-3’;
ppv-taqman:5’-taatagctacacagaagcaa-3’;
pcv-f:5’-tgagcgggaaaatgcagaa-3’;
pcv-r:5’-ccaggtggccccacaa-3’;
pcv-taqman:5’-tggaagacgaatgtacacg-3’;
prv-f:5’-cgtcgtgagcagcatgat-3’;
prv-r:5’-ccatgatgaccagcacgat-3’;
prv-taqman:5’-catcgggatcctggc-3’;
app-f:5’-ggtaccggtcttaggtatcattgaa-3’;
app-r:5’-cttcgtggtgaccgcaattt-3’;
app-taqman:5’-cgtgcatatctgcc-3’;
ss-f:5’-ttcgaagcaacgcgaagaa-3’;
ss-r:5’-cccatctctagggcggtcat-3’;
ss-taqman:5’-ccaggtcttgacatcc-3’;
hps-f:5’-gcggcaggcttaacacatg-3’;
hps-r:5’-cgtcagcaaagaaagcaagct-3’;
hps-taqman:5’-tcgaacggtagcaggga-3’;
sc-f:5’-cacagtccgttgtcgagcttta-3’;
sc-r:5’-gcggctctagcaccaacac-3’;
sc-taqman:5’-cagatactgcctttgctt-3’。
其中口蹄疫病毒、猪传染性胃肠炎病毒、猪乙型脑炎病毒、猪轮状病毒、猪流感病毒、猪圆环病毒、猪胸膜肺炎放线杆菌和副猪嗜血杆菌的taqman探针的核苷酸序列的5'端标记fam荧光报告基团;猪流行性腹泻病毒、猪冠状病毒、猪肺炎支原体、猪瘟病毒、猪细小病毒、猪伪狂犬病毒、猪链球菌和猪衣原体taqman探针的核苷酸序列的5'端标记rox荧光报告基团。3'端标记mgb淬灭荧光基团。淬灭荧光基团选择mgb的原因在于,taqman-mgb探针与传统的taqman-tamra探针比较具有以下优势:(1)提高tm值--平均15bases可提高18℃,这样可以使探针的长度缩短,尤其对at含量高的序列设计有很大的帮助,并且提高配对与非配对模板间的tm值差异。(2)提高信噪比--由于在探针的3'端的淬灭基团为不发光的荧光基团,并且与报告基团在空间的位置更接近,实验结果更精确,分辨率更高。
2、样本核酸提取
利用总dna/rna提取试剂盒(北京亿森宝生物科技有限公司,货号ear005)提取口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌和猪衣原体核酸。放置于-20℃备用。
3、冻干微芯片制备
按照如下反应体系分别进行8组冻干微芯片rt-pcr体系配制,即猪口蹄疫病毒和猪流行性腹泻病毒,猪传染性胃肠炎病毒和猪冠状病毒,猪乙型脑炎病毒和猪肺炎支原体,猪轮状病毒和猪瘟病毒,猪流感病毒和猪细小病毒,猪圆环病毒和猪伪狂犬病毒,猪胸膜肺炎放线杆菌和猪链球菌,副猪嗜血杆菌和猪衣原体冻干微芯片rt-pcr体系:
荧光定量pcr的ariaysb微芯片(北京亿森宝生物科技有限公司)的整个冻干微芯片上样孔为24个,将上述荧光定量pcr阳性对照孔、样本孔和阴性对照孔冻干微芯片rt-pcr体系(包含2种引物探针)各2μl分别加入阳性对照孔、样本孔和阴性对照孔。
将包被有pcr试剂的微芯片先于-80℃冷冻1h。设备冻干条件为:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
4、冻干微芯片特异性验证
取冻干微芯片,将冻干微芯片稀释液,即使用taqbuffer(10×),withkcl,(thermoscientific,货号b650060),加入无核酸酶水稀释为2×buffer和1×buffer。阳性对照和阴性对照孔每孔加入1×buffer2μl。样本孔每孔加入2×buffer1μl。在微芯片表面加入600μl矿物油,待其覆盖所有上样孔后。分别将口蹄疫病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体酸提取物取1μl加入16种猪病病原冻干微芯片的样本孔内。
冻干微芯片荧光rt-pcr反应条件如下:50℃10min,为第一步循环;95℃1min,为第二步循环;95℃5s,60℃15s,为第三步40个循环,所述第三步每个循环的延伸结束时进行fam和rox通道荧光信号检测。
冻干微芯片包被的是16种猪病病原双重荧光rt-pcr试剂特异性实验结果。对猪口蹄疫病毒的特异性检测如图1至图3,图1结果显示fam通道检测猪口蹄疫病毒阳性对照和猪口蹄疫病毒rna有扩增,ct值分别为20.56,24.93有扩增曲线,阴性对照无扩增。图2结果显示fam通道检测猪口蹄疫病毒阳性对照有扩增,ct值为20.07,猪流行性腹泻病毒rna和阴性对照无扩增。图3结果显示fam通道检测猪口蹄疫病毒阳性对照有扩增,ct值为20.74,猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体、猪蓝耳病毒和阴性对照无扩增。对猪流行性腹泻病毒的特异性检测如图4至图6,图4结果显示rox通道检测猪流行性腹泻病毒阳性对照和猪传染性胃肠炎病毒rna有扩增,ct值分别为22.77,18.40有扩增曲线,阴性对照无扩增。图5结果显示rox通道检测猪流行性腹泻病毒阳性对照有扩增,ct值为22.20,猪口蹄疫病毒rna和阴性对照无扩增。图6结果显示rox通道检测猪流行性腹泻病毒阳性对照有扩增,ct值为22.47,猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体、猪蓝耳病毒和阴性对照无扩增。
本发明对其它14种猪病病原(猪传染性胃肠炎病毒、猪冠状病毒、猪乙型脑炎病毒、猪肺炎支原体、猪轮状病毒、猪瘟病毒、猪流感病毒、猪细小病毒、猪圆环病毒、猪伪狂犬病毒、猪胸膜肺炎放线杆菌、猪链球菌、副猪嗜血杆菌、猪衣原体病原)的特异性检测的扩增曲线与图1至图6扩增曲线形态基本一致,为节约篇幅,本发明不再一一罗列。对猪传染性胃肠炎病毒的特异性检测结果显示fam通道检测猪传染性胃肠炎病毒阳性对照和猪传染性胃肠炎病毒rna有扩增,ct值分别为19.73,24.00有扩增曲线其他病原和阴性对照无扩增。对猪流行性腹泻病毒的特异性结果显示rox通道检测猪冠状病毒阳性对照和猪冠状病毒dna有扩增,ct值分别为21.15,28.72有扩增曲线,其他病原和阴性对照无扩增。对猪乙型脑炎病毒的特异性检测结果显示fam通道检测猪乙型脑炎病毒阳性对照和猪乙型脑炎病毒rna有扩增,ct值分别为22.95,27.83有扩增曲线,其他病原和阴性对照无扩增。对猪肺炎支原体的特异性检测结果显示rox通道检测猪肺炎支原体阳性对照和猪肺炎支原体dna有扩增,ct值分别为21.64,27.42有扩增曲线,其他病原和阴性对照无扩增。对猪轮状病毒的特异性检测结果显示fam通道检测猪轮状病毒阳性对照和猪轮状病毒rna有扩增,ct值分别为19.76,21.58有扩增曲线,其他病原和阴性对照无扩增。对猪瘟病毒的特异性检测结果显示rox通道检测猪瘟病毒阳性对照和猪瘟病毒rna有扩增,ct值分别为19.51,23.89有扩增曲线,其他病原和阴性对照无扩增。对猪流感病毒的特异性检测结果显示fam通道检测猪流感病毒阳性对照和猪流感病毒rna有扩增,ct值分别为18.30,15.83有扩增曲线,其他病原和阴性对照无扩增。对猪细小病毒的特异性检测结果显示rox通道检测猪细小病毒阳性对照和猪细小病毒dna有扩增,ct值分别为17.39,16.09有扩增曲线,其他病原和阴性对照无扩增。对猪圆环病毒的特异性检测结果显示fam通道检测猪圆环病毒阳性对照和猪圆环病毒dna有扩增,ct值分别为17.84,23.90有扩增曲线,其他病原和阴性对照无扩增。对猪伪狂犬病毒的特异性检测结果显示rox通道检测猪伪狂犬病毒阳性对照和猪伪狂犬病毒dna有扩增,ct值分别为18.11,23.27有扩增曲线,其他病原和阴性对照无扩增。对猪胸膜肺炎放线杆菌的特异性检测结果显示fam通道检测猪胸膜肺炎放线杆菌阳性对照和猪胸膜肺炎放线杆菌dna有扩增,ct值分别为18.83,16.67有扩增曲线,其他病原和阴性对照无扩增。对猪链球菌的特异性检测结果显示rox通道检测猪链球菌阳性对照和猪链球菌dna有扩增,ct值分别为17.10,18.93有扩增曲线,其他病原和阴性对照无扩增。对副猪嗜血杆菌的特异性检测结果显示fam通道检测副猪嗜血杆菌阳性对照和副猪嗜血杆菌dna有扩增,ct值分别为19.19,19.54有扩增曲线,其他病原和阴性对照无扩增。对猪衣原体的特异性检测结果显示rox通道检测猪衣原体阳性对照和猪衣原体dna有扩增,ct值分别为20.10,26.06有扩增曲线,其他病原和阴性对照无扩增。所得结果与预期完全吻合。
实验例2、16种猪病病原冻干微芯片荧光rt-pcr检测试剂盒与常规荧光rt-pcr试剂敏感性验证和比较
将浓度为1×107tcid50/ml的猪口蹄疫病毒液进行10倍梯度稀释。提取1×106tcid50/ml~1×100tcid50/ml各梯度浓度猪口蹄疫病毒的基因组rna作为模板,无核酸酶水作为阴性对照,进行冻干微芯片荧光rt-pcr试剂和常规荧光rt-pcr试剂检测猪口蹄疫病毒通用敏感性检测。
按照如下反应体系进行冻干微芯片rt-pcr体系a配制:
荧光定量pcr的ariaysb微芯片(北京亿森宝生物科技有限公司)的整个冻干微芯片上样孔为24个,将上述荧光定量pcr阳性对照孔、样本孔和阴性对照孔冻干微芯片rt-pcr体系(包含2种引物探针)各2μl分别加入阳性对照孔、样本孔和阴性对照孔。
将包被有pcr试剂的微芯片先于-80℃冷冻1h。设备冻干条件为:预冻阶段,隔板温度下降到-55℃,预冻时保持时间为1h,然后设备进行抽真空,保持冷冻干燥1h;解析干燥阶段,再将隔板温度升至-25℃保持1h,然后将隔板温度升至37℃并保持2h,最后将隔板降至25℃并保持1h。
荧光定量pcr的ariaysb微芯片(北京亿森宝生物科技有限公司)的整个冻干微芯片上样孔为24个,将上述冻干微芯片阳性对照孔和阴性对照孔(包含猪口蹄疫病毒和猪流行性腹泻病毒2种引物探针)加入2μl1×buffer。在微芯片表面加入600μl矿物油,待其覆盖所有上样孔。并样本孔中分别加入1×106tcid50/ml~1×100tcid50/ml各梯度浓度猪口蹄疫病毒的基因组rna。
冻干微芯片荧光rt-pcr反应条件如下:50℃10min,为第一步循环;95℃1min,为第二步循环;95℃5s,60℃15s,为第三步40个循环,所述第三步每个循环的延伸结束时进行fam通道荧光信号检测。
常规荧光rt-pcr试剂体系配制:
常规荧光rt-pcr如下:50℃30min,为第一步循环;95℃5min,为第二步循环;95℃15s,60℃45s,为第三步40个循环,所述第三步每个循环的延伸结束时进行fam通道荧光信号检测。
图7结果显示,冻干微芯片荧光rt-pcr,最低检测样本浓度为1×101tcid50/ml,ct值为31.56,因此反应循环数40可大大满足最低检测要求。从不同浓度起始模板的扩增曲线可以看出,曲线基线平整,指数区明显,斜率较大,这些均说明在该条件下模板的扩增是较为理想的。图8结果显示,常规荧光rt-pcr最低检测样本浓度为1×102tcid50/ml,ct值为32.56。结果表明,冻干微芯片荧光rt-pcr检测的敏感性比常规荧光rt-pcr检测的敏感性高(约高10倍左右)。由于ct值与起始模板的对数存在线性关系,可利用ct值和模板其实浓度制作标准曲线,列出线性关系方程。图9和图10结果显示,冻干微芯片荧光rt-pcr扩增效率为118.78%,常规荧光rt-pcr扩增效率为98.88%,冻干微芯片荧光rt-pcr扩增效率更高。两者的标准曲线公式及相关系数都较为接近。冻干微芯片荧光rt-pcr的相关系数为0.998,常规荧光rt-pcr相关系数为0.996,所以冻干微芯片荧光rt-pcr的相关性更好一些。冻干微芯片荧光rt-pcr反应体系为2μl,常规荧光rt-pcr体系为25μl,冻干微芯片荧光rt-pcr反应体系缩小了20多倍。冻干微芯片荧光rt-pcr反应运行时间不到40分钟,常规荧光rt-pcr反应时间为120分钟,运行时间缩短2/3。
实验例3:16种猪病病原冻干微芯片荧光rt-pcr检测试剂盒的制备及检测
1、试剂盒的制备:
冻干微芯片荧光rt-pcr体系按实施例1进行制备。
试剂1:稀释液taqbuffer(10×)(thermoscientific,货号b650060),5μl
试剂2:矿物油(sangonbiotech,货号a630217)1ml
试剂3:无核酸酶50μl。
2、试剂盒的重复性分析
选取3个已知阳性的样品,分别进行批间重复检测。批间重复实验:将3个已知阳性样品分批次检测,每个样品单独检测。
试剂1使用前需使用试剂3将其稀释成2×buffer和1×buffer,阳性对照和阴性对照孔每孔加入1×buffer2μl;在微芯片表面加入600μl试剂2,待其覆盖所有上样孔。样本孔需将2×buffer和样品核酸按1:1混合后,样本孔每孔加入2μl。
冻干微芯片荧光rt-pcr反应条件如下:50℃10min,为第一步循环;95℃1min,为第二步循环;95℃5s,60℃15s,为第三步40个循环,所述第三步每个循环的延伸结束时进行荧光信号检测,并记录实验结果。
从表1中的检测结果可以看出批间变异系数在0.25%~1.95%之间,说明本试剂盒重复性良好。
表1试剂盒重复性分析
由于采用了以上技术方案,本发明通过设计特异性引物和探针并优化微芯片冻干条件,发展了能够快速、有效地检测16种猪病病原的微芯片荧光定量pcr检测的反应体系,同时制备了基于该方法的检测试剂盒,所述检测方法准确性、特异性和敏感性高,所述检测试剂盒重复性好。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,本领域技术人员利用上述揭示的技术内容做出些许简单修改、等同变化或修饰,均落在本发明的保护范围内。
sequencelisting
<110>北京亿森宝生物科技有限公司
中国动物疫病预防控制中心
<120>用于鉴别16种猪病病原冻干微芯片、试剂盒及方法
<130>p180497/ysb
<160>48
<170>patentinversion3.5
<210>1
<211>19
<212>dna
<213>artificialsequence
<220>
<223>fmdv-f
<400>1
ggccgagaccacaaatgtg19
<210>2
<211>19
<212>dna
<213>artificialsequence
<220>
<223>fmdv-r
<400>2
tcggccttgccatgtgtaa19
<210>3
<211>16
<212>dna
<213>artificialsequence
<220>
<223>fmdv-taqman
<400>3
agggatgggtctgctt16
<210>4
<211>23
<212>dna
<213>artificialsequence
<220>
<223>pedv-f
<400>4
gcaaatacattggcagcataacc23
<210>5
<211>21
<212>dna
<213>artificialsequence
<220>
<223>pedv-r
<400>5
tgctggtgaggatggtctttc21
<210>6
<211>21
<212>dna
<213>artificialsequence
<220>
<223>pedv-taqman
<400>6
atgcaattagctgtacagtgt21
<210>7
<211>19
<212>dna
<213>artificialsequence
<220>
<223>tegv-f
<400>7
tggtgagcccttgcaaatg19
<210>8
<211>23
<212>dna
<213>artificialsequence
<220>
<223>tegv-r
<400>8
cagttacaacaacccgcaatttt23
<210>9
<211>21
<212>dna
<213>artificialsequence
<220>
<223>tegv-taqman
<400>9
taatagcaccttcagcagaat21
<210>10
<211>18
<212>dna
<213>artificialsequence
<220>
<223>dcv-f
<400>10
agccacccaccaaaccaa18
<210>11
<211>23
<212>dna
<213>artificialsequence
<220>
<223>dcv-r
<400>11
tgggtttagcagactggtcttgt23
<210>12
<211>17
<212>dna
<213>artificialsequence
<220>
<223>dcv-taqman
<400>12
aggacaagaagcctgac17
<210>13
<211>16
<212>dna
<213>artificialsequence
<220>
<223>jev-f
<400>13
cgcggaccaggcattc16
<210>14
<211>22
<212>dna
<213>artificialsequence
<220>
<223>jev-r
<400>14
gaactctccccatgtgtttgga22
<210>15
<211>16
<212>dna
<213>artificialsequence
<220>
<223>jev-taqman
<400>15
aagcgaagcaggagat16
<210>16
<211>22
<212>dna
<213>artificialsequence
<220>
<223>mhp-f
<400>16
tgaccgtcttaactcgccaaat22
<210>17
<211>24
<212>dna
<213>artificialsequence
<220>
<223>mhp-r
<400>17
ggcggtagggaattaaaactattg24
<210>18
<211>17
<212>dna
<213>artificialsequence
<220>
<223>mhp-taqman
<400>18
cgcaagtcttgataaaa17
<210>19
<211>27
<212>dna
<213>artificialsequence
<220>
<223>prtv-f
<400>19
tttgtttacattgactactgggatgat27
<210>20
<211>24
<212>dna
<213>artificialsequence
<220>
<223>prtv-r
<400>20
agcagcaagtgaccgaacatatac24
<210>21
<211>17
<212>dna
<213>artificialsequence
<220>
<223>prtv-taqman
<400>21
acaagcattcagaaaca17
<210>22
<211>18
<212>dna
<213>artificialsequence
<220>
<223>csfv-f
<400>22
tttgcgtggcaggttcct18
<210>23
<211>25
<212>dna
<213>artificialsequence
<220>
<223>csfv-r
<400>23
aatgatgccaaatacctcctactga25
<210>24
<211>18
<212>dna
<213>artificialsequence
<220>
<223>csfv-taqman
<400>24
aaagtcacagcacttaat18
<210>25
<211>17
<212>dna
<213>artificialsequence
<220>
<223>siv-f
<400>25
ccgaaatcgcgcagaga17
<210>26
<211>24
<212>dna
<213>artificialsequence
<220>
<223>siv-r
<400>26
catgagagcctcaagatctgtgtt24
<210>27
<211>20
<212>dna
<213>artificialsequence
<220>
<223>siv-taqman
<400>27
tgaagatgtctttgctggaa20
<210>28
<211>27
<212>dna
<213>artificialsequence
<220>
<223>ppv-f
<400>28
gcagctaacacaagaaaaggttatcac27
<210>29
<211>20
<212>dna
<213>artificialsequence
<220>
<223>ppv-r
<400>29
cctgagctggcctaattgct20
<210>30
<211>20
<212>dna
<213>artificialsequence
<220>
<223>ppv-taqman
<400>30
taatagctacacagaagcaa20
<210>31
<211>19
<212>dna
<213>artificialsequence
<220>
<223>pcv-f
<400>31
tgagcgggaaaatgcagaa19
<210>32
<211>16
<212>dna
<213>artificialsequence
<220>
<223>pcv-r
<400>32
ccaggtggccccacaa16
<210>33
<211>19
<212>dna
<213>artificialsequence
<220>
<223>pcv-taqman
<400>33
tggaagacgaatgtacacg19
<210>34
<211>18
<212>dna
<213>artificialsequence
<220>
<223>prv-f
<400>34
cgtcgtgagcagcatgat18
<210>35
<211>19
<212>dna
<213>artificialsequence
<220>
<223>prv-r
<400>35
ccatgatgaccagcacgat19
<210>36
<211>15
<212>dna
<213>artificialsequence
<220>
<223>prv-taqman
<400>36
catcgggatcctggc15
<210>37
<211>25
<212>dna
<213>artificialsequence
<220>
<223>app-f
<400>37
ggtaccggtcttaggtatcattgaa25
<210>38
<211>20
<212>dna
<213>artificialsequence
<220>
<223>app-r
<400>38
cttcgtggtgaccgcaattt20
<210>39
<211>14
<212>dna
<213>artificialsequence
<220>
<223>app-taqman
<400>39
cgtgcatatctgcc14
<210>40
<211>19
<212>dna
<213>artificialsequence
<220>
<223>ss-f
<400>40
ttcgaagcaacgcgaagaa19
<210>41
<211>20
<212>dna
<213>artificialsequence
<220>
<223>ss-r
<400>41
cccatctctagggcggtcat20
<210>42
<211>16
<212>dna
<213>artificialsequence
<220>
<223>ss-taqman
<400>42
ccaggtcttgacatcc16
<210>43
<211>19
<212>dna
<213>artificialsequence
<220>
<223>hps-f
<400>43
gcggcaggcttaacacatg19
<210>44
<211>21
<212>dna
<213>artificialsequence
<220>
<223>hps-r
<400>44
cgtcagcaaagaaagcaagct21
<210>45
<211>17
<212>dna
<213>artificialsequence
<220>
<223>hps-taqman
<400>45
tcgaacggtagcaggga17
<210>46
<211>22
<212>dna
<213>artificialsequence
<220>
<223>sc-f
<400>46
cacagtccgttgtcgagcttta22
<210>47
<211>19
<212>dna
<213>artificialsequence
<220>
<223>sc-r
<400>47
gcggctctagcaccaacac19
<210>48
<211>18
<212>dna
<213>artificialsequence
<220>
<223>sc-taqman
<400>48
cagatactgcctttgctt18
- 还没有人留言评论。精彩留言会获得点赞!