高通量多组学样品分析的制作方法
高通量多组学样品分析
相关申请
[0001]
本申请要求2018年5月3日提交的美国临时申请号62/666,483的权益,将其通过引用以其全部内容并入本文。
技术领域
[0002]
本披露内容一般涉及分子生物学领域,特别涉及使用分子条形码化对细胞的多组学分析。
背景技术:
[0003]
诸如分子条形码化的方法和技术对于单细胞转录组学分析是有用的,特别是使用例如逆转录、聚合酶链式反应(pcr)扩增、和下一代测序(ngs)来解密基因表达谱以确定细胞的状态。分子条形码化还可用于单细胞蛋白质组学分析。需要对单细胞进行多组学分析的方法和技术。
技术实现要素:
[0004]
本文披露包括样品分析方法的实施例。例如,样品分析可以包括单细胞分析,基本上由单细胞分析组成,或由单细胞分析组成。在一些实施例中,所述方法包括:使来自细胞的双链脱氧核糖核酸(dsdna)(例如基因组dna(gdna))与转座体(transposome)接触,无论所述gdna是否在细胞、细胞的细胞器(例如细胞核或线粒体)、或接触期间的细胞级分或提取物中。转座体可以包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶(例如转座酶)和具有包含捕获序列的5
’
突出端的衔接子的两个拷贝,以产生多个突出dsdna片段,每个突出dsdna片段包含所述5
’
突出端的两个拷贝。所述方法可以包括使用多个条形码对所述多个突出dsdna片段进行条形码化以产生多个经条形码化的dna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列,其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列。所述方法可以包括检测所述多个经条形码化的dna片段的序列。所述方法可以包括基于测序数据中的多个经条形码化的dna片段的序列确定将dsdna序列与包含dsdna的结构相关的信息。所述方法还可以包括使所述多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端的至少一部分互补的序列;并且变性所述多个互补dsdna片段以产生多个单链dna(ssdna)片段,其中所述ssdna片段被条形码化,从而条形码化所述dna片段。在一些实施例中,dsdna包括gdna,基本上由gdna组成,或由gdna组成。在本文所述的任何样品分析方法中,转座体可以靶向包含dsdna的特定结构,例如染色质、特定dna甲基化状态、特定细胞器中的dna等。可以设想,样品分析方法可以鉴定与转座体靶向的结构相关的特定dna序列,例如染色质可接近的dna、构建体dna、细胞器dna等。
[0005]
在一些实施例中,样品分析的方法包括:从dsdna产生多个核酸片段(例如,在接触
过程中来自细胞的gdna,无论所述gdna是在细胞中还是在所述细胞的细胞核中),其中所述多个核酸片段中的每个包含捕获序列,所述捕获序列的互补序列、所述捕获序列的反向互补序列或其组合;使用多个条形码对所述多个核酸片段进行条形码化以产生多个经条形码化的dna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列,其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列;并且检测所述多个经条形码化的dna片段的序列。所述方法可以进一步包括基于所述测序数据中的所述多个经条形码化的dna片段的序列确定将所述dsdna序列与包含所述dsdna的结构相关的信息。
[0006]
在一些实施例中,对于本文所述的任何样品分析方法,产生多个核酸片段可以包括:使所述dsdna与转座体接触,其中所述转座体包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶和包含所述捕获序列的衔接子的两个拷贝,以产生多个互补dsdna片段,每个互补dsdna片段包含与所述捕获序列互补的序列。双链核酸酶可加载有两个拷贝的衔接子。所述方法可以进一步包括使互补dsdna片段变性以产生多个单链dna(ssdna)片段。所述方法可以包括对多个ssdna片段进行条形码化,从而产生多个经条形码化的dna片段。所述方法可以进一步包括使经条形码化的dna片段变性以产生经条形码化的单链dna(ssdna)片段。
[0007]
在一些实施例中,对于本文所述的任何样品分析方法,产生多个核酸片段可以包括:使所述dsdna与转座体接触,其中所述转座体包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶和具有包含捕获序列的5
’
突出端的衔接子的两个拷贝,以产生多个突出dsdna片段,每个突出dsdna片段具有所述5
’
突出端的两个拷贝;并且使具有5
’
突出端的多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端的至少一部分互补的序列。双链核酸酶可加载有两个拷贝的衔接子。所述方法可以进一步包括使互补dsdna片段变性以产生多个单链dna(ssdna)片段。所述方法可以包括对ssdna片段进行条形码化,从而产生经条形码化的dna。所述方法可以进一步包括使经条形码化的dna片段变性以产生经条形码化的单链dna(ssdna)片段。在一些实施例中,对于本文所述的任何样品分析方法,经条形码化的dna片段可以是ssdna片段。
[0008]
在一些实施例中,对于本文所述的任何样品分析方法,多个互补dsdna片段都不包含突出端(例如3
’
突出端或5
’
突出端)。在一些实施例中,对于本文所述的任何样品分析方法,衔接子可包含转座子的dna末端序列。举例来说,配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶可以包含转座酶,例如tn5转座酶。本文描述了其他合适的转座酶的实例。在一些实施例中,对于本文所述的任何样品分析方法,多个互补dsdna片段各自包含平末端。
[0009]
在一些实施例中,对于本文所述的任何样品分析方法,产生多个核酸片段包括:使dsdna片段化以产生多个dsdna片段。使dsdna片段化可以包括使dsdna与限制性内切酶接触以产生各自具有一个或两个平末端的多个dsdna片段。在一些实施例中,多个dsdna片段中的至少一个可以包含平末端。在一些实施例中,多个dsdna片段中的至少一个可以包含5
’
突出端和/或3
’
突出端。在一些实施例中,多个dsdna片段都不包含平末端。
[0010]
在一些实施例中,对于本文所述的任何样品分析方法,使dsdna片段化可以包括使dsdna与crispr相关联蛋白(例如,cas9或cas12a)接触以产生多个dsdna片段。举例来说,与
靶dna基序或序列互补的指导rna可用于靶向crispr相关联蛋白,以在靶dna基序或序列处产生双链dna断裂。
[0011]
在一些实施例中,对于本文所述的任何样品分析方法,产生多个核酸片段包括:将包含与捕获序列互补的序列的衔接子的两个拷贝附加到多个dsdna片段中的至少一个上以产生多个dsdna片段。例如,衔接子可以通过如本文所述的转座酶附加。例如,附加衔接子的两个拷贝可以包括将衔接子的两个拷贝与多个dsdna片段中的至少一个连接以产生包含衔接子的多个dsdna片段。
[0012]
在一些实施例中,对于本文所述的任何样品分析方法,捕获序列均包含聚(dt)区。与捕获序列互补的序列可以包含聚(da)区。
[0013]
在一些实施例中,对于本文所述的任何样品分析方法,使dsdna片段化可以包括使dsdna与限制性内切酶接触以产生多个dsdna片段,其中所述多个dsdna片段中的至少一个包含捕获序列。捕获序列可以与5
’
突出端的序列互补。与捕获序列互补的序列可以包含5
’
突出端的序列。在一些实施例中,捕获序列包括不包含三个、四个、五个、六个或更多个连续的t的序列。例如,捕获序列可以包含靶dsdna的一条或两条链的特征性序列。
[0014]
在一些实施例中,对于本文所述的任何样品分析方法,dsdna在细胞的细胞器内部,例如细胞核内。所述方法可以包括例如通过使用去污剂(诸如triton x-100)来透化核以产生透化的细胞核。所述方法可以包括在透化细胞核之前固定包含细胞核的细胞。在一些实施例中,对于本文所述的任何样品分析方法,dsdna在细胞核、核仁、线粒体或叶绿体中的至少一个的内部。在一些实施例中,dsdna选自由以下组成的组:核dna(例如,作为染色质的一部分)、核仁dna、基因组dna、线粒体dna、叶绿体dna、构建体dna、病毒dna或所列项中两个或更多个的组合。构建体dna的实例可以包括质粒、克隆载体、表达载体、杂合载体、小环、粘粒、病毒载体、bac、yac和hac。举例来说,可以将病毒dna插入存在于外基因组dna中的宿主基因组中。例如,本文所述的样品分析方法可以定量细胞的一个或多个细胞器中的dna或dna类别。例如,本文所述的样品分析方法可以定量细胞中的病毒dna或dna的病毒载量。例如,本文所述的样品分析方法可以定量细胞中的构建体dna(例如,质粒、克隆载体、表达载体、杂合载体、小环、粘粒、病毒载体、bac、yac和/或hac)。因此,预期所述方法可以产生有关包含dsdna的转座体可接近结构的信息。
[0015]
在一些实施例中,对于本文所述的任何样品分析方法,所述方法包括使所述多个核酸片段变性以产生多个ssdna片段,其中对所述多个核酸片段进行条形码化包括使用所述多个条形码对所述多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段。在一些实施例中,对于本文所述的任何样品分析方法,衔接子包含启动子序列。产生所述多个核酸片段可以包括使用体外转录来转录所述多个dsdna片段以产生多个核糖核酸(rna)分子,并且其中对所述多个核酸片段进行条形码化包括对所述多个rna分子进行条形码化。启动子序列可以包含t7启动子序列。
[0016]
在一些实施例中,对于本文所述的任何样品分析方法,确定与dsdna(例如gdna)相关的信息包括基于获得的测序数据中的多个经条形码化的dna片段的序列和/或丰度来确定dsdna(例如gdna)的染色质可接近性。确定dsdna的染色质可接近性可以包括:将多个经条形码化的dna片段的序列与dsdna(例如,gdna)的参考序列比对;鉴定dsdna的对应于多个ssdna片段的经条形码化的dna片段(例如,经条形码化的ssdna片段)的末端的区域达到阈
值以上的可接近性。确定dsdna(例如gdna)的染色质可接近性可以包括:将多个经条形码化的dna片段(例如,ssdna片段)的序列与dsdna(例如,gdna)的参照序列比对;并且根据测序数据中多个经条形码化的dna片段(例如经条形码化的ssdna片段)的经条形码化的dna片段(例如经条形码化的ssdna片段)的数量,确定与多个经条形码化的dna片段(例如经条形码化的ssdna片段)的经条形码化的dna片段(例如经条形码化的ssdna片段)的末端对应的dsdna(例如,gdna)区域的可接近性。
[0017]
在一些实施例中,对于本文所述的任何样品分析方法,确定与dsdna(例如,gdna)相关的信息包括基于获得的测序数据中的多个经条形码化的dna片段(例如,经条形码化的ssdna片段)的序列确定dsdna的基因组信息。样品分析方法可以包括消化与dsdna相关联的核小体。确定dsdna的基因组信息可以包括:通过将多个经条形码化的dna片段(例如,经条形码化的ssdna片段)的序列与dsdna的参考序列比对来确定dsdna的至少部分序列。
[0018]
在一些实施例中,对于本文所述的任何样品分析方法,确定将dsdna(例如,gdna)与包含dsdna的结构相关的信息包括基于获得的测序数据中的多个经条形码化的dna片段的序列确定dsdna(例如,gdna)的甲基化组信息。样品分析方法可以包括消化与dsdna相关联的核小体。所述样品分析方法可以包括对多个突出dna片段或多个核酸片段中的多个单链dna片段(例如,通过使突出dna片段或多个核酸变性获得)的胞嘧啶碱基进行亚硫酸氢盐转化以产生多个经亚硫酸氢盐转化的具有尿嘧啶碱基的ssdna。对多个突出dna片段进行条形码化或对多个核酸片段进行条形码化可以包括使用多个条形码对多个经亚硫酸氢盐转化的ssdna进行条形码化,以产生多个经条形码化的ssdna片段。确定甲基化组信息可以包括:确定测序数据中的多个经条形码化的dna片段(例如,经条形码化的ssdna片段)的位置具有胸腺嘧啶碱基,以及dsdna的参考序列中的相应位置具有胞嘧啶碱基,以确定dsdna中的相应位置具有甲基胞嘧啶碱基。
[0019]
在一些实施例中,对于本文所述的任何样品分析方法,条形码化包括:使用多个条形码对多个dna片段(例如,ssdna片段)或多个核酸进行随机地条形码化,以产生多个经随机条形码化的dna片段。条形码化可以包括:使用与颗粒相关联的多个条形码对多个dna片段(例如,ssdna片段)或多个核酸片段进行条形码化,以产生多个经条形码化的ssdna片段,其中与颗粒相关联的条形码包含相同的细胞标记序列和至少100个不同的分子标记序列。
[0020]
在一些实施例中,对于本文所述的任何样品分析方法,多个条形码中的至少一个条形码可以将固定在颗粒上。多个条形码中的至少一个条形码可以部分固定在颗粒上。多个条形码中的至少一个条形码可以被封闭在颗粒中。多个条形码中的至少一个条形码可以部分地封闭在颗粒中。颗粒可以是可破坏的。颗粒可以包含可破坏的水凝胶颗粒。颗粒可以包含交联琼脂糖(sepharose)珠、链霉亲和素珠、琼脂糖珠、磁性珠、缀合的珠、蛋白a缀合的珠、蛋白g缀合的珠、蛋白a/g缀合的珠、蛋白l缀合的珠、寡(dt)缀合的珠、二氧化硅珠、二氧化硅样珠、抗生物素微珠、抗荧光染料微珠或其任何组合。颗粒可以包含选自由以下组成的组的材料:聚二甲基硅氧烷(pdms)、聚苯乙烯、玻璃、聚丙烯、琼脂糖、明胶、水凝胶、顺磁体、陶瓷、塑料、玻璃、甲基苯乙烯、丙烯酸聚合物、钛、胶乳、交联琼脂糖、纤维素、尼龙、硅酮及其任何组合。在一些实施例中,对于本文所述的任何样品分析方法,可以将多个条形码中的至少一个条形码与其他条形码分配开。预期所述分配开可以包括,例如,将条形码放置在固体支持物上,如本文所述的颗粒,将条形码放置在诸如水凝胶滴的滴(例如,微滴)中,或在
基底的孔(例如微孔)中或流体装置(例如,微流体装置)的腔室。
[0021]
在一些实施例中,对于本文所述的任何样品分析方法,颗粒的条形码可包含具有至少1000个不同分子标记序列的分子标记。颗粒的条形码可包含具有至少10000个不同分子标记序列的分子标记。条形码的分子标记可以包含随机序列。颗粒可以包含至少10000个条形码。
[0022]
在本文所述的任何单细胞分析方法中,对多个突出dna片段或多个核酸片段进行条形码化可以包括:使多个ssdna(dna片段或核酸片段的ssdna)与多个条形码的捕获序列接触;使用所述多个条形码转录所述多个ssdna,以产生多个经条形码化的ssdna片段。样品分析方法可以包括:在获得所述多个经条形码化的ssdna片段的测序数据之前,扩增所述多个经条形码化的ssdna片段以产生多个经扩增的经条形码化的dna片段。扩增多个经条形码化的ssdna片段可以包括:通过聚合酶链反应(pcr)扩增所述经条码化的ssdna片段。
[0023]
在一些实施例中,本文所述的任何样品分析方法可以包括:使用所述多个条形码对所述细胞核的多个靶进行条形码化以产生多个经条形码化的靶;并且获得所述经条形码化的靶的测序数据。
[0024]
在一些实施例中,对于本文所述的任何样品分析方法,来自细胞的dsdna选自由以下组成的组:细胞核dna、核仁dna、基因组dna、线粒体dna、叶绿体dna、构建体dna、病毒dna或所列项中两个或更多个的组合。在一些实施例中,对于本文所述的任何样品分析方法,5
’
突出端包含聚dt序列。在一些实施例中,对于本文所述的任何样品分析方法,所述方法进一步包括在包含寡核苷酸的颗粒上捕获多个经条形码化的sdna片段中的ssdna片段,所述寡核苷酸包含捕获序列、细胞标记序列和分子标记序列,其中捕获序列包含与ssdna片段上的聚a尾结合的聚dt序列,所述捕获的ssdna片段包含甲基化胞苷,对ssdna片段进行二硫化物转化反应,以将甲基化胞苷转化为胸苷,使所述ssdna片段沿5
’
至3
’
方向延伸以产生经条形码化的包含胸苷的ssdna片段,所述经条形码的ssdna包含捕获序列、分子标记序列和细胞标记序列;使用逆转录酶或聚合酶或其组合使寡核苷酸沿5
’
至3
’
方向延伸,以产生与所述经条形码化的包含胸苷的ssdna互补的互补dna链;使所述经条形码化的ssdna和互补dna链变性以产生单链序列,并扩增所述单链序列。所述方法可以进一步包括确定测序数据中的多个ssdna片段的位置是否具有胸腺嘧啶碱基以及dsdna的参考序列中的相应位置是否具有胞嘧啶碱基,包括在二硫化物转化反应之后,确定胸腺嘧啶碱基在参考序列中的相应位置为胞嘧啶碱基。
[0025]
在一些实施例中,对于本文所述的任何样品分析方法,转座体的双链核酸酶选自由以下组成的组:转座酶、限制性内切核酸酶、crispr相关联蛋白、双链体特异性核酸酶或这些的组合。在一些实施例中,对于本文所述的任何样品分析方法,转座体进一步包含与包含dsdna的结构结合的抗体或其片段、适体或dna结合结构域。在一些实施例中,对于本文所述的任何样品分析方法,转座体进一步包含连接酶。
[0026]
在一些实施例中,描述了核酸试剂。核酸试剂可包含捕获序列、条形码、引物结合位点和双链dna结合剂。捕获序列可以包含聚(a)区。引物结合位点可包含通用引物结合位点。核酸试剂可以是质膜不可透性的。在一些实施例中,核酸试剂被配置为特异性结合死细胞。在一些实施例中,核酸试剂不结合活细胞。
[0027]
在一些实施例中,对于本文描述的任何样品分析方法,所述方法进一步包括使细
胞与核酸试剂接触。核酸试剂可以如本文所述。核酸试剂可包含捕获序列、条形码、引物结合位点;和双链dna结合剂。细胞可以是死细胞,并且核酸结合试剂可以结合到死细胞中的双链dna。所述方法可以包括洗涤死细胞以去除多余的核酸结合试剂。所述方法可以包括裂解死细胞。裂解可以释放核酸结合试剂。所述方法可以包括对核酸结合试剂进行条形码化。在一些实施例的方法中,细胞与包含含有细胞标记序列的寡核苷酸的固体支持物相关联,条形码化包括用细胞标记序列对核酸结合试剂条形码化。固体支持物可包含多个寡核苷酸,每个寡核苷酸包含细胞标记序列和不同分子标记序列。在一些实施例中,所述方法进一步包括对经条形码化的核酸结合试剂进行测序,并基于核酸试剂的条形码的存在来确定死细胞的存在。在一些实施例中,所述方法进一步包括使两个或更多个细胞各自与包含不同细胞标记的不同固体支持物相关联,从而使所述两个或更多个细胞中的每个与不同细胞标记一对一地相关联。在一些实施例中,所述方法进一步包括基于与核酸试剂的条形码相关联的独特细胞标记的数量,确定样品中的死细胞数量。确定具有与细胞标记相关联的不同序列的分子标记序列的和对照条形码序列的数量可以包括对于测序数据中的每个细胞标记,确定具有与所述细胞标记相关联的最高数量的不同序列的分子标记序列的和对照条形码序列的数量。在一些实施例的方法中,核酸结合试剂不进入活细胞,并且因此不与活细胞中的双链dna结合。在一些实施例中,所述方法进一步包括使死细胞与跟独特标识符寡核苷酸相关联的蛋白质结合试剂接触,其中蛋白质结合试剂与死细胞的蛋白质结合;并对所述独特标识符寡核苷酸条形码化。在一些实施例的方法中,蛋白质结合试剂包括抗体、四聚体、适体、蛋白质支架、侵袭素或其组合。在一些实施例的方法中,蛋白质结合试剂的蛋白质靶选自包含10-100个不同蛋白质靶的组,或者细胞组分结合试剂的细胞组分靶选自包含10-100个不同细胞组分靶的组。在一些实施例的方法中,蛋白质结合试剂的蛋白质靶包含碳水化合物、脂质、蛋白质、细胞外蛋白质、细胞表面蛋白质、细胞标志物、b细胞受体、t细胞受体、主要组织相容性复合体、肿瘤抗原、受体、整合素、细胞内蛋白质或其任何组合。在一些实施例的方法中,蛋白质结合试剂包含与细胞表面蛋白质结合的抗体或其片段。在一些实施例的方法中,条形码化是使用包含分子标记序列的条形码进行的。
[0028]
一些实施例包括样品分析方法。所述方法可以包括使样品的死细胞与核酸结合试剂,包含捕获序列、条形码、引物结合位点和双链dna结合剂的核酸结合试剂接触。核酸结合试剂可以结合死细胞中的双链dna。所述方法可以包括从死细胞洗涤多余的核酸结合试剂。所述方法可以包括裂解死细胞,从而从死细胞释放核酸结合试剂。所述方法可以包括对核酸结合试剂进行条形码化。在一些实施例的方法中,条形码化包括将死细胞捕获在固体支持物例如珠上,所述固体支持物包含细胞标记序列和分子标记序列。在一些实施例中,所述方法进一步包括确定与每个细胞标记序列相关联的不同分子标记序列的数量,并且基于与分子标记序列相关联的不同细胞标记序列的数量确定样品中的死细胞的数量。在一些实施例的方法中,确定具有与细胞标记相关联的不同序列的分子标记序列的和对照条形码序列的数量包括对于测序数据中的每个细胞标记,确定具有与细胞标记相关联的最大数量的不同序列的分子标记序列的数量。在一些实施例中,所述方法进一步包括使死细胞与跟独特标识符寡核苷酸相关联的蛋白质结合试剂接触。蛋白质结合试剂可以结合死细胞的蛋白质。所述方法可以进一步包括对独特标识符寡核苷酸进行条形码化。在一些实施例的方法中,蛋白质结合试剂与两个或更多个具有相同序列的样品索引寡核苷酸相关联。在一些实
施例的方法中,蛋白质结合试剂与具有不同样品索引序列的两个或更多个样品索引寡核苷酸相关联。在一些实施例的方法中,蛋白质结合试剂包括抗体、四聚体、适体、蛋白质支架、侵袭素或其组合。在一些实施例的方法中,蛋白质结合试剂的蛋白质靶选自包含10-100个不同蛋白质靶的组,或者其中细胞组分结合试剂的细胞组分靶选自包含10-100个不同细胞组分靶的组。在一些实施例的方法中,蛋白质结合试剂的蛋白质靶包含碳水化合物、脂质、蛋白质、细胞外蛋白质、细胞表面蛋白质、细胞标志物、b细胞受体、t细胞受体、主要组织相容性复合体、肿瘤抗原、受体、整合素、细胞内蛋白质或其任何组合。在一些实施例的方法中,蛋白质结合试剂包含与细胞表面蛋白质结合的抗体或其片段。
[0029]
在一些实施例的方法中,捕获序列和与捕获序列互补的序列是长度至少为5个核苷酸至约25个核苷酸的特定互补核酸对。
[0030]
在一些实施例中,描述了样品分析方法。所述方法可以包括使来自细胞的双链脱氧核糖核酸(dsdna)与转座体接触,其中所述转座体包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶和具有包含捕获序列的5
’
突出端的衔接子的两个拷贝,以产生多个突出dsdna片段,每个突出dsdna片段包含所述5
’
突出端的两个拷贝。所述方法可以包括使所述多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端中每个的至少一部分互补的序列。所述方法可以包括使多个互补dsdna片段变性以产生多个单链dna(ssdna)片段。所述方法可以包括使用多个条形码对多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列,其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中如果所述多个条形码包含相同的细胞标记序列。所述方法可以包括获得多个经条形码化的ssdna片段的测序数据。所述方法可以包括基于与相同的细胞标记序列相关联的独特分子标记序列的数量来定量细胞中dsdna的数量。在一些实施例中,所述方法进一步包括在包含寡核苷酸的固体支持物上捕获多个ssdna片段中的ssdna片段,所述寡核苷酸包含捕获序列、细胞标记序列和分子标记序列,其中所述捕获序列包含结合到ssdna片段的聚a尾的聚dt序列;使所述ssdna片段沿5
’
至3
’
方向延伸以产生经条形码化的ssdna片段,所述经条形码化的ssdna包含所述捕获序列、分子标记序列和细胞标记序列;使用逆转录酶或聚合酶或其组合使所述寡核苷酸沿5
’
至3
’
方向延伸,以产生与所述经条形码化的ssdna互补的互补dna链;使所述经条形码化的ssdna和互补dna链变性以产生单链序列;并且扩增所述单链序列。在一些实施例中,所述方法进一步包括多个ssdna片段的胞嘧啶碱基的亚硫酸氢盐转化,以产生多个经亚硫酸氢盐转化的包含尿嘧啶碱基的ssdna片段。
[0031]
在本文所述的任何方法中,dsdna可包含构建体dna。构建体dna可以选自由以下组成的组:质粒、克隆载体、表达载体、杂合载体、小环、粘粒、病毒载体、bac、yac和hac。在一些实施例中,构建体dna的数量为1至约1x 106。
[0032]
在本文所述的任何方法中,dsdna可包含病毒dna。细胞中病毒dna的载量范围约为1x 10
2-1x 106。
[0033]
在一些实施例中,描述了用于样品分析的试剂盒。试剂盒可包含如本文所述的转座体和如本文所述的多个条形码。每个转座体可以包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶(例如,本文所述的转座酶)和具有包含捕获序列的5
’
突出端
的衔接子的两个拷贝。任选地,转座体进一步包含连接酶。每个条形码可以包含细胞标记序列、分子标记序列和捕获序列,例如聚t序列。多个条形码中的至少两个包含不同的分子标记序列,并且多个条形码中的至少两个包含相同的细胞标记序列。例如,条形码可以包含至少10、50、100、500、1000、5000、10000、50000或100000个不同的分子标记。条形码可如本文所述固定在颗粒上。同一颗粒上的所有条形码可以包含相同的细胞标记。在一些实施例的试剂盒中,条形码在基底的孔中分配。在每个孔中分配的所有条形码可以包含相同的细胞标记序列,并且其中不同的孔包含不同的细胞标记序列。
附图说明
[0034]
图1示出了非限制性示例性条形码。
[0035]
图2示出了条形码化和数字计数的非限制性示例性工作流程。
[0036]
图3是示出了用于由多个靶产生经条形码化的靶的索引文库的非限制性示例性过程的示意图。
[0037]
图4a-4b示出了从单细胞高通量捕获多组学信息的非限制性示例性方法的示意图。
[0038]
图5a-5b示意性地示出了以改善的信号强度从单细胞捕获基因组和染色质可接近性信息的非限制性示例性方法。
[0039]
图6示意性地示出了一些实施例的非限制性示例性核酸试剂。
具体实施方式
[0040]
在以下详细描述中参考附图,附图形成在此的一部分。在图中,类似的符号典型地鉴别类似的部件,除非上下文另外规定。在详细描述、图示以及权利要求书中所描述的说明性实施例并不意图进行限制。在不脱离在此呈现的主题精神或范围的情况下,可以采用其他实施例,并且可做出其他改动。易于理解的是,如在此总体所述的和在附图中示出的本披露的方面可以各种的不同构造方式进行布置、取代、组合、分隔和设计,所有这些明显是涵盖于此的并且组成在此的披露内容的一部分。
[0041]
所有专利、公开的专利申请、其他出版物和genbank上的序列以及此处引用的其他数据库就相关技术而言均通过引用的方式完整地结合。
[0042]
带有具有不同分子标记差异的分子标记(也称为分子索引(mi))的条形码(例如随机条形码)可用于确定核酸靶的丰度,例如核酸靶的相对或绝对丰度。可以使用precise
tm
测定(细胞研究公司(cellular research,inc.)(帕洛阿尔托(palo alto),加利福尼亚州)和rhapsody
tm
测定(贝克顿迪金森公司(becton,dickinson and company)(富兰克林湖(franklin lakes),新泽西州))执行随机条形码化。precise
tm
测定或rhapsody
tm
测定可利用具有大量的(例如6561至65536个)随机条形码的非耗尽性池、聚(t)寡核苷酸上的独特分子标记序列,以在反转录(rt)步骤期间与样品中的所有聚(a)-mrna杂交。随机条形码可以包括通用pcr引发位点。在rt期间,靶基因分子与随机条形码随机地反应。每个靶分子可以与随机条形码杂交,从而产生经随机经条形码化的互补核糖核苷酸(cdna)分子。在标记后,可将来自微孔板微孔的经随机经条形码化的cdna分子合并到单个管中用于pcr扩增和测序。可以分析原始测序数据以产生读段数量、具有独特分子标记序列的随机条形码数量以
及mrna分子数量。
[0043]
本文披露包括样品分析方法的实施例。例如,本文描述的任何样品分析方法可以包括单细胞分析,由单细胞分析组成或基本上由单细胞分析组成。样品分析方法可用于使用分子条形码化情况下的多组学分析(例如precise
tm
测定和rhapsody
tm
测定)。在一些实施例中,样品分析方法包括:使双链脱氧核糖核酸(dsdna)与转座体接触,其中所述转座体包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶和具有包含捕获序列的5
’
突出端的衔接子的两个拷贝,以产生多个突出双链dna(dsdna)片段,每个具有所述5
’
突出端的两个拷贝。双链核酸酶(例如,转座酶)可以加载有两个拷贝的衔接子。所述方法可以包括使多个突出dsdna片段(包含5
’
突出端)与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与5
’
突出端的至少一部分互补的序列;使多个互补dsdna片段(每个都包含与5
’
突出端的至少一部分互补的序列)变性以产生多个单链dna(ssdna)片段;使用多个条形码对多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列,其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列;获得所述多个经条形码化的ssdna片段的测序数据;并且根据获得的测序数据中多个ssdna片段的序列,确定与dsdna(例如,gdna)相关的信息。
[0044]
在一些实施例中,对于本文所述的任何样品分析方法,双链dna可包含以下,基本上由以下组成或由以下组成:任何双链dna,例如基因组dna(gdna),细胞器dna(例如核dna、核仁dna、基因组dna、线粒体dna和叶绿体dna),病毒dna和/或构建体dna(例如质粒、克隆载体、表达载体、杂合载体、小环、粘粒、病毒载体和/或人工染色体,例如bac、yac和hac)。
[0045]
在一些实施例中,对于本文所述的任何样品分析方法,构建体dna选自由以下组成的组:质粒、克隆载体、表达载体、杂合载体、小环、粘粒、病毒载体、bac、yac和hac或所列项中任何的两个或更多个的组合。
[0046]
在一些实施例中,对于本文所述的任何样品分析方法,构建体dna的数量范围为1至约1x 106。
[0047]
在一些实施例中,对于本文所述的任何样品分析方法,病毒dna的载量范围为约1x 10
2-1x 106。
[0048]
如本文所述,许多合适的双链dna结合试剂可用于如本文所述的核酸试剂和样品分析方法中。在一些实施例中,对于本文描述的任何核酸试剂和/或样品分析方法,双链dna酸结合试剂非限制性地选自由以下组成的组:蒽环类(例如,阿柔比星、奥多柔比星、氨柔比星、安那霉素(annamycin)、波米克酸(bohemic acid)、卡柔比星、宇宙霉素b、柔红霉素、多柔比星、表柔比星,伊达比星、美诺立尔、诺加霉素、吡柔比星、萨巴比星、戊柔比星、多柔比星佐他瑞林、和佐柔比星)、阿米凯林、9-氨基吖啶、7-氨基放线菌素d、安吖啶、更生霉素、柔红霉素、多柔比星、玫瑰树碱、溴化乙锭、米托蒽醌、吡柔比星、匹克生琼、普罗黄素、和补骨脂素,或所列项中的两个或更多个的组合。
[0049]
在一些实施例中,本文描述的任何样品分析方法包括:从细胞的双链脱氧核糖核酸(dsdna)产生多个核酸片段,其中所述多个核酸片段中的每个包含捕获序列、捕获序列的互补序列、捕获序列的反向互补序列或其组合;使用多个条形码对所述多个核酸片段进行条形码化以产生多个经条形码化的单链脱氧核糖核酸(ssdna)片段,其中所述多个条形码
中的每个包含细胞标记序列、分子标记序列和捕获序列,其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列;获得所述多个经条形码化的ssdna片段的测序数据;并且根据获得的测序数据中多个ssdna片段的序列,确定与dsdna相关的信息。
[0050]
除非另有定义,否则在此所使用的技术和科学术语具有与本披露所属领域的普通技术人员通常理解的相同的含义。参见例如singleton等人,微生物学和分子生物学字典(dictionary of microbiology and molecular biology)第2版,约翰
·
威利父子公司(j.wiley&sons)(纽约州纽约市(new york,ny)1994);sambrook等人,分子克隆实验室手册(molecular cloning,a laboratory manual),冷泉港出版社(cold springs harbor press)(纽约冷泉港(cold springs harbor,ny)1989)。为了本披露的目的,以下提供关于以下术语的信息。
[0051]
如本文所使用的,鉴于本说明书,术语“衔接子”在本领域中具有其习惯和普通含义。它是指促进相关联的核酸的扩增、测序和/或捕获的序列。相关联的核酸可以包括靶核酸。相关联的核酸可以包含空间标记、靶记、样品标记、索引标记或条形码序列(例如,分子标记)中的一个或多个。衔接子可以是线性的。衔接子可以是预腺苷酸化的衔接子。衔接子可以是双链或单链的。一个或多个衔接子可以位于核酸的5
’
或3
’
末端上。当衔接子包含在5
’
和3
’
末端上的已知序列时,已知序列可以是相同或不同的序列。位于多核苷酸的5
’
和/或3
’
末端上的衔接子可以能够与固定在表面上的一个或多个寡核苷酸杂交。在一些实施例中,衔接子可以包含通用序列。通用序列可以是两个或更多个核酸分子共有的核苷酸序列区域。两个或更多个核酸分子还可以具有不同序列区域。因此,例如,5
’
衔接子可以包含相同和/或通用核酸序列并且3
’
衔接子可以包含相同和/或通用序列。可以存在于多个核酸分子的不同成员中的通用序列可以允许使用与通用序列互补的单一通用引物复制或扩增多个不同的序列。类似地,可以存在于核酸分子集合体的不同成员中的两个(例如一对)或更多个通用序列可以允许使用与通用序列互补的至少一个、两个(例如一对)或更多个通用引物复制或扩增多个不同的序列。因此,通用引物包含可与这种通用序列杂交的序列。具有靶核酸序列的分子可以被修饰成将通用衔接子(例如,非靶核酸序列)连接到不同的靶核酸序列的一端或两端。连接到靶核酸的一个或多个通用引物可以为通用引物的杂交提供位点。连接到靶核酸的一个或多个通用引物可以是彼此相同或不同的。
[0052]
如本文所使用的,鉴于本说明书,术语“相关联”或“与
……
相关联”在本领域中具有其习惯和普通含义。它可以指两个或更多个可鉴定为在某个时间点共定位的物质。关联可以指两个或更多个物质在或曾经在类似容器内。关联可以指信息学关联。例如关于两个或更多个物质的数字信息可以被存储并且可以用于确定一个或多个物质在某一时间点共定位。关联也可以指物理关联。在一些实施例中,两个或更多个关联的物质彼此“系接”、“连接”或“固定”,或“系接”、“连接”或“固定”至共同的固体或半固体表面。关联可以是指用于将标记连接到固体或半固体支持物诸如珠上的共价或非共价方式。关联可以指靶与标记之间的共价键。关联可以包括两个分子(例如靶分子和标记)之间的杂交。
[0053]
如本文所使用的,鉴于本说明书,术语“互补”在本领域中具有其习惯和普通含义。它可以是指两个核苷酸之间精确配对的能力。例如,如果核酸的指定位置处的核苷酸能够与另一个核酸的核苷酸氢键结合,则认为两个核酸在那一位置是彼此互补的。两个单链核
酸分子之间的互补性可以是“部分的”,其中仅一些核苷酸结合,或者当单链分子之间存在总体互补性时该结合可以是完全的。如果第一核苷酸序列与第二核苷酸序列互补,则可以称为第一核苷酸序列是第二序列的“互补序列”。如果第一核苷酸序列与反向(即核苷酸的次序是相反的)于第二序列的序列互补,则可以称为第一核苷酸序列是第二序列的“反向互补序列”。如本文所用,“互补”序列可以指序列的“互补”或“反向互补”。从本披露中理解的是,如果分子可以与另一个分子杂交,则它可以与正在杂交的分子互补或部分互补。
[0054]
如在此所用,术语“数字计数”可以是指用于估计样品中靶分子的数量的方法。数字计数可以包括确定已与样品中的靶关联的独特标记数量的步骤。所述方法本质上可以是随机的,其将计数分子的问题从定位并识别相同分子的一个问题转变成关于检测一组预先定义的标记的一系列是/否数字问题。
[0055]
如本文所用,鉴于本说明书,术语“标记”或“多个标记”在本领域中具有其习惯和普通含义。它们可以指与样品中的靶相关联的核酸代码。标记可以包含例如核酸标记,基本上由例如核酸标记组成,或由例如核酸标记组成。标记可以是整体或部分可扩增的标记。标记可以是整体或部分可测序的标记。标记可以是天然核酸中可鉴定为不同的一部分。标记可以包含已知序列,基本上由已知序列组成或由已知序列组成。标记可以包括核酸序列的接合点,例如天然序列和非天然序列的接合点。如在此所用,术语“标记”可以与术语“索引”、“标签”或“标记-标签”互换使用。标记可以传达信息。例如,在不同的实施例中,标记可用于确定样品身份、样品来源、细胞身份和/或靶。
[0056]
如在此所用,术语“非消耗贮存池(non-depleting reservoirs)”可以是指由许多不同的标记构成的条形码(例如,随机条形码)池。非消耗贮存池可以包含大量的不同条形码,使得当非消耗贮存池与靶库相关联时,每个靶很可能与独特的条形码相关联。每个标记的靶分子的独特性可以通过随机选择的统计学确定,并且取决于与标记的多样性相比集合体中相同靶分子的拷贝数。所得到的标记的靶分子组的大小可以通过条形码化过程的随机性质和检测到的条形码的数量分析确定,然后允许计算原始集合体或样品中存在的靶分子的数量。当存在的靶分子的拷贝数与独特的条形码的数量的比率较低时,标记的靶分子是高度独特的(即用指定的标记来标记一个以上的靶分子的可能性非常低)。
[0057]
如本文所使用的,鉴于本说明书,术语“核酸”在本领域中具有其习惯和普通含义。它是指多核苷酸序列或其片段。核酸可以包含核苷酸,基本上由核苷酸组成或由核苷酸组成。核酸对细胞可以是外源性或内源性的。核酸可以存在于无细胞环境中。核酸可以包含基因或其片段,基本上由基因或其片段组成或由基因或其片段组成。核酸可以包含dna,基本上由dna组成或由dna组成。核酸可以包含rna,基本上由rna组成或由rna组成。核酸可包含以下,基本上由以下组成或由以下组成:一个或多个类似物(例如改变的骨架、糖或核碱基)。类似物的一些非限制性实例包括:5-溴尿嘧啶、肽核酸、xeno核酸、吗啉化合物、锁核酸、二醇核酸、苏糖核酸、双脱氧核苷酸、蛹虫草菌素、7-脱氮-gtp、荧光团(例如,连接至糖的罗丹明或荧光素)、含硫醇的核苷酸、生物素连接的核苷酸、荧光碱基类似物、cpg岛、甲基-7-鸟苷、甲基化的核苷酸、肌苷、硫尿苷、假尿苷、二氢尿苷、辫苷以及怀俄苷。“核酸”、“多核苷酸”、“靶多核苷酸”和“靶核酸”可以互换使用。
[0058]
核酸可以包含一个或多个修饰(例如,碱基修饰、骨架修饰)以提供具有新的或增强的特征(例如,改善的稳定性)的核酸。核酸可以包含核酸亲和标签。核苷可以是碱基-糖
组合。核苷的碱基部分可以是杂环碱基。此类杂环碱基的两种最常见的种类是嘌呤和嘧啶。核苷酸可以是进一步包含共价连接至核苷的糖部分的磷酸酯基团的核苷。对于包含戊呋喃糖的那些核苷,磷酸酯基团可以连接至糖的2
’
、3
’
或5
’
羟基部分。在形成核酸时,磷酸酯基团可以共价连接彼此相邻的核苷以形成线性聚合化合物。进而,该线性聚合化合物的对应末端可以进一步连接以形成环状化合物;然而,线性化合物通常是适合的。此外,线性化合物可以具有内部的核苷酸碱基互补性并且因此可以便于产生完全或部分双链化合物的方式折叠。在核酸内,磷酸酯基团可以通常涉及形成核酸的核苷间骨架。键联或骨架可以是3
’
至5
’
磷酸二酯键。
[0059]
核酸可以包含修饰的骨架和/或修饰的核苷间键联。修饰的骨架可以包括在骨架中保留磷原子的那些和在骨架中不具有磷原子的那些。其中含有磷原子的适合的修饰的核酸骨架可以包括例如硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基以及其他烷基膦酸酯(诸如3
’-
亚烷基膦酸酯、5
’-
亚烷基膦酸酯、手性膦酸酯)、亚膦酸酯、氨基磷酸酯(包括3
’-
氨基氨基磷酸酯和氨基烷基氨基磷酸酯、二氨基磷酸酯)、硫代氨基磷酸酯、硫代烷基膦酸酯、硫代烷基膦酸三酯、硒代磷酸酯以及具有正常3
’5’
键联、2
’5’
键联类似物的硼烷磷酸酯,以及具有其中一个或多个核苷酸间键联是3
’
至3
’
、5
’
至5
’
或2
’
至2
’
键联的反向极性的那些。
[0060]
核酸可以包含这样的多核苷酸骨架,这些多核苷酸骨架通过短链烷基或环烷基核苷间键联、混合杂原子以及烷基或环烷基核苷间键联、或一个或多个短链杂原子或杂环核苷间键联形成。这些骨架可以包括具有以下各项的那些:吗啉代键联(部分地从核苷的糖部分中形成);硅氧烷骨架;硫化物、亚砜和砜骨架;甲酰乙酰基和硫代甲酰乙酰基骨架;亚甲基甲酰乙酰基和硫代甲酰乙酰基骨架;核乙酰基(riboacetyl)骨架;含烯烃的骨架;氨基磺酸酯骨架;亚甲基亚氨基和亚甲基肼基骨架;磺酸酯和磺酰胺骨架;酰胺骨架;以及具有混合的n、o、s和ch2组分的其他骨架。
[0061]
核酸可以包含核酸模拟物,基本上由核酸模拟物组成或由核酸模拟物组成。术语“模拟物”可以旨在包括这样的多核苷酸,其中仅呋喃糖环或呋喃糖环和核苷酸间键联两者被非呋喃糖基团置换,仅呋喃糖环的置换也可以称之为糖替代物。杂环碱基部分或修饰的杂环碱基部分可以被保持以用于与适当的靶核酸的杂交。一种这样的核酸可以是肽核酸(pna)。在pna中,多核苷酸的糖骨架可以被含酰胺骨架,具体地氨基乙基甘氨酸骨架置换。核苷酸可以被保留并且直接或间接地结合至骨架的酰胺部分的氮杂氮原子。pna化合物中的骨架可以包含给予pna含酰胺骨架的两个或更多个连接的氨基乙基甘氨酸单元。杂环碱基部分可以直接或间接地结合至该骨架的酰胺部分的氮杂氮原子。
[0062]
核酸可以包含吗啉代主链结构,基本上由吗啉代主链结构组成或由吗啉代主链结构组成。例如,核酸可以包含6元吗啉代环以取代核糖环。在这些实施例中的一些中,二氨基磷酸酯或其他非磷酸二酯核苷间键联可以置换磷酸二酯键。
[0063]
核酸可以包含以下,基本上由以下组成,或由以下组成:连接的吗啉代单元(例如吗啉代核酸),这些吗啉代单元具有连接到吗啉代环的杂环碱基。连接基团可以连接吗啉代核酸中的吗啉代单体单元。基于非离子吗啉代的寡聚化合物可以与细胞蛋白质具有不太希望的相互作用。基于吗啉代的多核苷酸可以是核酸的非离子模拟物。吗啉代种类内的多种化合物可以使用不同的连接基团连接。另一种类的多核苷酸模拟物可以称之为环己烯基核
酸(cena)。核酸分子中正常地存在的呋喃糖环可以被环己烯基环置换。可以制备cena dmt保护的亚磷酰胺单体并且将其用于使用亚磷酰胺化学的寡聚化合物合成。将cena单体掺入到核酸链可以增加dna/rna杂合体的稳定性。cena寡腺苷酸可以与核酸互补序列形成复合体,这些复合体具有与天然复合体类似的稳定性。另一修饰可以包括锁核酸(lna),其中2
’-
羟基基团连接至糖环的4
’
碳原子,从而形成2
’-
c、4
’-
c-氧基亚甲基键,从而形成二环糖部分。键可以是桥接2
’
氧原子和4
’
碳原子的亚甲基(-ch2)基团,其中n是1或2。lna和lna类似物可以显示出与互补核酸相当高的双链体热稳定性(tm=+3至+10℃)、3
’
核酸外切降解稳定性和良好的溶解特性。
[0064]
核酸还可以包含核碱基(经常简称为“碱基”)修饰或取代。如在此所用,“未修饰的”或“天然的”核碱基可以包括嘌呤碱基(例如腺嘌呤(a)和鸟嘌呤(g)),以及嘧啶碱基(例如胸腺嘧啶(t)、胞嘧啶(c)以及尿嘧啶(u))。修饰的核碱基可以包括其他合成以及天然的核碱基,诸如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基以及其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基以及其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶以及2-硫胞嘧啶、5-卤代尿嘧啶以及胞嘧啶、5-丙炔基(-c=c-ch3)尿嘧啶和胞嘧啶以及嘧啶碱基的其他炔基衍生物、6-偶氮基尿嘧啶、胞嘧啶以及胸腺嘧啶,5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶,8-卤基、8-氨基、8-氢硫基、8-硫烷基、8-羟基以及其他8-取代腺嘌呤和鸟嘌呤,5-卤基具体地5-溴、5-三氟甲基以及其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、2-f-腺嘌呤、2-氨基腺嘌呤、8-氮鸟嘌呤和8-氮腺嘌呤、7-脱氮鸟嘌呤和7-脱氮腺嘌呤、以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。修饰的核碱基可以包括三环嘧啶诸如吩噁嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并噁嗪-2(3h)-酮)、酚噻嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并噻嗪-2(3h)-酮)、g夹环(g-clamp)诸如取代的吩噁嗪胞苷(例如9-(2-氨基乙氧基)-h-嘧啶并(5,4-(b)(1,4)苯并噁嗪-2(3h)-酮)、酚噻嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并噻嗪-2(3h)-酮)、g夹环诸如取代的吩噁嗪胞苷(例如9-(2-氨基乙氧基)-h-嘧啶并(5,4-(b)(1,4)苯并噁嗪-2(3h)-酮)、咔唑胞苷(2h-嘧啶并(4,5-b)吲哚-2-酮)、吡啶并吲哚胞苷(h-吡啶并(3
’
,2
’
:4,5)吡咯并[2,3-d]嘧啶-2-酮)。
[0065]
如在此所用,术语“样品”可以是指包含靶的组合物。适合用于由本披露方法、装置和系统进行的分析的样品包括细胞、组织、器官或生物体。在一些实施例中,样品包含单细胞,基本上由单细胞组成或由单细胞组成。在一些实施例中,样品包含以下,基本上由以下组成,或由以下组成:至少100,000、200,000、300,000、500,000、800,000或1,000,000个单细胞。
[0066]
如在此所用,术语“取样装置”或“装置”可以是指可获得样品切片和/或将切片放置于基底上的装置。样品装置可以是指例如荧光激活细胞分选(facs)器、细胞分选器、活检针、活检装置、组织切片装置、微流体装置、刀片网格和/或切片机。
[0067]
如本文所用,鉴于本说明书,术语“固体载体”在本领域中具有其惯常和普通的含义。它可以是指多个条形码(例如,随机条形码)可以连接到其上的离散固体或半固体表面。固体支持物可以涵盖核酸可固定(例如共价地或非共价地)在其上的由塑料、陶瓷、金属或聚合物材料(例如水凝胶)组成的任何类型的固体、多孔或中空球体、球、轴承、圆柱或其他类似的构型。固体支持物可以包括离散颗粒,该离散颗粒可以是球形(例如微球)或具有非球形或不规则形状诸如立方体、长方体、锥形、圆柱形、圆锥形、椭圆形或圆盘形等。珠的形
状可以是非球形的。以阵列间隔开的多个固体支持物可以不包含基底。固体支持物可以与术语“珠”互换使用。预期对于本文中条形码固定在固体支持物、颗粒、珠等上的任何实施例,条形码也可以分配在诸如水凝胶滴的滴(例如,微滴)中,或在基底的孔(例如微孔)中或流体装置(例如,微流体装置)的腔室。因此,本文披露了通过“固体支持物”(例如珠)对核酸进行分组、分选或分配的任何情况,还明确考虑了在流体(例如,滴,例如微滴)或物理空间中的分配,例如在微孔(例如在多孔板上)或腔室(例如在流体装置中)中的分配。
[0068]
如在此所用,术语“随机条形码”可以是指包含本披露的标记的多核苷酸序列。随机条形码可以是可用于随机经条形码化的多核苷酸序列。随机条形码可以用于定量样品内的靶。随机条形码可以用于控制在标记与靶关联后可能发生的错误。例如,随机条形码可以用于评价扩增或测序错误。与靶关联的随机条形码可以称为随机条形码-靶或随机条形码-标签-靶。
[0069]
如在此所用,术语“基因特异性随机条形码”可以是指包含标记和基因特异性的靶结合区的多核苷酸序列。随机条形码可以是可用于随机经条形码化的多核苷酸序列。随机条形码可以用于定量样品内的靶。随机条形码可以用于控制在标记与靶关联后可能发生的错误。例如,随机条形码可以用于评价扩增或测序错误。与靶关联的随机条形码可以称为随机条形码-靶或随机条形码-标签-靶。
[0070]
如在此所用,术语“随机条形码化”可以是指核酸的随机标记(例如条形码化)。随机条形码化可以利用递归泊松策略来相关联和定量与靶关联的标记。如在此所用,术语“随机条形码化”可以与“随机进行标记”互换使用。
[0071]
如本文所使用的,鉴于本说明书,术语“靶”在本领域中具有其习惯和普通含义。它可以是指可以与条形码(例如,随机条形码)关联的成分。适合用于由本披露方法、装置和系统进行的分析的示例性靶包括寡核苷酸、dna、rna、mrna、微小rna、trna等。靶可以是单链或双链的。在一些实施例中,靶可以是蛋白质、肽或多肽。在一些实施例中,靶是脂质。如本文所使用的,“靶”可以与“种类”互换使用。
[0072]
如本文所用,鉴于本说明书,术语“逆转录酶”在本领域中具有其惯常和普通的含义。它可以是指具有逆转录酶活性(即催化由rna模板对dna的合成)的一组酶。一般来讲,此类酶包括但不限于逆转录病毒逆转录酶、逆转录转座子逆转录酶、逆转录质粒逆转录酶、逆转录子逆转录酶、细菌逆转录酶、ii组内含子衍生的逆转录酶以及其突变体、变体或衍生物。非逆转录病毒逆转录酶包括非ltr逆转录转座子逆转录酶、逆转录质粒逆转录酶、逆转录子逆转录酶以及ii组内含子逆转录酶。ii组内含子逆转录酶的实例包括乳酸乳球菌(lactococcus lactis)li.ltrb内含子逆转录酶、嗜热细长聚球藻(thermosynechococcus elongates)tei4c内含子逆转录酶或嗜热脂肪土芽孢杆菌(geobacillus stearothermophilus)gsi-iic内含子逆转录酶。其他种类的逆转录酶可以包括许多种类的非逆转录病毒逆转录酶(即转录子、ii组内含子以及产生多样性的逆转录因子等等)。
[0073]
术语“通用衔接子引物”、“通用引物衔接子”或“通用衔接子序列”可互换使用,是指可以用于杂交条形码(例如,随机条形码)以产生基因特异性条形码的核苷酸序列。通用衔接子序列可以例如是在用于本披露方法中的所有条形码上通用的已知序列。例如,当使用在此披露的方法标记多个靶时,靶特异性序列中的每一个可以连接到相同通用衔接子序列上。在一些实施例中,多于一个通用衔接子序列可以用于在此披露的方法中。例如,当使
用在此披露的方法标记多个靶时,靶特异性序列中的至少两个连接到不同通用衔接子序列上。通用衔接子引物和其互补序列可以被包含在两个寡核苷酸中,这两个寡核苷酸中的一个包含靶特异性序列而另一个包含条形码。例如,通用衔接子序列可以是包含靶特异性序列以产生与靶核酸互补的核苷酸序列的寡核苷酸部分。包含条形码和通用衔接子序列的互补序列的第二寡核苷酸可以与该核苷酸序列杂交并且产生靶特异性条形码(例如,靶特异性随机条形码)。在一些实施例中,通用衔接子引物具有与用于本披露方法中的通用pcr引物不同的序列。条形码
[0074]
条形码化(诸如随机条形码化)已描述于例如us 2015/0299784、wo 2015/031691、以及fu等人,proc natl acad sci u.s.a.[美国国家科学院院刊]2011年5月31日;108(22):9026-31中(这些出版物中每一个的内容均通过引用整体并入本文)。在一些实施例中,本文披露的条形码可以是随机条形码,所述随机条形码可以是指可以用于随机地标记(例如条形码化、加标签)靶的多核苷酸序列。如果随机条形码的不同条形码序列的数量与有待标记的任何靶的出现的数量的比率可以是或约是1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1,或这些值中任何两个之间的数字或范围,则条形码可以称作随机条形码。靶可以是包含具有相同或几乎相同序列的mrna分子的mrna种类。如果随机条形码的不同条形码序列的数量与有待标记的任何靶的出现的数量的比率是至少或至多1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1或100:1,则条形码可以称作随机条形码。随机条形码的条形码序列可以称为分子标记。
[0075]
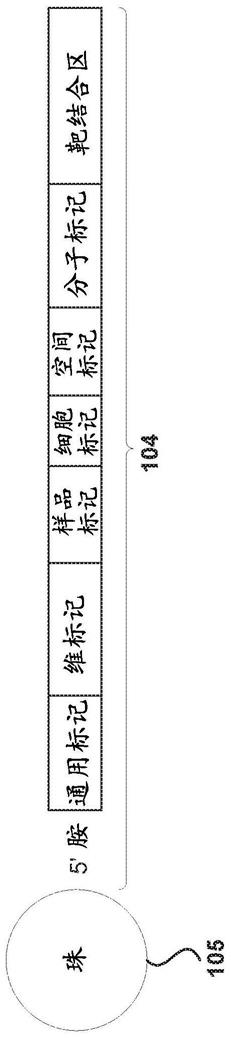
条形码,例如随机条形码,可以包含一个或多个标记。示例性标记可以包括通用标记、细胞标记、条形码序列(例如,分子标记)、样品标记、板标记、空间标记和/或预空间标记。图1示出了具有空间标记的示例性条形码104。条形码104可以包含可以将条形码连接至固体支持物105的5
’
胺。条形码可以包含通用标记、维标记、空间标记、细胞标记和/或分子标记。条形码可以包含通用标记、细胞标记和分子标记。条形码可以包含通用标记、空间标记、细胞标记和分子标记。条形码可以包含通用标记、维标记、细胞标记和分子标记。条形码中不同标记(包括但不限于通用标记、维标记、空间标记、细胞标记和/或分子标记)的顺序可以变化。例如,如图1所示,通用标记可以是最5
’
端标记,并且分子标记可以是最3
’
端标记。空间标记、维标记和细胞标记可以呈任何顺序。在一些实施例中,通用标记、空间标记、维标记、细胞标记以及分子标记呈任何次序。条形码可以包含靶结合区。靶结合区可以与样品中的靶(例如,靶核酸、rna、mrna、dna)相互作用。例如,靶结合区可以包含可以与mrna的聚(a)尾相互作用的寡(dt)序列。在一些情况中,条形码的标记(例如,通用标记、维标记、空间标记、细胞标记以及条形码序列)可以通过1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个或更多个核苷酸分开。
[0076]
标记例如细胞标记可以进一步包含限定长度例如各自七个核苷酸(等于在一些汉明纠错码中使用的位数)的独特的核酸子序列组,该核酸子序列组可以被设计成提供纠错能力。包括七个核苷酸序列的纠错子序列组可以被设计成使得组中的任何成对序列组合表现出限定的“遗传距离”(或错配碱基数),例如纠错子序列组可以被设计成表现出三个核苷
酸的遗传距离。在这种情况下,检查针对标记的靶核酸分子(下文更全面描述的)的序列数据组中的纠错序列可以允许检测或校正扩增或测序错误。在一些实施例中,用于产生纠错码的核酸子序列的长度可以变化,例如,它们可以是或约是1、2、3、4、5、6、7、8、9、10、15、20、30、31、40、50个核苷酸长度或这些值中任何两个之间的数字或范围。在一些实施例中,其他长度的核酸子序列可以用于产生纠错码。
[0077]
条形码可以包含靶结合区。靶结合区可以与样品中的靶相互作用。靶可以是或包括核糖核酸(rna)、信使rna(mrna)、微小rna、小干扰rna(sirna)、rna降解产物、各自包含多聚(a)尾的rna或其任何组合。在一些实施例中,多个靶可以包括脱氧核糖核酸(dna)。
[0078]
在一些实施例中,靶结合区可以包含可以与mrna的聚(a)尾相互作用的寡(dt)序列。条形码的一个或多个标记(例如,通用标记、维标记、空间标记、细胞标记和条形码序列(例如,分子标记))可以通过间隔子与条形码的另一个或两个其余标记分开。间隔子可以是例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个,或更多个核苷酸。在一些实施例中,条形码的标记中没有标记被间隔物分开。通用标记
[0079]
条形码可以包含一个或多个通用标记。一些实施例中,一个或多个通用标记对于连接到指定固体支持物的条形码组中的所有条形码可以是相同的。在一些实施例中,一个或多个通用标记对于连接到多个珠的所有条形码可以是相同的。在一些实施例中,通用标记可以包含能够与测序引物杂交的核酸序列。测序引物可以用于对包含通用标记的条形码进行测序。测序引物(例如,通用的测序引物)可以包括与高通量测序平台相关联的测序引物。在一些实施例中,通用标记可以包含能够与pcr引物杂交的核酸序列。在一些实施例中,通用标记可以包含能够与测序引物和pcr引物杂交的核酸序列。通用标记的能够与测序引物或pcr引物杂交的核酸序列可以称之为引物结合位点。通用标记可以包含可以用于启动条形码的转录的序列。通用标记可以包含可以用于延伸条形码或条形码内的区域的序列。通用标记的长度可以是或可以约是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。例如,通用标记可以包含至少约10个核苷酸。通用标记的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。在一些实施例中,可切割接头或修饰的核苷酸可以是通用标记序列的一部分以能够使条形码从支持物上切割下来。维标记
[0080]
条形码可以包含一个或多个维标记。在一些实施例中,维标记可以包含提供关于出现标记(例如随机标记)的维度的信息的核酸序列。例如,维标记可以提供关于靶被经条形码化的时间的信息。维标记可以与样品的条形码化(例如随机条形码化)时间关联。维标记可以在标记的时间处被激活。不同的维标记可以在不同的时间处被激活。维标记提供了关于靶、靶组和/或样品被经条形码化的顺序的信息。例如,可以在细胞周期的g0期时对细胞群条形码化。可以在细胞周期的g1期时用条形码(例如,随机条形码)再次脉冲处理细胞。可以在细胞周期的s期时用条形码再次脉冲处理细胞,如此类推。每次脉冲(例如细胞周期的每个阶段)下的条形码可以包含不同的维标记。以此方式,维标记提供了关于在细胞周期的哪个阶段标记了哪个靶的信息。维标记可以询问许多不同的生物时期。示例性的生物时期可以包括但不限于细胞周期、转录(例如转录起始)以及转录物降解。在另一实例中,样品
(例如一个细胞、细胞群)可以在用药物和/或疗法治疗之前和/或之后被标记。不同靶的拷贝数量的变化可以指示样品对药物和/或疗法的应答。
[0081]
维标记可以是可激活的。可激活的维标记可以在特定时间点处被激活。可激活的标记可以例如是组成型激活的(例如不被关闭的)。可激活的维标记可以例如是可逆型激活的(例如,可激活的维标记可以被打开和关闭)。维标记可以例如可逆地激活至少1、2、3、4、5、6、7、8、9、10次或更多次。维标记可以可逆地激活例如至少1、2、3、4、5、6、7、8、9、10次或更多次。在一些实施例中,维标记可以用以下各项激活:荧光、日光、化学事件(例如切割、另一分子的连接、修饰的添加(例如聚乙二醇化、苏素化、乙酰化、甲基化、脱乙酰化、脱甲基化)、光化学事件(例如光笼蔽)以及非天然核苷酸的引入。
[0082]
在一些实施例中,维标记对于连接到指定固体支持物(例如珠)的所有条形码(例如随机条形码)可以是相同的,但对于不同的固体支持物(例如珠)可以是不同的。在一些实施例中,相同固体支持物上的至少60%、70%、80%、85%、90%、95%、97%、99%或100%的条形码可以包含相同的维标记。在一些实施例中,相同固体支持物上的至少60%的条形码可以包含相同的维标记。在一些实施例中,相同固体支持物上的至少95%的条形码可以包含相同的维标记。
[0083]
在多个固体支持物(例如珠)中可以呈现多至106种或更多个独特的维标记序列。维标记的长度可以是或可约以是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。维标记的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。维标记可以包含约5个至约200个之间的核苷酸。维标记可以包含约10个至约150个之间的核苷酸。维标记的长度可以包含约20个至约125个之间的核苷酸。空间标记
[0084]
条形码可以包含一个或多个空间标记。在一些实施例中,空间标记可以包含提供关于与条形码相关联的靶分子的空间取向的信息的核酸序列。空间标记可以与样品的坐标相关联。坐标可以是固定坐标。例如坐标可以相对于基底是固定的。空间标记可以是参考二维或三维网格。坐标可以相对于界标是固定的。界标在空间中可以是可鉴定的。界标可以是可被成像的结构。界标可以是生物结构,例如解剖学界标。界标可以是细胞界标,例如细胞器。界标可以是非天然界标诸如具有可鉴定的标识符诸如颜色编码、条形码编码、磁性特性、荧光剂、放射性或独特的大小或形状的结构。空间标记可以与物理分配区(例如,孔、容器或微滴)相关联。在一些实施例中,多个空间标记一起使用以编码空间中的一个或多个位置。
[0085]
空间标记对于连接到指定固体支持物(例如珠)上的所有条形码可以是相同的,但对于不同的固体支持物(例如珠)可以是不同的。在一些实施例中,在包含相同空间标记的相同固体支持物上的条形码的百分比可以是或约是60%、70%、80%、85%、90%、95%、97%、99%、100%,或这些值中任何两个之间的数字或范围。在一些实施例中,在包含相同空间标记的相同固体支持物上的条形码的百分比可以是至少或至多60%、70%、80%、85%、90%、95%、97%、99%、或100%。在一些实施例中,相同固体支持物上的至少60%的条形码可以包含相同的空间标记。在一些实施例中,相同固体支持物上的至少95%的条形码可以包含相同的空间标记。
[0086]
在多个固体支持物(例如珠)中可以呈现多至106种或更多个独特的空间标记序列。空间标记的长度可以是或可以约是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。空间标记的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。空间标记可以包含约5个至约200个之间的核苷酸。空间标记可以包含约10个至约150个之间的核苷酸。空间标记的长度可以包含约20个至约125个之间的核苷酸。细胞标记
[0087]
条形码(例如,随机条形码)可以包括一个或多个细胞标记。在一些实施例中,细胞标记可以包含提供用于确定哪种靶核酸源自于哪个细胞的信息的核酸序列。在一些实施例中,细胞标记对于连接至指定固体支持物(例如珠)的所有条形码是相同的,但对于不同的固体支持物(例如珠)是不同的。在一些实施例中,在包含相同细胞标记的相同固体支持物上的条形码的百分比可以是或约是60%、70%、80%、85%、90%、95%、97%、99%、100%,或这些值中任何两个之间的数字或范围。在一些实施例中,在包含相同细胞标记的相同固体支持物上的条形码的百分比可以是或约是60%、70%、80%、85%、90%、95%、97%、99%、或100%。例如,相同固体支持物上的至少60%的条形码可以包含相同的细胞标记。作为另一个实例,相同固体支持物上的至少95%的条形码可以包含相同的细胞标记。
[0088]
在多个固体支持物(例如珠)中可以呈现多至106种或更多个独特的细胞标记序列。细胞标记的长度可以是或可以约是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。细胞标记的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。例如,细胞标记可以包含约5个至约200个之间的核苷酸。作为另一个实例,细胞标记可以包含约10个至约150个之间的核苷酸。作为又一个实例,细胞标记的长度可以包含约20个至约125个之间的核苷酸。条形码序列
[0089]
条形码可以包含一个或多个条形码序列。在一些实施例中,条形码序列可以包含提供对与条形码杂交的靶核酸物质的具体类型的鉴定信息的核酸序列。条形码序列可以包含为与条形码(例如靶结合区)杂交的靶核酸物质的具体出现次数提供计数器的核酸序列(例如,提供粗略的近似)。
[0090]
在一些实施例中,一组不同的条形码序列被连接到指定固体支持物(例如珠)上。在一些实施例中,可以存在或大约存在102、103、104、105、106、107、108、109个独特分子标记序列或这些值中的任意两个或两个之间的数字或范围。例如,多个条形码可以包含具有不同序列的约6561个条形码序列。作为另一个实例,多个条形码可以包含具有不同序列的约65536个条形码序列。在一些实施例中,可以存在至少或至多102、103、104、105、106、107、108或109个独特条形码序列。独特分子标记序列可以连接至给定的固体支持物(例如珠)。在一些实施例中,独特分子标记序列被颗粒(例如,水凝胶珠)部分或全部包围。
[0091]
在不同的实现方式中,条形码的长度可以不同。例如,条形码的长度可以是或可以约是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。作为另一个实例,条形码的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。分子标记
[0092]
条形码(例如,随机条形码)可以包括一个或多个分子标记。分子标记可以包括条形码序列。在一些实施例中,分子标记可以包含提供对与条形码杂交的靶核酸物质的具体类型的鉴定信息的核酸序列。分子标记可以包含为与条形码(例如靶结合区)杂交的靶核酸物质的具体出现次数提供计数器的核酸序列。
[0093]
在一些实施例中,一组不同的分子标记被连接到指定固体支持物(例如珠)上。在一些实施例中,可以存在或大约存在102、103、104、105、106、107、108、109个独特分子标记序列或这些值中的任意两个或两个之间的数字或范围。例如,多个条形码可以包含具有不同序列的约6561个分子标记。作为另一个实例,多个条形码可以包含具有不同序列的约65536个分子标记。在一些实施例中,可以存在至少或至多102、103、104、105、106、107、108或109个独特分子标记序列。具有独特分子标记序列的条形码可以连接至给定的固体支持物(例如珠)。
[0094]
对于使用多个随机条形码的形码化(例如随机条形码化),不同分子标记序列的数量与任何靶的出现数量的比率可以是或约是1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1,或这些值中任何两个之间的数字或范围。靶可以是包含具有相同或几乎相同序列的mrna分子的mrna种类。在一些实施例中,不同分子标记序列的数量与任何靶的出现数量的比率是至少或至多1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1或100:1。
[0095]
分子标记的长度可以是或可以约是1、2、3、4、5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。分子标记的长度可以是至少或至多1、2、3、4、5、10、15、20、25、30、35、40、45、50、100、200、或300个核苷酸。靶结合区
[0096]
条形码可包含一个或多个靶结合区,例如捕获探针。在一些实施例中,靶结合区可以与目的靶杂交。在一些实施例中,靶结合区可以包含与靶(例如靶核酸、靶分子,例如待分析的细胞核酸)例如特定基因序列特异性杂交的核酸序列。在一些实施例中,靶结合区可以包含可以连接(杂交)至特定靶核酸的特异性位置的核酸序列。在一些实施例中,靶结合区可以包含能够与限制性内切酶位点突出端(例如ecori粘性突出端)特异性杂交的核酸序列。条形码然后可以连接至包含与限制性内切位点突出端互补的序列的任何核酸分子。
[0097]
在一些实施例中,靶结合区可以包含非特异性靶核酸序列。非特异性靶核酸序列可以是指可以不依赖于靶核酸的特异性序列结合多个靶核酸的序列。例如,靶结合区可以包含随机多聚体序列,或与mrna分子上的聚(a)尾杂交的寡(dt)序列。随机多聚体序列可以是例如随机二聚体、三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体、十聚体或具有任何长度的较高的多聚体序列。在一些实施例中,靶结合区对于连接到指定珠上的所有条形码是相同的。在一些实施例中,对于连接到指定珠的多个条形码的靶结合区可以包含两个或更多个不同的靶结合序列。靶结合区的长度可以是或可以约是5、10、15、20、25、30、35、40、45、50个或者这些值中的任何两个值之间的数字或范围的核苷酸。靶结合区的长度可以是至多约5、10、15、20、25、30、35、40、45、50个或更多个核苷酸。
[0098]
在一些实施例中,靶结合区可以包含寡(dt),所述寡(dt)可以与包含聚腺苷酸化端部的mrna杂交。靶结合区可以是基因特异性的。例如,靶结合区可以被配置成杂交到靶的
特异性区域上。在一些实施例中,靶结合区不包含寡(dt)。靶结合区的长度可以是或约是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26 27、28、29、30个或者这些值中的任何两个值之间的数字或范围的核苷酸。靶结合区的长度可以是至少或至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。靶结合区的长度可以是从约5-30个核苷酸。当条形码包含基因特异性靶结合区时,条形码可以在此被称为基因特异性条形码。取向特性
[0099]
随机条形码(例如,随机条形码)可以包含可以用于定向(例如比对)条形码的一个或多个取向特性。条形码可以包含用于等电聚焦的一个部分。不同的条形码可以包含不同的等电聚焦点。当这些条形码被引入到样品时,可以使样品经受等电聚焦以便使条形码取向为已知方式。以此方式,取向特性可以用于发展样品中条形码的已知谱图。示例性取向特性可以包括电泳迁移率(例如基于条形码的大小)、等电点、自旋、导电性和/或自组装。例如,具有自组装取向特性的条形码可以在激活后自组装为特定取向(例如核酸纳米结构)。亲和特性
[0100]
条形码(例如,随机条形码)可以包括一个或多个亲和特性。例如,空间标记可以包含亲和特性。亲和特性可以包括可以有利于条形码结合到另一实体(例如细胞受体)上的化学和/或生物部分。例如,亲和特性可包含抗体,例如对样品上的特定部分(例如受体)具有特异性的抗体。在一些实施例中,抗体可以将条形码引导至特定细胞类型或分子。在特定细胞类型或分子处和/或附近的靶可以是标记的(例如随机标记的)。在一些实施例中,亲和特性还可以提供除空间标记的核苷酸序列之外的空间信息,因为抗体可以将条形码引导至特定位置。该抗体可以是治疗性抗体,例如单克隆抗体或多克隆抗体。抗体可以是人源化的或嵌合的。该抗体可以是裸抗体或融合抗体。
[0101]
抗体可以是指全长(即天然存在的或通过正常免疫球蛋白基因片段重组过程形成的)免疫球蛋白分子(例如igg抗体)或免疫球蛋白分子的免疫活性(即特异性结合)部分,如抗体片段。
[0102]
抗体片段可以是抗体的一部分,诸如f(ab
’
)2、fab
’
、fab、fv、sfv等。在一些实施例中,抗体片段可以结合通过全长抗体鉴定的相同抗原。抗体片段可以包括由抗体的可变区组成的分离片段,诸如由重链和轻链的可变区组成的“fv”片段以及其中轻链可变区和重链可变区通过肽接头(“scfv蛋白”)连接的重组单链多肽分子。示例性抗体可以包括但不限于用于癌细胞的抗体、用于病毒的抗体、结合到细胞表面受体(cd8、cd34、cd45)上的抗体以及治疗性抗体。通用衔接子引物
[0103]
条形码可以包含一个或多个通用衔接子引物。例如,基因特异性条形码,例如基因特异性随机条形码,可以包含通用衔接子引物。通用衔接子引物可以是指在所有条形码上通用的核苷酸序列。通用衔接子引物可用于构建基因特异性条形码。通用衔接子引物可以是或约是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26 27、28、29、30个或者在这些中的任何两个值之间的数值或范围的核苷酸。通用衔接子引物的长度可以是至少或至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。通用衔接子引物的长度可以是从5-30个核苷酸。
接头
[0104]
当条形码包含一个以上一种类型的标记(例如,一个以上细胞标记或一个以上条形码序列,例如一个分子标记)时,标记可以散布有接头标记序列。接头标记序列的长度可以是至少约5、10、15、20、25、30、35、40、45、50个或更多个核苷酸。接头标记序列的长度可以是至多约5、10、15、20、25、30、35、40、45、50个或更多个核苷酸。在某些情况下,接头标记序列的长度是12个核苷酸。接头标记序列可用于促进条形码的合成。接头标记可以包括纠错码(例如汉明码)。固体支持物
[0105]
在一些实施例中,本文披露的条形码,例如随机条形码,可以与固体支持物关联。固体支持物可以是例如合成颗粒。在一些实施例中,一些或全部条形码序列,例如固体支持物上多个条形码(例如,第一多个条形码)中的随机条形码(例如,第一多个条形码序列)的分子标记相差至少一个核苷酸。同一固体支持物上条形码的细胞标记可以相同。不同固体支持物上条形码的细胞标记可以相差至少一个核苷酸。例如,第一固体支持物上的第一多个条形码的第一细胞标签可以具有相同的序列,第二固体支持物上的第二多个条形码的第二细胞标签可以具有相同的序列。第一固体支持物上的第一多个条形码的第一细胞标记和第二固体支持物上的第二多个条形码的第二细胞标记可以相差至少一个核苷酸。细胞标记可以是例如约5-20个核苷酸长。条形码序列可以是例如约5-20个核苷酸长。合成颗粒可以是例如珠。
[0106]
珠可以是例如硅胶珠、可控孔度玻璃珠、磁性珠、dynabead、交联葡聚糖/交联琼脂糖珠、纤维素珠、聚苯乙烯珠、或其任何组合。珠可以包含以下材料:例如聚二甲基硅氧烷(pdms)、聚苯乙烯、玻璃、聚丙烯、琼脂糖、明胶、水凝胶、顺磁体、陶瓷、塑料、玻璃、甲基苯乙烯、丙烯酸聚合物、钛、胶乳、交联琼脂糖、纤维素、尼龙、硅酮或其任何组合。
[0107]
在一些实施例中,珠可以是用条形码或随机条形码官能化的聚合物珠,例如可变形珠或凝胶珠(例如来自10x基因公司(10x genomics)(旧金山,加利福尼亚州)的凝胶珠)。在一些实施方式中,凝胶珠可以包含基于聚合物的凝胶。凝胶珠可以例如通过将一个或多个聚合物前体包封成滴来产生。当聚合物前体暴露于促进剂(例如四甲基乙二胺(temed))后,可产生凝胶珠。
[0108]
在一些实施例中,颗粒可以是可破坏的(例如,可溶的或可降解的)。例如,聚合物珠可以例如在期望条件下溶解、熔化或降解。期望条件可以包括环境条件。期望条件可以导致聚合物珠以受控方式溶解、熔融或降解。凝胶珠可由于化学刺激、物理刺激、生物刺激、热刺激、磁刺激、电刺激、光刺激或其任何组合而溶解、熔化或降解。
[0109]
可以将分析物和/或试剂(例如寡核苷酸条形码)例如偶联/固定在凝胶珠的内表面上(例如,通过寡核苷酸条形码和/或用于产生寡核苷酸条形码的材料的扩散进入内部空间)和/或本文所述的凝胶珠或任何其他微胶囊的外表面。偶联/固定化可以通过任何形式的化学键合(例如,共价键,离子键)或物理现象(例如,范德华力,偶极-偶极相互作用等)来进行。在一些实施例中,试剂与本文所述的凝胶珠或任何其他微胶囊的偶联/固定可以是可逆的,例如经由不稳定的部分(例如,经由包括此处所述化学交联剂的化学交联剂)。在施加刺激后,不稳定部分可以被切割并释放固定化的试剂。在一些实施例中,不稳定部分是二硫键。例如,在通过二硫键将寡核苷酸条形码固定在凝胶珠上的情况下,将二硫键暴露于还原
剂可以切割二硫键并使寡核苷酸条形码从珠脱离。不稳定部分可以作为凝胶珠或微胶囊的一部分,作为将试剂或分析物与凝胶珠或微胶囊连接的化学接头的一部分和/或作为试剂或分析物的一部分而包括在内。在一些实施例中,多个条形码中的至少一个条形码可以固定在颗粒上、部分固定在颗粒上、封闭在颗粒中、部分封闭在颗粒中,或其任何组合。
[0110]
在一些实施例中,凝胶珠可包含多个不同的聚合物,包括但不限于:聚合物、热敏聚合物、光敏聚合物、磁性聚合物、ph敏感聚合物、盐敏感聚合物、化学敏感聚合物、聚电解质、多糖、肽、蛋白质和/或塑料。聚合物可以包括但不限于以下材料,例如聚(n-异丙基丙烯酰胺)(pnipaam)、聚(苯乙烯磺酸盐)(pss)、聚(烯丙基胺)(paam)、聚(丙烯酸)(paa)、聚(乙烯亚胺)(pei)、聚(二烯丙基二甲基氯化铵)(pdadmac)、聚(吡咯)(ppy)、聚(乙烯吡咯烷酮)(pvpon)、聚(乙烯基吡啶)(pvp)、聚(甲基丙烯酸)(pmaa)、聚(甲基丙烯酸甲酯)(pmma)、聚苯乙烯(ps)、聚(四氢呋喃)(pthf)、聚(邻苯二甲醛)(pthf)、聚(己基紫精)(phv)、聚(l-赖氨酸)(pll)、聚(l-精氨酸)(parg)、聚(乳酸-共-乙醇酸)(plga)。
[0111]
可以使用多种化学刺激来触发珠的破坏、溶解或降解。这些化学变化的例子可以包括但不限于ph介导的珠壁的变化,通过交联键的化学切割使珠壁崩解,触发珠壁的解聚和珠壁转换反应。容积变化也可以用于引发珠的破坏。
[0112]
通过各种刺激对微胶囊进行体积或物理改变在设计释放试剂的胶囊方面也具有许多优势。容积或物理变化发生在宏观范围内,其中珠破裂是由刺激引起的机械物理力的结果。这些过程可以包括但不限于压力引起的破裂、珠壁熔化或珠壁的孔隙率变化。
[0113]
生物刺激还可以用于引发珠的破坏、溶解或降解。通常,生物触发物类似于化学触发物,但是许多实例使用生物分子或生物系统中常见的分子,例如酶、肽、糖、脂肪酸、核酸等。例如,珠可以包含具有对特定蛋白酶的切割敏感的肽交联的聚合物。更具体地,一个实例可以包括包含gflgk肽交联的微胶囊。添加诸如蛋白酶组织蛋白酶b的生物触发物后,壳孔的肽交联被切割,珠的内容物被释放。在其他情况下,蛋白酶可以被热激活。在另一个实例中,珠包括包含纤维素的壳壁。水解酶壳聚糖的添加是纤维素键切割、壳壁解聚和释放其内部内容物的生物触发物。
[0114]
施加热刺激后,也可诱导珠释放其内容物。温度变化会可导致珠发生多种变化。热的变化可能导致珠熔化,从而使珠壁崩解。在其他情况下,热可能会增加珠内部组分的内部压力,从而使珠破裂或爆破。在其他情况下,热可以将珠转变成收缩的脱水状态。热还可以作用在珠壁内的热敏聚合物上,从而导致珠破裂。
[0115]
将磁性纳米颗粒包含到微胶囊的珠壁中可允许珠的触发破裂以及将珠引导成阵列。为了任何一个目的,本披露的设备可以包括磁珠。在一个实例中,在存在振荡磁场刺激的情况下,将fe3o4纳米颗粒掺入到包含珠的聚电解质中引发破裂。
[0116]
由于电刺激,珠也可以被破坏、溶解或降解。类似于上一部分中所述的磁性颗粒,电敏感珠可同时触发珠破裂和其他功能,例如在电场中对齐、电导率或氧化还原反应。在一个实例中,将包含电敏材料的珠在电场中对齐,使得可以控制内部试剂的释放。在其他实例中,电场可在珠壁自身内引起氧化还原反应,这可增加孔隙率。
[0117]
光刺激也可以用来破坏珠。许多光触发物都是可能的,并且可以包括使用各种分子(例如能够吸收特定波长范围的光子的纳米颗粒和发色团)的系统。例如,金属氧化物涂层可以用作胶囊触发物。涂有sio2的聚电解质胶囊的uv照射可以导致珠壁崩解。在又一个
实例中,可将光可切换材料例如偶氮苯基团掺入在珠壁中。施加uv或可见光后,此类化学药品在吸收光子后会发生可逆的顺式至反式异构化。在这个方面,光子开关的引入导致珠壁可在施加光触发物后崩解或变得更加多孔。
[0118]
例如,在图2中所示的条形码化(例如,随机条形码化)的非限制性实例中,在框208处将诸如单细胞的细胞引入微孔阵列的多个微孔之后,可以在框212将珠引入微孔阵列的多个微孔。每个微孔可包含一个珠。珠可以包含多个条形码。条形码可以包含附着在珠上的5
’
胺区。条形码可以包含通用标记、条形码序列(例如,分子标记)、靶结合区或其任何组合。
[0119]
在此披露的条形码可以与固体支持物(例如珠)关联(例如连接)。与固体支持物关联的条形码可各自包含选自包含具有独特序列的至少100或1000个条形码序列的组的条形码序列。在一些实施例中,与固体支持物关联的不同条形码可以包含具有不同序列的条形码。在一些实施例中,与固体支持物关联的条形码的一定百分比包含相同的细胞标记。例如,所述百分比可以是或约是60%、70%、80%、85%、90%、95%、97%、99%、100%或这些值中任意两个之间的数字或范围。作为另一个实例,所述百分比可以是至少或至多60%、70%、80%、85%、90%、95%、97%、99%或100%。在一些实施例中,与固体支持物关联的条形码可以具有相同的细胞标签。与不同固体支持物关联的条形码可以具有不同的细胞标记,所述细胞标记选自包含具有独特序列的至少100或1000个细胞标记的组。
[0120]
在此披露的条形码可以与固体支持物(例如珠)关联(例如连接)。在一些实施例中,对样品中的多个靶进行条形码化可以通过包括与多个条形码关联的多个合成颗粒的固体支持物执行。在一些实施例中,固体支持物可以包括与多个随机条形码关联的多个合成颗粒。不同固体支持物上的多个条形码的空间标记的区别可以在于至少一个核苷酸。固体支持物可以例如包含呈二维或三维的多个条形码。合成颗粒可以是珠。珠可以是硅胶珠、可控孔度玻璃珠、磁性珠、dynabeads、交联葡聚糖/交联琼脂糖珠、纤维素珠、聚苯乙烯珠、或其任何组合。固体支持物可以包括聚合物、基质、水凝胶、针阵列装置、抗体、或其任何组合。在一些实施例中,固体支持物可以是自由浮动的。在一些实施例中,固体支持物可以被包埋在半固体或固体阵列中。条形码可以不与固体支持物关联。条形码可以是单个核苷酸。条形码可以与基底关联。在一些实施例中,条形码可以与分配区中的单细胞相关联,所述分配区例如是滴,例如微滴,或者是基底的孔,例如微孔(例如在多孔板上)或腔室(例如在流体装置中)。示例性滴可以包括水凝胶滴。分配区中的条形码可以固定在固体支持物上,或它们可以不含溶液。
[0121]
如在此所用,术语“系接”、“连接”和“固定”可互换使用,并且可以是指用于将条形码连接到固体支持物的共价或非共价方式。多个不同的固体支持物中的任一种可以用作用于连接预先合成的条形码或用于条形码的原位固相合成的固体支持物。
[0122]
在一些实施例中,固体支持物是珠。珠可以涵盖核酸可固定(例如共价地或非共价地)在其上的固体、多孔或中空球体、球、轴承、圆柱或其他类似构型中的一种或多种类型。珠可以是例如由塑料、陶瓷、金属、聚合物材料或其任何组合组成的。珠可以是或包括离散颗粒,该离散颗粒是球形(例如微球)或具有非球形或不规则形状诸如立方体、长方体、锥形、圆柱形、圆锥形、椭圆形或圆盘形等等。在一些实施例中,珠可以是非球形形状。
[0123]
珠可以包括多种材料,包括但不限于,顺磁体材料(如镁、钼、锂和钽),超顺磁体材料(如铁氧体(fe3o4;磁铁矿)纳米粒子)、铁磁材料(例如铁、镍、钴、其一些合金以及一些稀
土金属化合物)、陶瓷、塑料、玻璃、聚苯乙烯、二氧化硅、甲基苯乙烯、丙烯酸聚合物、钛、乳胶、琼脂糖凝胶、琼脂糖、水凝胶、聚合物、纤维素、尼龙或其任何组合。
[0124]
在一些实施例中,珠(例如,标记附着于其上的珠)是水凝胶珠。在一些实施例中,珠包含水凝胶。
[0125]
本文披露的一些实施例包括一个或多个颗粒(例如,珠)。每个颗粒可以包含多个寡核苷酸(例如,条形码)。多个寡核苷酸中的每个可以包含条形码序列(例如,分子标记序列)、细胞标记和靶结合区(例如,寡(dt)序列、基因特异性序列、随机多聚体,或其组合)。多个寡核苷酸中的每个的细胞标记序列可以相同。不同颗粒上的寡核苷酸的细胞标记序列可以不同,从而可以鉴定不同颗粒上的寡核苷酸。在不同的实现方式中,不同的细胞标记序列的数量可以不同。在一些实施例中,细胞标记序列的数量可以是或约是10、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、106、107、108、109,这些值中任何两个之间的数字或范围,或更大。在一些实施例中,细胞标记序列的数量可以是至少或至多10、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、106、107、108或109。在一些实施例中,多个颗粒中的不超过1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000或更多个包括具有相同细胞序列的寡核苷酸。在一些实施例中,包括具有相同细胞序列的寡核苷酸的多个颗粒可以是至多0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%或更多。在一些实施例中,多个颗粒中没有颗粒具有相同的细胞标记序列。
[0126]
每个颗粒上的多个寡核苷酸可包含不同的条形码序列(例如,分子标记)。在一些实施例中,条形码序列的数量可以是或约是10、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、106、107、108、109,或这些值中任何两个之间的数字或范围。在一些实施例中,条形码序列的数量可以是至少或至多10、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、106、107、108或109。例如,多个寡核苷酸中的至少100个包含不同的条形码序列。作为另一个实例,在单个颗粒中,多个寡核苷酸中的至少100、500、1000、5000、10000、15000、20000、50000个、这些值中的任何两个之间的数量或范围、或者更多个包含不同的条形码序列。一些实施例提供了多个包含条形码的颗粒。在一些实施例中,有待标记的靶的出现(或拷贝或数量)与不同条形码序列的比率可以是至少1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90或更多。在一些实施例中,多个寡核苷酸中的每个进一步包含样品标记、通用标记或两者。颗粒可以是例如纳米颗粒或微粒。
[0127]
珠的大小可以变化。例如,珠的直径可以在0.1微米至50微米的范围内。在一些实施例中,珠的直径可以是或约是0.1、0.5、1、2、3、4、5、6、7、8、9、10、20、30、40、50微米,或这些值中任何两个之间的数字或范围。
[0128]
珠的直径可以与基底的孔直径相关。在一些实施例中,珠的直径可以比孔的直径长或短或约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或这些值中任何两个之间的数字或范围。珠的直径可以与细胞(例如由基底的孔截留的单细胞)直径相关。在一些实施例中,例如,珠的直径可以比孔的直径长或短至少或至多10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。珠的直径可以与细胞(例如由基底的孔截留的单细胞)直径相关。在一些实施例中,珠的直径可以比细胞的直径长或短或约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%或这些值中任何两个之间的数字或范围。在一些实施例中,例如,珠的直径可以比细胞的直径长或短至少或至多10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%或300%。
[0129]
珠可以连接到和/或包埋在基底中。珠可以连接到和/或包埋在凝胶、水凝胶、聚合物和/或基质中。珠在基底(例如凝胶、基质、支架或聚合物)中的空间位置可以使用珠上条形码上存在的可以充当位置地址的空间标记鉴定。
[0130]
珠的实例可以包括但不限于链霉亲和素珠、琼脂糖珠、磁性珠、微珠、抗体缀合的珠(例如抗免疫球蛋白微珠)、蛋白质a缀合的珠、蛋白g缀合的珠、蛋白a/g缀合的珠、蛋白l缀合的珠、寡(dt)缀合的珠、二氧化硅珠、二氧化硅样珠、抗生物素微珠、抗荧光染料微珠以及bcmag
tm
羧基末端的磁性珠。
[0131]
珠可以关联有(例如浸渗有)量子点或荧光染料以使得其在一个荧光光学通道或多个光学通道中发荧光。珠可以与氧化铁或氧化铬关联以使得其具有顺磁性或铁磁性。珠可以是可鉴定的。例如,可以使用照相机对珠进行成像。珠可以具有与珠关联的可检测编码。例如,珠可以包含条形码。珠可以例如由于在有机或无机溶液中的溶胀而改变大小。珠可以是疏水性的。珠可以是亲水性的。珠可以是生物相容的。
[0132]
固体支持物(例如珠)可以是可视化的。固体支持物可以包含可视化标签(例如荧光染料)。固体支持物(例如珠)可以被蚀刻有标识符(例如数字)。标识符可以通过对珠进行成像来可视化。
[0133]
固体支持物可以包含不溶性、半溶性或不溶性材料。当固体支持物包含接头、支架、构建块或连接到其上的其他反应性部分时它可以被称为“官能化的”,然而,当固体支持物没有连接到其上的这种反应性部分时它可以被称为“非官能化的”。固体支持物可以下述形式采用:游离于溶液中,诸如以微量滴定孔形式;以流通形式,诸如在柱中;或在测试条(dipstick)中。
[0134]
固体支持物可以包括膜、纸、塑料、涂覆表面、平表面、玻璃、载玻片、芯片或其任何组合。固体支持物可以呈树脂、凝胶、微球或其他几何构型的形式。固体支持物可以包含二氧化硅芯片、微粒、纳米颗粒、板、阵列、毛细管、板支持物诸如玻璃纤维过滤器、玻璃表面、金属表面(钢铁、金、银、铝、硅以及铜)、玻璃支持物、塑料支持物、硅支持物、芯片、过滤器、膜、微孔板、载玻片、塑料材料包括多孔板或膜(例如由聚乙烯、聚丙烯、聚酰胺、聚偏氟乙烯形成的)、和/或晶片、梳状物、插针或针(例如适合于组合性合成或分析的插针阵列)或平表面诸如晶片(硅晶片)、带有具有或不具有滤底的凹陷的晶片的凹陷或纳升孔的阵列中的珠。
[0135]
固体支持物可以包含聚合物基质(例如,凝胶,水凝胶)。聚合物基质可以能够渗透细胞内空间(例如在细胞器周围)。聚合物基质可以能够被泵送贯穿整个循环系统。
基底和微孔阵列
[0136]
如本文所用,基底可以指固体支持物的类型。基底可以是指可以包含本披露的条形码随机条形码的固体支持物。基底可以例如包含多个微孔。例如,基底可以是包含两个或更多个微孔的孔阵列。在一些实施例中,微孔可以包括限定体积的小反应室。在一些实施例中,微孔可以截留一个或多个细胞。在一些实施例中,微孔可以仅截留一个细胞。在一些实施例中,微孔可以截留一个或多个固体支持物。在一些实施例中,微孔可以仅截留一个固体支持物。在一些实施例中,微孔截留单细胞和单个固体支持物(例如珠)。微孔可包含本披露的条形码试剂。条形码化方法
[0137]
本披露提供了用于估计身体样品(例如,组织、器官、肿瘤、细胞)中的不同位置处的不同靶的数量的方法。这些方法可以包括将条形码(例如,随机条形码)放置成紧密接近样品、裂解样品、使不同的靶与条形码关联、扩增靶并且/或者数字计数靶。该方法可以进一步包括分析和/或可视化从条形码上的空间标记获得的信息。在一些实施例中,方法包括可视化样品中的多个靶。将多种靶映射到样品的谱图上可以包括产生样品的二维谱图或三维谱图。二维谱图和三维谱图可在对样品中的多个靶进行条形码化(例如,随机条形码化)之前或之后产生。可视化样品中的多种靶可以包括将多种靶映射到样品的谱图(map)上。将多种靶映射到样品的谱图上可以包括产生样品的二维谱图或三维谱图。二维谱图和三维谱图可在对样品中的多个靶进行条形码化之前或之后产生。在一些实施例中,二维谱图和三维谱图可以在裂解样品之前产生。在产生二维谱图或三维谱图之前或之后裂解样品可以包括加热样品、使样品与洗涤剂接触、改变样品的ph、或其任何组合。
[0138]
在一些实施例中,对多个靶进行条形码化包括将多个条形码与多个靶进行杂交以产生经条形码化的靶(例如,经随机经条形码化的靶)。对多个靶进行条形码化可以包括产生经条形码化的靶的索引文库。可以使用包括多个条形码(例如,随机条形码)的固体支持物来执行经条形码化的靶的索引文库的产生。使样品和条形码接触
[0139]
本披露提供了用于使样品(例如细胞)与本披露的基底接触的方法。可以使包括例如细胞、器官或组织薄切片的样品与条形码(例如,随机条形码)接触。可以例如通过重力流动接触细胞,其中细胞可以沉降并且产生一个单层。样品可以是组织薄切片。薄切片可以置于基底上。样品可以是一维的(例如,形成平面)。样品(例如细胞)可以例如通过使细胞生长/培养在基底上而铺开在基底上。
[0140]
当条形码紧密接近靶时,靶可以与条形码杂交。可以非可消耗比接触条形码,使得每个不同的靶可以与本披露的不同的条形码关联。为了确保靶与条形码之间的有效关联,靶可以交联至条形码。细胞裂解
[0141]
在分布细胞和条形码之后,可以裂解细胞以释放靶分子。细胞裂解可以通过多种方式中的任何一种完成,例如通过化学或生化方式、通过渗透压休克或通过热裂解、机械裂解或光线裂解。细胞可以通过添加以下各项来裂解:包含洗涤剂(例如sds、十二烷基硫酸锂、triton x-100、吐温-20或np-40)的细胞裂解缓冲液、有机溶剂(例如甲醇或丙酮)或消化酶(例如蛋白酶k、胃蛋白酶或胰蛋白酶)或其任何组合。为了增加靶和条形码的关联,可
以通过例如降低温度和/或增加裂解物的粘度改变靶分子的扩散速率。
[0142]
在一些实施例中,样品可以使用滤纸裂解。滤纸可以用在滤纸之上的裂解缓冲液浸湿。可以在可以有助于样品的裂解和样品的靶与基底的杂交的压力存在下,将滤纸施加至样品。
[0143]
在一些实施例中,裂解可以通过机械裂解、热裂解、光学裂解和/或化学裂解执行。化学裂解可以包括使用消化酶诸如蛋白酶k、胃蛋白酶和胰蛋白酶。裂解可以通过向基底添加裂解缓冲液来执行。裂解缓冲液可以包含tris hcl。裂解缓冲液可以包括至少约0.01m、0.05m、0.1m、0.5m、或1m或更多tris hcl。裂解缓冲液可以包括至多约0.01m、0.05m、0.1m、0.5m、或1m或更多tris hcl。裂解缓冲液可以包含约0.1m tris hcl。裂解缓冲液的ph可以是至少约1、2、3、4、5、6、7、8、9、10,或更高。裂解缓冲液的ph可以是至多约1、2、3、4、5、6、7、8、9、10,或更高。在一些实施例中,裂解缓冲液的ph是约7.5。裂解缓冲液可以包含盐(例如licl)。在裂解缓冲液中盐的浓度可以是至少约0.1m、0.5m、或1m、或更高。在裂解缓冲液中盐的浓度可以是至多约0.1m、0.5m、或1m、或更高。在一些实施例中,裂解缓冲液中盐的浓度是约0.5m。裂解缓冲液中可以包含洗涤剂(例如sds、十二烷基硫酸锂、triton x、吐温、np-40)。裂解缓冲液中洗涤剂的浓度可以是至少约0.0001%、0.0005%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、2%、3%、4%、5%、6%、或7%或更高。裂解缓冲液中洗涤剂的浓度可以是至多约0.0001%、0.0005%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、2%、3%、4%、5%、6%或7%或更高。在一些实施例中,裂解缓冲液中洗涤剂的浓度是约1%十二烷基硫酸锂。裂解方法中使用的时间可以取决于使用的洗涤剂的量。在一些实施例中,使用的洗涤剂越多,裂解需要的时间越少。裂解缓冲液可以包含螯合剂(例如edta、egta)。裂解缓冲液中螯合剂的浓度可以是至少约1、5、10、15、20、25或30mm或更高。裂解缓冲液中螯合剂的浓度可以是至多约1、5、10、15、20、25或30mm或更高。在一些实施例中,裂解缓冲液中螯合剂的浓度是约10mm。裂解缓冲液可以包含还原剂(例如β-巯基乙醇、dtt)。裂解缓冲液中还原剂的浓度可以是至少约1、5、10、15、或20mm或更高。裂解缓冲液中还原剂的浓度可以是至多约1、5、10、15、或20mm或更高。在一些实施例中,裂解缓冲液中还原剂的浓度是约5mm。在一些实施例中,裂解缓冲液可以包含约0.1m trishcl、约ph 7.5、约0.5m licl、约1%十二烷基硫酸锂、约10mm edta以及约5mm dtt。
[0144]
裂解可以在约4℃、10℃、15℃、20℃、25℃或30℃的温度下执行。裂解可以执行约1、5、10、15或20或更多分钟。裂解细胞可以包含至少约100000、200000、300000、400000、500000、600000或700000个或更多个靶核酸分子。裂解细胞可以包含至多约100000、200000、300000、400000、500000、600000或700000个或更多个靶核酸分子。条形码连接到靶核酸分子上
[0145]
在裂解细胞并使核酸分子从其释放之后,核酸分子可以与共定位的固体支持物的条形码随机地关联。关联可以包括条形码的靶识别区与靶核酸分子的互补部分的杂交(例如条形码的寡(dt)可以与靶的聚(a)尾相关作用)。用于杂交的测定条件(例如缓冲液ph、离子强度、温度等)可以被选择以促进特定的稳定性杂交体的形成。在一些实施例中,从裂解的细胞中释放的核酸分子可以与基底上的多个探针关联(例如与基底上的探针杂交)。当探针包含寡(dt)时,mrna分子可以与探针杂交并且进行逆转录。寡核苷酸的寡(dt)部分可以充当用于cdna分子的第一链合成的引物。例如,在图2中所示的条形码的非限制性实例中,
在框216,mrna分子可以与珠上的条形码杂交。例如,单链核苷酸片段可以与条形码的靶结合区杂交。
[0146]
连接可以进一步包括将条形码的靶识别区与靶核酸分子的一部分连接。例如,靶结合区可以包括可能够与限制性位点突出端(例如,ecori粘性末端突出端)进行特异性杂交的核酸序列。测定程序可以进一步包括用限制性内切酶(例如ecori)处理靶核酸以产生限制位点突出端。条形码然后可以连接至包含与限制性内切位点突出端互补的序列的任何核酸分子。连接酶(例如t4 dna连接酶)可以用于接合两个片段。
[0147]
例如,在图2中所示的条形码的非限制性实例中,在框220处,来自多个细胞(或多个样品)的经标记的靶(例如,靶-条形码分子)可以随后合并到例如管中。可以通过例如回收条形码和/或与靶-条形码分子连接的珠来合并经标记的靶。
[0148]
连接的靶-条形码分子的基于固体支持物的集合体的收回可以通过使用磁性珠和外部施加的磁场来实现。一旦靶-条形码分子已被合并,所有进一步的加工可以在单一反应器中进行。另外的加工可以包括例如逆转录反应、扩增反应、切割反应、解离反应和/或核酸延伸反应。另外的加工反应可以在微孔内进行,也就是说,无需首先合并来自多个细胞的标记的靶核酸分子。逆转录
[0149]
本披露提供了一种用于使用逆转录产生靶-条形码缀合物的方法(例如,在图2的框224处)。靶-条形码缀合物可以包含条形码和靶核酸(即,经条形码化的cdna分子,例如经随机经条形码化的cdna分子)的全部或一部分的互补序列。关联的rna分子的逆转录可以通过添加逆转录引物以及逆转录酶发生。逆转录引物可以是寡(dt)引物、随机的六核苷酸引物或靶特异性寡核苷酸引物。寡(dt)引物可以是或可以约是12-18个核苷酸的长度并且结合哺乳动物mrna的3
’
末端处的内源性聚(a)尾。随机的六核苷酸引物可以在多个互补位点处结合mrna。靶特异性寡核苷酸引物典型选择性地引发目的mrna。
[0150]
在一些实施例中,标记的rna分子的逆转录可以通过添加逆转录引物发生。在一些实施例中,逆转录引物是寡(dt)引物、随机的六核苷酸引物或靶特异性寡核苷酸引物。一般来讲,寡(dt)引物是约12-18个核苷酸的长度并且结合哺乳动物mrna的3
’
末端处的内源性聚(a)尾。随机的六核苷酸引物可以在多个互补位点处结合mrna。靶特异性寡核苷酸引物典型选择性地引发目的mrna。
[0151]
逆转录可以重复地发生以产生多个标记的cdna分子。在此披露的方法可以包括进行至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次逆转录反应。该方法可以包括进行至少约25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100次逆转录反应。扩增
[0152]
可以执行一次或多次核酸扩增反应(例如,在图2的框228处)以产生经标记的靶核酸分子的多个拷贝。扩增可以多重复路方式执行,其中多个靶核酸序列同时进行扩增。扩增反应可以用于向核酸分子添加测序衔接子。扩增反应可以包括扩增样品标记(若存在的话)的至少一部分。扩增反应可以包括扩增细胞标记和/或条形码序列(例如,分子标记)的至少一部分。扩增反应可以包括扩增样品标签、细胞标记、空间标记、条形码序列(例如,分子标记)、靶核酸或其组合的至少一部分。扩增反应可以包括扩增多个核酸的0.5%、1%、2%、
3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%、100%或在这些值的任何两个值之间的范围或数值。该方法可以进一步包括进行一次或多次cdna合成反应以产生包含样品标记、细胞标记、空间标记和/或条形码序列(例如,分子标记)的靶-条形码分子的一个或多个cdna拷贝。
[0153]
在一些实施例中,扩增可以使用聚合酶链式反应(pcr)执行。如在此所用,pcr可以是指用于通过同时引物延伸dna的互补链进行特定dna序列的体外扩增的反应。如在此所用,pcr可以涵盖反应的衍生形式,包括但不限于rt-pcr、实时pcr、巢式pcr、定量pcr、多重pcr、数字pcr以及组装pcr。
[0154]
标记的核酸的扩增可以包括基于非pcr的方法。基于非pcr的方法的实例包括但不限于多重置换扩增(mda)、转录介导的扩增(tma)、基于核酸序列的扩增(nasba)、链置换扩增(sda)、实时sda、滚环扩增或环-对-环扩增。其他基于非pcr的方法包括用于扩增dna或rna靶的dna依赖性rna聚合酶驱动的rna转录扩增或rna指导的dna合成和转录的多个循环、连接酶链式反应(lcr)和qβ复制酶(qβ)方法、使用回文探针、链置换扩增、使用限制性内切酶的寡核苷酸驱动的扩增、其中引物与核酸序列杂交并且所得双链体在延伸反应和扩增之前被切割的扩增方法、使用缺乏5
’
外切核酸酶活性的核酸聚合酶的链置换扩增、滚环扩增以及分枝式延伸扩增(ram)。在一些实施例中,扩增不产生环化的转录物。
[0155]
在一些实施例中,本文披露的方法进一步包括对经标记的核酸(例如,经标记的rna、经标记的dna、经标记的cdna)进行聚合酶链式反应,以产生经标记的扩增子(例如,经随机标记的扩增子)。经标记的扩增子可以是双链分子。双链分子可以包括双链rna分子、双链dna分子或与dna分子杂交的rna分子。双链分子的一条或两条链可以包含样品标记、空间标记、细胞标记和/或条形码序列(例如分子标记)。经标记的扩增子可以是单链分子。单链分子可以包括dna、rna或其组合。本披露的核酸可以包括合成的或改变的核酸。
[0156]
扩增可以包括使用一个或多个非天然核苷酸。非天然核苷酸可以包括光不稳定性或可触发的核苷酸。非天然核苷酸的实例可以包括但不限于肽核酸(pna)、吗啉代和锁核酸(lna)以及二醇核酸(gna)和苏糖核酸(tna)。非天然核苷酸可以添加到扩增反应的一个或多个循环。非天然核苷酸的添加可以用于鉴定扩增反应中特定循环或时间点的产物。
[0157]
进行一次或多次扩增反应可以包括使用一个或多个引物。一个或多个引物可以包含例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个或更多个核苷酸。一个或多个引物可以包含至少1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个或更多个核苷酸。一个或多个引物可以包含小于12-15个核苷酸。一个或多个引物可以退火至多个经标记的靶(例如,经随机标记的靶)的至少一部分。一个或多个引物可以退火至多个经标记的靶的3
’
末端或5
’
末端。一个或多个引物可以退火至多个经标记的靶的内部区域。内部区域可以是自多个经标记的靶的3
’
末端的至少约50、100、150、200、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、650、700、750、800、850、900或1000个核苷酸。一个或多个引物可以包括一组固定引物。一个或多个引物可以包括至少一个或多个定制引物。一个或多个引物可以包括至少一个或多个对照引物。一个或多个引物可以包括至少一个或多个基因特异性引物。
[0158]
一个或多个引物可以包括通用引物。通用引物可以退火至通用引物结合位点。一个或多个定制引物可以退火至第一样品标记、第二样品标记、空间标记、细胞标记、条形码序列(例如,分子标记)、靶或其任何组合。一个或多个引物可以包括通用引物和定制引物。定制引物可以被设计用于扩增一个或多个靶。靶可以包括一个或多个样品中总核酸的亚组。靶可以包括一个或多个样品中总的标记的靶的亚组。一个或多个引物可以包括至少96个或更多个定制引物。一个或多个引物可以包括至少960个或更多个定制引物。一个或多个引物可以包括至少9600个或更多个定制引物。一个或多个定制引物可以退火至两个或更多个不同的标记的核酸。两个或更多个不同的标记的核酸可以对应于一个或多个基因。
[0159]
任何扩增方案可以用于本披露的方法中。例如,在一种方案中,第一轮pcr可以使用基因特异性引物和针对通用illumina测序引物1序列的引物扩增连接到珠的分子。第二轮pcr可以使用侧接illumina测序引物2序列的巢式基因特异性引物和针对通用illumina测序引物1序列的引物扩增第一pcr产物。第三轮pcr添加p5和p7以及样品索引以将pcr产物转入到illumina测序文库中。使用150bp
×
2测序的测序可以揭示读段1上的细胞标记和条形码序列(例如分子标记)、读段2上的基因和索引1读段上的样品索引。
[0160]
在一些实施例中,可以使用化学切割将核酸从基底去除。例如,可以使用核酸中存在的化学基团或修饰碱基来有助于其从固体支持物的去除。例如,可以使用酶将核酸从基底去除。例如,可以通过限制性内切核酸酶(在本文中也称为“限制性内切酶”)消化从底物去除核酸。例如,用尿嘧啶-d-糖基化酶(udg)处理含有dutp或ddutp的核酸可以用于将核酸从基底去除。例如,可以使用执行核苷酸切除的酶诸如碱基切除修复酶诸如脱嘌呤/脱嘧啶(ap)将核酸从基底去除。在一些实施例中,可以使用光可切割的基团和光将核酸从基底去除。在一些实施例中,可以使用可切割接头将核酸从基底去除。例如,可切割接头可以包括生物素/抗生物素蛋白、生物素/链霉亲和素、生物素/中性链亲和素、ig蛋白a、光不稳定性接头、酸或碱不稳定性接头或适体中的至少一种。
[0161]
当探针是基因特异性的时,分子可以与探针杂交并且进行逆转录和/或扩增。在一些实施例中,在核酸已合成(例如逆转录)之后,可以对其进行合成。扩增可以多重复路方式执行,其中多个靶核酸序列同时进行扩增。扩增可以向核酸添加测序衔接子。
[0162]
在一些实施例中,扩增可以在基底上例如以桥式扩增执行。可以对cdna进行同聚物加尾以产生用于使用基底上的寡(dt)探针进行的桥式扩增的相容性端。在桥式扩增中,与模板核酸的3
’
末端互补的引物可以是每对中共价地连接到固体颗粒的第一引物。当含有模板核酸的样品与颗粒接触并且执行单个热循环时,模板分子可以退火至第一引物并且通过添加核苷酸使第一引物在正向方向上延长以形成由模板分子和与模板互补的新形成的dna组成的双链体分子。在下一循环的加热步骤中,可以使双链体分子变性,从而模板分子从颗粒中释放并且留下通过第一引物连接到颗粒的互补dna链。在随后进行的退火和延长步骤的退火阶段中,互补链可以与第二引物杂交,该第二引物与从第一引物去除的位置处的互补链的区段互补。这种杂交可以使得互补链在第一引物与第二引物之间形成桥,该桥通过共价键固定到第一引物并且通过杂交固定到第二引物。在延长阶段中,可以通过在相同反应混合物中添加核苷酸使第二引物在反向方向上延长,从而将桥转化为双链桥。然后开始下一循环,并且可以使双链桥变性以产生两个单链的核酸分子,每个核酸分子具有经由第一引物和第二引物连接到颗粒的一端,并且每个核酸分子的另一端是未连接的。在这
个第二循环的退火和延长步骤中,每个链可以与相同颗粒上的先前未使用的另外的互补引物杂交以形成新的单链桥。现在杂交的两种先前未使用的引物进行延长以将两个新桥转化为双链桥。
[0163]
扩增反应可以包括扩增多个核酸的至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%或100%。
[0164]
标记的核酸的扩增可以包括基于pcr的方法或基于非pcr的方法。标记的核酸的扩增可以包括标记的核酸的指数式扩增。标记的核酸的扩增可以包括标记的核酸的线性扩增。扩增可以通过聚合酶链式反应(pcr)执行。pcr可以是指用于通过同时引物延伸dna的互补链进行特定dna序列的体外扩增的反应。pcr可以涵盖反应的衍生形式,包括但不限于rt-pcr、实时pcr、巢式pcr、定量pcr、多重pcr、数字pcr、抑制pcr、半抑制pcr以及组装pcr。
[0165]
在一些实施例中,标记的核酸的扩增包括基于非pcr的方法。基于非pcr的方法的实例包括但不限于多重置换扩增(mda)、转录介导的扩增(tma)、基于核酸序列的扩增(nasba)、链置换扩增(sda)、实时sda、滚环扩增或环-对-环扩增。其他基于非pcr的方法包括用于扩增dna或rna靶的dna依赖性rna聚合酶驱动的rna转录扩增或rna指导的dna合成和转录的多个循环、连接酶链式反应(lcr)、qβ复制酶(qβ)、使用回文探针、链置换扩增、使用限制性内切核酸酶的寡核苷酸驱动的扩增、其中引物与核酸序列杂交并且所得双链体在延伸反应和扩增之前被切割的扩增方法、使用缺乏5
’
外切核酸酶活性的核酸聚合酶的链置换扩增、滚环扩增和/或分枝式延伸扩增(ram)。
[0166]
在一些实施例中,在此披露的方法进一步包括在扩增的扩增子(例如靶)上进行巢式聚合酶链式反应。扩增子可以是双链分子。双链分子可以包括双链rna分子、双链dna分子或与dna分子杂交的rna分子。双链分子的一条或两条链可以包含样品标签或分子标识符标记。可替代地,扩增子可以是单链分子。单链分子可以包括dna、rna或其组合。本文所述的核酸可包含合成的或改变的核酸。
[0167]
在一些实施例中,该方法包括重复地扩增标记的核酸以产生多个扩增子。在此披露的方法可以包括进行至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次扩增反应。可替代地,该方法包括进行至少约25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100次扩增反应。
[0168]
扩增可以进一步包括将一个或多个对照核酸添加到包含多个核酸的一个或多个样品。扩增可以进一步包括将一个或多个对照核酸添加到多个核酸。对照核酸可以包含对照标记。
[0169]
扩增可以包括使用一个或多个非天然核苷酸。非天然核苷酸可以包括光不稳定性和/或可触发的核苷酸。非天然核苷酸的实例包括但不限于肽核酸(pna)、吗啉代和锁核酸(lna)以及二醇核酸(gna)和苏糖核酸(tna)。非天然核苷酸可以添加到扩增反应的一个或多个循环。非天然核苷酸的添加可以用于鉴定扩增反应中特定循环或时间点的产物。
[0170]
进行一次或多次扩增反应可以包括使用一个或多个引物。一个或多个引物可以包括一个或多个寡核苷酸。一个或多个寡核苷酸可以包含至少约7-9个核苷酸。一个或多个寡核苷酸可以包含小于12-15个核苷酸。一个或多个引物可以退火至多个标记的核酸的至少一部分。一个或多个引物可以退火至多个标记的核酸的3
’
末端和/或5
’
末端。一个或多个引
物可以退火至多个标记的核酸的内部区域。内部区域可以是自多个经标记的核酸的3
’
末端的至少约50、100、150、200、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、650、700、750、800、850、900或1000个核苷酸。一个或多个引物可以包括一组固定引物。一个或多个引物可以包括至少一个或多个定制引物。一个或多个引物可以包括至少一个或多个对照引物。一个或多个引物可以包括至少一个或多个管家基因引物。一个或多个引物可以包括通用引物。通用引物可以退火至通用引物结合位点。一个或多个定制引物可以退火至第一样品标签、第二样品标签、分子标识符标记、核酸或其产物。一个或多个引物可以包括通用引物和定制引物。定制引物可以被设计用于扩增一个或多个靶核酸。靶核酸可以包括一个或多个样品中总核酸的亚组。在一些实施例中,引物是连接到本披露的阵列的探针。
[0171]
在一些实施例中,对样品中的多个靶进行条形码化(例如,随机条形码化)还包括产生经条形码化的靶(例如,经随机经条形码化的靶)或经条形码化的靶片段的索引文库。不同条形码的条形码序列(例如,不同随机条形码的分子标记)可以彼此是不同的。产生经条形码化的靶的索引文库包括由样品中的多个靶产生多个索引的多核苷酸。例如,对于包含第一索引的靶和第二索引的靶的经条形码化的靶的索引文库,第一索引的多核苷酸的标记区与第二索引的多核苷酸的标记区的区别可以在于,在于约,在于至少或在于至多1、2、3、4、5、6、7、8、9、10、20、30、40、50个核苷酸,或这些值中的任何两个之间的数字或范围。在一些实施例中,产生经条形码化的靶的索引文库包括使多个靶例如mrna分子与多个寡核苷酸(包含聚(t)区和标记区)接触;并且使用逆转录酶进行第一链合成以产生单链标记的cdna分子,每个cdna分子包含cdna区和标记区,其中多个靶包括具有不同序列的至少两个mrna分子并且多个寡核苷酸包括具有不同序列的至少两个寡核苷酸。产生经条形码化的靶的索引文库可以进一步包括扩增单链标记的cdna分子,以产生经双链标记的cdna分子;并且对双链标记的cdna分子进行巢式pcr,以产生标记的扩增子。在一些实施例中,该方法可以包括产生经衔接子标记的扩增子。
[0172]
条形码化(例如,随机条形码化)可以使用核酸条形码或标签标记单独的核酸(例如dna或rna)分子。在一些实施例中,当cdna分子由mrna产生时,随机条形码化涉及将dna条形码或标签添加到cdna分子中。巢式pcr可以被进行来使pcr扩增偏移最小化。衔接子可以被添加来使用例如下一代测序(ngs)进行测序。测序结果可用于确定靶的一个或多个拷贝的细胞标记、分子标记和核苷酸片段序列,例如在图2的框232处。
[0173]
图3是显示用于产生经条形码化的靶(例如经随机经条形码化的靶)(例如经条形码化的mrna或其片段)的索引文库的非限制性示例性过程的示意图。如步骤1所示,逆转录过程可编码具有独特分子标记序列、细胞标记序列和通用pcr位点的每个mrna分子。具体地,通过将一组条形码(例如随机条形码)310与rna分子302的聚(a)尾区308杂交(例如随机杂交),rna分子302可以被逆转录来产生经标记的cdna分子304(包括cdna区306)。条形码310中的每个可以包含靶结合区,例如聚(dt)区312、标记区314(例如条形码序列或分子)和通用pcr区316。
[0174]
在一些实施例中,细胞标记序列可以包含3至20个核苷酸。在一些实施例中,分子标记序列可以包含3至20个核苷酸。在一些实施例中,多个随机条形码中的每个进一步包含
通用标记和细胞标记中的一个或多个,其中通用标记对于固体支持物上的多个随机条形码是相同的并且细胞标记对于固体支持物上的多个随机条形码是相同的。在一些实施例中,通用标记可以包含3至20个核苷酸。在一些实施例中,细胞标记包含3至20个核苷酸。
[0175]
在一些实施例中,标记区314可以包含条形码序列或分子标记318和细胞标记320。在一些实施例中,标记区314可以包含通用标记、维标记以及细胞标记中的一个或多个。条形码序列或分子标记318的长度可以是,可以是约,可以是至少或可以是至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100个或者在这些值中的任何值之间的数值或范围的核苷酸。细胞标记320的长度可以是,可以是约,可以是至少,或可以是至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100个或者在这些值中的任何值之间的数值或范围的核苷酸。通用标记的长度可以是,可以是约,可以是至少或可以是至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100个或者在这些值中的任何值之间的数值或范围的核苷酸。通用标记对于固体支持物上的多个随机条形码可以是相同的并且细胞标记对于固体支持物上的多个随机条形码可以是相同的。维标记的长度可以是,可以是约,可以是至少,或可以是至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100个或者在这些值中的任何值之间的数值或范围的核苷酸。
[0176]
在一些实施例中,标记区314可以包含,包含约,包含至少或包含至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000个或者在这些值中的任何值之间的数值或范围的不同标记,诸如条形码序列或分子标记318和细胞标记320。每个标记的长度可以是,可以是约,可以是至少或可以是至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100个或者在这些值中的任何值之间的数值或范围的核苷酸。条形码或随机条形码310的组可以包含,包含约,包含至少或包含至多10、20、40、50、70、80、90、102、103、104、105、106、107、108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
、10
20
或这些值中的任何值之间的数值或范围的条形码或随机条形码310。并且,条形码或随机条形码310的组可以例如各自包含独特标记区314。经标记的cdna分子304可以被纯化以去除多余的条形码或随机条形码310。纯化可以包括ampure珠纯化。
[0177]
如步骤2所示,来自步骤1的逆转录过程的产物可以合并到1个管中并且使用第1pcr引物库和第1通用pcr引物进行pcr扩增。由于独特的标记区314,合并是可能的。具体地,标记的cdna分子304可以被扩增来产生巢式pcr标记的扩增子322。扩增可以包括多重pcr扩增。扩增可以包括在单一反应体积中使用96种多重引物进行的多重pcr扩增。在一些实施例中,多重pcr扩增可以利用,利用约,利用至少或利用至多10、20、40、50、70、80、90、102、103、104、105、106、107、108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
、10
20
个或者在这些值中的任何值之间的数值或范围的多重引物。扩增可以包括使用第一pcr引物池324,其包含靶向特定基因的定制引物326a-c和通用引物328。定制引物326可以与经标记的cdna分子304的cdna部分306
’
内的区域杂交。通用引物328可以与经标记的cdna分子304的通用pcr区316杂交。
[0178]
如图3的步骤3所示,来自步骤2的pcr扩增的产物可以用巢式pcr引物库和第2通用pcr引物扩增。巢式pcr可以使pcr扩增偏移最小化。具体地,巢式pcr标记的扩增子322可以通过巢式pcr进一步扩增。巢式pcr可以包括在单一反应体积中使用巢式pcr引物332a-c的巢式pcr引物池330和第2通用pcr引物328
’
进行多重pcr。巢式pcr引物池328可以包含,包含
约,包含至少或包含至多1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000个或者在这些值中的任何值之间的数值或范围的不同巢式pcr引物330。巢式pcr引物332可以含有衔接子334并且与经标记的扩增子322的cdna部分306”内的区域杂交。通用引物328
’
可以含有衔接子336并且与标记的扩增子322的通用pcr区316杂交。因此,步骤3产生衔接子标记的扩增子338。在一些实施例中,巢式pcr引物332和第2通用pcr引物328
’
可以不含有衔接子334和336。衔接子334和336反而可以连接至巢式pcr的产物,以产生经衔接子标记的扩增子338。
[0179]
如步骤4所示,来自步骤3的pcr产物可以使用文库扩增引物进行pcr扩增以用于测序。具体地,衔接子334和336可以用于对衔接子标记的扩增子338进行一种或多种另外的测定。衔接子334和336可以与引物340和342杂交。一个或多个引物340和342可以是pcr扩增引物。一个或多个引物340和342可以是测序引物。一个或多个衔接子334和336可以用于进一步扩增经衔接子标记的扩增子338。一个或多个衔接子334和336可以用于对经衔接子标记的扩增子338进行测序。引物342可以包含板索引344,从而可以使用下一代测序(ngs)在一个测序反应中对使用同一组条形码或随机条形码310产生的扩增子进行测序。多组学分析
[0180]
本文披露包括用于高通量样品分析的方法的实施例。所述方法可与用于用单个颗粒分配单细胞的任何样品分析平台或系统一起使用,例如基于以下的平台和系统:滴(例如,chromium
tm
单细胞3
’
溶液(10x基因组公司(10x genomics(旧金山,加利福尼亚州)),微孔(例如,rhapsody
tm
测定(贝克顿迪金森公司(富兰克林湖,新泽西州)),微流腔室和图案化的基底。所述方法可以捕获多组信息,包括基因组、基因组可接近性(例如染色质可接近性)、以及甲基化组。所述方法可与用于转录组学分析、蛋白质组学分析和/或样品跟踪的方法一起使用。使用条形码化进行蛋白质组学分析已经在公开为us 2018/0088112的美国申请号15/715028中进行了描述,其内容通过引用整体并入本文。使用条形码化进行样品跟踪已经在公开为us 2018/0346970的美国申请号15/937,713中进行了描述,其内容通过引用整体并入本文。在一些实施例中,可以使用条形码化获得单细胞的多组学信息,例如基因组学、染色质可接近性、甲基化组学、转录组学和蛋白质组学。
[0181]
在一些实施例中,该方法包括在基因组dna片段的末端附加与捕获探针的序列互补的序列,所述序列具有细胞和分子标记或索引。例如,可以将聚(da)尾(或任何序列)添加至基因组片段,使得它们可以被侧接细胞和分子条形码的聚(dt)探针(或所添加序列的互补序列)捕获。所述方法可用于以高通量方式从单细胞中捕获以下中的全部或部分:包括基因组、甲基化组、染色质可接近性、转录组和蛋白质组。
[0182]
所述方法可以包括在将细胞材料加载到任何这些样品分析系统上之前的样品制备。例如,利用酶促切割,例如本文所述的双链核酸酶(例如转座酶,限制性内切酶和crispr相关联蛋白),可以将dsdna(例如gdna)片段化成固定细胞或细胞核内的基因组片段。限制性内切酶可用于高通量多组学样品分析。例如,所述方法可以包括将细胞与限制性内切酶一起孵育(随后例如去除限制性内切酶)。作为另一个实例,所述方法可以包括将细胞与连接酶和衔接子(所述衔接子具有聚(dt)/聚(da)或具有侧翼是限制性序列的t7启动子序列的聚(dt)/聚(da))一起孵育。作为另一个实例,捕获探针可以具有限制性位点的序列。在该实施例中,可能不需要添加dt/da衔接子。在一些实施例中,cas9/crispr可用于切割基因组
的指定位置。
[0183]
细胞或细胞核可以是新鲜的或固定的(例如,用固定剂固定的细胞,例如醛、氧化剂、hepes-谷氨酸缓冲液介导的有机溶剂保护作用(hope)固定剂)。在一些实施例中所述该方法包括使细胞与本文所述的核酸试剂接触。然后可以洗涤细胞以除去过量的核酸试剂。如本文所述,核酸试剂可以与死细胞中的dsdna结合,但不能与活细胞中的dsdna结合,从而在洗涤后仅死细胞将保持被核酸试剂标记。在一些实施例中,然后将与捕获探针互补的序列(例如,条形码,例如随机条形码)附加到基因组片段的每个末端。捕获探针可以固定在固体支持物上或溶液中。单细胞转录组分析系统的捕获探针可以是聚(dt)序列。因此,基因组片段的每个末端可以附加有聚(da)序列。然后可以将细胞或细胞核加热或暴露于化学物质以使在每个末端附加有聚(da)序列的双链基因组片段变性,然后将其加载到样品分析系统中。在细胞和/或细胞核裂解后,具有附加序列的基因组片段可以被存在的捕获探针捕获,就像带有聚(da)尾的mrna分子可以被捕获探针的聚(dt)序列捕获一样。可以添加逆转录酶和/或dna聚合酶以复制(例如,逆转录)基因组片段,并将细胞和分子标记或索引附加到基因组片段上。
[0184]
本文披露包括样品分析方法的实施例。图4a-4b示出了从单细胞高通量捕获多组学信息的方法400的非限制性示例实施例的示意图。在一些实施例中,方法400包括使用转座体产生具有包含捕获序列的5
’
突出端(或3
’
突出端)的双链dna片段。方法400可以包括:使410双链脱氧核糖核酸(dsdna)(例如基因组dna(gdna))与转座体428接触。转座体428可包含被配置为在包含dsdna 430的结构处诱导双链dna断裂的双链核酸酶和具有包含捕获序列的5
’
突出端的衔接子的两个拷贝432a、432b(例如,聚(dt)序列434a、434b)。双链核酸酶430可加载有衔接子434a、434b的两个拷贝432a和432b。衔接子的每个拷贝436a、436b可包含转座子的dna末端序列(例如,tn5序列436a、436b或其子序列)。双链核酸酶可以是或包含转座酶,例如tn5转座酶。使410dsdna(例如,gdna)与转座体428接触可以产生多个突出dsdna片段438,每个具有5
’
突出端434a、434b的两个拷贝432a、432b。
[0185]
在一些实施例中,方法400包括使多个突出dsdna片段(具有5
’
突出端)438与聚合酶接触(例如,在框412处)以产生多个互补dsdna片段,每个互补dsdna片段包含与5
’
突出端434a、434b的至少一部分互补的序列434a
’
、434b
’
。方法400可以包括使多个互补dsdna片段440变性(例如,在框414处)(每个dsdna片段440包含与5
’
突出端的至少一部分互补的序列)以产生多个单链dna(ssdna)片段442,并且使用多个条形码444对所述多个ssdna片段进行条形码化(例如,在框424处),以产生多个经条形码化的ssdna片段(例如,经条形码化的ssdna片段446或其互补序列)。多个条形码444中的至少一些(例如,至少1、2、3、4、5、6、7、8、10、100、1000、10000、100000、1000000、10000000个或更多)包含细胞标记448、分子标记450和捕获序列434。多个条形码444中的至少两个条形码的分子标记448可以包含具有不同的分子标记序列。多个条形码444中的至少两个条形码可以包含具有相同的细胞标记序列的细胞标记450。方法400可以包括:获得多个经条形码化的ssdna片段446(或其互补序列)的测序数据;并且基于获得的测序数据中的多个ssdna片段446(或其互补序列)的序列确定与dsdna(例如,gdna)相关的信息。
[0186]
方法400可以包括使用转座体428(其可以包含例如转座酶,限制性内切核酸酶和/或crispr相关联蛋白,例如cas9或cas12a)以从细胞的基因组dna产生dna片段。在一些实施
例中,方法400可以包括:从细胞的双链脱氧核糖核酸(dsdna)例如gdna产生多个核酸片段。例如,多个核酸片段可以不从扩增产生。作为另一个实例,多个核酸片段可以是或包括通过体外转录产生的rna分子。
[0187]
在一些实施例中,多个核酸片段中的每个可以包含捕获序列434a、434b,捕获序列的互补序列,捕获序列的反向互补序列或其组合。方法400可以包括使用多个条形码444对多个核酸片段进行条形码化424,以产生多个经条形码化的单链脱氧核糖核酸(ssdna)片段446(或其互补序列,例如互补序列或反向互补序列446)。多个条形码444中的至少一些(例如,至少1、2、3、4、5、6、7、8、9、10、100、1000、10000、100000、1000000、10000000个或更多)可以包含细胞标记450、分子标记448和捕获序列434(或捕获序列的互补序列、捕获序列的反向互补序列或其组合)。多个条形码444中的至少两个条形码的分子标记448包含不同的分子标记序列。多个条形码444中的至少两个条形码可以包含具有相同的细胞标记序列的细胞标记450。方法400可以包括获得多个经条形码化的ssdna片段446的测序数据(或其互补序列);并且根据获得的测序数据中多个ssdna片段445的序列,确定与dsdna(例如,gdna)相关的信息。
[0188]
在一些实施例中,dsdna(例如,gdna)在细胞核452内部。方法400可以任选地包括透化(例如,在框402处)细胞核452以产生透化的细胞核。方法400可以任选地包括在透化细胞核之前,固定包含细胞核452的细胞(例如,在框402处)。
[0189]
在一些实施例中,方法400包括使多个核酸片段440变性414以产生多个ssdna片段442。对多个核酸片段进行条码化424可以包括使用多个条码444对多个ssdna片段442进行条码化424,以产生多个经条码化的ssdna片段446和/或其互补序列。
[0190]
在一些实施例中,对于本文所述的任何样品分析方法,所述方法进一步包括使细胞与本文所述的核酸试剂接触。核酸试剂可包含捕获序列、条形码、引物结合位点和双链dna结合剂。细胞可以是死细胞。核酸试剂可以结合死细胞中的双链dna。所述方法可以进一步包括洗涤细胞以去除多余的核酸试剂。所述方法可以进一步包括裂解细胞,从而释放核酸试剂。所述方法可以进一步包括对核酸试剂进行条形码化。预期死细胞对核酸试剂是可透性的,而活细胞则对核酸试剂是不可透性的或对不超过痕量的核酸试剂是可透性的。因此,预期本文描述的方法可以通过以下来鉴定死细胞和活细胞:鉴定核酸试剂是否已与细胞dna结合(例如,通过确定与核酸试剂相关联的条形码是否与细胞相关联)和/或确定至少阈值数量的核酸试剂是否已与细胞结合(例如,通过确定与核酸试剂相关联的条形码的至少阈值计数是否与细胞相关联,例如,至少10、50、100、500、1000、5000或10000个不同的条形码)。使用转座体产生dna片段
[0191]
在一些实施例的方法和试剂盒中,可以用转座体产生dna片段。如本文所用,“转座体”包含(i)被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶,和(ii)包含捕获序列的衔接子的至少两个拷贝。可以将衔接子配置为添加到dsdna的末端。因此,衔接子可以被配置用于在该部分已经在dsdna中诱导双链断裂之后将捕获序列添加到dsdna的末端。双链核酸酶可包含酶,例如转座酶(例如,tn5、tn7、tn10、tc3、或水手转座酶(mariner transposase),例如mos1),限制性内切核酸酶(例如,ecori、noti、hindiii、hhai、bamh1或sal i),crispr相关联蛋白(例如cas9或cas12a),双链特异性核酸酶(dsn)或这些的组合。
预期虽然一些双链核酸酶例如转座酶可以促进向dsdna片段的末端添加衔接子,但是其他例如限制性内切核酸酶则不能。这样,转座体可任选地包含连接酶(例如,t4、t7或taq dna连接酶)。进一步考虑到转座体可以靶向包含dsdna的特定结构,例如染色质、甲基化的dsdna,转录起始复合物等。因此,通过将衔接子靶向包含dsdna的结构,将dsdna片段化,并对dsdna进行条形码化以获得关于dsdna的序列信息,转座体可以提供有关与包含dsdna的结构相关联的dna序列的信息。这样,转座体可进一步包含将转座体靶向至包含dsdna的结构的部分,例如抗体(例如与组蛋白h3的组蛋白磷酸化的s28特异性结合的抗体hta28)或其片段,适体(核酸或肽)或dna结合结构域(例如锌指结合结构域)。在本文所述的任何样品分析方法中,转座体可以靶向包含dsdna的特定结构,例如染色质、特定dna甲基化状态、特定细胞器中的dna等。可以设想,样品分析方法可以鉴定与转座体靶向的结构相关的特定dna序列,例如染色质可接近的dna、构建体dna、细胞器dna等。在一些实施例中,描述了用于样品分析的试剂盒。试剂盒可包含如本文所述的转座体和如本文所述的多个条形码。条形码可如本文所述固定在颗粒上。
[0192]
举例来说,产生多个核酸片段可以包括:使dsdna(例如,gdna)与转座体428接触,其中转座体428包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶(例如,转座酶)430和包含捕获序列(例如,聚(dt)序列)的衔接子的两个拷贝434a、434b,以产生多个双链dna(dsdna)片段440,每个包含与捕获序列434a、434b互补的序列434a
’
、434b
’
。例如,衔接子可以不包括5
’
突出端,例如聚(dt)突出端434a、434b。双链核酸酶(例如,转座酶)430可以加载有衔接子的两个拷贝434a、434b。在一些实施例中,捕获序列434a、434b包含聚(dt)区域。与捕获序列互补的序列434a
’
434b
’
可包含聚(da)区。
[0193]
产生多个核酸片段可以包括:使dsdna(例如,gdna)与转座体428接触410,其中转座体428包含被配置为在包含dsdna的结构处诱导双链dna断裂的双链核酸酶(例如,转座酶)430和具有包含捕获序列的5
’
突出端434a、434b的衔接子的两个拷贝432a、432b,以产生多个双链dna(dsdna)片段438,每个具有5
’
突出端434a、434b的两个拷贝。双链核酸酶430可以加载有衔接子的两个拷贝432a、432b。在一些实施例中,方法400可以包括使具有5
’
突出端434a、434b的多个dsdna片段438与聚合酶接触412,以产生包含多个dsdna片段的多个核酸片段440,每个dsdna片段包含5
’
突出端的至少一部分的互补序列434a
’
、434b
’
(例如,互补序列或反向互补序列)。在一些实施例中,多个dsdna片段442均不包含突出端(例如3
’
突出端或5
’
突出端,如5
’
突出端434a
’
、434b
’
)。更高的信号强度
[0194]
为了捕获基因组和染色质可接近性信息,可通过在转座体428的聚(da)尾前面并入启动子(例如t7启动子)来进一步扩增信号(例如,目的dsdna片段的数量,例如用于染色质可接近性分析的dsdna片段)。例如,可以通过在加载到单细胞系统或平台416上之前在细胞核452或细胞内掺入体外转录来进一步扩增dsdna(例如gdna)(例如1000倍)。例如,序列中的t7启动子502可以被附加到dsdna(例如,gdna)片段的末端。
[0195]
转座位并添加聚(dt)序列和启动子后,将固定的细胞或细胞核与体外转录(ivt)反应混合物孵育。数千个带有dsdna(例如gdna)序列的rna拷贝会产生并包含在固定细胞或细胞核内。如本文所述,可以发生单细胞捕获和裂解(例如,在图4a-4b中的框418处)。
[0196]
图5a-5b示意性地示出了以改善的信号强度从单细胞捕获基因组和染色质可接近
性信息的非限制性示例性方法。在一些实施例中,衔接子432a、432b任选地包含启动子序列。启动子序列可以包含t7启动子序列502。产生多个核酸片段可以包括使用体外转录来转录多个dsdna片段,以产生多个核糖核酸(rna)分子504。对多个核酸片段进行条码化424包括对多个rna分子504进行条码化。使用限制性内切酶产生具有平末端的dsdna片段
[0197]
在一些实施例中,产生多个核酸片段包括:使用限制性内切酶将dsdna(例如,gdna)片段化以产生多个具有平末端的dsdna片段。使dsdna(例如,gdna)片段化可以包括使dsdna(例如,gdna)与限制性内切酶接触以产生各自具有平末端的多个dsdna片段。多个dsdna片段中的至少一个可以包含平末端。多个dsdna片段中的至少一个可以包含5
’
突出端或3
’
突出端。多个dsdna片段都可以不包含平末端。使dsdna(例如,gdna)片段化可以包括使双链gdna与限制性内切酶接触以产生具有平末端的多个dsdna片段。dsdna片段中的至少一个、一些或全部可以包括平末端。使用crispr相关联蛋白产生dsdna片段
[0198]
在一些实施例中,产生多个核酸片段包括:使用crispr相关联蛋白(例如cas12a的cas9)使dsdna(例如gdna)片段化以产生多个双链脱氧核糖核酸(dsdna)片段。使dsdna(例如,gdna)片段化可以包括使双链gdna与crispr相关联蛋白接触以产生多个dsdna片段。dsdna片段中的至少一个、一些或全部可以包括平末端。预期在一些实施例中,可使用靶向特定序列或基序的指导rna(grna)将dsdna中的断裂靶向特定序列或基序,从而使crispr相关联蛋白在特定序列或基序处诱导双链断裂。产生核酸片段
[0199]
在一些实施例中,产生多个核酸片段(例如,使用限制性内切酶或crispr相关联蛋白)包括:将包含与捕获序列互补的序列的衔接子的两个拷贝附加(例如,在参考图4a-4b讨论的框410处)到多个dsdna片段中的至少一些(例如,至少1、2、3、4、5、6、7、8、9、10、100、1000、10000、100000、1000000、10000000个或更多)上以产生多个dsdna片段(例如,具有平末端的多个dsdna片段)。附加衔接子的两个拷贝可以包括将衔接子的两个拷贝连接到多个dsdna片段中的至少一些(例如,至少1、2、3、4、5、6、7、8、9、10、100、1000、10000、100000、1000000、10000000个或更多)上以产生包含衔接子的多个dsdna片段。使用限制性内切酶产生具有突出端的dsdna片段
[0200]
在一些实施例中,产生多个核酸片段包括:使用限制性内切酶使dsdna(例如,gdna)片段化以产生多个具有突出端的dsdna片段,因此不需要添加衔接子。使dsdna(例如,gdna)片段化可以包括使dsdna(例如,gdna)与限制性内切酶接触以产生多个dsdna片段,其中多个dsdna片段中的至少一个包含捕获序列。捕获序列可以与5
’
突出端的序列互补。与捕获序列互补的序列可以包含5
’
突出端的序列。染色质可接近性
[0201]
参照图4a-4b,为了捕获染色质可接近性信息406a,可将细胞核452与酶促切割物(例如,转座酶,限制性内切酶和cas9)一起孵育,并且dsdna(例如,gdna)片段可以附加有衔接子432a、432b。切割可发生在染色质被暴露的位置(例如,最暴露,比平均暴露更多,并暴露到期望的程度)。例如,转座酶432可以将衔接子432a、432b插入dsdna(例如,gdna)。
[0202]
在一些实施例中,确定与dsdna(例如,gdna)相关的信息包括基于获得的测序数据
中的多个ssdna片段442的序列和/或丰度,确定dsdna(例如,gdna)的染色质可接近性406a。确定dsdna(例如gdna)的染色质可接近性442可以包括:将多个ssdna片段442的序列与dsdna(例如,gdna)的参考序列比对;确定与多个ssdna片段442的ssdna片段的末端对应的dsdna(例如gdna)区域可接近或具有一定可接近性(例如,高可接近性,高于平均可接近性以及可接近性高于阈值或期望程度)。确定dsdna(例如gdna)的染色质可接近性可以包括:将多个ssdna片段的序列与dsdna(例如,gdna)的参考序列比对;并且根据测序数据中多个ssdna片段的ssdna片段的数量,确定与多个ssdna片段的ssdna片段的末端对应的dsdna(例如,gdna)区域的可接近性。
[0203]
例如,切割可发生在染色质具有高于平均可接近性的位置。对应于ssdna片段的末端的dsdna区域(例如gdna)可以具有高于平均的可接近性。dsdna(例如gdna)的此类区域在获得的测序数据中可以具有高于平均的丰度。作为另一个实例,dsdna(例如,gdna)包含区域a-区域b1-区域b2-区域c。如果区域b1和区域b2具有高于平均的可接近性,而区域a和区域c具有低于平均的可接近性,则可以切割区域b1和区域b2(例如,在区域b1和区域b2之间),而不切割区域a和区域c。测序数据可以包括发生切割的区域b1和区域b2(和发生切割的区域附近)的序列的高于平均的丰度。测序数据中可以不存在区域a和区域c的序列(或具有低丰度)。因此,可以基于多个ssdna片段中的每个的序列和数量来确定dsdna(例如,gdna)的染色质可接近性。基因组信息
[0204]
为了捕获基因组信息406b,在经受酶促切割和添加衔接子之前,可以首先使细胞核452暴露于试剂以消化408核小体结构(例如,去除核小体/组蛋白)。在一些实施例中,确定与dsdna(例如,gdna)相关的信息包括基于获得的测序数据中的多个ssdna片段442的序列,确定dsdna(例如,gdna)的基因组信息406b。所述方法可以包括消化与双链dsdna(例如,gdna)相关联的408个核小体。确定dsdna(例如gdna)的基因组信息可以包括:通过将多个ssdna片段442的序列与dsdna(例如,gdna)的参考序列比对来确定dsdna(例如,gdna)的至少部分序列。在一些实施例中,可以确定细胞的全部或部分基因组。在一些实施例中,dsdna是细胞的基因组dna(gdna)。在一些实施例中,dsdna是细胞的细胞器例如线粒体或叶绿体的基因组dna。甲基化组信息
[0205]
为了捕获甲基化组信息406c,在dsdna(例如,gdna)片段被捕获探针444捕获并保持单链442之后,使用亚硫酸氢盐处理422将甲基胞嘧啶碱基454mc变成胸腺嘧啶碱基。随后,可以通过rt 424或dna聚合酶来拷贝dsdna(例如,gdna)。
[0206]
在一些实施例中,确定与dsdna(例如,gdna)相关的信息包括基于获得的测序数据中的多个ssdna片段442的序列,确定dsdna(例如,gdna)的甲基化组信息406c。所述方法可以包括:消化与dsdna(例如gdna)相关联的408个核小体。方法400可以包括:对多个单链dna 442的胞嘧啶碱基进行亚硫酸氢盐转化422,以产生多个具有尿嘧啶碱基454u的经亚硫酸氢盐转化的ssdna 442b。对多个ssdna片段442进行条形码化424可以包括使用多个条形码444对多个经亚硫酸氢盐转化的ssdna 452b进行条形码化424,以产生多个经条形码化的ssdna片段446和/或其互补序列。确定甲基化组信息406c可以包括:确定测序数据中的多个ssdna片段442的位置具有胸腺嘧啶碱基(或尿嘧啶碱基454u),以及dsdna(例如gdna)的参考序列
中的相应位置具有胞嘧啶碱基,从而确定dsdna(例如,gdna)中的相应位置具有甲基胞嘧啶碱基454mc。
[0207]
在一些实施例中,确定甲基化组信息包括样品分析的方法,所述方法包括使来自细胞的双链脱氧核糖核酸(dsdna)与转座体接触,其中所述转座体包含被配置为在包含dsdna(所述dsdna加载有具有包含捕获序列的5
’
突出端的衔接子的两个拷贝)的结构处诱导双链dna断裂的双链核酸酶,以产生多个突出dsdna片段,每个包含5
’
突出端的两个拷贝。所述方法可进一步包括使所述多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端中每个的至少一部分互补的序列;使所述多个互补dsdna片段变性以产生多个单链dna(ssdna)片段;使用多个条形码对所述多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列;其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列,获得所述多个经条形码化的ssdna片段的测序数据,并且根据测序数据中多个经条形码化的ssdna片段的序列,确定与所述dsdna相关的信息。在一些实施例中,所述方法进一步包括在包含寡核苷酸的颗粒上捕获多个经条形码化的ssdna片段中的ssdna片段,所述寡核苷酸包含捕获序列、细胞标记序列和分子标记序列。举例来说,捕获序列可以包含与ssdna片段上的聚a尾结合的聚dt序列。捕获的ssdna片段可包含甲基化胞苷,对ssdna片段进行二硫化物转化反应,以将甲基化胞苷转化为胸苷,使所述ssdna片段沿5
’
至3
’
方向延伸以产生经条形码化的包含胸苷的ssdna片段,所述经条形码化的ssdna包含捕获序列、分子标记序列和细胞标记序列;使用逆转录酶或聚合酶或其组合使寡核苷酸沿5
’
至3
’
方向延伸,以产生与所述经条形码化的包含胸苷的ssdna互补的互补dna链;使所述经条形码化的ssdna和互补dna链变性以产生单链序列,并扩增所述单链序列。
[0208]
在一些实施例中,获得甲基化组信息包括确定测序数据中的多个ssdna片段的位置具有胸腺嘧啶碱基,以及dsdna的参考序列中的相应位置具有胞嘧啶碱基(所述确定包括多个ssdna片段中的ssdna片段的甲基化胞嘧啶的二硫化物转化,从而将甲基化胞嘧啶碱基转化为胸腺嘧啶碱基),并确定胸腺嘧啶碱基在参考序列中的相应位置为胞嘧啶碱基。多组学
[0209]
在一些实施例中,所述方法可以包括:使用多个条形码444对多个靶(例如,细胞核452中的靶)进行条形码化以产生多个经条形码化的靶;并且获得所述经条形码化的靶的测序数据。靶可以是核酸靶,例如mrna靶,样品索引寡核苷酸(例如,公开为us 2018/0346970的美国申请号15/937,713中描述,其通过引用整体并入本文),以及用于确定蛋白表达的寡核苷酸(例如,公开为us 2018/0088112的美国申请号15/715028中描述,其通过引用整体并入本文)。在一些实施例中,可以在单细胞中确定基因组、染色质可接近性、甲基化组、转录组和蛋白质组信息中的两个或更多个。
[0210]
在一些实施例中,样品分析方法包括使来自细胞的双链脱氧核糖核酸(dsdna)与转座体接触,其中所述转座体包含被配置为在包含dsdna(所述dsdna加载有具有包含捕获序列的5
’
突出端的衔接子的两个拷贝)的结构处诱导双链dna断裂的双链核酸酶,以产生多个突出dsdna片段,每个包含5
’
突出端的两个拷贝,使所述多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端中每个的至少一部
分互补的序列;使所述多个互补dsdna片段变性以产生多个单链dna(ssdna)片段;使用多个条形码对所述多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列;其中所述多个条形码中的至少两个包含不同的分子标记序列,并且其中所述多个条形码中的至少两个包含相同的细胞标记序列,获得所述多个经条形码化的ssdna片段的测序数据,并且根据测序数据中多个经条形码化的ssdna片段的序列,确定与所述dsdna相关的信息。在一些实施例中,所述方法进一步包括使细胞与核酸试剂接触,所述核酸试剂包含捕获序列、条形码、引物结合位点和双链dna结合剂,其中所述细胞是死细胞,并且其中所述核酸结合剂与所述死细胞中的双链dna结合,洗涤所述死细胞以去除多余的核酸试剂,裂解所述死细胞,从而释放所述核酸试剂,并对所述核酸试剂进行条形码化。
[0211]
在样品分析方法的一些实施例中,细胞与包含含有细胞标记序列的寡核苷酸的固体支持物相关联,并且其中条形码化包括用所述细胞标记序列对核酸试剂进行条形码化。
[0212]
在样品分析方法的一些实施例中,固体支持物包含多个寡核苷酸,每个寡核苷酸包含细胞标记序列和不同的分子标记序列。
[0213]
在一些实施例中,样品分析的方法进一步包括对经条形码化的核酸试剂进行测序,并基于核酸试剂的条形码的存在来确定死细胞的存在。
[0214]
在一些实施例中,样品分析方法进一步包括使两个或更多个细胞各自与包含不同细胞标记的不同固体支持物相关联,从而使所述两个或更多个细胞中的每个与不同细胞标记一对一地相关联。
[0215]
在一些实施例中,样品分析方法进一步包括基于与核酸试剂的条形码相关联的独特细胞标记的数量,确定样品中的死细胞数量。
[0216]
在一些实施例中,样品分析方法包括确定具有与所述细胞标记相关联的不同序列的分子标记序列的和对照条形码序列的数量包括对于测序数据中的每个细胞标记,确定具有与所述细胞标记相关联的最高数量的不同序列的分子标记序列的和对照条形码序列的数量。
[0217]
在样品分析方法的一些实施例中,细胞是活细胞,并且其中核酸试剂不进入活细胞,因此不与活细胞中的双链dna结合。
[0218]
在一些实施例中,样品分析方法进一步包括使死细胞与跟独特的标识符寡核苷酸相关联的蛋白质结合试剂接触,由此蛋白质结合试剂与死细胞的蛋白质结合,并且对独特标识符寡核苷酸进行条形码化。
[0219]
在样品分析方法的一些实施例中,蛋白质结合试剂包含抗体、四聚体、适体、蛋白质支架、侵袭素或其组合。在一些实施例中,蛋白质结合试剂包含抗体或其片段、适体、小分子、配体、肽、寡核苷酸或其任何组合。举例来说,蛋白质结合试剂可包含以下,基本上由以下组成,或由以下组成:多克隆抗体、单克隆抗体、重组抗体、单链抗体(scab)、或其片段,例如fab、fv、scfv,等等。举例来说,抗体可以包含以下,基本上由以下组成,或由以下组成:abseq抗体(参见shahi等人(2017),sci rep.[科学报道]7:44447,其内容通过引用整体并入本文)。蛋白质结合试剂的独特标识符可以包含核苷酸序列。在一些实施例中,独特标识符包含长度为25-45个核苷酸的核苷酸序列。在一些实施例中,独特标识符与样品或细胞的基因组序列不同源。在一些实施例中,蛋白质结合试剂可以与独特标识符寡核苷酸共价关
联。在一些实施例中,蛋白质结合试剂可以与独特标识符寡核苷酸共价关联。例如,蛋白质结合试剂可以通过接头与独特标识符寡核苷酸相关联。在一些实施例中,接头可以包含化学基团,所述化学基团将寡核苷酸可逆地附接至蛋白质结合试剂。化学基团可以例如通过胺基团缀合至接头。在一些实施例中,接头可包含化学基团,所述化学基团与缀合至蛋白质结合试剂的另一个化学基团形成稳定的键。例如,化学基团可以是uv光可切割基团、链霉亲和素、生物素、胺等。在一些实施例中,化学基团可以通过氨基酸(例如赖氨酸)或n末端上的伯胺与蛋白质结合试剂缀合。寡核苷酸可以与蛋白质结合试剂的任何合适的位点缀合,只要它不干扰蛋白质结合试剂与其蛋白质靶之间的特异性结合即可。在蛋白质结合试剂是抗体的实施例中,寡核苷酸可以在除抗原结合位点以外的任何地方与抗体缀合,例如fc区,c
h
1结构域,c
h
2结构域,c
h
3结构域,c
l
结构域等。在一些实施例中,每个蛋白质结合试剂可以与单个寡核苷酸分子缀合。在一些实施例中,每个蛋白质结合试剂可以与一个以上的寡核苷酸分子缀合,例如至少2、至少3、至少4、至少5、至少10、至少20、至少30、至少40、至少50、至少100、至少1,000个或更多寡核苷酸分子,其中每个寡核苷酸分子包含相同的独特标识符。
[0220]
在样品分析方法的一些实施例中,蛋白质结合试剂的蛋白质靶选自包含10-100个不同蛋白质靶的组,或者细胞组分结合试剂的细胞组分靶选自包含10-100个不同细胞组分靶的组。
[0221]
在样品分析方法的一些实施例中,蛋白质结合试剂的蛋白质靶包含碳水化合物、脂质、蛋白质、细胞外蛋白质、细胞表面蛋白质、细胞标志物、b细胞受体、t细胞受体、主要组织相容性复合体、肿瘤抗原、受体、整合素、细胞内蛋白质或其任何组合。
[0222]
在样品分析方法的一些实施例中,蛋白质结合试剂包含与细胞表面蛋白质结合的抗体或其片段。
[0223]
在样品分析方法的一些实施例中,条形码化是使用包含分子标记序列的条形码进行的。
[0224]
在一些实施例中,样品分析方法包括使样品的死细胞与核酸试剂接触。核酸试剂可以包含以下,基本上由以下组成或由以下组成:本文所述的任何核酸试剂。例如,核酸结合试剂可包含捕获序列、条形码、引物结合位点和双链dna结合剂。举例来说,条形码可包含本文所述的细胞标记、分子标记和靶结合区域。核酸试剂可以结合死细胞中的双链dna。所述方法可以包括例如,通过离心样品,从样品中吸出液体并向样品中添加新的流体(例如缓冲液),从死细胞中洗涤多余的核酸试剂。洗涤可以去除未结合的核酸试剂,而双链dna结合的核酸结合试剂可以保持与死细胞的双链dna结合。预期对于活细胞,洗涤将去除所有(或去除痕量核酸试剂外的所有)。所述方法可以包括裂解死细胞。裂解可以从死细胞释放核酸试剂。举例来说,可以通过添加包括洗涤剂(例如,sds、十二烷基硫酸锂、triton x-100、tween-20或np-40)的细胞裂解缓冲液、有机溶剂(例如甲醇或丙酮)、消化酶(例如蛋白酶k、胃蛋白酶或胰蛋白酶)或其任何组合来裂解死细胞。所述方法可以包括对本文所述的核酸试剂进行条形码化。条形码化可产生包含被细胞标记进行标记的核酸试剂(或其补序列)的条形码的核酸。任选地,核酸可以进一步包含分子标记。预期细胞标记可以使核酸试剂与细胞(例如,死细胞)一对一地相关联,并且分子标记可以用于定量与单细胞相关联的核酸试剂的数量(例如,死细胞)。
[0225]
在样品分析方法的一些实施例中,条形码化包括将死细胞捕获在固体支持物例如珠上,所述固体支持物包含细胞标记序列和分子标记序列。
[0226]
在一些实施例中,样品分析方法进一步包括确定与每个细胞标记序列相关联的不同分子标记序列的数量,并且基于与分子标记序列相关联的不同细胞标记序列的数量确定样品中的死细胞的数量。例如,在一些实施例中,如本文所述的核酸试剂的条形码的存在可以指示细胞是死细胞。例如,在一些实施例中,超过阈值的核酸试剂条形码数量可以指示细胞是死细胞。阈值可以包括例如检测极限或超过阴性对照(例如已知活细胞)的核酸试剂条形码数量。在一些实施例中,与细胞相关联的核酸试剂的至少10、50、100、500、1000、5000或10000个条形码的数量可以指示细胞是死细胞。
[0227]
在样品分析方法的一些实施例中,确定具有与所述细胞标记相关联的不同序列的分子标记序列的和对照条形码序列的数量包括对于测序数据中的每个细胞标记,确定具有与所述细胞标记相关联的最高数量的不同序列的分子标记序列的数量。
[0228]
在一些实施例中,样品分析方法进一步包括使死细胞与跟独特的标识符寡核苷酸相关联的蛋白质结合试剂接触,由此蛋白质结合试剂与死细胞的蛋白质结合。所述方法可以进一步包括对独特标识符寡核苷酸进行条形码化。任选地,可以在洗涤死细胞之前使蛋白质结合试剂与死细胞接触。在一些实施例中,使死细胞与两种或更多种不同的蛋白质结合试剂接触,每种试剂均与独特标识符寡核苷酸相关联。因此,如果存在的话,死细胞的至少两种不同蛋白质可以与不同蛋白质结合试剂结合。
[0229]
在样品分析方法的一些实施例中,蛋白质结合试剂与两个或更多个具有相同序列的样品索引寡核苷酸关联。
[0230]
在样品分析方法的一些实施例中,蛋白质结合试剂与具有不同样品索引序列的两个或更多个样品索引寡核苷酸相关联。
[0231]
在样品分析方法的一些实施例中,蛋白质结合试剂包含抗体、四聚体、适体、蛋白质支架、侵袭素或其组合。
[0232]
在样品分析方法的一些实施例中,蛋白质结合试剂的蛋白质靶选自包含10-100个不同蛋白质靶的组,或者其中细胞组分结合试剂的细胞组分靶选自包含10-100个不同细胞组分靶的组。
[0233]
在样品分析方法的一些实施例中,蛋白质结合试剂的蛋白质靶包含碳水化合物、脂质、蛋白质、细胞外蛋白质、细胞表面蛋白质、细胞标志物、b细胞受体、t细胞受体、主要组织相容性复合体、肿瘤抗原、受体、整合素、细胞内蛋白质或其任何组合。
[0234]
在样品分析方法的一些实施例中,蛋白质结合试剂包含与细胞表面蛋白质结合的抗体或其片段。
[0235]
在样品分析方法的一些实施例中,捕获序列和与捕获序列互补的序列是长度至少为5个核苷酸至约25个核苷酸的特定互补核酸对。
[0236]
在一些实施例中,样品分析方法包括使来自细胞的双链脱氧核糖核酸(dsdna)与转座体接触。所述转座体可包含被配置为在包含dsdna(所述dsdna加载有具有包含捕获序列的5
’
突出端的衔接子的两个拷贝)的结构处诱导双链dna断裂的双链核酸酶,以产生多个突出dsdna片段,每个包含5
’
突出端的两个拷贝。所述方法可以包括使所述多个突出dsdna片段与聚合酶接触以产生多个互补dsdna片段,每个互补dsdna片段包含与所述5
’
突出端中
每个的至少一部分互补的序列。所述方法可以包括使多个互补dsdna片段变性以产生多个单链dna(ssdna)片段。所述方法可以包括使用多个条形码对多个ssdna片段进行条形码化以产生多个经条形码化的ssdna片段,其中所述多个条形码中的每个包含细胞标记序列、分子标记序列和捕获序列。与单细胞相关联的所有细胞标记序列可以是相同的,以便将每个单细胞与细胞标记序列一对一地相关联。多个条形码中的至少两个可以包含不同的分子标记序列。所述方法可以包括获得多个经条形码化的ssdna片段的测序数据。所述方法可以包括基于与相同的细胞标记序列相关联的独特分子标记序列的数量来定量细胞中dsdna的数量。
[0237]
在一些实施例中,样品分析方法进一步包括在包含寡核苷酸的固体支持物上捕获多个ssdna片段中的ssdna片段,所述寡核苷酸包含捕获序列、细胞标记序列和分子标记序列。捕获序列可以包含与跟靶结合序列互补的ssdna片段的序列杂交的靶结合序列。例如,捕获序列可以包含与ssdna片段上的聚a尾结合的聚dt序列。所述方法可以包括使ssdna片段沿5
’
至3
’
方向延伸以产生经条形码化的ssdna片段。例如,可以用dna聚合酶进行延伸。经条形码化的ssdna可以包含捕获序列、分子标记序列和细胞标记序列。所述方法可以包括使用逆转录酶或聚合酶或其组合使寡核苷酸沿5
’
至3
’
方向延伸,以产生与经条形码化的ssdna互补的互补dna链。所述方法可以包括使经条形码化的ssdna和互补dna链变性以产生单链序列。所述方法可以包括扩增单链序列。
[0238]
在一些实施例中,样品分析方法进一步包括多个ssdna片段的胞嘧啶碱基的亚硫酸氢盐转化,以产生多个经亚硫酸氢盐转化的包含尿嘧啶碱基的ssdna片段。因此,预期的是,当产生与经条形码化的ssdna互补的互补dna链时,与尿嘧啶碱基互补的位置将包含腺嘌呤(而不是鸟嘌呤,如以下情况下可以预料:如果胞嘧啶碱基没有被甲基化并且因此在亚硫酸氢盐转化过程之后仍然是胞嘧啶)。因此,预期的是,在互补dna链上预期包含鸟嘌呤的位置上腺嘌呤(而不是鸟嘌呤)的存在可以指示该位置上胞嘧啶的甲基化。腺嘌呤的存在可以通过直接测序互补dna链或通过对其互补序列进行测序来确定。任选地,可以将该序列与参考序列,例如基因组参考序列进行比较。参考序列可以是电子存储的参考。条形码化
[0239]
在一些实施例中,条形码化424包括将细胞416加载到单细胞平台上。ssdna片段442或核酸可以与捕获序列434杂交420以用于条形码化。经条形码化的ssdna片段446、互补序列、反向互补序列446rc或其组合可在测序之前参照图3所述被扩增426和/或参照图3所述被扩增426用于测序。
[0240]
在一些实施例中,条形码化424可以包括:使用多个条形码444对多个ssdna片段442或多个核酸进行随机条地条形码化以产生多个经随机条形码化的ssdna片段446。条形码化424可以包括:使用与颗粒456相关联的多个条形码444对多个ssdna片段442进行条形码化以产生多个经条形码化的ssdna片段446,其中与颗粒456相关联的条形码444包含相同的细胞标记序列和至少100个不同的分子标记序列。
[0241]
在一些实施例中,多个条形码中的至少一个条形码可以固定在颗粒上。多个条形码中的至少一个条形码可以部分固定在颗粒上。多个条形码中的至少一个条形码可以被封闭在颗粒中。多个条形码中的至少一个条形码可以部分地封闭在颗粒中。颗粒可以是可破坏的(例如,可溶的或可降解的)。颗粒可以包含可破坏的水凝胶颗粒。颗粒可以包含交联琼
脂糖(sepharose)珠、链霉亲和素珠、琼脂糖珠、磁性珠、缀合的珠、蛋白a缀合的珠、蛋白g缀合的珠、蛋白a/g缀合的珠、蛋白l缀合的珠、寡(dt)缀合的珠、二氧化硅珠、二氧化硅样珠、抗生物素微珠、抗荧光染料微珠或其任何组合。颗粒可以包含选自由以下组成的组的材料:聚二甲基硅氧烷(pdms)、聚苯乙烯、玻璃、聚丙烯、琼脂糖、明胶、水凝胶、顺磁体、陶瓷、塑料、玻璃、甲基苯乙烯、丙烯酸聚合物、钛、胶乳、交联琼脂糖、纤维素、尼龙、硅酮及其任何组合。
[0242]
在一些实施例中,颗粒的条形码可包含具有至少1000个不同分子标记序列的分子标记。颗粒的条形码可包含具有至少10000个不同分子标记序列的分子标记。条形码的分子标记可以包含随机序列。颗粒可以包含至少10000个条形码。
[0243]
对多个ssdna片段进行条形码化可以包括:使所述多个ssdna片段与所述多个条形码的所述捕获序列接触;使用所述多个条形码转录所述多个ssdna,以产生多个经条形码化的ssdna片段。所述方法可以包括:在获得所述多个经条形码化的ssdna片段的测序数据之前,扩增所述多个经条形码化的ssdna片段以产生多个经扩增的经条形码化的dna片段。扩增多个经条形码化的ssdna片段可以包括:通过聚合酶链反应(pcr)扩增所述经条码化的ssdna片段。核酸试剂
[0244]
在一些实施例中,核酸试剂包含以下,基本上由以下组成或由以下组成:捕获序列、条形码、引物结合位点和双链dna结合剂。核酸试剂的条形码可包含标识符序列,其指示条形码与核酸试剂相关联。任选地,根据本文所述的方法和试剂盒,不同的分子核酸试剂可包含不同的条形码序列。所述核酸可用于本文所述的任何样品分析方法中。在一些实施例中,试剂盒包含以下,基本上由以下组成或由以下组成:本文描述的核酸试剂。任选地,试剂盒还包含本文所述的固体支持物(例如,颗粒)。如本文所述的多个条形码可以固定在固体支持物上。
[0245]
一些实施例的示例核酸试剂600在图6中示出。核酸试剂600可以包含双链dna结合剂610。核酸试剂600可以包含引物结合位点620,例如pcr柄。核酸试剂600可以包含条形码630。条形码可以包含独特标识符序列。核酸试剂600可以包含捕获序列640,例如聚(a)尾。
[0246]
在一些实施例中,核酸试剂是质膜不可透性的。不受理论的限制,预期的是,这样的核酸试剂不能通过完整的质膜(或以不超过痕量地通过完整的质膜),并且因此不进入活细胞的细胞核(或不以超过痕量的量进入活细胞的细胞核)。相反,由于死细胞的质膜不完整,因此核酸试剂可以进入死细胞的细胞核。在一些实施例中,核酸试剂被配置为特异性结合死细胞,并且核酸试剂不结合活细胞。
[0247]
在核酸试剂的一些实施例中,捕获序列包含聚(a)区。
[0248]
在核酸试剂的一些实施例中,引物结合位点包含通用引物结合位点。
[0249]
在一些实施例中,描述了将核酸试剂结合至细胞的方法。所述方法可以包括用核酸试剂标记样品的细胞。多余的核酸试剂可以洗掉。任选地,细胞还用本文所述的一个或多个条形码标记,例如与独特标识符序列相关联的蛋白质结合试剂,例如abseq抗体。然后可以将细胞与包含固定在其上的条形码的颗粒相关联。细胞的核酸(例如,mrna)和/或独特标识符序列(蛋白质结合试剂的,例如abseq抗体的独特标识符序列)和细胞的核酸结合试剂可以与单细胞标记相关联,例如固定在固体支持物上或分配区中。核酸可以用如本文所述
的单细胞标记和分子标记条形码化。可以制备经条形码化的核酸的文库。可以对文库进行测序。注意,除了提供关于细胞的蛋白质和/或核酸的计数的信息之外,测序还可以提供关于核酸试剂(或核酸试剂的阈值数量)是否与细胞相关联的信息。核酸试剂与细胞的关联或核酸试剂的阈值数量(例如,至少10、50、100、500、1000、5000或10000个核酸试剂分子)与细胞的关联可以表明细胞是死细胞。
[0250]
虽然在此已披露了各个方面和实施例,其他方法和实施例对于本领域技术人员而言将是清楚的。在此所披露的各个方面和实施例是出于说明的目的并且不预期是限制性的,其中真实的范围和精神是由以下权利要求书所指示的。
[0251]
本领域的技术人员将理解,对于本文披露的这个和其他过程和方法,可以以不同的顺序来实现在所述过程和方法中执行的功能。此外,概述的步骤和操作仅作为示例提供,并且某些步骤和操作可以是任选的,在不背离所披露实施例的实质的情况下可以组合为较少的步骤和操作,或者可以扩展为附加的步骤和操作。
[0252]
关于在此使用基本上任何复数和/或单数术语,那些本领域技术人员可以根据上下文和/或应用的需要将复数翻译成单数和/或将单数翻译成复数。为了清晰起见,可以在此清晰地列出各种单数/复数的转换。
[0253]
本领域技术人员将理解的是,一般而言,在此所使用的术语,尤其是在所附权利要求书中的术语(例如,所附权利要求书的主体)通常意指“开放性的”术语(例如,术语“包含(including)”应当被解释为“包含但不局限于”,术语“具有”应当被解释为“具有至少”,术语“包括(includes)”应当被解释为“包括但不限于”等)。本领域的普通技术人员另外将认识到的是,如果意指特定数量的一种所介绍的权利要求陈述,那么将在该权利要求中明确陈述这种意思,并且在无这类陈述的存在下,不呈现这种意思。例如,为了有助于理解,以下所附权利要求书可以包含介绍性短语“至少一个”和“一个或多个”的使用,以用来介绍权利要求陈述。然而,此类短语的使用不应当解释为意指经由不定冠词“一个”或“一种”介绍权利要求陈述将任何含有此类介绍的权利要求陈述的具体权利要求限制于仅含有一个这种陈述的实施例,即使在相同的权利要求包括介绍性短语“一个或多个”或“至少一个”以及不定冠词例如“一个”或“一种”(例如,“一个”和/或“一种”,也应当解释为表示“至少一个”或“一个或多个”)的时候也是如此;这对于使用定冠词来介绍权利要求陈述同样适用。另外,即使明确地陈述一个介绍的权利要求陈述的特定数量,本领域技术人员将会意识到此陈述物也应当解释为意味着至少该陈述的数量(例如,仅陈述“两个陈述”而无其他修饰语意指至少两个陈述,或两个或者多个陈述)。此外,在使用类似于“a、b以及c等中的至少一个”的惯例的情况下,通常这样的句法结构意指在一定意义上本领域技术人员将理解该惯例(例如,“具有a、b以及c中的至少一个的系统”将包括但不局限于仅具有a、仅具有b、仅具有c、同时具有a和b、同时具有a和c、同时具有b和c、和/或同时具有a、b以及c等的系统)。在使用类似于“a、b以及c等中的至少一个”的惯例的情况下,通常这样的句法结构意指在一定意义上本领域技术人员将理解该惯例(例如,“具有a、b或c中的至少一个的系统”将包括但不局限于仅具有a、仅具有b、仅具有c、同时具有a和b、同时具有a和c、同时具有b和c、和/或同时具有a、b以及c等的系统)。本领域的普通技术人员将进一步理解的是无论是在说明书、权利要求书还是附图中,呈现两个或更多个替代性术语的几乎任何分离性词语和/或短语都应当理解为考虑到了包括这些术语中的一者、这些术语中的任一者或这两个术语的可能性。例
如,短语“a或b”应理解为包括“a”或“b”或“a和b”的可能性。
[0254]
此外,当以马库什(markush)组的方式描述本披露的多个特征或方面时,在本领域内的技术人员将会认识到还以该马库什组中任一个单独的成员或多个成员的子组的方式来对本披露进行描述。
[0255]
如本领域技术人员将理解,出于诸如就提供书面说明而言的任何和所有目的,在此披露的所有范围也包括任何和所有可能的子范围及其子范围的组合。任何列出的范围都可以容易被认为已经充分描述并使得同一范围分成至少相等的二等分、三等分、四等分、五等分、十等分等。作为一个非限制性实例,在此讨论的每个范围可以容易分为下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解的是,所有诸如“多至”、“至少”等语言包括所提数值,并且是指可以接着分成如上所讨论的子范围的范围。最后,如本领域技术人员将理解,一个范围包括每个独立成员。因此,例如,具有1-3个细胞的组是指具有1、2或3个细胞的组。类似地,具有1-5个细胞的组是指具有1、2、3、4或5个细胞的组,等等。
[0256]
根据前述内容,将理解的是,出于说明的目的已经在本文中描述了本披露的各种实施例,并且在不脱离本披露的范围和精神的情况下可以进行各种修改。因此,本文披露的各种实施例不旨在限制,真实的范围和精神由所附权利要求指示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1