用于产生肿瘤类器官的组合物和产生肿瘤类器官的方法
用于产生肿瘤类器官的组合物和产生肿瘤类器官的方法
1.相关申请的引用
2.本技术要求2018年10月16日提交的美国临时申请号62/746,296的优先权权益,其全部内容通过引用并入本文。
3.背景
1.技术领域
4.本发明涉及产生类器官(organoid)的方法以及由此产生的类器官。
2.
背景技术:
5.通常,患者肿瘤细胞作为二维(2d)单层培养,这无法概括肿瘤本身的复杂组成。另外,作为单层培养的细胞缺乏与体内发现的基质细胞和胞外基质(extracellular matrix,ecm)的相互作用。类器官(3d)培养使得肿瘤细胞即使在非常少量起始原料的情况下也能够增殖。类器官已经在鉴定潜在的癌症驱动因素和新治疗靶标中发挥了作用(boj et al.,2015)。然而,需要改进且更有效的产生类器官的方法。
6.发明概述
7.在一个实施方案中,本文中提供了用于动物或人细胞的基础细胞培养基,所述培养基包含外源胶原蛋白i同三聚体(homotrimer)。在一些方面中,所述培养基是无血清的。在一些方面中,所述培养基包含血清替代物。在一些方面中,所述培养基补充有血清。
8.在一个实施方案中,本文中提供了用于动物或人细胞的细胞培养添加剂,所述添加剂包含外源胶原蛋白i同三聚体。在一些方面中,添加剂是胞外基质、水凝胶、生物支架或合成支架。在一些方面中,胞外基质包含层黏连蛋白、巢蛋白、以及胶原蛋白iv。在一些方面中,胞外基质是matrigel。在一些方面中,胞外基质是合成的。
9.在一个实施方案中,本文中提供了用于动物或人细胞的细胞培养表面,所述表面包含外源胶原蛋白i同三聚体。在一些方面中,所述表面是细胞培养板、通道、导管、阀、或微流控装置。所述表面可以是用于3d结构培养或组织工程的任何材料。所述表面可以是可用胶原蛋白同三聚体包被以支持细胞生存力的任何表面。
10.在一个实施方案中,本文中提供了用于获得和/或培养类器官的方法,所述方法包括在存在本发明实施方案中任一个所述的富胶原蛋白同三聚体的培养基、添加剂或表面的情况下,用胞外基质培养细胞。在一些方面中,细胞是原代细胞。在一些方面中,原代细胞是癌细胞。在一些方面中,癌细胞是胰腺导管腺癌细胞。在一些方面中,癌细胞从人组织中解离。在一些方面中,人组织通过活检获得。在一些方面中,细胞是干细胞。
11.在一些方面中,胞外基质是由engelbreth
‑
holm
‑
swarm(ehs)小鼠肉瘤细胞分泌的基底膜制剂。在一些方面中,胞外基质包含层黏连蛋白、巢蛋白、以及胶原蛋白iv。在一些方面中,胞外基质是matrigel。在一些方面中,外基质是合成的。
12.在一个实施方案中,本文中提供了通过本方法的实施方案获得的类器官。在一些方面中,类器官在体外形成。在一些方面中,类器官中至少75%、80%、85%、90%、95%、或
98%的细胞是有生存力的。在一些方面中,类器官在培养物中维持至少1周至至少1个月。在一些方面中,类器官在培养物中维持超过1个月、2个月、3个月、4个月、5个月、或6个月。在一些方面中,类器官在培养物中维持至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月或至少12个月。在一些方面中,类器官是胰腺导管腺癌类器官。在一些方面中,类器官是器官纤维化类器官。在一些方面中,类器官是肾纤维化类器官。在一些方面中,类器官包含至少1
×
103个细胞至1
×
107个细胞的群体。
13.在一个实施方案中,本文中提供了进行药物发现筛选的方法,其包括将本发明实施方案中任一个的类器官与受试化合物一起培养。在一些方面中,测定包括使类器官与受试化合物接触。受试化合物可以是化学预防剂、癌症化学治疗剂、环境化学物质、食品补充剂或潜在的毒物。
14.在一个实施方案中,本文中提供了进行毒性测定的方法,其包括培养本发明实施方案中任一个的类器官。在一些方面中,所述测定确定受试化合物的器官特异性细胞毒性。在一些方面中,所述测定包括使类器官与受试化合物接触。受试化合物可以是化学预防剂、癌症化学治疗剂、环境化学物质、食品补充剂或潜在的毒物。
15.本文中使用的就指定组分而言的“基本上不含”在本文中用于意指该指定组分未被有目的地配制到组合物中和/或仅作为污染物或以痕量存在。因此,由组合物的任何非预期污染导致的指定组分的总量远低于0.05%,优选低于0.01%。最优选的是其中用标准分析方法不能检测到指定组分量的组合物。
16.本文在说明书中使用的没有数量词修饰的名词可意指一个/种或更多个/种。如本文在权利要求书中所使用的,当与词语“包含/包括”联合使用时,没有数量词修饰的名词可意指一个/种或多于一个/种。
17.除非明确地指出仅指替代方案或者替代方案相互排斥,否则权利要求书中术语“或/或者”的使用用于意指“和/或”,但是本公开内容支持指仅替代方案和“和/或”的定义。本文中使用的“另一”可意指至少第二个或更多个。
18.在本技术通篇,术语“约”用于表示值包括装置、用来确定所述值的方法的固有误差变化,或者研究对象之间存在的差异。
19.通过以下发明详述,本发明的其他目的、特征和优点将变得明显。然而,应理解,虽然指出了本发明的一些优选实施方案,但是发明详述和具体实施例仅以举例说明的方式给出,因为对本领域技术人员而言,根据该发明详述,本发明的精神和范围内的多种变化和修改将变得明显。
20.附图简述
21.以下附图构成本说明书的一部分,并且被包括在内以进一步说明本发明的某些方面。通过结合本文中给出的一些具体实施方案的详细描述来参考这些附图中的一个或更多个可以更好地理解本发明。
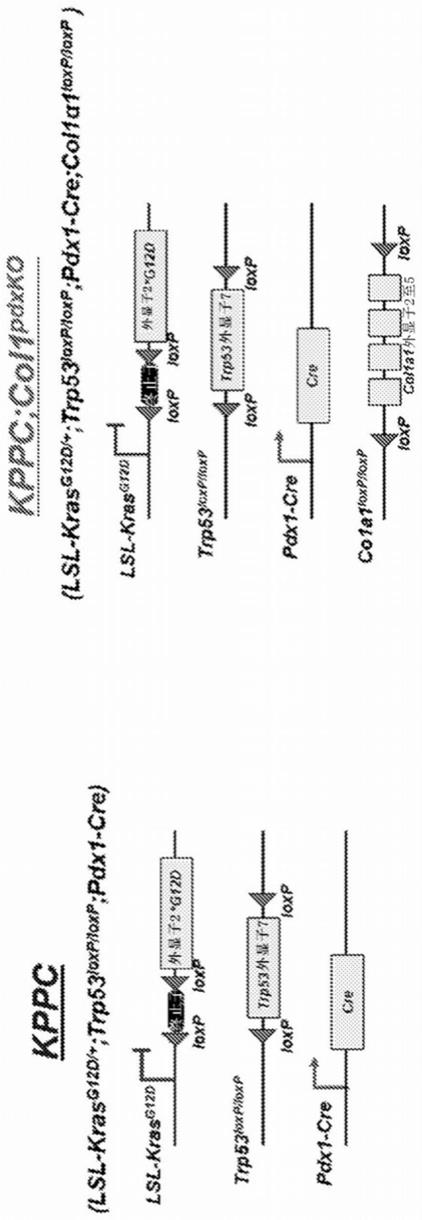
22.图1a至c
‑
图1a:使用lsl
‑
kras
gi2d
:trp53
loxp/loxp
;pdx1
‑
cre:col1a1
loxp/loxp
(被称为kppc;col1
pdxko
)小鼠在胰腺癌背景下在癌细胞系中缺失i型胶原蛋白α1(col1a1)的遗传策略。将lsl
‑
kras
g12d
;trp53
loxp/loxp
;pdx1
‑
cre(kppc)小鼠用作对照动物。图1b:由相同53日龄的kppc和kppc;col1
pdxko
小鼠的肿瘤混合物建立了类器官。图1c:对来自kppc和kppc;col1
pdxko
肿瘤的类器官的平均直径进行晕化。
23.发明详述
24.已将人肿瘤片置于塑料上或置于matrigel上以培养为类器官,以研究癌症生物学、基因调节或治疗效力/抗性以及药物筛选。类器官需要胶原蛋白i同三聚体用于其生长并进展为类似于人癌症组织的病变。缺乏胶原蛋白i同三聚体的癌细胞不能形成成功的类器官。因此,胶原蛋白i同三聚体对于在培养物中产生类器官是必需的,并且用胶原蛋白i同三聚体补充培养物有利于类器官形成。
25.i.类器官的产生和培养
26.a.胞外基质
27.将分离的干细胞或原代细胞优选地在至少部分模拟其中所述干细胞或原代细胞自然驻留的细胞生态位(niche)的微环境中培养。该细胞生态位可通过在存在代表控制细胞命运的关键调节信号的生物材料(例如基质、支架和培养基质)的情况下培养所述细胞来模拟。这样的生物材料包含天然、半合成和合成的生物材料,和/或其混合物。支架提供二维或三维网络。用于这样的支架的合适的合成材料包含选自以下的聚合物:多孔固体、纳米纤维以及水凝胶,例如如肽(包括自组装肽),由聚乙二醇磷酸酯、聚乙二醇富马酸酯、聚丙烯酰胺、聚羟乙基甲基丙烯酸酯、聚乙酸纤维素和/或其共聚物构成的水凝胶。如技术人员已知的,机械特性例如如支架的弹性影响细胞的增殖、分化和迁移。所述支架补充有天然、半合成或合成的配体,其提供细胞的增殖和/或分化和/或迁移所需的信号。
28.细胞生态位部分地由干细胞或原代细胞和周围细胞、以及由所述生态位中的细胞产生的胞外基质(ecm)确定。在本发明的一个优选方法中,将分离的组织片段或细胞附着至ecm。ecm由多种多糖、水、弹性蛋白、以及糖蛋白构成,其中所述糖蛋白包含胶原蛋白、巢蛋白(entactin)(巢蛋白(nidogen))、纤连蛋白和层黏连蛋白。ecm由结缔组织细胞分泌。已知不同类型的ecm,其包含含有不同类型的糖蛋白和/或不同的糖蛋白组合的不同的组合物。所述ecm可通过在容器中培养ecm产生细胞(例如如成纤维细胞),然后除去这些细胞并添加分离的组织片段或细胞来提供。胞外基质产生细胞的一些实例是软骨细胞(主要产生胶原蛋白和蛋白聚糖)、成纤维细胞(主要产生iv型胶原蛋白、层黏连蛋白、间质前胶原蛋白、以及纤连蛋白)以及结肠肌成纤维细胞(主要产生胶原蛋白(i、iii和v型)、硫酸软骨素蛋白聚糖、透明质酸、纤连蛋白、以及生腱蛋白c)。
29.或者,所述ecm是商业提供的。可商购获得的胞外基质的一些实例是胞外基质蛋白(invitrogen)和来自engelbreth
‑
holm
‑
swarm(ehs)小鼠肉瘤细胞的基底膜制剂(例如matrigel
tm
(bd biosciences))。可使用合成的胞外基质材料,例如pronectin(sigma z378666)。如果期望的话,可使用胞外基质材料的混合物。使用ecm培养细胞增强了细胞的长期存活。在不存在ecm的情况下,无法长时期培养细胞培养物。另外,ecm的存在允许培养三维组织类器官,其在不存在ecm的情况下不能被培养。胞外基质材料通常会包被到细胞培养容器上,但可以(作为补充或替代)以溶液提供。
30.用于本发明方法的优选ecm包含至少两种独特的糖蛋白,例如两种不同类型的胶原蛋白或者胶原蛋白和层黏连蛋白。ecm可以是合成的水凝胶胞外基质或天然存在的ecm。另外优选的ecm由matrigel
tm
(bd biosciences)提供,其包含层黏连蛋白、巢蛋白、以及胶原蛋白iv。
31.如本文中其他地方所述的,本发明的组合物可包含血清,或者可以是无血清的和/
或无血清替代物的。培养基和细胞制剂优选地符合fda对生物产品所要求的标准的gmp过程,以确保产品一致性。
32.b.培养基
33.本发明方法中使用的细胞培养基包含服从本文中提供的限制的任何合适的细胞培养基。细胞培养基通常包含大量的对于支持维持所培养细胞所必需的成分。考虑到以下公开内容,技术人员可容易地配制合适的成分组合。根据本发明的培养基通常将是包含标准细胞培养成分的营养液,所述成分例如氨基酸、维生素、无机盐、碳能源和缓冲剂,如在文献和下文中更详细地描述的。
34.本发明的培养基通常将在去离子蒸馏水中配制。本发明的培养基通常将在使用之前灭菌以防止污染,例如通过紫外线、加热、辐照或过滤。可将培养基冷冻(例如在
‑
20℃或
‑
80℃下)以储存或运输。所述培养基可包含一种或更多种抗生素以防止污染。所述培养基的内毒素含量可以为小于0.1个内毒素单位/ml,或者内毒素含量可以为小于0.05个内毒素单位/ml。用于确定培养基的内毒素含量的方法是本领域已知的。
35.优选的细胞培养基是用基于碳酸盐的缓冲液在ph为7.4(优选以ph 7.2至7.6或至少7.2且不高于7.6)下缓冲的限定的合成培养基,而细胞在包含5%至10%co2,或至少5%且不超过10%co2,优选5%co2的气氛中培养。
36.技术人员将从公知常识中理解可用作本发明细胞培养基中基础培养基的培养基类型。潜在合适的细胞培养基可商购获得并且包括但不限于dulbecco改良eagle培养基(dmem)、最小必需培养基(minimal essential medium,mem)、knockout
‑
dmem(ko
‑
dmem)、格拉斯哥最小必需培养基(glasgow minimal essential medium,g
‑
mem)、基础培养基eagle(basal medium eagle,bme)、dmem/ham’s f12、advanced dmem/ham’s f12、iscove改良dulbecco培养基和最小必需培养基(minimal essential media,mem)、ham’s f
‑
10、ham’s f
‑
12、medium 199、以及rpmi 1640培养基。基础培养基可包含advanced dmem f12、hepes、青霉素/链霉素、谷氨酰胺、nacetyl cystein、b27、n2和gastrin。
37.此外优选的是,所述细胞培养基补充有纯化的、天然的、半合成的和/或合成的生长因子,并且不包含未限定组分,例如胎牛血清(fetal bovine serum)或胎牛血清(fetal calf serum)。多种不同的血清替代制剂可商购获得并且是技术人员已知的。根据常规技术,在使用血清替代物的情况下,其可以以培养基体积的约1%至约30%使用。
38.在一个实施方案中,组织样品(例如胰腺组织样品)在细胞培养基中孵育。在一个实施方案中,细胞培养基是dulbecco改良eagle培养基(dmem)。在另一个实施方案中,细胞培养基是dulbecco改良eagle培养基/nutrient mixture f
‑
12(dmem/f
‑
12)。在另一个实施方案中,细胞培养基补充有血清。在一个实施方案中,细胞培养基补充有胎牛血清(fbs)。
39.在一个实施方案中,将组织样品(例如胰腺组织样品)酶促解离。在一个实施方案中,组织样品通过将组织与补充有胶原酶的细胞培养基一起孵育来酶促解离。胶原酶可分解组织中存在的胶原蛋白。在一个实施方案中,细胞培养基中胶原酶的终浓度为300单位/ml。在另一个实施方案中,细胞培养基中胶原酶的终浓度为至少50单位/ml、至少100单位/ml、至少200单位/ml、至少300单位/ml、至少400单位/ml、至少500单位/ml、至少600单位/ml、至少700单位/ml、至少800单位/ml、至少900单位/ml或至少1000单位/ml。
40.在一个实施方案中,将解离的组织(例如解离的胰腺组织)通过离心从解离培养基
中分离。在一个实施方案中,所述组织可还通过将组织与胰蛋白酶一起孵育来解离。胰蛋白酶是丝氨酸蛋白酶并且可使蛋白质水解。在一个实施方案中,将所述胰蛋白酶以6.25mg/1的终浓度添加至前列腺组织。在另一个实施方案中,胰蛋白酶的终浓度为至少1mg/l、至少2mg/l、至少3mg l、至少4mg/l、至少5mg/l、至少6mg/l、至少7mg/l、至少8mg/l、至少9mg/l、至少10mg/l、至少11mg/l、至少12mg/l、至少13mg/l、至少14mg/l、至少15mg/l、至少16mg/l、至少17mg/l、至少18mg/l、至少19mg/l、或至少20mg/l。在一个实施方案中,将胰蛋白酶添加在汉克平衡盐溶液(hank’s balanced salt solution,hbss)和edta中。在一个实施方案中,将所述样品在冰上孵育1小时。在一个实施方案中,将所述样品孵育至少5分钟、至少10分钟、至少15分钟、至少20分钟、至少30分钟、至少45分钟、至少1小时、至少2小时、至少3小时、至少4小时、或至少5小时。
41.必要或期望时,上述培养基可根据需要以合适的浓度或量补充有补充组分或成分,包括任选组分。细胞培养基溶液提供来自以下类别中的一种或更多种的至少一种组分:(1)能源,通常为碳水化合物形式,例如葡萄糖;(2)所有必需氨基酸,并且通常是二十种氨基酸加半胱氨酸的基本集合;(3)低浓度的所需的维生素和/或其他有机化合物;(4)游离脂肪酸或脂质;以及(5)痕量元素,其中痕量元素被限定为通常以非常低的浓度,通常在微摩尔范围内的所需的无机化合物或天然存在元素。
42.所述培养基还可以可选地补充有来自以下类别中的任一种的一种或更多种组分:(1)盐,例如镁、钙、以及磷酸盐;(2)激素和另一些生长因子,例如血清、胰岛素、运铁蛋白、表皮生长因子和成纤维细胞生长因子;(3)蛋白质和组织水解物,例如可获自纯化的明胶、植物材料或动物副产物的蛋白胨或蛋白胨混合物;(4)核苷和碱基,例如腺苷、胸苷、以及次黄嘌呤;(5)缓冲剂,例如hepes;(6)抗生素,如庆大霉素或氨苄青霉素;(7)细胞保护剂;以及(8)半乳糖。
43.维持在培养物中的细胞可通过将其从先前培养物转移至具有新鲜培养基的培养物来传代。在一个实施方案中,诱导的细胞在细胞培养物中稳定维持至少3代、至少4代、至少5代、至少6代、至少7代、至少8代、至少9代、至少10代、至少11代、至少12代、至少13代、至少14代、至少15代、至少20代、至少25代或至少30代。
44.在一个实施方案中,所述培养基补充有5%matrigel
tm
。在一个实施方案中,所述培养基补充有约0.1%matrigel
tm
、约0.2%matrigel
tm
、约0.3%matrigel
tm
、约0.4%matrigel
tm
、约0.5%matrigel
tm
、约0.6%matrigel
tm
、约0.7%matrigel
tm
、约0.8%matrigel
tm
、约0.9%matrigel
tm
、约1%matrigel
tm
、约2%matrigel
tm
、约3%matrigel
tm
、约4%matrigel
tm
、约5%matrigel
tm
、约6%matrigel
tm
、约7%matrigel
tm
、约8%matrigel
tm
、约9%matrigel
tm
、约10%matrigel
tm
、约15%matrigel
tm
、或约20%matrigel
tm
。在一个实施方案中,所述培养基补充有至少0.1%matrigel
tm
、至少0.2%matrigel
tm
、至少0.3%matrigel
tm
、至少0.4%matrigel
tm
、至少0.5%matrigel
tm
、至少0.6%matrigel
tm
、至少0.7%matrigel
tm
、至少0.8%matrigel
tm
、至少0.9%matrigel
tm
、至少1%matrigel
tm
、至少2%matrigel
tm
、至少3%matrigel
tm
、至少4%matrigel
tm
、至少5%matrigel
tm
、至少6%matrigel
tm
、至少7%matrigel
tm
、至少8%matrigel
tm
、至少9%matrigel
tm
、至少10%matrigel
tm
、或至少20%matrigel
tm
。
45.在一个实施方案中,所述培养基补充有5%fbs。在另一个实施方案中,所述fbs是
热灭活炭剥离fbs(charcoal
‑
stripped fbs)(例如gibco,目录号12676)。在一个实施方案中,所述培养基补充有约0.1%fbs、约0.2%fbs、约0.3%fbs、约0.4%fbs、约0.5%fbs、约0.6%fbs、约0.7%fbs、约0.8%fbs、约0.9%fbs、约1%fbs、约2%fbs、约3%fbs、约4%fbs、约5%fbs、约6%fbs、约7%fbs、约8%fbs、约9%fbs、约10%fbs、约15%fbs、或约20%fbs或更多。在一个实施方案中,所述培养基中补充有至少0.1%fbs、至少0.2%fbs、至少0.3%fbs、至少0.4%fbs、至少0.5%fbs、至少0.6%fbs、至少0.7%fbs、至少0.8%fbs、至少0.9%fbs、至少1%fbs、至少2%fbs、至少3%fbs、至少4%fbs、至少5%fbs、至少6%fbs、至少7%fbs、至少8%fbs、至少9%fbs、至少10%fbs或至少20%fbs。
46.在一个实施方案中,可使用matrigel
tm
漂浮法培养细胞以产生类器官。在另一个实施方案中,可使用matrigel
tm
包埋法培养细胞以产生类器官。在一个实施方案中,可将类器官培养至少3周。在另一些实施方案中,可将类器官培养至少1周、至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、或至少8个月。本发明还提供了已培养至少6、8、10、12、14、16、18、或20周的类器官。
47.ii.类器官及其用途
48.在一个实施方案中,类器官是胰腺类器官。在一个实施方案中,类器官是前列腺类器官。在另一个实施方案中,类器官是膀胱类器官。在另一个实施方案中,类器官是肝类器官。在另一个实施方案中,类器官是肾类器官。在另一个实施方案中,类器官是乳房类器官。在另一个实施方案中,类器官是肺类器官。在一个实施方案中,类器官是心脏类器官。在另一个实施方案中,类器官是皮肤类器官。在一个实施方案中,类器官是胃类器官。在另一个实施方案中,类器官是脑类器官。在另一个实施方案中,类器官是结肠类器官。在另一个实施方案中,类器官是肠类器官。在另一些实施方案中,任何类器官可用于本发明的方法。
49.本发明提供了用于从组织或混合的细胞群中解离细胞的方法。在一个实施方案中,细胞从胰腺组织中解离。在一个实施方案中,细胞从前列腺组织中解离。在另一个实施方案中,细胞从膀胱组织中解离。在另一个实施方案中,细胞从肝组织中解离。在另一个实施方案中,细胞从肾组织中解离。在另一个实施方案中,细胞从乳房组织中解离。在另一个实施方案中,细胞从肺组织中解离。在一个实施方案中,细胞从心脏组织中解离。在另一个实施方案中,细胞从皮肤组织中解离。在一个实施方案中,细胞从胃组织中解离。在另一个实施方案中,细胞从脑组织中解离。在另一个实施方案中,细胞从结肠组织中解离。在另一个实施方案中,细胞从肠组织中解离。
50.在一个实施方案中,细胞从正常组织中解离。在一个实施方案中,细胞从非癌组织中解离。在另一个实施方案中,细胞从癌组织中解离。在另一个实施方案中,细胞从人组织中解离。在另一个实施方案中,细胞从小鼠组织中解离。在另一些实施方案中,细胞从来自任何哺乳动物的组织中解离。在一个实施方案中,细胞从局部性肿瘤中解离。在另一个实施方案中,细胞从恶性肿瘤中解离。在另一个实施方案中,细胞从转移性肿瘤中解离。
51.在另一个实施方案中,从一个或更多个局部性肿瘤中培养类器官。在一个实施方案中,从恶性肿瘤中培养类器官。在另一个实施方案中,从转移性肿瘤中培养类器官。在一个实施方案中,肿瘤是前列腺肿瘤。在另一个实施方案中,肿瘤是胰腺、乳房、心脏、肺、肝、膀胱、肾、皮肤、胃、脑、结肠、或肠肿瘤。
52.在一个实施方案中,组织样品可通过活检获得。获得组织样品的方法是本领域技术人员已知的。在一个实施方案中,组织样品从胰腺活检中获得。在一个实施方案中,组织样品从膀胱活检中获得。在另一个实施方案中,组织样品从肝活检中获得。在另一个实施方案中,组织样品从肾活检中获得。在另一个实施方案中,组织样品从乳房活检中获得。在另一个实施方案中,组织样品从肺活检中获得。在一个实施方案中,组织样品从心脏活检中获得。在另一个实施方案中,组织样品从皮肤活检中获得。在一个实施方案中,组织样品从胃活检中获得。在另一个实施方案中,组织样品从脑活检中获得。在一个实施方案中,组织样品从结肠活检中获得。在另一个实施方案中,组织样品从肠活检中获得。在一些实施方案中,组织样品通过细针抽吸活检获得。在另一个实施方案中,组织样品通过芯针活检获得。在另一个实施方案中,组织样品通过手术活检获得。
53.在一个实施方案中,对象是动物。在某些实施方案中,对象是人。在另一些实施方案中,对象是哺乳动物。在一些实施方案中,对象是啮齿动物,例如小鼠或大鼠。在另一个实施方案中,对象是小鼠。在一个实施方案中,小鼠是遗传改造小鼠。在一些实施方案中,对象是牛、猪、绵羊、山羊、猫、马、狗、和/或用作家畜或养作宠物的任何其他动物物种。
54.在一个实施方案中,在二维培养中作为附着细胞培养的细胞培养物来源于类器官。在一个实施方案中,细胞是癌性的。在另一个实施方案中,细胞是肿瘤细胞。在另一个实施方案中,细胞是正常的。在另一个实施方案中,细胞是非癌性的。
55.在一个实施方案中,通过切成小块将细胞从组织样品中解离。在一个实施方案中,组织样品是胰腺组织样品。在另一个实施方案中,组织样品是乳房、心脏、肺、肝、膀胱、肾、乳房、皮肤、胃、脑、前列腺、结肠、或肠组织样品。在另一个实施方案中,使用1克组织。在一个实施方案中,使用至少0.1克、至少0.2克、至少0.3克、至少0.4克、至少0.5克、至少0.6克、至少0.7克、至少0.8克、至少0.9克、至少1.0克、至少2.0克、至少3.0克、至少4.0克、至少5.0克、至少6.0克、至少7.0克、至少8.0克、至少9.0克、或至少10.0克组织。在另一个实施方案中,使用整个器官。
56.根据本发明的类器官可包含至少1
×
103个细胞、至少1
×
104个细胞、至少1
×
105个细胞、至少1
×
106个细胞、至少1
×
107个细胞或更多的细胞群。在一些实施方案中,每个类器官包含约1
×
103个细胞至5
×
103个细胞;通常,可在24孔板的一个孔中一起培养10至20个类器官。
57.类器官可以是仍使用本发明的方法进行培养并因此与胞外基质接触的类器官。优选地,将类器官包埋在胞外基质中。在本发明的上下文中,“接触”意指物理或机械或化学接触,其意味着为了将所述类器官与所述胞外基质分离,需要使用力。
58.可将类器官在至少2、3、4、5、6、7、8、9、10周或者1、2、3、4、5、6、7、8、9、10、11或12个月或更长时间期间培养。
59.本发明还提供了类器官,其优选地包含至少50%有生存力细胞(viable cell),更优选至少60%有生存力细胞,更优选至少70%有生存力细胞,更优选至少80%有生存力细胞,更优选至少90%有生存力细胞。可在facs中使用hoechst染色或碘化丙啶染色来评估细胞的生存力。
60.在另一个方面中,本发明提供了如上所述的根据本发明的细胞或类器官在药物发现筛选、毒性测定中或在再生医学中的用途。此外,本发明提供了本发明的类器官子代在毒
性测定中的用途。这样的毒性测定可以是使用来源于类器官的细胞或类器官或其部分进行的体外测定。与例如目前在毒性测定中使用的细胞系相比,这样的子代和类器官易于培养并且与原代细胞更接近地类似。预期用类器官获得的毒性结果与在患者中获得的结果更接近地类似。基于细胞的毒性测试用于确定器官特异性细胞毒性。在所述测试中测试的化合物包含癌症化学预防剂、癌症化学治疗剂、环境化学物质、食品补充剂和潜在的毒物。将细胞暴露于多种浓度的受试试剂,持续一定的时间段。在初步测定中,使用五天的暴露并自最高可溶浓度起对数稀释,确定了测定中受试试剂的浓度范围。在暴露期结束时,评价培养物对生长的抑制。分析数据以确定将终点抑制了50%的浓度(tc
50
)。
61.例如,根据本发明的该方面,可使候选化合物与本文中所述的细胞或类器官接触,并且可监测细胞或细胞活性的任何变化。本发明的细胞或类器官的其他非治疗用途的一些实例包括:胚胎学、细胞谱系、以及分化途径的研究;基因表达研究,包括重组基因表达;涉及组织损伤和修复的机制;炎性和感染性疾病的研究;致病机制的研究;以及癌症的细胞转化和病因学的机制的研究。
62.出于高通量目的,将类器官在多孔板(例如如96孔板或384孔板)中培养。使用分子文库来鉴定影响所述类器官的分子。优选的文库包含抗体片段文库、肽噬菌体展示文库、肽文库(例如lopap
tm
,sigmaaldrich)、脂质文库(biomol)、合成化合物文库(例如lopac
tm
,sigmaaldrich)、或天然化合物文库(specs,timtec)。此外,可使用诱导或抑制细胞子代中更多个基因之一的表达的遗传文库。这些遗传文库包含cdna文库、反义文库和sirna或其他非编码rna文库。优选地将细胞暴露于多种浓度的受试试剂,持续一定的时间段。在暴露期结束时,对培养物进行评价。术语“影响”用于涵盖细胞中的任何变化,包括但不限于增殖的降低或损失、形态改变和细胞死亡。所述类器官也可用于鉴定特异性靶向癌细胞(但不是类器官)的药物。
63.在一个方面中,本发明提供了用于鉴定抑制癌症的化合物的方法,所述方法包括:(a)使类器官与受试化合物接触;(b)确定与在不存在受试化合物的情况下类器官的生长相比,在存在受试化合物的情况下类器官的生长是否受到抑制;其中类器官生长的抑制表明鉴定了抑制癌症的化合物。
64.此外,类器官可用于培养病原体。
65.在一些实施方案中,本发明涉及肿瘤组织库,患者特异性类器官可储存在其中并且用于大规模筛选候选治疗化合物。这样的类器官库也可用于患者特异性诊断、潜在治疗的效力的测定、以及合适的靶向肿瘤群(癌干细胞)的鉴定,以及个性化医疗中的其他应用。
66.在本公开内容中,提及“细胞”是背景依赖性的,并且可包括原代细胞,包括通过组织活检和从对象中获得细胞的其他已知方法获得的细胞,以及来自所培养细胞的细胞系和其他类似来源的细胞。
67.iii.实施例
68.包括以下实施例以示出本发明的一些优选实施方案。本领域技术人员应理解,以下实施例中公开的技术代表由本发明人发现在本发明的实践中发挥良好作用的技术,并因此可认为构成其实践的优选模式。然而,本领域技术人员根据本公开内容应理解,在不脱离本发明的精神和范围的情况下,可对所公开的一些具体实施方案作出许多改变并且仍获得相同或相似的结果。
69.实施例1
‑
胶原蛋白i同三聚体支持类器官形成
70.将lsl
‑
kras
g12d
;pdx1
‑
cre(被称为kc)或lsl
‑
kras
g12d
;trp53
loxp/loxp
;pdx1
‑
cre(被称为kppc)小鼠与col1a1
loxp/loxp
小鼠品系(具有loxp
‑
侧翼外显子2至5;由购自欧洲小鼠突变细胞库(european mouse mutant cell repository,eummcr)的col1al
tmla(eucomm)wtsi
品系建立)杂交,从而产生了kc;col1a1
loxp/loxp
(被称为kc;col1
pdxko
)和kppc;col1a1
loxp/loxp
(被称为kppc;col1
pdxko
)小鼠(图1a)。这些小鼠允许pdac细胞中的col1a1缺失。在无随机化或不知情的情况下监测具有期望基因型的上述实验小鼠并对其进行分析。将具有期望的pdac基因型的雌性和雄性小鼠二者用于实验小鼠。所有小鼠均在md安德森癌症中心(md anderson cancer center,mdacc)动物设施在标准饲养条件下饲养,并且所有动物操作均通过mdacc机构动物护理和使用委员会的审查和批准。
71.收集来自kppc和kppc;col1f/f小鼠的年龄匹配的肿瘤(在相同的53日龄)以在matrigel上进行3d类器官培养。如预期的,在一周培养之后,与kppc对照小鼠相比,kppc;col1f/f类器官的生长显著更小。
72.分别从kppc;col1
pdxko
小鼠和kppc对照小鼠的肿瘤组织建立在3dmatrigel中的pdac类器官。与kppc类器官相比,kppc;col1
pdxko
类器官显示出显著阻碍的生长(图1b&c)。另外,还并行测试了用于有益于长期保存和连续切片的将凝胶上的类器官制成经石蜡包埋的样品的数种不同的方法。人工脱水包埋方法有效。从这些经石蜡包埋的类器官样品中获得切片,并对其进行h&e染色。同时,还使用2d皿从这些小鼠中产生原代癌细胞系(kppc和kppc;col1f/f)。还将对这些细胞系测试类器官形成。
73.***
74.根据本公开内容,本文中公开且要求保护的所有方法均可在没有过度实验的情况下做出和执行。虽然已根据一些优选实施方案对本发明的组合物和方法进行了描述,但是对于本领域技术人员而言将明显的是,在不偏离本发明的概念、精神和范围的情况下,可对本文中所述的方法以及所述方法的步骤或步骤顺序作出改变。更具体地,将明显的是,在化学和生理学二者上均相关的某些试剂可替代本文中所述的试剂同时实现相同或类似的结果。对本领域技术人员而言明显的所有这样的类似替换和修改被认为是在由所附权利要求书限定的本发明的精神、范围和概念之内。
75.参考文献
76.以下参考文献就其提供补充本文中所阐述的那些的示例性操作或其他细节而言特定地通过引用并入本文。
77.boj et al.,“organoid models of human and mouse ductal pancreatic cancer,”cell,160:324
‑
338,2015.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1