一种具有抗肿瘤活性柠檬苦素类化合物及其制备方法与流程
本发明属于医药技术领域,涉及一种具有抗肿瘤活性的柠檬苦素类化合物及其制备方法和应用。
背景技术:
恶性肿瘤,亦称为癌症,是严重危害人类健康和生命的多发病和常见病,是由控制细胞生长增殖机制失常而引起的疾病。在很多国家,尤其在中等发达国家,恶性肿瘤致死率高,且发病率在世界范围内仍呈上升趋势。恶性肿瘤的治疗方法仍是以化疗主要。病人对现有的化疗药物耐受能力差,且毒副作用较大。因此,研究具有抗肿瘤的天然产物已经是科学界的研究热点。
印度楝(azadirachtaindica)又称印度楝树,为楝科蒜楝属植物,分布于老挝、缅甸、柬埔寨、泰国等东南亚国家。印度楝属于热带植物,具有多药用疗效和美容功能,在阿育吠陀医学中已有四千多年的使用历史了。印度楝可以用来治疗各种疾病:其花可用于治疗眼疾、心绞痛、消化不良和鼻息肉;其果被用作驱虫剂,还被用来治疗痔疮和肾脏疾病;种子和叶子可用于治疗疟疾,也可作为避孕药具和杀虫药;茎皮用于治疗腹泻和阿米巴痢疾;而根皮可用于治疗皮肤病、疟疾、糖尿病、胃病和溃疡。已有研究表明,该植物具有多种生物活性,如抗黑色素活性、抗疟活性、抗氧化活性等。通过对印度楝化学成分研究,发现其主要成分为柠檬苦素类、黄酮类和三萜类化合物。因而,本发明对印度楝种子的化学成分进行深入研究,分离得到具有抗肿瘤活性的新化合物。
技术实现要素:
本发明的目的是提供一种从印度楝(azadirachtaindica)种子中分离得到的具有抗肿瘤活性的新化合物。
本发明的另一目的在于提供上述柠檬苦素类化合物的制备方法。
本发明的又一目的在于提供上述化合物在柠檬苦素类化合物或其药学上可接受的盐在制备抗肿瘤药物中的应用。
本发明的技术方案是通过以下技术方案实现的:
如式(ⅰ)所示的柠檬苦素类化合物或其药学上可接受的盐,
一种抗肿瘤组合物,该组合物以上述的柠檬苦素类化合物或其药学上可接受的盐为主要活性成分辅以辅料制成。
上述柠檬苦素类化合物或其药学上可接受的盐、组合物在制备抗肿瘤药物中的应用。上述的肿瘤为白血病、胃癌、肺癌、乳腺癌。研究发现本发明所述的柠檬苦素类化合物对多种肿瘤细胞均具有显著的抗肿瘤活性,包括人急性白血病细胞hl-60、人胃癌细胞az521、非小细胞肺癌细胞a549、人乳腺癌细胞sk-br-3。
一种如式(ⅰ)所示柠檬苦素类化合物的制备方法,包括以下步骤:粉碎后的印度楝种子依次经过正己烷脱脂和甲醇浸渍后得到提取液,将提取液减压浓缩得到浸膏,将浸膏加水混悬后用乙酸乙酯萃取得到乙酸乙酯萃取物;
将乙酸乙酯萃取物经过两次硅胶柱洗脱分离后,再经过ods柱进行梯度洗脱分离,最后用高效制备液相纯化得到如式(ⅰ)所示的柠檬苦素类化合物。
作为一种优选技术方案,正己烷脱脂时,印度楝种子与正己烷的质量比为1:1~2;
作为一种优选技术方案,首次硅胶柱梯度洗脱时,采用的洗脱液分别为90:10、70:30、50:50、30:70、0:100的正己烷-乙酸乙酯和100%甲醇,每个梯度为一个组分,将30:70的正己烷-乙酸乙酯洗脱的组分浓缩后,再次用硅胶柱梯度洗脱。
第二次硅胶柱洗脱时,采用的洗脱液分别为7:3、6:4、1:1、4:6、3:7、0:1的正己烷-乙酸乙酯和100%甲醇,根据薄层层析情况,洗脱液组分通过薄层色谱法检测合并成15个组分,将第6个组分浓缩后经ods柱梯度洗脱分离。
经过ods柱梯度洗脱分离时,采用的洗脱液为50:50、45:55、40:60、35:55、30:70、25:55、20:80、15:85、10:90、0:100的水-甲醇,将水-甲醇30:70洗脱液组分浓缩,用高效制备液相纯化;
用高效制备液相纯化时,采用十八烷基键合硅胶色谱柱,以甲醇-水50:50(v/v)为流动相。
本发明所述的室温为25±5℃,但不限于此。
同现有技术相比,本发明的有益效果为:
本发明以印度楝(azadirachtaindica)为原料,依次采用甲醇提取、乙酸乙酯萃取萃取和硅胶柱色谱与高效液相色谱分离,简便、快速的提取分离出新化合物。新化合物具有抗肿瘤活性,可用于指导印度楝(azadirachtaindica)种子的应用,也为研究与开发新的抗肿瘤药物提供了候选化合物。
附图说明
图1为分离纯化的柠檬苦素类化合物的hr-esi-ms图谱
图2为分离纯化的柠檬苦素类化合物的1hnmr(100mhz,cdcl3)图谱
图3为分离纯化的柠檬苦素类化合物的13c-nmr(400mhz,cdcl3)图谱
图4为分离纯化的柠檬苦素类化合物的hsqc图谱
图5为分离纯化的柠檬苦素类化合物的1h-1hcosy图谱
图6为分离纯化的柠檬苦素类化合物的hmbc图谱
图7为分离纯化的柠檬苦素类化合物的nosey图谱
具体实施方式
下面所列实施例有助于本领域技术人员更好地理解本发明的技术方案,而不会限制权利要求书中所详细描述的本发明。
实施例1
一、化合物的分离纯化
取干燥的印度楝(azadirachtaindica)种子720g,粉碎后用正己烷脱脂(印度楝(azadirachtaindica)种子与正己烷的质量比为12.00g:13.79g)共3次,每次3小时,过滤,得药渣,甲醇室温浸渍(每次3l甲醇,共3次,每次一周),过滤,合并提取液,减压回收溶剂,得到224g印度楝(azadirachtaindica)种子浸膏。浸膏加水混悬,置于分液漏斗中,用与水混悬液等体积的乙酸乙酯萃取3次,减压回收溶剂后,得到乙酸乙酯萃取物70g。
将乙酸乙酯萃取物上硅胶柱色谱,用正己烷-乙酸乙酯90:10、70:30、50:50、30:70、0:100和100%甲醇梯度洗脱,收集每个梯度洗脱液,每个梯度为一个组分,共6个组分(fr1–fr6)。将第4个组分(fr4)(5.9658g)浓缩,上硅胶柱色谱(硅胶200g),用正己烷-乙酸乙酯7:3、6:4、1:1、4:6、3:7、0:1和100%甲醇洗脱,根据薄层层析情况,洗脱液组分通过薄层色谱法检测合并成15(fr4-1–fr4-15)个组分。将第6个组分(fr4-6)(138.8mg)浓缩,上ods柱色谱(6.375g),用水-甲醇50:50、45:55、40:60、35:55、30:70、25:55、20:80、15:85、10:90、0:100梯度洗脱,收集每个梯度洗脱液;将水-甲醇30:70洗脱液组分浓缩,用高效制备液相纯化,采用十八烷基键合硅胶色谱柱,以甲醇-水50:50(v/v)为流动相,检测波长254nm,capcellpakaqcolumn(250×10mm,5μm),流速2.0ml/min,收集31.5分钟洗脱液组分并浓缩,洗脱得到化合物1(16.5mg)。
二、化合物的结构鉴定
(1)化合物1为白色无定形粉末,紫外254nm照射下有暗斑,365nm照射下无荧光,喷以1%香草醛-浓硫酸后显紫红色。
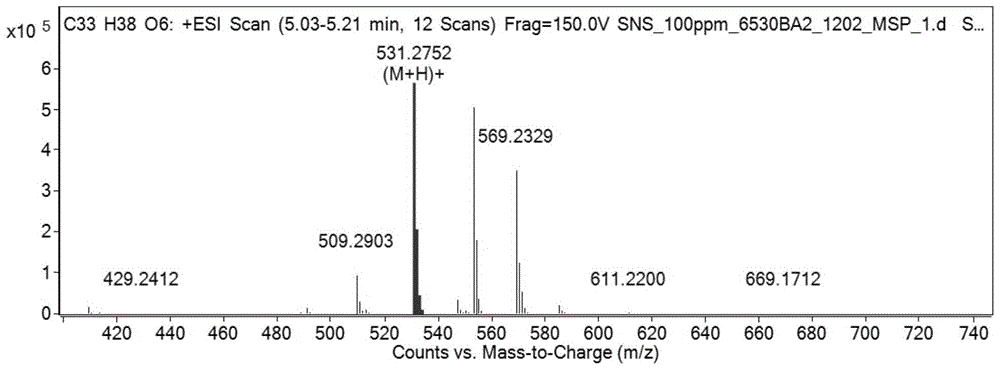
高分辨质谱:m/z531.2752[m+na]+(calcd531.2747)(图1),推测分子式:c33h38o6,分子量:530,15个不饱和度。
红外光谱表明,化合物1在3511cm-1有强吸收带表明有oh存在;在1740cm-1,1716cm-1和1668cm-1有强吸收带表明有羰基。1h-nmr(图2)、13c-nmr(图3)和hsqc(图4)数据显示5个甲基[δh0.76(3h,s),δc21.3;δh1.17(3h,s),δc20.9;δh1.39(3h,s),δc20.4;δh1.22(3h,s),δc32.2;δh1.32(3h,s),δc27.8],4个亚甲基,14次四基[δh7.15(1h,d,j=10.1hz),δc157.4;δh5.90(1h,d,j=10.1hz),δc126.4;δh5.44(1h,s),δc119.4;δh7.06(1h,d,j=0.9hz),δc146.7;7.41(1h,m),δc128.5;δh7.97(1h,m),δc129.7;δh7.54(1h,m),δc133.3;δh7.41(1h,m),δc128.5;δh7.97(1h,m),δc129.7;δh4.47(1h,dd,j=2.4,11.6hz),δc68.5;δh5.64(1h,d,j=2.4hz),δc79.2],4个季碳原子(δc45.6,δc43.5,δc40.8,δc47.5),2个烯碳(δc158.0,δc134.0),3个羰基碳原子(δc205.8,δc174.3,δc167.2)和一个芳烃碳原子(δc134.0)。通过1h-1hcosy(图5)和hmbc(图6)确定各片断的连接位置。nosey(图7)谱图显示h-19[δh1.17(3h,s)]与h-29[δh1.22(1h,s)]有相关信号和h-29与h-6[δh4.47(1h,d,j=13.7hz)]有相关信号,表明c-6处于α位置。h-19与h-30[δh1.32(3h,s)]有相关信号和h-30与h-7[δh5.64(1h,d,j=2.4hz)]有相关信号,表明c-7处于α位置。h-19与h-30有信号相关和h-30与h-17[δh2.78(1h,m)]有信号相关,表明c-17处于α位置。综上所述,化合物1被鉴定为(5α,6α,7α,13α,17α)-6-hydroxy-7-(benzoyloxy)-21,23-epoxy-4,4,8-trimethyl-24-norc-hola-1,14,20,22-tetraene-3-one.
表1化合物1的1h和13c核磁数据归属(δ单位:ppm,j单位:hz)
实施例2化合物的抗肿瘤活性测定
从中国科学院细胞库购买人急性白血病细胞hl60,人胃癌细胞az521,非小细胞肺癌细胞a549,人乳腺癌细胞skbr3。
顺铂溶液的配制:先称取1.5mg顺铂溶于100.0μldmso,得到浓度为50.0mm的顺铂溶液。取100.0μl浓度为50.0mm的顺铂溶液,加入900.0μldmem培养基得到浓度为5.0mm的顺铂溶液;取960.0μl浓度为5.0mm的顺铂溶液,加入240.0μldmem培养基得到浓度为4.0mm的顺铂溶液;取750.0μl浓度为4.0mm的顺铂溶液,加入250.0μldmem培养基得到浓度为3.0mm的顺铂溶液;取600.0μl浓度为3.0mm的顺铂溶液,加入300.0μldmem培养基得到浓度为2.0mm的顺铂溶液;取400.0μl浓度为2.0mm的顺铂溶液,加入400.0μldmem培养基得到浓度为1.0mm的顺铂溶液;取400.0μl浓度为1.0mm的顺铂溶液,加入400.0μldmem培养基得到浓度为500.0μm的顺铂溶液;取400.0μl浓度为500.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为250.0μm的顺铂溶液;取400.0μl浓度为250.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为125.0μm的顺铂溶液;取400.0μl浓度为125.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为62.5μm的顺铂溶液。另取1.0μl浓度为50.0mm的顺铂溶液,加入999.0μldmem培养基得到浓度为50.0μm的顺铂溶液;取960.0μl浓度为50.0μm的顺铂溶液,加入240.0μldmem培养基得到浓度为40.0μm的顺铂溶液;取750.0μl浓度为40.0μm的顺铂溶液,加入250.0μldmem培养基得到浓度为30.0μm的顺铂溶液;取600.0μl浓度为30.0μm的顺铂溶液,加入300.0μldmem培养基得到浓度为20.0μm的顺铂溶液;取400.0μl浓度为20.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为10.0μm的顺铂溶液;取400.0μl浓度为10.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为5.0μm的顺铂溶液;取400.0μl浓度为5.0μm的顺铂溶液,加入400.0μldmem培养基得到浓度为2.5μm的顺铂溶液;取400.0μl浓度为2.5μm的顺铂溶液,加入400.0μldmem培养基得到浓度为1.25μm的顺铂溶液;取400.0μl浓度为1.25μm的顺铂溶液,加入400.0μldmem培养基得到浓度为0.625μm的顺铂溶液。
受试化合物样液的配制:
1)先称取1.64mg化合物1溶于154.7μldmso,得到浓度为20.0mm的受试化合物1溶液;取100.0μl浓度为20.0mm的受试化合物1溶液,加入900μldmem培养基得到浓度为2.0mm的受试化合物1溶液;取500.0μl浓度为2.0mm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为1.0mm受试化合物1溶液;取500.0μl浓度为1.0mm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为500.0μm的受试化合物1溶液;取500.0μl浓度为500.0μm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为250.0μm的受试化合物1溶液;取400.0μl浓度为250.0μm的受试化合物1溶液,加入600.0μldmem培养基得到浓度为100.0μm的受试化合物1溶液。另取1.0μl浓度为20.0mm的受试化合物1溶液,加入999μldmem培养基得到浓度为20.0μm的受试化合物1溶液;取500.0μl浓度为20.0μm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为10.0μm受试化合物1溶液;取500.0μl浓度为10.0μm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为5.0μm的受试化合物1溶液;取500.0μl浓度为5.0μm的受试化合物1溶液,加入500.0μldmem培养基得到浓度为2.5μm的受试化合物1溶液;取400.0μl浓度为2.5μm的受试化合物1溶液,加入600.0μldmem培养基得到浓度为1.0μm的受试化合物1溶液。
取对数生长期的人急性白血病细胞hl60,以8×103个/孔的密度接种到96孔板中,每孔加入90μldmem培养基,试验组:将不同浓度受试化合物1溶液(2.0mm、1.0mm、500.0μm、250.0μm、100μm)加入到各孔中,每孔加入10μl受试化合物溶液,顺铂溶液以浓度梯度(5.0mm、4.0mm、3.0mm、2.0mm、1.0mm、500μm、250.0μm、125.0μm、62.5μm)加入到各孔中,每孔加入100μl顺铂溶液,每组设置三个平行孔。另设3孔加入10μldmem培养基作为对照组。孵育48h,取出96孔板,避光条件下加入20μl的cck-8(碧云天生物技术公司),继续避光孵育2h,使用酶标仪在450nm波长下测定各孔的吸光度值,记录结果,计算细胞的抑制率。
取对数生长期的人胃癌细胞az521或非小细胞肺癌细胞a549或人乳腺癌细胞skbr3细胞,0.25%胰酶消化后收集细胞,以5×103个/孔的密度接种到96孔板中,每孔加入100μl含10%胎牛血清的dmem培养基,孵育24h待细胞贴壁后,用移液枪吸弃上清液。试验组:将不同浓度受试化合物1溶液(20.0μm、10.0μm、5.0μm、2.5μm、1μm)加入到各孔中,每孔加入100μl受试化合物1溶液,每组设置三个平行孔。顺铂溶液以浓度梯度(50μm、40μm、30μm、20μm、10μm、5μm、2.5μm、1.25μm、0.625μm)加入到各孔中,每孔加入100μl顺铂溶液,每组设置三个平行孔。另设3孔加入100μldmem培养基作为对照组。继续孵育48h,取出96孔板,避光条件下加入10μl5mg/ml的mtt溶液,继续避光孵育4h,使用酶标仪在492nm波长下测定各孔的吸光度值,记录结果,计算细胞的抑制率:
细胞抑制率(%)=(对照组吸光度值-试验组吸光值)/(对照组吸光度值)×100%
其中化合物对细胞半抑制浓度ic50由剂量效应曲线得到。
表2化合物对hl60、az521、a549与skbr3细胞的抑制作用
结果显示,化合物1对急性白血病细胞hl60,人胃癌细胞az521,非小细胞肺癌细胞a549,人乳腺癌细胞skbr3。具有很强的细胞毒性。表明本发明柠檬苦素类化合物能够抑制肿瘤细胞的生长,有可能发展成为具有抗肿瘤作用的药物,丰富了印度楝(azadirachtaindica)种子的研究。由此可知,本发明分离得到的柠檬苦素类化合物可以在制备抗肿瘤药物中进行应用,所述的肿瘤为白血病、胃癌、肺癌、乳腺癌。
- 还没有人留言评论。精彩留言会获得点赞!