一种几丁质脱乙酰基酶的制作方法
技术领域:
本发明属于蛋白酶技术领域,具体涉及一中几丁质脱乙酰基酶。
背景技术:
:
甲壳素又名几丁质,学名为(1,4)-2-乙酰氨基-2-脱氧-β-d-葡聚糖,是自然界生物所含有的一种含量仅次于纤维素的氨基多糖,主要存在于无脊椎动物,如虾、昆虫、海藻、真菌及酵母中。但是甲壳素不溶于水、酸、碱和有机溶剂,所以其没有太大的商业价值,而其脱去乙酰基后的产物壳聚糖则广泛应用于医药、食品、化工、化妆品等行业。目前生产壳聚糖主要使用的化学法存在诸多问题,例如,反应时间长、能耗大、产品质量不稳定,特别是排放物会造成巨大的环境污染。
几丁质脱乙酰酶(chitindeacetylase,cda)可以水解脱掉几丁质上的乙酰基,生产脱乙酰度稳定、分子质量分布范围窄的高品质壳聚糖产品,且反应条件温和,为解决壳聚糖生产中的环境污染问题提供了一条新的途径。目前报道的cda的生产菌株大部分都是真菌,而且来源于真菌的这些cda大多都是糖蛋白,必须经过糖基化修饰才有活性;目前报道的细菌来源的cda较少,而且大部分都是几丁寡糖脱乙酰酶,可作用的底物谱较窄,且存在所产酶活力低、提纯后的酶活力下降、基因工程菌酶活提升不明显等问题,目前仍未实现产业化。因此,筛选性能优良且细菌来源的新型cda是解决cda工业化应用的重要课题之一,具有重要的实用价值和学术研究价值。
技术实现要素:
:
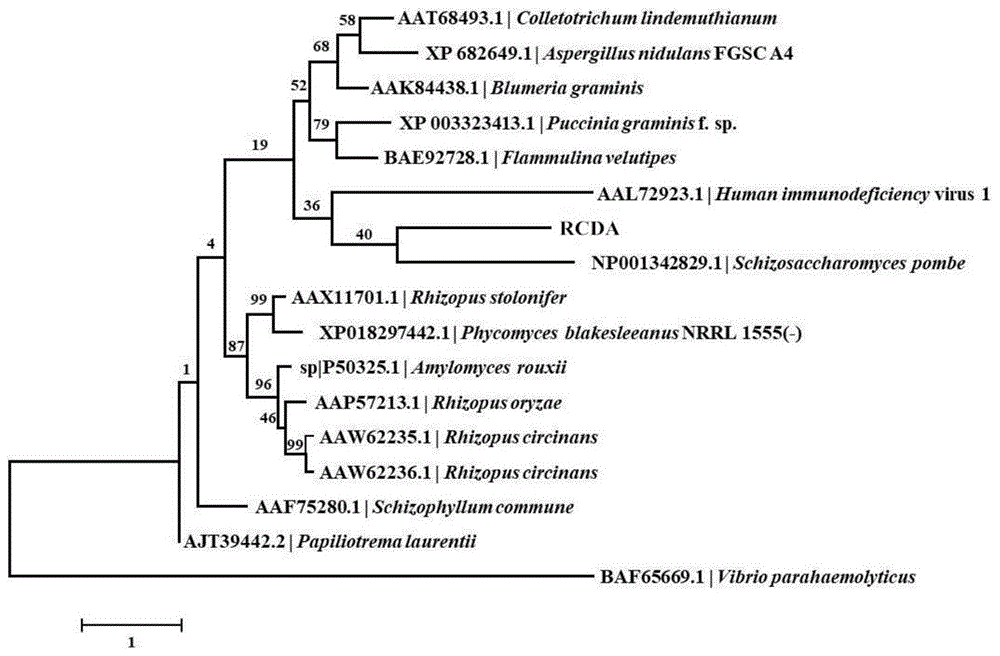
针对现有技术的不足,本发明旨在提供一中几丁质脱乙酰基酶及其应用,所述几丁质脱乙酰基酶rcda来源于rhodococcusequi,是目前首次报道的一种新型的蛋白序列,与已报道的几丁质脱乙酰基酶蛋白序列相似度较低(图1)。
所述几丁质脱乙酰基酶rcda具有序列表seqidno.1所示的氨基酸序列;
本发明还保护编码seqidno.1所示rcda的基因;
本发明还提供所述几丁质脱乙酰基酶rcda在水解几丁质中的应用。
本发明提供的几丁质脱乙酰基酶rcda具有以下酶学性质:
(1)rcda的最佳反应温度为45℃,可耐受温度为小于55℃;
(2)rcda的最佳反应ph为7.0,酶活温度的ph范围为5.0-9.0;
(3)离子浓度在1mm以下时,金属离子对其酶活性影响不大,而当离子浓度在1mm以上时,zn2+、cu2+、ni2+对cda活性有较强的抑制作用;
(4)rcda的底物谱较宽,对低分子量几丁寡糖、胶体几丁质、乙二醇几丁质以及具有一定脱乙酰度的壳聚糖都具有脱乙酰活性,对带乙酰基的多种氨基酸也表现出了脱乙酰活性。
有益效果:
与已经报道的细菌cda相比,rcda的底物谱更宽,能够作用于大分子的底物,对脱乙酰度85%的壳聚糖的脱乙酰相对活性达到132.94%,对胶体几丁质的相对活性达到111.2%,对乙二醇几丁质的相对活性为89.12%。此外,rcda对带乙酰基的氨基酸底物也表现出较高的活性,包括n-乙酰-dl-蛋氨酸、n-乙酰-dl-色氨酸、n-乙酰-l-半胱氨酸、n-乙酰-l-亮氨酸,这些都是首次被报道。
附图说明:
图1系统进化分析;
图2酶学特性分析
其中,a为最适温度曲线;b为最适ph曲线;c为温度稳定性曲线;d为ph稳定性曲线;e为金属离子耐受性。
具体实施方式:
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
本发明所述的rcda其氨基酸序列如下(seqidno.1):
mskkiyvnfgvdvdavagwlgsyggedspgdisrgmfagevgvprlvkmfdkydittswfvpghsietfpreieqvvaagheigihgyshenpiamtrqqetdildrsieliesftgskptgytapwwefskvtnelliergvkydhslmhndftpyyvrvgdswskidysqpaetwmkplvrgqetdlveipanwllddlppqmfiksspnshgfvsprhleemwrdqfdwvyremdyaifpvtihpdvsgrpqsllmlerlieyinqhdgvewvtfdhmvndfkerfprqs
实施例1底物谱
研究了rcda的作用底物谱,选择大分子的几丁质粉、胶体几丁质、乙二醇几丁质、脱乙酰度为85%的壳聚糖以及小分子量的几丁寡糖和带乙酰基的几种氨基酸作为底物,在过量的底物溶液中加入5mlrcda粗酶液,在搅拌下,让混合物在37℃和ph4.0下反应,搅拌12小时。然后将样品煮沸5分钟,采用高效液相色谱法对脱乙酰生成的乙酸含量表征其不同底物的脱乙酰能力,将对4-硝基乙酰苯胺的底物活性(157.6u/ml)设定为100%。结果如表1所示,rcda对大多数被测底物都有活性,包括低分子量几丁寡糖、胶体几丁质、乙二醇几丁质以及具有一定脱乙酰度的壳聚糖;此外rcda对带乙酰基的多种氨基酸也表现出了脱乙酰活性。
与其它已经报道的细菌几丁质脱乙酰酶相比,rcda对大分子底物表现出了更高的活性,同时也表现出了更广的底物谱。
表1.rcda对不同底物的相对酶活性
实施例2酶学特性
(1)为了确定酶的最佳反应温度,将酶在不同温度(30-60℃),ph7.0条件下反应60min,检测酶活性;
(2)为了研究酶的温度稳定性,将酶在不同温度(25-60℃)下预孵育30min,ph7.0,37度反应60分钟检测酶的剩余酶活力;
(3)为了确定最佳ph值,测定了酶在37℃,不同ph条件下,反应60min的酶活力;
(4)为了研究酶的ph值稳定性,将酶放置于各种ph2-10缓冲液中预孵育过夜,然后在ph7.0,37度反应60分钟检测剩余酶活力;
(5)同时研究了rcda与不同的金属离子zn2+、fe2+、mg2+、mn2+、cu2+、ca2+、ni2+及不同离子浓度(0.5、1.0、5.0、10.0mm)对酶活力的影响,在rcda中加入金属离子,在ph7.0,37℃反应60min检测酶活;
以上酶学特性的检测,是以4-硝基乙酰苯胺为反应底物,0.3ml200mg/l的4-硝基乙酰苯胺水溶液加入0.3mlrcda粗酶液,加入0.9ml缓冲溶液调节ph,调节水浴锅温度进行反应。
不同底物的相对酶活是以4-硝基乙酰苯胺作为底物时的酶活(157.6u/ml)作为标准(100%)计算相对活性和残留活性。
本发明所采用的酶活单位的定义:在一定反应条件下(如未特别说明则为ph7.0,37℃)每小时产生1微克对硝基苯胺所需要的酶量定义为一个酶活力单位u。
酶活力计算公式为:
a400:酶解液样品的吸光值;
a0:空白的吸光值;
d:稀释倍数;
t:酶促反应时间,h;
k:线性系数。
结果如图2所示,rcda的最佳反应温度和ph分别为45℃(图2-a)和7.0(图2-b)。热稳定性试验表明,在40℃以下处理30min后,rcda的酶活性几乎保持100%,而在55℃及以上完全失活(图2-c)。酶在ph5.0~9.0之间酶活力稳定(图2-d)。当离子浓度在1mm以下时,金属离子对其酶活性影响不大,而当离子浓度在1mm以上时,zn2+、cu2+、ni2+对cda活性有较强的抑制作用(图2-e)。
实施例3rcda的应用
将几丁质粉首先使用48%浓度的胆碱水溶液90℃预处理12h,胆碱添加量为10ml每5g物料,预处理后过滤并将固相中残留的离子液体用无离子水洗涤至ph6.8-7.0,然后105℃烘干至恒重。称取烘干后的物料1g加入10ml本发明几丁质脱乙酰酶粗酶液(酶活为157.6u/ml)37℃反应12h,采用液相色谱检测脱乙酰反应后液体中生成的乙酸总量达到127mg/g几丁质粉。
在本实施例中胆碱的作用是对几丁质的晶体结构进行破坏,增加酶的作用面积,预处理后烘干至恒重的是经过预处理后的几丁质粉,添加rcda发生了脱乙酰反应,产生乙酸,所以以乙酸的产量表征rcda对几丁质粉的脱乙酰能力。
以上所述仅为本发明的较佳实施案例而已,并不用以限制本发明。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>天津科技大学
<120>一种几丁质脱乙酰基酶
<130>1
<160>1
<170>siposequencelisting1.0
<210>1
<211>293
<212>prt
<213>rhodococcusequi
<400>1
metserlyslysiletyrvalasnpheglyvalaspvalaspalaval
151015
alaglytrpleuglysertyrglyglygluaspserproglyaspile
202530
serargglymetphealaglygluvalglyvalproargleuvallys
354045
metpheasplystyraspilethrthrsertrpphevalproglyhis
505560
serilegluthrpheproarggluilegluglnvalvalalaalagly
65707580
hisgluileglyilehisglytyrserhisgluasnproilealamet
859095
thrargglnglngluthraspileleuaspargserilegluleuile
100105110
gluserphethrglyserlysprothrglytyrthralaprotrptrp
115120125
glupheserlysvalthrasngluleuleuilegluargglyvallys
130135140
tyrasphisserleumethisasnaspphethrprotyrtyrvalarg
145150155160
valglyaspsertrpserlysileasptyrserglnproalagluthr
165170175
trpmetlysproleuvalargglyglngluthraspleuvalgluile
180185190
proalaasntrpleuleuaspaspleuproproglnmetpheilelys
195200205
serserproasnserhisglyphevalserproarghisleugluglu
210215220
mettrpargaspglnpheasptrpvaltyrargglumetasptyrala
225230235240
ilepheprovalthrilehisproaspvalserglyargproglnser
245250255
leuleumetleugluargleuileglutyrileasnglnhisaspgly
260265270
valglutrpvalthrpheasphismetvalasnaspphelysgluarg
275280285
pheproargglnser
290
- 还没有人留言评论。精彩留言会获得点赞!