一种高效提高微藻甘油三酯含量的代谢工程方法与流程
本发明属于生物代谢工程领域,具体涉及一种通过代谢工程提高微藻中性油脂甘油三酯含量的方法。
背景技术:
能源是经济可持续发展的动力,当今社会经济发展所需的能源主要依靠传统化石能源,但是化石能源不但不可再生,其燃烧会释放大量温室气体和大气污染物。生物柴油被认为是最有潜力代替传统化石燃料解决交通运输燃油问题的可再生生物能源。生物柴油的使用不会导致大气中二氧化碳的净积累,而且有害气体排放量比传统柴油低。以微藻为原料制备生物柴油有以下优势:1)微藻培养周期短,生长速率快;2)微藻可在海洋、湖泊甚至潮湿的土壤中进行培养,不占用耕地;3)微藻油脂含量高,单位面积的产油量远远高于其他油料作物;4)微藻可生产蛋白质、碳水化合物、高值产物等,在人类食品和动物饲料的应用中有前景;5)可利用工业生活废水和废气进行微藻培养,既经济节约,又清洁环保;6)培养方式多样,既能自养、异养,又能混养,既能分批培养,又能半连续和连续培养,通过对培养条件的控制,全年均可持续获得生物质原料。
为了提高微藻油脂含量从而进一步降低生产成本,代谢工程改造甘油三酯(tag)合成途径是行之有效的策略之一。在微藻tag生物合成中,依赖于酰基coa的从头合成途径被认为占主导地位。它起始于3-磷酸甘油,经过三个酰基化反应形成。最后一个酰基化反应是此途径的限速步骤,由甘油二酯酰基转移酶(dgat)催化,将酰基从酰基coa上转移到甘油二酯(dag)生成tag,储存在脂滴中。过表达限速酶基因dgat有潜力提高tag的含量。
技术实现要素:
本发明的目的是提供具有高活力、催化tag合成的dgat,及其基因和表达载体,通过代谢工程的方法,提高tag在微藻中的生物合成,从而降低微藻油脂的生产成本。
为实现上述目的,本发明采取了以下技术方案:
一种甘油二酯酰基转移酶(dgat),来源于三角褐指藻(phaeodactylumtricornutum),是下述蛋白质(i)或(ii):
(i)序列表中的seqidno:1所示氨基酸序列的蛋白质;
(ii)序列表中的seqidno:1所示氨基酸序列经过一至十个氨基酸残基的取代、缺失或添加而衍生的蛋白质,并且所衍生的蛋白质具有与(i)相同的功能。
序列表中seqidno:1所示氨基酸序列由756个氨基酸残基组成,含有8个疏水跨膜区域。通过ncbi蛋白序列比对软件分析表明,该蛋白序列含有mbotsuperfamily保守区域,属于dgat。所述取代、缺失或添加的一至十个氨基酸残基可以是非保守区域中的氨基酸残基,其改变不会对该蛋白的功能产生影响。对氨基酸残基进行取代、缺失或添加的方法,以及对蛋白功能的检测均是本领域技术人员所熟知的,通常是利用基因工程的手段对其编码基因进行突变,然后再表达出相应的蛋白并检测其功能。
编码上述甘油二酯酰基转移酶(dgat)的基因也在本发明的保护范围内。所述基因的核酸序列可以是三角褐指藻dgat基因的cdna序列,也可以是基因组dna序列,或者是与这些序列具有90%以上同源性且编码相同功能蛋白的dna序列。例如,序列表中seqidno:2所示的是三角褐指藻dgat1基因的编码序列。
包含上述核酸序列的载体、宿主细胞也在本发明的保护范围内。
所述载体可以是包含上述核酸序列以及与该核酸序列操作性相连的表达调控序列的表达载体。所述的表达载体包括但不限于微藻表达载体、植物表达载体、动物表达载体、酵母表达载体和细菌表达载体,由相应的高效启动子驱动在宿主中表达dgat,提高tag的合成。在具体实施方案中,所述表达调控序列包括高效表达的组成型或诱导型启动子,例如盐藻黄素-叶绿色a/c结合蛋白(fcp)启动子、内源β-微管蛋白(β-tubulin)启动子、β-肌动蛋白(β-actin)启动子、核酮糖二磷酸羧化酶-加氧酶(rbcs)启动子、硝酸还原酶(nr)启动子等。
所述载体还可以包含抗性筛选标记,在本发明的一个实施例中,表达载体以ble作为抗性筛选标记。抗性筛选标记也可以是其它经过密码子优化后的抗性基因,比如潮霉素(hygromycin)抗性基因、巴龙霉素(paromomycin)抗性基因、遗传霉素(g418)抗性基因、八氢番茄红素去饱和酶(pds)突变基因(抗除草剂)。可以使用各种组成型或诱导型启动子来驱动抗性筛选标记的表达,比如紫黄质-叶绿素a结合蛋白(vcp)启动子、内源β-微管蛋白(β-tubulin)启动子、β-肌动蛋白(β-actin)启动子、核酮糖二磷酸羧化酶-加氧酶(rbcs)启动子、硝酸还原酶(nr)启动子等。
将包含上述dgat基因的表达载体通过电击法、基因枪法或是农杆菌介导法导入宿主细胞,通过筛选获得tag合成增强的工程宿主细胞,可用于生产tag。在本发明的一个实施例中,将所述表达载体导入微藻细胞中,通过筛选获得tag含量提高的工程藻株。
将上述工程宿主细胞培养繁殖可作为tag提取原材料,其生产的tag含量高,可用于生物能源和食品等。
具体的,本发明的实施例中从三角褐指藻(硅藻)中分离克隆出一种dgat基因(命名为dgat1)的编码序列并进行分析,然后克隆到酵母表达载体pyes2-ct上,将该表达载体导入tag缺陷型酿酒酵母h1244中进行功能互补验证。对获得的酵母转化子进行荧光染色和提取油脂分析表明,该基因编码有功能的dgat,能够使h1244重新生成tag。通过提取表达dgat1的h1244细胞的微粒体(microsome)粗蛋白进行体外功能分析,进一步证明了dgat1催化合成tag的能力。
进一步的,将含有所述dgat1基因的微藻表达载体在大肠杆菌dh5α中繁殖扩增后提取质粒,用限制性内切酶线性化后通过电击法导入三角褐指藻中,抗性筛选获得转化藻株。过量表达的dgat1活力强,能提供一种代谢拉力将三角褐指藻中的碳流拉到tag,从而提高tag的含量。对所获得的转化藻株提取油脂进行分析,筛选出tag含量提高的工程藻株。
本发明获得的tag增强工程藻株可作为原材料进行tag提取和纯化。提取和纯化的tag可用于生物能源和食品等。
本发明上述获得的tag增强工程藻株用于tag生产的优点表现在:1、光合效率高(远远高于植物),生长快;2、可在海水中培养和规模化生长,不与粮食生产产生冲突,不占用淡水资源;3、没有细胞壁,tag含量高,有利于下游的提取和纯化步骤。
本发明上述高效合成tag的dgat1基因也可克隆到其它表达载体,包括但不限于植物表达载体、动物表达载体、酵母表达载体和细菌表达载体,由相应的高效启动子驱动在宿主中表达,提高tag的含量。获得的工程宿主生产的tag含量高,可用于生物能源和食品等。
附图说明
图1为实施例1中三角褐指藻dgat1在tag缺陷型酿酒酵母h1244中的功能互补检测结果;
图2为实施例3中过表达dgat1的三角褐指藻中油脂荧光染色照片;
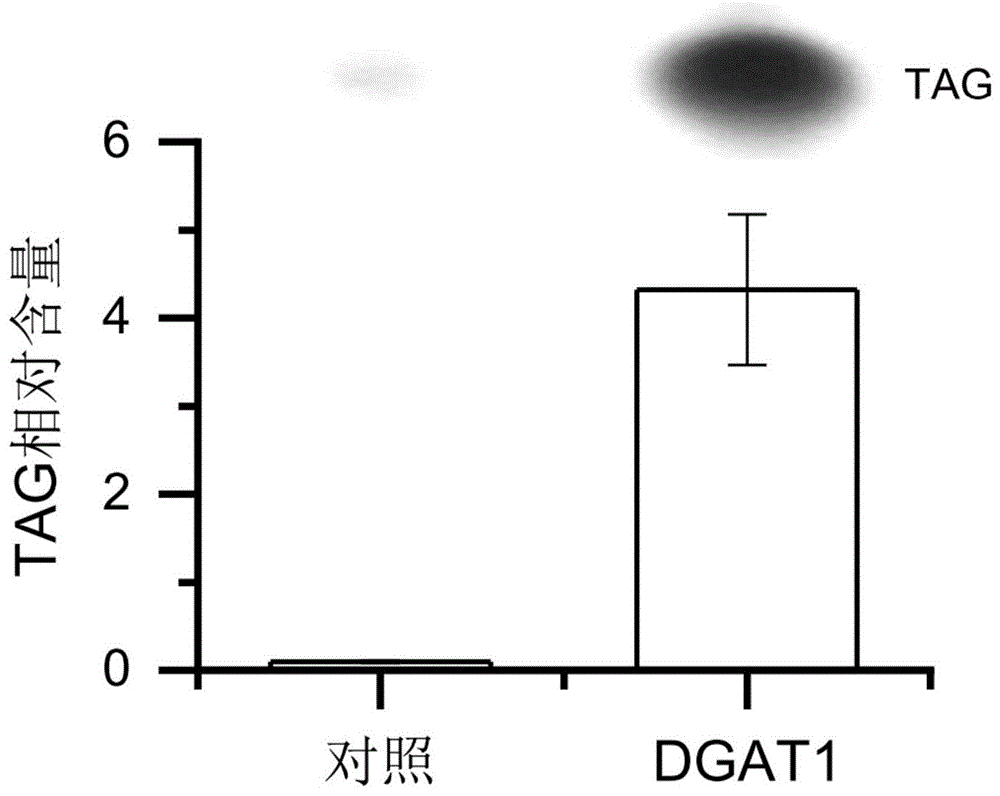
图3为实施例4中过表达dgat1的三角褐指藻中油脂定量分析结果。
具体实施方式
下文结合附图,通过实施例以更详细的方式介绍本发明,但并不以此来限定本发明的技术方案。
实施例1、三角褐指藻dgat1基因的克隆、序列分析和在酵母体系中的功能鉴定
(1)三角褐指藻dgat1基因的克隆和序列分析
三角褐指藻(phaeodactylumtricornutum)ccmp2561由美国国家藻类和微生物保藏中心(bigelownationalcenterformarinealgaeandmicrobiota)提供,用f/2培养基在温度为22℃、光强为40μem-2s-1、摇床转速为150rpm条件下进行培养。细胞生长达到对数期后,通过离心(2000×g,5min)收获约107个细胞,在有液氮存在的情况下研磨破碎细胞,然后用trireagent试剂盒(invitrogen,carlsbad,ca,usa)提取总rna。总rna的提取方法参照试剂盒说明书的步骤。总rna的浓度用nannodrop2000c(thermoscientific,wilmington,delaware,usa)测定,并通过凝胶电泳进行质量检测。取1μg总rna进行反转录合成cdna,采用的试剂盒为superscriptiiifirst-strandsynthesissystem(invitrogen),方法参照试剂盒说明书的步骤。以反转录合成的cdna为模板,在高保真dna聚合酶的作用下进行pcr扩增,得到全长的三角褐指藻dgat1基因编码序列。pcr扩增所用引物为:
正向引物:5’-ggcggatccatgaccacgcctgtatcttccg-3’(bamhi)(seqidno:3);
反向引物:5’-ggctctagaacgaatcaagcaggaatttttccataaaaag-3’(xbai)(seqidno:4)。
扩增后的dna序列纯化后用限制性内功酶bamhi和xbai进行酶切,然后纯化回收克隆到酵母表达载体pyes2-ct(invitrogen)的相应酶切位点上,获得质粒pyes-dgat1,并进行测序验证。用软件tmhmmserverv.2.0(http://www.cbs.dtu.dk/services/tmhmm/)对dgat1翻译的蛋白序列进行跨膜区域预测,表明它有8个跨膜区域。通过ncbi蛋白序列比对软件(https://blast.ncbi.nlm.nih.gov/blast.cgi)分析表明,该蛋白序列含有mbotsuperfamily保守区域。
(2)三角褐指藻dgat1基因在酵母体系中的功能互补
酿酒酵母h1244是一种tag缺陷型突变体,不能够积累tag。如果将外源基因导入此突变体后能够生成tag,说明该外源基因编码有功能的dgat。将上述构建好的质粒pyes-dgat1通过peg介导法导入酿酒酵母h1244感受态细胞,用含2%葡萄糖的sc-uracil培养基(teknova,hollister,ca,usa)平板进行转化子筛选。h1244感受态细胞用试剂盒s.c.easycomptransformationkit(invitrogen)制备,制备和转化方法参照说明书的步骤进行。挑取平板上长出的单克隆接种到含2%棉子糖的sc-uracil液体培养基培养24小时(温度为30℃,摇床转速为220rpm),然后离心(3000×g,5min)去除上清,重悬于50ml含2%半乳糖的sc-uracil液体培养基到od600=0.4,继续培养36小时诱导dgat1的表达合成tag。
诱导36小时后的细胞离心(3000×g,5min)后用预冷的去离子水洗涤2次,加入玻璃珠,用bead-beater(biospecproducts,bartlesville,ok,usa)将细胞打碎。然后加入3ml体积比为2:1的氯仿:甲醇混合溶液,剧烈振荡10min进行油脂抽提。接着加入0.75ml0.75%的氯化钠水溶液,混匀后离心(1000×g,5min)分层:上层为甲醇与氯化钠水溶液混合层,下层为含油脂的氯仿层。将下层用玻璃吸管吸出,用液氮吹干后定容到200μl。取10μl点样到tlc硅胶板(merck,darmstadt,germany),用体积比为80:20:2的正己烷∶甲基叔丁基醚∶冰醋酸混合溶液作为展开剂进行薄层层析。展开后的tlc硅胶板喷洒染色液(10%硫酸铜,8%磷酸),风干后在180℃烘烤3min显色。如果是tag定量分析,则将tlc板通过碘蒸气染色后回收tag。回收的tag在含有1.5%硫酸的甲醇中进行转甲酯化反应(85℃,2.5h)。甲酯化后的脂肪酸通过高效气相-质谱(gc-ms)进行定量分析。gc-ms配备的毛细色谱柱为rtx-2330(30m×0.25mm×0.25μm)、进校口、离子源和接口的温度分别为250℃、200℃和260℃。载气为高纯度氦气。样品(1μl)以19:1的分流比入进样口。柱厢初始温度为150℃,以每分钟10℃的速率上升到200℃,然后以每分钟15℃的速率上升到250℃,并在250℃保持3分钟。不同脂肪酸通过标准品进行定量分析。结果表明三角褐指藻dgat1的表达能够使h1244重新合成tag,从而证明了它的功能(图1)。
实施例2、微藻表达载体的构建和三角褐指藻的转化
(1)微藻表达载体的构建
载体ppha-dgat1的构建来源于ppha-t1(geetal,plantcell26,1681–1697,2012)。首先,将三角褐指藻dgat1基因编码序列用引物[正向引物:5’-ggcggatccatgaccacgcctgtatcttccg-3’(ecori)(seqidno:5);反向引物:5’-ggctctagaacgaatcaagcaggaatttttccataaaaag-3’(bamhi)(seqidno:6)]从质粒pyes-dgat1上通过pcr扩增出来,酶切纯化后连接到ppha-t1的相应酶切位点上,形成载体ppha-dgat1。该载体含有的抗性筛选基因为博来霉素抗性基因(ble),dgat1基因表达由内源的盐藻黄素-叶绿色a/c结合蛋白a(fcpa)启动子驱动。所有经pcr扩增后的产物都经过测序验证无误。
(2)三角褐指藻的转化
将三角褐指藻在f/2液体培养基中培养至对数期(~5×106cells/ml),按每个电击反应取25ml藻液,离心(2000×g,10min,4℃)收集。去上清液后,向离心管中加入1ml冰上预冷的375mm无菌sorbitol重悬藻细胞并转移至灭菌的1.5ml离心管中,充分混匀,然后离心(2000×g,10min,4℃)。弃去上清,再用冰上预冷的375mm无菌sorbitol洗涤两次。洗涤结束后,弃上清,加入100μl375mmsorbitol重悬,再加入5μg线性化的质粒ppha-dgat1,轻弹混匀,冰上放置30min,然后将混合物转移至2mm电击杯中进行电击。电击参数:500v、25μf、400ohm。电击后,将细胞立即转移至盛有10mlf/2培养基的15ml无菌离心管中,22℃,40μem-2s-1光强培养24小时。取出装有藻液的15ml离心管,离心(4000×g,10min,4℃),弃9ml上清,将剩余浓缩藻液混合均匀,取200μl用无菌玻璃棒均匀涂布于含100μg/ml博来霉素(zeocin)的抗性平板上进行筛选。一般3-4周后,平板上肉眼可见抗性克隆,4-5周后可以挑取抗性克隆于24孔板,添加含37.5μg/ml博来霉素(zeocin)的液体f/2培养基进行培养。
实施例3、三角褐指藻转化子的筛选和鉴定
(1)转化子的基因表达鉴定
将转化子在含有37.5μg/ml博来霉素(zeocin)的液体f/2培养基中培养到对数期后离心(2000×g,5min)收取约5×107cells,用于总rna的提取、cdna的合成、以及随后的实时荧光定量pcr。总rna的提取以及cdna的合成参照实施例1中的步骤。实时荧光定量pcr用sybrgreenpcrmastermix(invitrogen),具体参照说明书中的步骤进行。dgat1表达用内参基因β-actin进行归一化处理。dgat1所用正向引物和反向引物分别为5’-attgcgtttgggatcgaatg-3’(seqidno:7)和5’-catgccgaagttttcgttgaa-3’(seqidno:8)。β-actin所用正向引物和反向引物分别为5’-tattgttcatcgcaagtgcttctaa-3’(seqidno:9)和5’-taatacacctcctacaaacgttgaaga-3’(seqidno:10)。
(2)转化子的油脂提取和分析
将转化子在37.5μg/ml博来霉素的液体f/2培养基中培养到平台期后离心(2000×g,5min)收取用于活细胞油脂荧光染色分析以及油脂提取和分析。关于活细胞荧光染色分析,将藻细胞浓度稀释到约1×106cells/ml,以体积比1000:1(藻液:荧光染料)加入荧光染料bodipy493/503(10mg/ml),在暗处培育10分钟后在荧光显微镜下进行观察。激发波长为480nm,发射波长为480nm。结果表明,转化子的荧光更强(图2)。油脂提取方法参照实施例1中酵母油脂提取的步骤。提取后的油脂用tlc进行层析分离和回收tag,以及后续的转甲酯化和gc-ms定量分析,具体参照实施例1中的步骤。结果表明,转化子tag含量比野生型有了大幅升高(图3)。
利用本发明的方法,将三角褐指藻来源的dgat1在该藻中进行过表达,培育出的工程藻株tag含量提高了1.2倍,达到细胞干生的57%,总脂肪酸(tfa)含量提高了1倍,达到细胞干重的70%。相比之下,niu等(marinedrugs,2013,11:4558-4569)尝试在三角褐指藻中过表达dgat2a,总脂含量仅提高40%,占细胞干重的37.5%。dinamarca等(journalofphycology,53:405-414)在三角褐指藻中过表达dgat2d,tag含量仅提高80%,且占细干重含量未知。cui等(biotechnollogyforbiofuels,2018,11:32)在三角褐指藻中过表达dgat3,tag含量仅提高30%(占细胞干重的23%),总脂含量仅提高10%(占细胞干重的36%)。tag含量的大幅增加有利于下游的提取、纯化等工艺流程。本发明获得的工程藻株以及从其提取的tag可用于生物能源和食品业等。
sequencelisting
<110>北京大学
<120>一种高效提高微藻甘油三酯含量的代谢工程方法
<130>wx2020-03-019
<160>10
<170>patentinversion3.5
<210>1
<211>756
<212>prt
<213>phaeodactylumtricornutum
<400>1
metthrthrprovalsersergluaspthralathrleuglnglnlys
151015
ilevalalaleuglnalaglnleuleuseralathrhisalaleuglu
202530
argmetlysasngluargglyalaserseralaasphisserlysser
354045
alaglnargasnglyseraspproserseraspprothrglythrala
505560
provalalaalaproproalalysserglytyrleuphelysgluleu
65707580
aspargalaileglytrpglyglyilelystrpserleuargtyrval
859095
lysleugluserglyargilesertyrtyrglyserhishisaspthr
100105110
serproargtyrgluleuglnleuargglycysalavalargaspasp
115120125
glytrplysargasnproargphelysthrlysargasnglupropro
130135140
proleuleuaspthrthrglyalatyrphepheleupheservaltyr
145150155160
hisalaproaspalaalaglulysgluileaspgluthrgluilethr
165170175
proleuleuargpheserthrproserargalagluhissersertrp
180185190
ilelysleualaserglusercysalatyrsergluthraspgluphe
195200205
leualaaspglualaalaargalathrglnargalaleuglnhisgln
210215220
glualaleuglnmetalaglnalametproglyalalysproglythr
225230235240
leuproproleutyrphealaprothrilelysargserargserphe
245250255
alalysleuglngluhishisglyaspglymetproargvalasnmet
260265270
argargthrlysserargasppheasnalaasplysleuaspalaarg
275280285
serthrlysglytyrproproserlyspromethisargalaalaglu
290295300
prosertyrleuseralaaspalaproileglnasntyrargglyphe
305310315320
leuasnleuglyvalileileleuilevalserasnpheargleuile
325330335
leuglythrileargserasnglyphevalleuthrthralavallys
340345350
histyrlysasnleuasnhisleulysgluaspprotrpglngluphe
355360365
prophevalserglypheleuleuglnleuvalphevalserileala
370375380
pheglyileglutrpmetleucysarglystyrpheasngluasnphe
385390395400
glymetileleuhishispheasnalahisseralaleuleuilepro
405410415
leuglyilevaltrpasnleuileaspargproalavalglyalaile
420425430
leuleuleuhisalathrilethrtrpmetlysleuilesertyrmet
435440445
leualaasngluasptyrargleuserserargargvalglyglyasn
450455460
prohisleualathrleualaleuvalgluasnleuaspseraspglu
465470475480
alaasnileasntyrproglnasnvalthrleuargasnilephetyr
485490495
phetrpcysalaprothrleuthrtyrglnilealapheprolysser
500505510
proargvalargtyrtrplysilealaaspileleumetargmetthr
515520525
valserilealaleuphethrpheleuleualaglnilevalglnpro
530535540
alaleuglugluleuvalseraspleuaspgluthrasnglysertyr
545550555560
thralaalailephealaglutyrtrpleulysleuserilealaasn
565570575
thrtyrleutrpleuleumetphetyrthrtyrphehisleutyrleu
580585590
asnleuphealagluleuleuargpheglyaspargvalphetyrlys
595600605
asptrptrpasnsersergluvalseralatyrtrpargleutrpasn
610615620
metprovalhistyrtrpleuilearghisvaltyrpheprocysval
625630635640
argleulysmetprolysvalalaalathrphevalvalphepheleu
645650655
seralavalmethisgluvalleuvalservalprophehisileile
660665670
argprotrpserpheileglymetmetmetglnileproleuvalala
675680685
phethrlystyrleutyrarglyspheproglyglyserpheglyasn
690695700
valleuphetrpmetthrphecysvalileglyglnprometalaile
705710715720
leuleutyrthrvalasptyrglntyrglylyshishisserthrasn
725730735
metgluilepheaspthraspaspcysargpheleutrplysasnser
740745750
cysleuilearg
755
<210>2
<211>2271
<212>dna
<213>phaeodactylumtricornutum
<400>2
atgaccacgcctgtatcttccgaagatacggctactttgcaacaaaagatcgtggcgtta60
caggcacagctattgtcagcgactcacgctcttgagcgaatgaagaatgaacgaggcgcg120
tcttctgctgaccattccaaatcagcacagaggaacggttccgatcctagcagcgacccc180
acaggaactgcccctgtcgctgctcctccagccaagagcggctatctgttcaaggagctc240
gatcgcgccattggctggggcggtattaagtggagcttgcgatacgtgaaactagaaagc300
ggccgaatatcatactacggatcgcatcacgatacttctccacgttacgagcttcagttg360
cgtggatgcgctgtacgagacgatggctggaaacgcaacccgcgctttaagaccaaacgg420
aatgaacccccgcctttgctagatacaaccggcgcttactttttcctcttttccgtgtac480
catgcacccgacgcagctgagaaggaaattgatgagaccgaaattacacctttgttgcgt540
ttttcgacaccttcccgagccgaacactcgtcctggataaagcttgcctcggaatcctgt600
gcttacagcgaaacggacgagtttctcgctgacgaggccgctcgcgcaacccagcgtgct660
ttgcaacatcaagaagcgctgcaaatggcccaagccatgcctggggcaaagccaggaacg720
ctgccgccactctacttcgcgcctaccataaagcgttcgcgttcctttgctaagctacaa780
gaacatcatggagatgggatgcctcgggtaaatatgcgtcggaccaaatcgcgagatttt840
aacgcggataagttggatgcgcgaagtaccaagggctatcccccttccaagccgatgcat900
cgtgcggcagagccctcatacctcagcgcggatgctcccattcaaaactaccgaggattt960
ctgaatttaggcgttattattttgattgtttctaactttcggctgatcttgggcacaatc1020
cgtagcaacggatttgtcttgacgactgcagtgaagcactacaagaacctaaatcacctc1080
aaggaagatccctggcaggaatttccttttgtatcaggatttcttctccagctcgtcttt1140
gtttcgattgcgtttgggatcgaatggatgttgtgccggaaatacttcaacgaaaacttc1200
ggcatgatccttcatcacttcaatgcccactcagccttgctgatacctttaggtattgtt1260
tggaatctcatcgatagacctgcggttggtgcaattttgcttttacacgctacgataaca1320
tggatgaaactcatttcttacatgttggcgaacgaagattaccggctatcatcgcgtcgc1380
gttgggggcaacccacacctagctacgctcgcattagtcgaaaatctagattcagatgag1440
gcgaacattaactacccccaaaatgttactctccgcaacattttttatttttggtgtgct1500
ccgacgttgacttaccagattgccttcccgaagtccccgcgagttcgctattggaaaatc1560
gcggatatcctgatgcgcatgacggtgtccatcgcactattcacctttttgctggcacaa1620
attgttcagcctgcattggaagagctagtgagcgacctggacgagaccaatggatcctac1680
accgcagcaatatttgccgagtactggctgaaactttcgattgctaacacatatttatgg1740
cttcttatgttctatacatatttccatttgtatctgaacctctttgctgagcttctgcga1800
tttggagatcgtgtgttctacaaagattggtggaattcgtcggaagtatctgcatattgg1860
aggctttggaatatgcctgttcactattggttgatccgacatgtgtatttcccctgcgtg1920
cgactgaagatgccgaaggtcgctgcaacctttgtcgtttttttcctctccgccgttatg1980
cacgaggtgcttgtcagcgtaccctttcatattattcgtccgtggtcttttatcgggatg2040
atgatgcagattcctttggttgcgttcacaaagtatctctatcgcaaattcccgggcggc2100
tcgtttggtaatgtcctgttctggatgacattttgcgtcattggccagccaatggcgatt2160
ctcttgtacacagttgattaccagtatgggaaacaccacagcacgaacatggagatattc2220
gatacggacgactgccgctttttatggaaaaattcctgcttgattcgttga2271
<210>3
<211>31
<212>dna
<213>人工序列
<400>3
ggcggatccatgaccacgcctgtatcttccg31
<210>4
<211>40
<212>dna
<213>人工序列
<400>4
ggctctagaacgaatcaagcaggaatttttccataaaaag40
<210>5
<211>31
<212>dna
<213>人工序列
<400>5
ggcggatccatgaccacgcctgtatcttccg31
<210>6
<211>40
<212>dna
<213>人工序列
<400>6
ggctctagaacgaatcaagcaggaatttttccataaaaag40
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
attgcgtttgggatcgaatg20
<210>8
<211>21
<212>dna
<213>人工序列
<400>8
catgccgaagttttcgttgaa21
<210>9
<211>25
<212>dna
<213>人工序列
<400>9
tattgttcatcgcaagtgcttctaa25
<210>10
<211>27
<212>dna
<213>人工序列
<400>10
taatacacctcctacaaacgttgaaga27
- 还没有人留言评论。精彩留言会获得点赞!