在线监控目标蛋白的产量和质量的方法与流程
本发明涉及生物技术领域,尤其涉及一种在线监控目标蛋白的产量和质量的方法。
背景技术:
随着单克隆抗体(简称单抗)生产工艺的不断改进,质量源于设计的理念也在逐步地被应用到生产工艺及工艺优化的各个阶段。因此,在细胞培养阶段实时监控单抗产品的产量和关键质量属性势在必行。在细胞培养阶段,若需要同时监控产量、纯度、糖型等关键质量属性(criticalqualityattributes,cqa),需要有相对应的分析方法支持;这个阶段的样品中成分复杂,如果需要进行纯度或其它质量属性的分析,则需要先进行一步手动纯化,耗时费力,且难以对纯化操作步骤进行验证;同时增加了工艺等待时间;且早期的样品稳定性较差,会直接影响分析方法的准确性。
近些年,越来越多的生物制品尤其是单克隆抗体产品进入了商业化生产阶段,与之对应的生产工艺也在朝着自动化、连续化发展,这就需要对生产工艺的监控及结果反馈的及时性提出了更高的要求。因此,一种多属性在线监控技术对自动化生产工艺的重要性不言而喻。
二维液相色谱是当前液相色谱领域中的研究热点,集中在蛋白质、多肽、小分子药物等产品的特性分析、组分鉴定、结构表征及在线纯化等应用,其本身是由多个阀组件连接起来的两套液相色谱,能大大提高多种产品属性同时分析的可行性。但是,二维液相的应用开发多见于研发阶段,且目前针对二维液相的研究多集中在对液相组件的更新及优化,鲜有将其结合到生产工艺流程的尝试。
综上所述,现有技术在实际使用上显然存在不便与缺陷,所以有必要加以改进。
技术实现要素:
针对上述的缺陷,本发明的目的在于提供一种在线监控目标蛋白的产量和质量的方法,以实现自动监控目标蛋白溶液的产量和质量,并且提高了监控的效率。
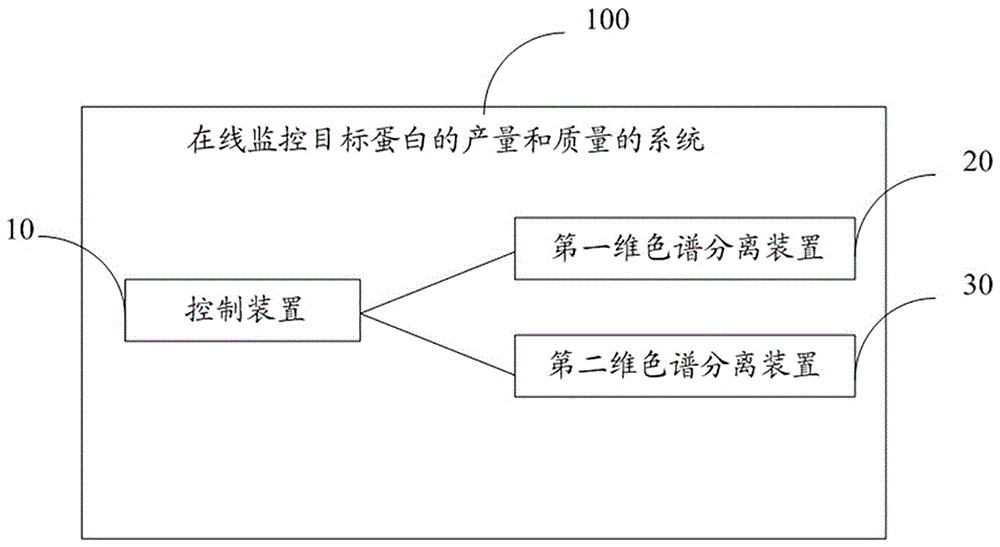
为了实现本发明的一个发明目的,本发明提供了一种在线监控目标蛋白的产量和质量的方法,所述方法利用在线监控目标蛋白的产量和质量的系统实现;所述系统包括:控制装置、第一维色谱分离装置以及第二维色谱分离装置;所述方法包括:
a、第一维色谱分离装置接收所述控制装置的控制信号,将含有所述目标蛋白的细胞培养发酵液进行proteina亲和色谱分离,获得含有所述目标蛋白的洗脱液,并向所述控制装置返回第一检测信号;所述控制装置根据所述第一检测信号计算所述目标蛋白溶液的产量信息;
b、第二维色谱分离装置接收所述控制装置的控制信号,将含有所述目标蛋白的洗脱液进行阳离子交换色谱和/或体积排阻色谱分离,获得目标蛋白溶液,并向所述控制装置返回第二检测信号;所述控制装置根据所述第二检测信号计算所述目标蛋白溶液的质量信息。
根据所述的方法,所述系统还包括:细胞培养取样装置;所述方法还包括:
c、所述细胞培养取样装置接收所述控制装置的控制信号,将包含目标蛋白的细胞培养样品取样并进行离心和/或过滤后,获得所述含有目标蛋白的细胞培养发酵液。
根据所述的方法,所述第一维色谱分离装置包括:第一进样模组、proteina亲和色谱柱以及第一检测器;
所述第一进样模组包括进样环和收集器,所述进样环通过第一多角阀与细胞培养取样装置和所述收集器连接;
所述第一检测器与所述proteina亲和色谱柱和所述收集器连接;
所述控制装置包括:第一控制模块、第二控制模块、第三控制模块以及第一计算模块;
所述步骤a包括:
a1、所述第一控制模块向所述第一进样模组发送第一控制信号,控制所述进样环将含有所述目标蛋白的细胞培养发酵液输送到所述proteina亲和色谱柱;
a2、所述第二控制模块向所述proteina亲和色谱柱发送第三控制信号,控制所述proteina亲和色谱柱对含有所述目标蛋白的细胞培养发酵液进行蛋白质洗脱,获得含有所述目标蛋白的洗脱液;
a3、所述第三控制模块向所述第一检测器发送第四控制信号,所述第一检测器返回所述第一检测信号;
a4、所述第一计算模块根据所述第一检测信号计算所述目标蛋白溶液的产量。
根据所述的方法,所述第二维色谱分离装置包括:阳离子交换色谱柱、体积排阻色谱柱以及第二检测器;所述proteina亲和色谱柱、阳离子交换色谱柱以及体积排阻色谱柱通过第二多角阀与所述收集器连接;
所述控制装置还包括:串联通路选择模块、第五控制模块以及第二计算模块;
所述步骤b包括:
b1、所述串联通路选择模块控制所述第二多角阀的通路,设置含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱或者体积排阻色谱柱;
b2、所述阳离子交换色谱柱对含有所述目标蛋白的洗脱液进行阳离子交换色谱分离;或者所述体积排阻色谱柱对含有所述目标蛋白的洗脱液进行体积排阻色谱分离;获得所述目标蛋白溶液;
b3、所述第五控制模块向所述第二检测器的发送第五控制信号,控制所述第二检测器检测经过所述阳离子交换色谱柱或者体积排阻色谱柱的含有所述目标蛋白的洗脱液的紫外吸收信号,并向所述控制装置返回所述第二检测信号;
b4、所述第二计算模块根据所述第二检测信号计算所述目标蛋白溶液产品的电荷异质性或者单体纯度及分子大小异质性。
根据所述的方法,所述第二维色谱分离装置包括:阳离子交换色谱柱和体积排阻色谱柱;所述proteina亲和色谱柱、阳离子交换色谱柱,或者所述proteina亲和色谱柱、所述体积排阻色谱柱通过第三多角阀与所述第一检测器连接;
第二检测器与所述阳离子交换色谱柱或者所述体积排阻色谱柱连接;
所述控制装置还包括:并联通路选择模块、第五控制模块以及第二计算模块;
所述步骤b包括:
b5、所述并联通路选择模块通过控制所述第三多角阀的通路,设置含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱和体积排阻色谱柱;
b6、所述阳离子交换色谱柱和所述体积排阻色谱柱分别对含有所述目标蛋白的洗脱液进行阳离子交换色谱分离和体积排阻色谱分离,获得所述目标蛋白溶液;
b7、所述第五控制模块向所述第二检测器和第一检测器发送第六控制信号,检测经过所述阳离子交换色谱柱和体积排阻色谱柱的含有所述目标蛋白的洗脱液的紫外吸收信号,并向所述控制装置返回所述第二检测信号;
b8、所述第二计算模块根据所述第二检测信号计算所述目标蛋白溶液的电荷异质性和单体纯度及分子大小异质性。
根据所述的方法,所述细胞培养取样装置包括相互连接的细胞培养罐、离心器和/或过滤器;所述控制装置还包括:第四控制模块;
所述步骤c包括:
c1、所述第四控制模块控制所述细胞培养罐培养包含所述目标蛋白的细胞培养样品,并输送到所述离心器和/或过滤器;
c2、所述第四控制模块控制所述离心器和/或过滤器对包含所述目标蛋白的细胞培养样品进行离心和/或过滤后,获得含有所述目标蛋白的细胞培养发酵液。
根据所述的方法,所述系统还包括:第一泵模组和/或废液回收器,所述第一泵模组与第一进样模组和所述第二维色谱分离装置连接,所述废液回收器与所述第二维色谱分离装置连接;
所述方法还包括:
所述第一泵模组在所述第一维色谱分离装置和第二维色谱分离装置进行色谱分离时提供流动相、等度或梯度洗脱的动力;和/或
所述第二维色谱分离装置将其进行色谱分离后产生的废液输送到所述废液回收器。
根据所述的方法,所述proteina亲和色谱柱、阳离子交换色谱柱以及体积排阻色谱柱设置于一个多柱位柱温箱;
所述第一检测器和第二检测器均为紫外线检测器;
所述第一泵模组包括左泵和右泵;所述左泵连接所述proteina亲和色谱柱,所述右泵连接所述阳离子交换色谱柱和/或体积排阻色谱柱;
所述多角阀为六角阀。
根据所述的方法,所述细胞培养样品为包含目标蛋白的细胞培养样品。
本发明提供了利用在线监控目标蛋白的产量和质量的系统实现的在线监控目标蛋白的产量和质量的方法,该在线监控目标蛋白的产量和质量的系统包括了控制装置、第一维色谱分离装置以及第二维色谱分离装置,其中第一维色谱分离装置以及第二维色谱分离装置构成了二维液相系统,由此接入到细胞培养取样装置在细胞培养过程中实时取样后,经过在线离心或过滤后,直接接入二维液相进行产量和质量(电荷异质性或者纯度及分子大小异质性)的分析,由此实现自动监控目标蛋白溶液上游发酵液的产量和质量,并且提高了监控的效率。
附图说明
图1是本发明实施例提供的在线监控单抗上游发酵液的产量和质量的系统组成框图;
图2是本发明实施例提供的在线监控目标蛋白的产量和质量的系统组成框图;
图3是本发明实施例提供的在线监控目标蛋白的产量和质量的系统组成框图;
图4是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量的流程示意图;
图5是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量的流程示意图;
图6是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量的方法流程图;
图7是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量的数据分析中的proteina-cex谱图;
图8是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量的数据分析中的proteina-sec谱图;
图9是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量系统中的多角阀切换示意图;
图10是本发明实施例提供的在线监控目标蛋白上游发酵液的产量和质量系统中的多角阀切换示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
材料来源:
测试样品单抗1为重组人鼠嵌合抗cd20单克隆抗体(rituximab生物类似药)。
测试样品单抗2为重组抗cd38人源化单克隆抗体(daratumumab生物类似药)。
参见图1~图5,在本发明的一个实施例中,提供了一种在线监控目标蛋白的产量和质量的系统100,包括:
控制装置10,用于执行在线监控操作指令,并输出控制信号,以及根据接收到的检测信号计算与所述目标蛋白相关的产量和质量的信息;该控制装置10执行预设的或者现场控制的在线监控操作指令,并向该系统100中的多个装置发出相应的控制信号,以控制所述多个装置执行相应的操作;
第一维色谱分离装置20,用于接收所述控制装置10的控制信号,将含有所述目标蛋白的细胞培养发酵液进行proteina亲和色谱分离,获得含有所述目标蛋白的洗脱液,并向所述控制装置10返回第一检测信号;该第一维色谱分离装置20对含有所述目标蛋白的细胞培养发酵液进行proteina亲和色谱分离;
第二维色谱分离装置30,用于接收所述控制装置10的控制信号,将含有所述目标蛋白的洗脱液进行阳离子交换色谱和/或体积排阻色谱分离,获得目标蛋白溶液,并向所述控制装置返回第二检测信号;该第二维色谱分离装置30对含有所述目标蛋白的洗脱液进行阳离子交换色谱和/或体积排阻色谱分离;
其中,控制装置10根据所述第一检测信号计算所述目标蛋白溶液的产量信息;以及根据所述第二检测信号计算所述目标蛋白溶液的质量信息。
在该实施例中,将传统的proteina亲和色谱和阳离子交换色谱(cex)和/或体积排阻色谱(sec)通过二维液相切换阀联动起来,其监测结果与单独分析结果一致,大大节省了人工操作的时间,如由离线监控的1-2天缩短到在线监控的1小时之内,实现在线监控细胞培养过程中单抗产量和如上所述质量属性。并且,本发明将特别适用于单抗工艺开发和生产上游发酵液的在线中控检测。其中所述细胞培养样品为单抗细胞培养样品。此外,目标蛋白溶液可以是任何蛋白质溶液,特别是任何通过培养宿主细胞中产生的重组蛋白。最佳的目标蛋白溶液是抗体(单克隆抗体)、免疫粘附素和其他抗体样分子,例如包括ch2/ch3区的融合蛋白。图4和图5的图示中,第一维液相流路代表第一维色谱分离装置20的液相流路;第二维液相流路代表第二维色谱分离装置30的液相流路。
参见图1~图5,在本发明的一个实施例中,在线监控目标蛋白的产量和质量的系统100还包括:
细胞培养取样装置40,用于接收所述控制装置10的控制信号,将包含目标蛋白的细胞培养样品取样并进行离心和/或过滤后,获得含有所述目标蛋白的细胞培养发酵液。该细胞培养取样装置40对包含目标蛋白的细胞培养样品进行取样、离心和/或过滤,获得含有所述目标蛋白的细胞培养发酵液。
参见图1~图5,在本发明的一个实施例中,在线监控目标蛋白的产量和质量的系统100还包括:
第一泵模组50,与第一进样模组21和所述第二维色谱分离装置30连接,所述第一泵模组50用于为第一维色谱分离装置20和第二维色谱分离装置30提供流动相、等度或梯度洗脱的动力;并且该第一泵模组50包括左泵51和右泵52;左泵51连接第一维色谱分离装置20,右泵52连接第二维色谱分离装置30,分别为两者提供色谱分离的流动相、等度或梯度洗脱的动力。
此外,在线监控目标蛋白的产量和质量的系统100还包括废液回收器60,与第二维色谱分离装置30连接,该废液回收器60用于接收经过所述第二维色谱分离装置30分离后产生的废液。
参见图1~图5,在本发明的一个实施例中,第一维色谱分离装置20包括:
第一进样模组21,包括进样环311和收集器312,进样环311通过第一多角阀46与细胞培养取样装置40和所述收集器312连接;该第一进样模组21可以将细胞培养取样装置40经过培养、取样及离心和/或过滤的含有所述目标蛋白的细胞培养发酵液自动传输到proteina亲和色谱柱22;细胞培养取样装置40包括相互连接的细胞培养罐41、离心器和/或过滤器42。
proteina亲和色谱柱22,用于对含有所述目标蛋白的细胞培养发酵液进行蛋白质洗脱,获得含有所述目标蛋白的洗脱液;该proteina亲和色谱柱22将含有所述目标蛋白的细胞培养发酵液中的蛋白质捕获到proteina亲和色谱柱22上,通过控制装置10的设置,采用洗脱相将蛋白质从proteina亲和色谱柱22上洗脱下来。
第一检测器23,与proteina亲和色谱柱22和收集器312连接,第一检测器23用于检测流经的含有所述目标蛋白的洗脱液的紫外吸收信号的第一检测信号。该第一检测器23捕获流经的含有所述目标蛋白的洗脱液的蛋白质的紫外吸收信号,并将包含该紫外吸收信号信息的第一检测信号返回到控制装置10,该第一检测信号用于目标蛋白溶液产量和第二维色谱进样含量的计算。
参见图3~图5,在本发明的一个实施例中,控制装置10包括:
第一控制模块11,用于向所述第一进样模组21发送第一控制信号,控制所述进样环311将含有所述目标蛋白的细胞培养发酵液输送到所述proteina亲和色谱柱22;以及
用于向所述收集器312发送第二控制信号,回收经过第一检测器23检测的含有所述目标蛋白的洗脱液;
第二控制模块12,用于向所述proteina亲和色谱柱22发送第三控制信号,控制所述proteina亲和色谱柱22对含有所述目标蛋白的细胞培养发酵液进行蛋白质洗脱,获得含有所述目标蛋白的洗脱液;
第三控制模块13,用于向所述第一检测器23的发送第四控制信号,控制所述第一检测器23返回所述第一检测信号;第一检测器23返回的是捕获流经的含有所述目标蛋白的洗脱液的紫外吸收信号的第一检测信号;
第一计算模块15,用于根据所述第一检测信号计算所述目标蛋白溶液的产量。该第一检测信号是包括含有所述目标蛋白的洗脱液的紫外吸收信号,经过第一计算模块15的计算洗脱液获得目标蛋白溶液的产量,以及第二维色谱进样量。
在本发明的一个实施例中,控制装置10还包括:
第四控制模块14,用于向所述细胞培养取样装置40发送第七控制信号,控制所述细胞培养取样装置40将包含目标蛋白的细胞培养样品培养并进行离心和/或过滤后,将获得的含有所述目标蛋白的细胞培养发酵液输送到所述第一进样模组21。通过该第四控制模块14控制细胞培养取样装置40对细胞培养样品培养并进行离心和/或过滤。
参见图1~图3,以及图4,在本发明的一个实施例中,第二维色谱分离装置30包括:
阳离子交换色谱柱31,用于对所述含有所述目标蛋白的洗脱液进行阳离子交换色谱分离;
体积排阻色谱柱32,用于对所述含有所述目标蛋白的洗脱液进行体积排阻色谱分离;
所述proteina亲和色谱柱22、阳离子交换色谱柱31或体积排阻色谱柱32通过第二多角阀47与所述收集器312连接;通过控制装置10控制第二多角阀47设置含有所述目标蛋白的细胞培养发酵液通过proteina亲和色谱柱22后,含有所述目标蛋白的洗脱液通过阳离子交换色谱柱31或者体积排阻色谱柱32;
第二检测器33,与所述阳离子交换色谱柱31和体积排阻色谱柱32连接;所述第二检测器33用于检测流经的所述目标蛋白溶液的紫外吸收信号,并向所述控制装置10返回含有所述目标蛋白溶液的紫外吸收信号的所述第二检测信号。
在该实施例中,控制装置10包括:
串联通路选择模块16,用于对通过控制所述第二多角阀47的通路,设置含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱31或者体积排阻色谱柱32;在串联通路选择模块16控制第二多角阀47接通含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱31的通路后,另一条含有所述目标蛋白的洗脱液经过体积排阻色谱柱32的通路被关闭,反之亦然,即在本实施例中含有所述目标蛋白的洗脱液只会根据控制经过所述阳离子交换色谱柱31和体积排阻色谱柱32之中的一个色谱柱。
第五控制模块17,用于向第二检测器33发送第五控制信号,检测经过阳离子交换色谱柱31或者体积排阻色谱柱32的含有所述目标蛋白的洗脱液的紫外吸收信号的第二检测信号,向控制装置10返回所述第二检测信号,并获取所述目标蛋白溶液;
第二计算模块18,用于根据所述第二检测信号计算所述目标蛋白溶液的电荷异质性或者单体纯度及分子大小异质性。在该实施例中,通过串联通路选择模块16选择含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱31或者体积排阻色谱柱32,由此可以计算获得目标蛋白溶液的电荷异质性,或者是获得单体纯度及分子大小异质性。根据选择的不同的通路将获得不同的所述目标蛋白溶液的质量的信息,可以是目标蛋白溶液的电荷异质性,或者是目标蛋白溶液的单体纯度及分子大小异质性。
参见图1~图3以及图5,在本发明的一个实施例中,第二维色谱分离装置30包括:
阳离子交换色谱柱31,用于对所述含有所述目标蛋白的洗脱液进行阳离子交换色谱分离;
体积排阻色谱柱32,用于对所述含有所述目标蛋白的洗脱液进行体积排阻色谱分离;
所述proteina亲和色谱柱22、阳离子交换色谱柱31,或者proteina亲和色谱柱22、体积排阻色谱柱32通过第三多角阀48与第一检测器23连接;
所述阳离子交换色谱柱31或者所述体积排阻色谱柱32与所述第二检测器33连接;
第一检测器23还用于检测流经的所述目标蛋白的洗脱液的紫外吸收信号的第二检测信号,并向所述控制装置10返回所述第一检测信号。在该实施例中,第一检测器23除了前述的返回第一检测信号,还会承担第二维色谱分离装置30的第二检测信号的检测,以向控制装置10返回第二检测信号。
与上一实施例不同的是,在该实施例中,阳离子交换色谱柱31和体积排阻色谱柱32属于并联通路,含有所述目标蛋白的洗脱液同时流过阳离子交换色谱柱31和体积排阻色谱柱32;由控制装置10进行控制实现,具体的控制装置10包括:
并联通路选择模块19,用于通过控制所述第三多角阀48的通路,设置含有所述目标蛋白的洗脱液均经过所述阳离子交换色谱柱31和体积排阻色谱柱32;
第五控制模块17,用于向所述第二检测器33和第一检测器23发送第六控制信号,检测经过所述阳离子交换色谱柱31和体积排阻色谱柱32的含有所述目标蛋白的洗脱液,并获取所述目标蛋白溶液;在含有所述目标蛋白的洗脱液均经过所述阳离子交换色谱柱31和体积排阻色谱柱32的情况下,第一检测器23也会承担部分第二维色谱分离装置30的第二检测信号的检测;
第二计算模块18,用于根据所述第二检测信号计算所述目标蛋白溶液产品的电荷异质性和纯度及分子大小异质性;
在该实施例中,通过并联通路选择模块19控制多角阀的通路,将含有所述目标蛋白的洗脱液均经过所述阳离子交换色谱柱31和体积排阻色谱柱32;由此第二计算模块18计算获得目标蛋白溶液的电荷异质性、单体纯度及分子大小异质性。图5中的第四多角阀49分别与第一检测器23和第二检测器33以及收集器312连接。
此外,优选的proteina亲和色谱柱22、阳离子交换色谱柱31以及体积排阻色谱柱32设置于一个多柱位柱温箱45;使该在线监控目标蛋白的产量和质量的系统100的结构更为紧凑,操作便捷。第一检测器23和第二检测器33均为紫外线检测器,返回第一检测信号和第二检测信号。上述多个实施例中所述多角阀为六角阀,即第一多角阀至第四多角阀等均可分别选用六角阀,或者是八角阀等;而所述细胞培养样品为包含目标蛋白的细胞培养样品。此外,控制装置10的各个控制模块可以直接进行反馈信号的接收,或者是控制装置10在实现上还可以包括一信号传输模块,该信号传输模块用于接收其他装置传送的信号,例如第一检测信号、第二检测信号等,再将这些信号传输到控制装置10的各个控制模块。而本发明中描述的第一控制信号至第七控制信号,其数字并不代表绝对的控制信号的发生的先后顺序,只为区分控制装置10的多个模块发出的控制信号的控制功能。
为了实现本发明的另一发明目的,本发明提供了一种在线监控目标蛋白的产量和质量的方法,所述方法利用在线监控目标蛋白的产量和质量的系统100实现;所述系统100包括:控制装置10、第一维色谱分离装置20以及第二维色谱分离装置30;所述方法包括:
步骤s601、第一维色谱分离装置20接收所述控制装置10的控制信号,将含有所述目标蛋白的细胞培养发酵液进行proteina亲和色谱分离,获得含有所述目标蛋白的洗脱液,并向所述控制装置10返回第一检测信号;所述控制装置10根据所述第一检测信号计算所述目标蛋白溶液的产量信息;
步骤s602、第二维色谱分离装置30接收所述控制装置10的控制信号,将含有所述目标蛋白的洗脱液进行阳离子交换色谱和/或体积排阻色谱分离,获得目标蛋白溶液,并向所述控制装置10返回第二检测信号;所述控制装置10根据所述第二检测信号计算所述目标蛋白溶液的质量信息。
在该实施例中,采用上述多个实施例中的在线监控目标蛋白的产量和质量的系统100实现在线监控目标蛋白的产量和质量,具体的,控制装置10控制含有所述目标蛋白的细胞培养发酵液先通过第一维色谱分离装置20的proteina亲和色谱,获得含有所述目标蛋白的洗脱液,控制装置10根据收到的所述第一检测信号计算所述目标蛋白溶液的产量信息;如得到其目标蛋白溶液的浓度(titer);然后通过中心切割,将proteina亲和色谱中抗体峰收集下来,进入第二维色谱分离装置30的阳离子交换色谱和/或体积排阻色谱,控制装置10根据接收到的第二检测信号分析目标蛋白溶液的电荷异质性和/或纯度及分子大小异质性;整个过程由控制装置10按照设定的程序自主完成,无需人工干预。
在本发明的一个实施例中,所述第一维色谱分离装置20包括:第一进样模组、proteina亲和色谱柱22以及第一检测器23;
所述第一进样模组21包括进样环311和收集器312,所述进样环311通过第一多角阀46与细胞培养取样装置40和所述收集器312连接;
所述第一检测器23与所述proteina亲和色谱柱22和所述收集器312连接;
所述控制装置10包括:第一控制模块11、第二控制模块12、第三控制模块13以及第一计算模块15;
所述步骤s601包括:
a1、第一控制模块11向所述第一进样模组21发送第一控制信号,控制所述进样环311将含有所述目标蛋白的细胞培养发酵液输送到所述proteina亲和色谱柱22;
a2、所述第二控制模块12向所述proteina亲和色谱柱22发送第三控制信号,控制所述proteina亲和色谱柱22对含有所述目标蛋白的细胞培养发酵液进行蛋白质洗脱,获得含有所述目标蛋白的洗脱液;
a3、所述第三控制模块13向所述第一检测器23发送第四控制信号,所述第一检测器23返回所述第一检测信号;
a4、所述第一计算模块15根据所述第一检测信号计算所述目标蛋白溶液产品的产量。
参见图1~图3,以及图4,在本发明的一个实施例中,第二维色谱分离装置30包括:阳离子交换色谱柱31和/或体积排阻色谱柱32;所述proteina亲和色谱柱22、阳离子交换色谱柱31以及体积排阻色谱柱32通过第二多角阀47与所述收集器312连接;所述控制装置10还包括:串联通路选择模块16、第五控制模块17以及第二计算模块18;所述步骤s602包括:
b1、所述串联通路选择模块16控制所述第二多角阀47的通路,设置含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱31或者体积排阻色谱柱32;
b2、所述阳离子交换色谱柱31对含有所述目标蛋白的洗脱液进行阳离子交换色谱分离;或者所述体积排阻色谱柱32对含有所述目标蛋白的洗脱液进行体积排阻色谱分离;获得所述目标蛋白溶液;
b3、所述第五控制模块17向所述第二检测器33的发送第五控制信号,检测经过所述阳离子交换色谱柱31或者体积排阻色谱柱32的含有所述目标蛋白的洗脱液的紫外吸收信号洗脱液,并向所述控制装置10返回所述第二检测信号;
b4、所述第二计算模块18根据所述第二检测信号计算所述目标蛋白溶液的电荷异质性或者单体纯度及分子大小异质性。
在该实施例中,对于由第一维色谱分离装置20和第二维色谱分离装置30构成的二维液相,分别接入proteina亲和色谱和sec或cex,通过自动进样器收集样品。当含有目标蛋白的细胞培养样品从细胞培养罐41中取出后,经过离心过滤后流入二维液相的进样系统的取样环311,然后通过第一维色谱分离装置20,第一维的proteina亲和色谱将含有所述目标蛋白的细胞培养发酵液中的目标蛋白捕获到色谱柱上,通过控制装置10的设置,采用洗脱相将目标蛋白从色谱柱上洗脱下来,获得含有所述目标蛋白的洗脱液。控制装置10实现上可以是电脑控制系统。之后,流经第一检测器23,第一检测器23返回检测到的所述目标蛋白的洗脱液的紫外吸收信号的第一检测信号到控制装置10,控制装置10根据反馈的第一检测信号计算得到含有所述目标蛋白的洗脱液的目标蛋白的产量信息,该信息以第一检测信号形式反馈回控制装置10,同时控制装置10控制样品收集回进样系统的收集器312中;之后,通过第一进样模组21可将第一维色谱分离装置20收集到的样品,即含有所述目标蛋白的洗脱液取出并打进第二维色谱分离装置30(cex或sec),通过阳离子交换色谱柱31或者体积排阻色谱柱32的分离,得到所述目标蛋白溶液,第二检测器33返回检测到的所述目标蛋白溶液的洗脱液的紫外吸收信号的第二检测信号到控制装置10,控制装置10根据反馈的第二检测信号,进行计算得到的所述目标蛋白溶液的电荷异质性或者单体纯度及分子大小异质性的质量信息。
在本发明的一个实施例中,所述系统100还包括:细胞培养取样装置40;在步骤s601之前还包括:
c、细胞培养取样装置40接收所述控制装置10的控制信号,将包含目标蛋白的细胞培养样品取样并进行离心和/或过滤后,获得所述含有目标蛋白的细胞培养发酵液。通过该步骤可以对细胞培养样品取样以及离心和/或过滤处理。
所述细胞培养取样装置40包括相互连接的细胞培养罐41、离心器和/或过滤器42;所述控制装置10还包括:第四控制模块15;
具体的,步骤c包括
步骤c1、第四控制模块15控制细胞培养罐41培养所述包含目标蛋白的细胞培养样品,并输送到离心器和/或过滤器42;
步骤c2、第四控制模块15控制离心器和/或过滤器42对所述包含目标蛋白的细胞培养样品进行离心和/或过滤后,获得所述含有目标蛋白的细胞培养发酵液。由此整个系统100由包含目标蛋白的细胞培养样品的制备到最后的所述目标蛋白溶液的产量和质量信息的获取,实现了全自动化。
参见图4,在本发明的一个实施例中,按照上述的细胞培养发酵液通过阳离子交换色谱柱31或者体积排阻色谱柱32的操作的实施方式,在进行所述步骤c之前,需要进行如下步骤(一)~步骤(三)的操作;
步骤(一):试剂配制(以proteina亲和色谱和阳离子交换二维色谱为例)。试剂的配制均可以按照以下描述的倍数进行,保证试剂成分含量不变即可。
需准备盐酸溶液(1.2mol/l)、氢氧化钠溶液(4.0mol/l)、proteina流动相a(10.0mmol/l磷酸盐,2.7mmol/lkcl和137.0mmol/lnacl,ph7.4)、proteina流动相b(12.0mmol/lhcl,150.0mmol/lnacl,ph2.5±0.1)、cex流动相a(20.0mmol/lmes,ph6.5±0.1)、cex流动相b(20.0mmol/lmes,150mmol/lnacl,ph6.5±0.1)。
步骤(二):细胞培养样品制备
细胞培养样品在进入第一维色谱分离装置20之前,可先通过紫外分光光度法预估样品中单抗的浓度。根据测得的细胞培养样品浓度,选择稀释或者多次进样等手段处理细胞培养样品后再进入第一维色谱分离装置20以及第二维色谱分离装置30进行分析。
步骤(三):在线监控目标蛋白的产量和质量的系统100的准备,具体如下:
1、在监测开始之前,先将第一维色谱分离装置20以及第二维色谱分离装置30中涉及的通道用超纯水清洗干净。之后将对应的流动相接入系统,并依次冲洗各流路。同步打开第一检测器23、第二检测器33,并且预热30min。
2、将流速调为0.2ml/min,观察第一维色谱分离装置20以及第二维色谱分离装置30中的色谱柱的流向,按多柱位柱温箱上的流向将多个色谱柱按正确的流向接入柱温箱中,左泵51连接proteina亲和色谱柱,右泵52连接cex色谱柱,用对应色谱柱流动相a冲洗色谱柱5min,转换成色谱柱对应流动相b冲洗色谱柱5min。将左泵51流速缓慢调到1.6ml/min,右泵52流速缓慢调到1.0ml/min,用对应色谱柱流动相a冲洗色谱柱各5min,换成对应色谱柱流动相b冲洗色谱柱各5min,最终换成对应色谱柱流动相a,冲洗色谱柱5min。色谱柱平衡:用各泵流动相a使用初始流速平衡色谱柱至基线平稳即可进样。
3、第一维色谱分离装置20以及第二维色谱分离装置30的参数设定:
参数设定需根据细胞培养样品(单抗样品)的性质而设定,该实例以单抗1样品为例。
proteina亲和色谱参数:
色谱柱:thermoscientific(usa)paidsensorcartridgecolumn(2.1×30mm)
柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:50μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度(可根据流速和色谱柱体积进行换算更改)如下表1所示:
表1
右泵52平衡梯度,如下表2所示:
表2
第一多角阀46切换设置(可根据流路连接进行位置调整),如下表3所示:
表3
第一进样模组21的收集器312的参数设置,如下表4所示:
表4
收集器312的收集位置设置:
每次运行新序列时,将收集管位置“tubeposition”设置为ra1,收集管编号“tubenumber”设置为1。
阳离子交换色谱(cex)参数设置:
色谱柱:thermoscientific(usa)propacwcx-10(4×250mm,10μm)(同类型的离子交换色谱柱可替换,相应的洗脱梯度需要更改)
柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:50μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度,如下表5:
表5
右泵52洗脱梯度(以单抗1的cex洗脱梯度为例,不同单抗产品可采用对应的洗脱梯度),如下表6所示:
表6
第一多角阀46切换设置(可根据流路连接进行位置调整),如下表7所示:
表7
步骤(四):控制装置10进行数据分析
调整cex谱图的积分事件,确保色谱峰都得到积分。cex谱图的峰面积百分比计算:
%酸性组分峰面积=酸性组分峰面积/色谱峰总峰面积×100%;
%主成分峰面积=主成分峰面积/色谱峰总峰面积×100%;
%碱性组分峰面积=碱性组分峰面积/色谱峰总峰面积×100%;
该数据分析的结果如图7所示,其中,几个特性方面的分析:
1、专属性:空白溶液在样品proteina亲和色谱图和cex色谱图中出峰位置处无干扰。
2、线性和范围:经过第一维proteina亲和色谱纯化样品,进样量在200–350μg的范围内时,回收率应不小于70%。
3、重复性:进样量为200μg时,连续重复进样三针,cex主成分峰面积百分比的rsd能达到1.0%以下。
4、精确度:当进样量依次为200μg、250μg、300μg和350μg时,cex主成分峰面积百分比的rsd达到2.5%以下。
参见图4,在本发明目的一个实施例中,按照上述的含有目标蛋白的细胞培养发酵液通过阳离子交换色谱柱31的操作,在cex进行操作,更换了cex的分析方法,分析时间进一步降低;在进行所述步骤c之前,需要进行如下步骤(一)~步骤(三)的操作;
步骤(一):试剂配制(以proteina亲和色谱和阳离子交换二维色谱为例)。试剂的配制均可以按照以下描述的倍数进行,保证试剂成分含量不变即可。
需准备盐酸溶液(1.2mol/l)、氢氧化钠溶液(4.0mol/l)、proteina流动相a(10.0mmol/l磷酸盐,2.7mmol/lkcl和137.0mmol/lnacl,ph7.4)、proteina流动相b(12.0mmol/lhcl,150.0mmol/lnacl,ph2.5±0.1)、cex流动相a(20.0mmol/lmes,ph6.5±0.1)、cex流动相b(20.0mmol/lmes,150mmol/lnacl,ph6.5±0.1)。
步骤(二):细胞培养样品制备
细胞培养样品在进入第一维色谱分离装置20之前,可先通过紫外分光光度法预估样品中单抗的浓度。根据测的样品浓度,选择稀释或者多次进样等手段处理样品后再进入第一维色谱分离装置20进行分析。
取对应单抗样品的参比品制备标准曲线溶液,稀释溶液为proteina亲和色谱流动相a,浓度范围为0.25-4.0mg/ml。
步骤(三):在线监控目标蛋白的产量和质量的系统100的准备,具体如下:
1、在检测开始之前,先将第一维色谱分离装置20以及第二维色谱分离装置30中涉及的通道用超纯水清洗干净。之后将对应的流动相接入系统,并依次冲洗各流路。同步打开第一检测器23、第二检测器33,并且预热30min。
2、将流速调为0.2ml/min,观察第一维色谱分离装置20以及第二维色谱分离装置30中的色谱柱的流向,按多柱位柱温箱上的流向将多个色谱柱按正确的流向接入柱温箱中,左泵51连接proteina亲和色谱柱,右泵52连接cex色谱柱,用对应色谱柱流动相a冲洗色谱柱5min,转换成色谱柱对应流动相b冲洗色谱柱5min。将左泵51流速缓慢调到1.6ml/min,右泵52流速缓慢调到0.7ml/min,用对应色谱柱流动相a冲洗色谱柱各5min,换成对应色谱柱流动相b冲洗色谱柱各5min,最终换成对应色谱柱流动相a,冲洗色谱柱5min。色谱柱平衡:用各泵流动相a使用初始流速平衡色谱柱至基线平稳即可进样。
3、第一维色谱分离装置20以及第二维色谱分离装置30的参数设定:
参数设定需根据单抗样品的性质而设定,该实例以单抗2样品为例。
proteina亲和色谱参数:
色谱柱:thermoscientific(usa)paidsensorcartridgecolumn(2.1×30mm)
柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:100μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度(可根据流速和色谱柱体积进行换算更改)如下表8所示:
表8
右泵52平衡梯度,如下表9所示:
表9
第一多角阀46切换设置(可根据流路连接进行位置调整),如下表10所示:
表10
第一进样模组21的收集器312的参数设置,如下表11所示:
表11
收集器312的收集位置设置:
每次运行新序列时,将收集管位置“tubeposition”设置为ra1,收集管编号“tubenumber”设置为1。
阳离子交换色谱(cex)参数设置:
色谱柱:thermoscientific(usa)propacelitewcx(4×150mm,5μm)(同类型的离子交换色谱柱可替换,相应的洗脱梯度需要更改)柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:20μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度,如下表12所示:
表12
右泵52洗脱梯度(以单抗2的cex洗脱梯度为例,不同单抗产品可采用对应的洗脱梯度),如下表13所示:
表13
第一多角阀46切换设置(可根据流路连接进行位置调整)如下表14所示:
表14
步骤(四):控制装置10进行数据分析;
调整cex谱图的积分事件,确保色谱峰都得到积分。cex谱图的峰面积百分比计算:%酸性组分峰面积=酸性组分峰面积/色谱峰总峰面积×100%;
%主成分峰面积=主成分峰面积/色谱峰总峰面积×100%;
%碱性组分峰面积=碱性组分峰面积/色谱峰总峰面积×100%;
参见图4,在本发明的一个实施例中,按照上述的含有目标蛋白的细胞培养发酵液通过体积排阻色谱柱32的操作,在sec进行操作,更换了sec的分析方法,分析单抗样品的纯度及分子大小异质性。分析时间进一步降低;在进行所述步骤s601之前,需要进行如下步骤(一)~步骤(三)的操作;
步骤(一):试剂配制(以proteina亲和色谱和体积排阻二维色谱为例)。试剂的配制均可以按照以下描述的倍数进行,保证试剂成分含量不变即可。
需准备盐酸溶液(1.2mol/l)、氢氧化钠溶液(4.0mol/l)、proteina流动相a(10.0mmol/l磷酸盐,2.7mmol/lkcl和137.0mmol/lnacl,ph7.4)、proteina流动相b(12.0mmol/lhcl,150.0mmol/lnacl,ph2.5±0.1)、sec流动相a(100mmol/l磷酸盐缓冲液,150mmol/lnacl,ph6.8±0.2)。
步骤(二):细胞培养样品制备
细胞培养样品在进入第一维色谱分离装置20之前,可先通过紫外分光光度法预估样品中单抗的浓度。根据测的样品浓度,选择稀释或者多次进样等手段处理样品后再进入第一维色谱分离装置20以及第二维色谱分离装置30进行分析。取对应单抗样品的参比品制备标准曲线溶液,稀释溶液为proteina亲和色谱流动相a,浓度范围为0.25-4.0mg/ml。
步骤(三):在线监控目标蛋白的产量和质量的系统100的准备,具体如下:
1、在检测开始之前,先将第一维色谱分离装置20以及第二维色谱分离装置30中涉及的通道用超纯水清洗干净。之后将对应的流动相接入系统,并依次冲洗各流路。同步打开第一检测器23、第二检测器33,并且预热30min。
2、将流速调为0.2ml/min,观察第一维色谱分离装置20以及第二维色谱分离装置30中的色谱柱的流向,按多柱位柱温箱上的流向将多个色谱柱按正确的流向接入柱温箱中,左泵51连接proteina亲和色谱柱,右泵52连接sec色谱柱,用对应色谱柱流动相a冲洗色谱柱5min,转换成色谱柱对应流动相b冲洗色谱柱5min。将左泵51流速缓慢调到1.6ml/min,右泵52流速缓慢调到0.5ml/min,用对应色谱柱流动相a冲洗色谱柱各5min,换成对应色谱柱流动相b冲洗色谱柱各5min,最终换成对应色谱柱流动相a,冲洗色谱柱至少30min。色谱柱平衡:用各泵流动相a使用初始流速平衡色谱柱至基线平稳即可进样。
3、第一维色谱分离装置20以及第二维色谱分离装置30的参数设定:
参数设定需根据细胞培养样品(单抗样品)的性质而设定,该实例以单抗2样品为例。
proteina亲和色谱参数:
色谱柱:thermoscientific(usa)paidsensorcartridgecolumn(2.1×30mm)
柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:100μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度(可根据流速和色谱柱体积进行换算更改),如下表15所示:
表15
右泵52平衡梯度,如下表16:
表16
第一多角阀46切换设置(可根据流路连接进行位置调整),如下表17:
表17
第一进样模组21的收集器312的参数设置,如下表18所示:
表18
收集器312的收集位置设置:
每次运行新序列时,将收集管位置“tubeposition”设置为ra1,收集管编号“tubenumber”设置为1。
体积排阻色谱(sec)参数设置:
色谱柱:waters(usa)xbridgebehsec(7.8×300mm,3.5μm)(同类型、同尺寸的体积排阻色谱柱32可替换,相应的洗脱梯度需要更改)
柱温:30℃;检测器参数:检测波长280nm(或220nm);进样模式:50μl(可根据浓度调整进样量,满环进样模式或部分进样模式)
左泵51洗脱梯度,如下表19所示:
表19
右泵52洗脱梯度(以单抗2的sec洗脱梯度为例),如下表20所示:
表20
第一多角阀46切换设置(可根据流路连接进行位置调整),如下表21所示:
表21
步骤(四):控制装置10进行数据分析,参见图8;
调整sec谱图的积分事件,确保色谱峰都得到积分。sec谱图的峰面积百分比计算:
%高聚体峰面积=高聚体峰面积/色谱峰总峰面积×100%;
%单体峰面积=单体峰面积/色谱峰总峰面积×100%;
%低分子量物质峰面积=低分子量物质峰面积/色谱峰总峰面积×100%。
参见图1、图2以及图5,在本发明的一个实施例中,第二维色谱分离装置30包括:阳离子交换色谱柱31和体积排阻色谱柱32;proteina亲和色谱柱22、阳离子交换色谱柱31通过第三多角阀48与所述第一检测器23连接;或者proteina亲和色谱柱22、体积排阻色谱柱32通过第三多角阀48与所述第一检测器23连接;
阳离子交换色谱柱31或者体积排阻色谱柱32与所述第二检测器33连接;
所述控制装置10还包括:并联通路选择模块19、第五控制模块17以及第二计算模块18;
所述步骤s602包括:
b5、所述并联通路选择模块19通过控制所述第三多角阀48的通路,设置含有所述目标蛋白的洗脱液经过所述阳离子交换色谱柱31和体积排阻色谱柱32;
b6、所述阳离子交换色谱柱31和所述体积排阻色谱柱32分别对含有所述目标蛋白的洗脱液分别进行阳离子交换色谱分离和体积排阻色谱分离,获得所述目标蛋白溶液;
b7、所述第五控制模块17向所述第二检测器33和第一检测器23发送第六控制信号,检测经过所述阳离子交换色谱柱31和体积排阻色谱柱32的含有所述目标蛋白的洗脱液的紫外吸收信号,并向控制装置10返回所述第二检测信号;
b8、所述第二计算模块18根据所述第二检测信号计算所述目标蛋白溶液的电荷异质性和单体纯度及分子大小异质性。
在该实施例中,通过第一维色谱分离装置20以及第二维色谱分离装置30构成的二维液相,并联proteina亲和色谱、sec和cex色谱柱,同时分析得到目标蛋白溶液的产量、sec和cex结果。由于同时获得sec和cex的结果,因此在线监控单抗上游发酵液的产量和质量的效率和准确度会更高。当包含目标蛋白的细胞培养样品从培养罐中取出后,经过离心过滤后流入二维液相的进样系统中的进样系统的取样环311,第一维的proteina亲和色谱将含有所述目标蛋白的细胞培养发酵液的蛋白质先捕获到色谱柱上,通过控制装置10的设置,采用洗脱相将蛋白质从色谱柱上洗脱下来,获得含有所述目标蛋白的洗脱液。控制装置10实现上可以是电脑控制系统。之后,流经第一检测器23,控制装置10计算得到含有所述目标蛋白的洗脱液的目标蛋白溶液的产量的信息,该信息反馈回控制装置10,同时控制装置10控制样品收集回进样系统的收集器312中;通过第一进样模组21可将第一维色谱分离收集到的样品,即含有所述目标蛋白的洗脱液取出并打进第二维色谱并依次打进位于多柱位柱温箱45中并联的cex和sec色谱柱中,通过阳离子交换色谱柱31和体积排阻色谱柱32的分离,再分别流过对应的第一检测器23、第二检测器33(其中并联的流路中会和第一维色谱共用一个检测器),控制模块10根据反馈的信息,同时计算得到蛋白质的电荷异质性和单体纯度及分子大小异质性信息。
在本发明的一个实施例中,采用上一实施例的阳离子交换色谱柱31和体积排阻色谱柱32的流路并联的方式进行操作。在阳离子交换色谱柱31和体积排阻色谱柱32的流路串联的方式中,二维液相的自动进样器模块中有一个取样环,用来收集存放样品。而在本实施例中,通过多角阀,如六通阀的切换,实现样品在proteina亲和色谱柱中的捕集和洗脱。洗脱后的单抗样品会暂时存放在自动进样器中的进样小瓶中,通过程序设定操作进样针,依次将样品送入并联的cex和sec色谱柱中,最终同时获得单抗产品的电荷异质性和纯度及分子大小异质性信息。
1:细胞培养样品捕集。六通阀的连接如图9所示,流路中的样品流经2_1,经过proteina亲和色谱柱,蛋白质被捕集到色谱柱中,其余液体会从4_3的流路流入废液;此时,proteina的洗脱相(proteina流动相b)会从6_5的流路经过。
2:细胞培养样品洗脱。六通阀的连接如图10所示,流路中的样品流经2_3,直接转入废液或处于停止取样状态;proteina的洗脱相(proteina流动相b)会从6_1的流路接入到proteina色谱柱中,将捕集到的蛋白质从色谱柱上洗脱下来,再流经4_5进入进样系统的收集器312中。
在上述多个实施例中,细胞培养样品先通过第一维色谱分离装置20的proteina亲和色谱系统,得到其样品的浓度(titer);然后通过中心切割,将proteina亲和色谱中抗体峰收集下来,进入第二维色谱分离装置30的第二维的阳离子交换或体积排阻色谱,分析样品的电荷异质性或者纯度及分子大小异质性;整个过程由控制装置10按照设定的程序自主完成,无需人工干预。可直接接入到细胞培养设备后,实现在线监控的目的。同时监控单克隆抗体产品的产量属性(titer)外,还能实现先将样品初步纯化、富集,再同时监测产品的电荷异质性(cex)、纯度及分子大小异质性(sec)信息。并且,在本发明的一个实施例方式中收集proteina亲和色谱色谱图中2.0–2.5分钟的样品后,需通过仪器设置和阀切换,将收集下来的样品和第二维的色谱流动相按照一定的比例(例如2:1、1.5:1等)混合。混合第一维收集下来的样品和第二维流动相的过程可以通过多种方式实现,例如进样环311、进样瓶等。通过特定的方法设置,使第二维进样的体积可根据第一维得到的产量信息(titer)进性调整,以保证第二维进样的蛋白含量满足需求。针对低浓度(小于2.0mg/ml)单克隆抗体产品,需通过重复第一维proteina亲和色谱进样的方式,提高信号强度及分离效率。并且通过上述多个实验实施例,可以看到通过二维液相同时分析单抗产品的产量和质量属性的结果,应和相同色谱方法分别分析产量和质量的结果一致,相对标准偏差(rsd)小于等于4.0%。通过二维液相同时分析单抗产品的产量和质量属性,可将整体分析时间从传统的4小时/样品降低至小于1小时/样品,大大的提高了监控效率。
由上述多个实施例可见,本发明提供的系统100可以在利用该系统100进行监控的过程中实现对产量和质量(电荷异质性或者纯度及分子大小异质性)在线监控的自动化和连续化,将样品前处理步骤从人工转移至仪器自动完成,缩短了分析完成时间,减少了操作步骤,降低了出错的概率,并能对产品过程进行特异性的开发和验证。
此外,本发明所提供的所述方法还包括:
所述第一泵模组50在所述第一维色谱分离装置20和第二维色谱分离装置30进行色谱分离时提供流动相、等度或梯度洗脱的动力;和/或
所述第二维色谱分离装置30将其分离产生的废液输送到所述废液回收器60。
综上所述,本发明提供了利用在线监控目标蛋白的产量和质量的系统实现的在线监控目标蛋白的产量和质量的方法,该在线监控目标蛋白的产量和质量的系统包括了控制装置、第一维色谱分离装置以及第二维色谱分离装置,其中第一维色谱分离装置以及第二维色谱分离装置构成了二维液相系统,由此接入到细胞培养取样装置在细胞培养过程中实时取样后,经过在线离心或过滤后,直接接入二维液相进行产量和质量(电荷异质性或者纯度及分子大小异质性)的分析:由此实现自动监控目标蛋白溶液上游发酵液的产量和质量,并且提高了监控的效率。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员当可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!