水稻半胱氨酸合酶编码基因OsASTOL1突变体及其应用的制作方法
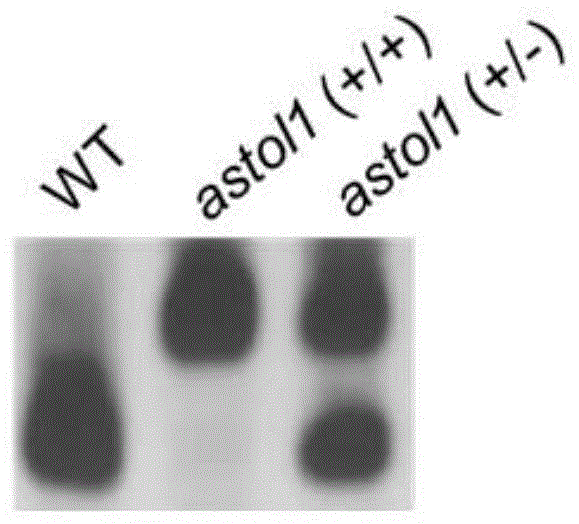
本发明属于植物基因工程技术领域,涉及水稻半胱氨酸合酶基因osastol1突变体及其应用。
背景技术:
目前,重金属污染带来的食品安全问题日益突出。水稻是重要的粮食作物,全球有一半左右的人口以水稻为主要粮食作物。相对于其他作物,水稻对砷(as)具有富集效应(suetal.,2009),人们会通过日常摄取而受到as的威胁(zhaoetal.,2010)。因此解析水稻对as的吸收解毒机制以及通过基因工程技术开发降低水稻籽粒对as的积累的方法十分重要。在植物体内,as(iii)是as的主要存在形态,可以被植物谷胱甘肽(gsh)和螯合肽(pcs)螯合并被转运到液泡中(zhaoetal.,2010;clemensandma,2016)。gsh和pcs是硫素(s)代谢的产物,增加水稻体内gsh和pcs含量是降低水稻籽粒as积累的重要手段(hayashietal.,2017;dengetal.,2018)。
由于长期维生素和矿物营养元素摄取不足造成的“隐形饥饿”也日益受到国际社会的关注。硒(se),是人类所必需的营养元素,缺硒会增加患癌症和心血管疾病等健康问题的风险(sorsetal.,2005)。在中国的许多地区平均硒摄入量是低于世界卫生组织(who)建议标准(40μgd-1),甚至有的地区的硒摄入量低于10μgd-1(combs,2001;chenetal.,2002)。水稻作为重要的主食,提高水稻籽粒中硒含量是满足人类硒摄入的一种良好途径。在土壤中的硒酸盐是植物硒元素吸收的主要来源。由于硫酸盐和硒酸盐的化学相似性,硒酸盐可以通过硫酸盐转运蛋白吸收进入根部(shibagakietal.,2002)。
目前,水稻中直接影响到水稻籽粒中砷和硒积累的基因报道较少。osastol1基因在genbank中的登录号为af073695.2,注释为半胱氨酸合酶(cysteinesynthase)。
技术实现要素:
本发明的目的是提供突变的水稻半胱氨酸合酶编码基因osastol1。
本发明的目的是提供水稻半胱氨酸合酶编码基因突变体的应用。
本发明的目的可通过以下技术方案实现:
突变的水稻osastol1基因,其cds序列如seqidno.1所示,第566位处发生单碱基替换(由野生型的g突变为a)造成氨基酸的替换(野生型的丝氨酸被替换为突变型的天冬酰胺)。
本发明所述的突变的半胱氨酸合酶基因在降低了水稻籽粒中砷含量中的应用。
本发明所述的突变的半胱氨酸合酶基因在提高水稻根部和地上部硫和硒元素的含量中的应用。
本发明所述的突变的半胱氨酸合酶基因在通过基因工程手段降低水稻籽粒中砷含量、提高水稻根部和地上部硫和硒元素的含量中的应用。
含有本发明所述的突变的半胱氨酸合酶基因的重组表达载体。
本发明所述的重组表达载体在降低了水稻籽粒中砷含量中的应用。
本发明所述的重组表达载体在提高水稻根部和地上部硫和硒元素的含量中的应用。
本发明所述的重组表达载体在通过基因工程手段降低水稻籽粒中砷含量、提高水稻根部和地上部硫和硒元素的含量中的应用。
一种水稻的品种改良方法,通过基因工程手段对seqidno.2所示的水稻野生型半胱氨酸合酶基因第566位处碱基进行编辑,使其发生单碱基替换,由野生型的g突变为a。
所述的半胱氨酸合酶在增强水稻根部对砷的积累中的应用。
所述的半胱氨酸合酶在增强根部对硫酸盐的吸收能力并且显著提高了水稻地上部总硫积累中的应用。
所述的半胱氨酸合酶在增强根部对硒酸盐的吸收能力并且显著提高了水稻地上部总硒积累中的应用。
所述的半胱氨酸合酶在显著降低水稻籽粒中总砷的积累和显著提高水稻籽粒中总硫和总硒的积累且不显著影响农艺性状中的应用。
本发明的有益效果
1、本发明通过系统研究,首次提供了一种突变的水稻半胱氨酸合酶编码基因osastol1及其生物学功能。
2、半胱氨酸合酶编码基因osastol1发生该突变后,在水培条件下显著提高了水稻根部砷的含量(图1)。
3、半胱氨酸合酶编码基因osastol1发生该突变后,在水培条件下显著提高了水稻体内硫和硒元素的积累量(图2和图3)。
4、半胱氨酸合酶编码基因osastol1发生该突变后,在田间实验条件下显著降低了籽粒砷含量,显著提高了水稻籽粒硫和硒含量,而不影响水稻的农艺性状(图4,图5和图6)。
5、通过crispr-cas9基因编辑敲除突变osastol1基因回补astol1突变体,回补株系的地上部硫和根部砷含量恢复至野生型水平(图7)。
附图说明
图1为野生型与杂合和纯合突变体区分鉴定的分子标记。
图2为osastol1基因突变后显著提高了根部砷元素的积累。在1/2kimurab营养液中水培四周后用5μmas(iii)处理3天,astol1杂合突变体材料与野生型相比,根部积累了一倍多的总as而地上部as含量无差异;
图3为osastol1基因突变后显著提高了水稻体内硫元素的积累。在1/2kimurab营养液中水培五周,astol1杂合和纯合突变体材料与野生型相比,在地上部显著增加了总s含量;
图4为osastol1基因突变后显著提高了水稻体内硒元素的积累。在1/2kimurab营养液中水培五周后用2μm硒酸钠处理3天,astol1杂合突变体材料与野生型相比,在根部和地上部显著增加了总se含量;
图5为不同田间试验中,astol1杂合突变体材料与野生型相比,显著减少了水稻籽粒中as的积累。
图6为不同田间试验中,astol1杂合突变体材料与野生型相比,显著增加了水稻籽粒中s和se的积累。
a:在不同稻田中,野生型和astol1杂合突变体材料中籽粒s含量;
b:在不同稻田中,野生型和astol1杂合突变体材料中籽粒se含量;
图7为田间试验中,野生型和astol1杂合突变体材料的农艺性状指标(株高,有效分蘖数,穗粒数,结实率,千粒重和单株产量)。
图8为在astol1突变体背景下敲除突变型osastol1基因可以将地上部总硫和根部总砷含量恢复至野生型水平。
a:在1/2kimurab营养液中水培五周,在astol1突变体背景下敲除突变型osastol1基因的四个独立转基因株系地上部的总硫含量恢复到野生型的水平。
b:在1/2kimurab营养液中水培五周,5μmas(iii)处理3天,在astol1突变体背景下敲除突变型osastol1基因的四个独立转基因株系根部的总砷含量恢复到野生型的水平。
图9为在野生型背景下过表达突变型osastol1基因的转基因苗。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
实施例1
半胱氨酸合酶基因osastol1水稻突变体的获得和基因定位,具体实施过程如下:
1)水稻甲基磺酸乙酯(ems)化学诱变库的构建:约1kg水稻种子(kasalath)37℃浸泡24小时后,用1%ems(v/v)进行化学诱变8小时,然后用自来水冲洗干净去除残留的ems。在37℃条件下催芽48小时,然后将这些诱变后的水稻种子播种到稻田,水稻成熟后每个单株收获种子m2代并干燥保存备有,完成水稻突变体库的构建。
2)水稻突变体的筛选及基因定位:在筛选水稻突变体库时,以20μmas(iii)筛选得到一株半显性耐砷水稻突变体,命名为arsenitetolerant1(astol1),并对其进行水稻全基因组测序,克隆到突变基因为水稻半胱氨酸合酶编码基因osastol1,突变位点为osastol1基因cds序列区域的第五个外显子第566位的g突变为a,导致单个氨基酸替换(丝氨酸—天冬酰胺),该突变的水稻半胱氨酸合酶编码基因osastol1的cds序列如seqidno.1所示。
本实施例中得到了一株kasalath水稻背景的半胱氨酸合酶编码基因osastol1突变体。
实施例2
astol1杂合和纯合突变体的鉴定,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中培养;
3)取叶片进行dna提取后,用如下引物进行pcr扩增:
dcaps-f:5’-ctcacgatgccggcctccctga-3’
dcaps-r:5’-tcccagtatgagtccacagaacaca-3’
10μl扩增体系:5μlmixbuffer;1μldna;引物各1μl;2μlddh2o
扩增条件:(1)95℃,5min;(2)95℃,30s;(3)55℃,30s;(4)72℃10s;(5)95℃5min;(6)12℃5min;步骤(2)-(4)重复35个循环。
实施例3
astol1杂合和纯合突变体的鉴定,具体实施过程如下:
1)将实施例2中扩增所得的pcr产物使用ddei限制性内切酶于37℃酶切过夜。酶切体系如下:3μlpcr产物;1μlcutsmartbuffer;0.2μlddei;5.8μlddh2o
2)将酶切产物加上2μlloadingbuffer,在8%聚丙烯酰氨凝胶(sds-page)用190v电压电泳1h进行分离;
3)将电泳后的胶放入0.5%的agno3溶液,放置与摇床上,银染10-14min;
3)用去离子水冲洗三遍,把水洗后的胶放入显影液(1.0-1.5%naoh、0.5%甲醛)中,缓慢平行摇动,直至出现清晰的带型为止。
本实施例中得到了一种鉴定astol1杂合和纯合突变体的分子标记,如图1所示,上方单一的条带表示野生型,下方单一的条带表示astol1纯合突变体,两条带的表示astol1杂合突变体。
实施例4
astol1杂合突变体材料与野生型水稻体内总as含量的比较,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中,再培养2周;期间用实施例2中的方法鉴定出astol1杂合突变体材料;
3)5l培养皿中种植8棵4周左右大小的水稻,每种材料4个重复,以5μmas(iii)处理3天;
4)as(iii)处理3天后将收集水稻地上部与地下部,并用去离子水清洗3次,于65℃烘干3天;
5)将样品称重后加5ml混酸(hno3:hclo4=85:15)在石墨消煮炉中进行消煮;
6)以2%hno3将样品消煮液定容至10ml,充分摇匀并转移至15ml离心管中保存;
7)利用电感耦合等离子体-质谱(icp-ms)测定各样品中as含量。
本实施例结果表明osastol1杂合突变体材料与野生型相比,根部积累更多的总as而非在地上部(图2)。
实施例5
astol1杂合和纯合突变体材料与野生型水稻体内总s含量的比较,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中,再培养3周;期间用实施例2中的方法鉴定出astol1杂合和纯合突变体材料;
3)收集五周左右大小水稻地上部与地下部,并用去离子水清洗3次,于65℃烘干3天;
5)将样品称重后加5ml混酸(hno3:hclo4=85:15)在石墨消煮炉中进行消煮。
6)以2%hno3将样品消煮液定容至10ml,充分摇匀并转移至15ml离心管中保存。
7)利用icp-ms测定各样品中s含量。
本实施例结果表明osastol1杂合和纯合突变体材料与野生型相比,地上部积累更多的总s(图3)。
实施例6
astol1杂合突变体材料与野生型水稻体内总se含量的比较,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中,再培养2周;期间用实施例2中的方法鉴定出astol1杂合突变体材料;
3)5l培养皿中种植8棵4周左右大小的水稻,每种材料4个重复,以2μmse(vi)处理3天;
4)se(vi)处理3天后将收集水稻地上部与地下部,并用去离子水清洗3次,于65℃烘干3天;
5)将样品称重后加5ml混酸(hno3:hclo4=85:15)在石墨消煮炉中进行消煮;
6)以2%hno3将样品消煮液定容至10ml,充分摇匀并转移至15ml离心管中保存;
7)利用icp-ms测定各样品中se含量。
本实施例结果表明osastol1杂合突变体材料与野生型相比,根部和地上部积累更多的总se(图4)。
实施例7
野生型水稻和astol1杂合突变体材料在大田实验中籽粒总as,总s和总se含量的比较,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中,再培养2周;期间用实施例2中的方法鉴定出astol1杂合突变体材料;
3)长至三四片叶时移苗至水稻田中,每穴一株,每株间距10cm,行间距15cm。期间,正常水分,养分管理控制及病虫害防治;
4)于不同年份种植在不同地方的水稻田中(江苏南京和海南陵水);
5)待水稻成熟后,随机取四个单株的水稻籽粒测定水稻野生型与astol1杂合突变体籽粒中的总as,总s和总se的含量。
6)待水稻成熟后,选取每行中间水稻单株共9株以测定水稻野生型与astol1杂合突变体的农艺性状。
7)水稻籽粒中总as,总s和se含量测定:称取0.5g籽粒于微波消煮管中,加入5ml浓硝酸(优级纯)进行微波消煮,用5%硝酸定容至10ml转移至15ml离心管中保存。利用icp-ms测定籽粒样品中的as和s含量,用液相色谱-原子荧光光谱仪(lc-afs8500)测定籽粒样品中的se含量。
本实施例结果表明种植在不同地区的稻田时,astol1杂合突变体材料与野生型相比,其籽粒中显著降低as的积累(图5)和富集更多的s(图6a)和se(图6b),并且农艺性状没有太大变化(图7)。
实施例8
通过crispr-cas9基因编辑技术将半胱氨酸合酶编码基因osastol1的突变基因在突变体astol1中进行敲除,验证是否能够成功回补根部高as和地上部高s积累的突变表型,具体实施过程如下:
1)通过分析在osastol1编码区的第二个外显子找到靶点i序列(atgggtgagaccatcgcca),在osastol1功能域编码区的反义链上找到靶点ii序列(ttggctcaatcagcacactc)。以找到的这两个目的基因片段设计引物,引物(5’-3’)序列如下:
astol1-u3-f:5’-ggcaatgggtgagaccatcgcca-3’
astol1-u3-r:5’-aaactggcgatggtctcacccat-3’
astol1-u6-f:5’-gccgttggctcaatcagcacactc-3’
astol1-u6-r:5’-aaacgagtgtgctgattgagccaa-3’
2)将引物自连反应形成的短的靶点片段分别连入被bsai单酶切的线性化载体pylsgrna-osu3和pylsgrna-osu6a,从而形成u3-astol1-sgrna和u6a-astol1-sgrna片段,然后将含有两个靶点序列的片段最终连入最终载体pylcrispr/cas9-mtmono质粒。
3)验证正确的质粒进行转基因。转基因所用种子来源于上一代杂合突变体,所以得到的转基因水稻背景分别为野生型,杂合突变体,纯合突变体。在获得转基因t0代后,首先通过实施例2中的dcaps标记进行基因型鉴定,然后用如下测序引物对两个靶点进行pcr扩增和dna测序。
astol1-crispr-f1:5’-tcctgatgcttcctcctccaactc-3’
astol1-crispr-r1:5’-gcttcacctatccttgacgctgg-3’
astol1-crispr-f2:5’-cccgtgtctaagcctagaactcctt-3’
astol1-crispr-r2:5’-tcaggtccagtggtctcgtaatgg-3’
4)比对kasalath野生型序列和测序序列,记录好每株苗的突变位点,挑选测序纯合的单株即为突变的astol1基因的敲除材料,然后将其繁种后备用。
5)将野生型与四个独立的经过基因编辑astol1杂合突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
6)培养两周后将幼苗转移至1/2kimurab营养液中,再培养2周;期间用实施例2中的方法鉴定出水稻的基因型背景;
7)以5μmas(iii)处理3天后将收集水稻地上部与地下部,并用去离子水清洗3次,于65℃烘干3天;将样品称重后加5ml混酸(hno3:hclo4=85:15)在石墨消煮炉中进行消煮;以2%hno3将样品消煮液定容至10ml,充分摇匀并转移至15ml离心管中保存;
8)利用icp-ms测定各样品中s和as含量。
本实施例结果显示astol1突变体背景中通过crispr-cas9基因编辑技术得到的敲除回补株系的地上部的总s含量和根部as含量已恢复至野生型水稻的正常水平(图8a和图8b),证明半胱氨酸合酶编码基因osastol1的突变影响了水稻突变体根部高as和地上部高s积累的表型。
实施例9
野生型背景下过表达突变型osastol1基因的转基因材料的获得,具体实施过程如下:
1)将野生型与astol1突变体的种子在37℃下催芽3天后,播种在悬浮的塑料小黑网上;
2)培养两周后将幼苗转移至1/2kimurab营养液中,用实施例2和3中的方法鉴定出astol1纯合突变体材料;
3)取astol1纯合突变体叶片于液氮中保存,利用植物总rna提取试剂盒(北京百泰克公司)提取rna。
4)使用反转录试剂盒(南京诺唯赞公司)进行总cdna的合成。
5)突变型osastol1基因全长的获得及过表达载体的构建:
根据osastol1全长cdna序列设计过表达引物,引物序列如下:
osastol1-f:ggatccccgggtaccatggccgtccagg;
osastol1-r:gagctctctagaactagttcattcaaccaccat;
以步骤4)提取的水稻cdna为模板扩增得到突变型osastol1基因开放阅读框序列。含目的基因的pcr产物经回收纯化后连入用spei及kpni双酶切得到含特定酶切位点的ptck303载体,得到表达载体ptck303-osastol1,经测序验证正确后备用。
6)将酶连正确的载体ptck303-osastol1转入农杆菌备用。
7)将获得的转有ptck303-osastol1质粒的农杆菌,侵染kasalath水稻愈伤组织,共培养2天后经过选择培养、分化、生根、炼苗得到t0代转基因植株。
本实施例结果得到在野生型背景下过表达突变型osastol1基因的转基因材料(图9)。
参考文献
chen,l.,yang,f.,xu,j.,hu,y.,hu,q.,zhang,y.,andpan,g.(2002).determinationofseleniumconcentrationofriceinchinaandeffectoffertilizationofseleniteandselenateonseleniumcontentofrice.j.agric.foodchem.50,5128-5130.
clemens,s.,andma,j.f.(2016).toxicheavymetalandmetalloidaccumulationincropplantsandfoods.annualreviewofplantbiology.
combs,g.f.(2001).seleniuminglobalfoodsystems.br.j.nutr.85,517-547.
deng,f.,yamaji,n.,ma,j.f.,lee,s.k.,jeon,j.s.,martinoia,e.,lee,y.,andsong,w.y.(2018).engineeringricewithlowergrainarsenic.plantbiotechnologyjournal16,1691-1699.
hayashi,s.,kuramata,m.,abe,t.,takagi,h.,ozawa,k.,andishikawa,s.(2017).phytochelatinsynthaseospcs1playsacrucialroleinreducingarseniclevelsinricegrains.theplantjournal91,840-848.
shibagaki,n.,rose,a.,mcdermott,j.p.,fujiwara,t.,hayashi,h.,yoneyama,t.,anddavies,j.p.(2002).selenate-resistantmutantsofarabidopsisthalianaidentifysultr1;2,asulfatetransporterrequiredforefficienttransportofsulfateintoroots.plantjournal29,475-486.
sors,t.g.,ellis,d.r.,andsalt,d.e.(2005).seleniumuptake,translocation,assimilationandmetabolicfateinplants.photosynth.res.86,373-389.
su,y.-h.,mcgrath,s.p.,andzhao,f.-j.(2009).riceismoreefficientinarseniteuptakeandtranslocationthanwheatandbarley.plantandsoil328,27-34.
zhao,f.-j.,mcgrath,s.p.,andmeharg,a.a.(2010).arsenicasafoodchaincontaminant:mechanismsofplantuptakeandmetabolismandmitigationstrategies.annualreviewofplantbiology61,535-559.
序列表
<110>南京农业大学
<120>水稻半胱氨酸合酶编码基因osastol1突变体及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>1227
<212>dna
<213>水稻(kasalath)
<400>1
atggccgtccaggttcaacgaacgcccctcccccggtccacgtacaccggccatcggggc60
tatctcctgcgggccccacctgcagtgacacggtgcaccgtggaccgcgccttcccgcgc120
agtcatggacctccccttcctcgtctcctgtataaaacctcgcgtcctgatgcttcctcc180
tccaactccacgagtcgccatttcccaaggaggagcaaggattgttgttgtttcgctgtc240
agatcgattcctgacgggataatgggtgagaccatcgccaaggatgtcaccgagttgatt300
gggaacacgccgttggtgtacctcaaccgggtgacggatgggtgcgtcgggcgcgtcgcg360
gccaagctcgagtccatggagccatgctccagcgtcaaggataggattggatacagtatg420
atcactgatgcagaggagaaggggctgatcactccaggcaagagtgtgctgattgagcca480
actagtggcaacacaggcattggactggccttcatggctgctgcaaagggttacaggctt540
gtactcacgatgccggcctccatgaacatggagaggagaatcatattgaaggcttttggt600
gctgaattgatacttactgacccactcttgggaatgaaaggagctgtccaaaaggcagaa660
gaactggcagcgaagacaaacaactcatttatcctccaacaattcgagaaccctgctaac720
ccaaagatccattacgagaccactggacctgaaatctggaaaggaacaggaggtaaagtt780
gatggtttagtttctggtattgggacaggtggcactattactggagctggacgatacctc840
agagagcaaaatcctgatatcaagatctatggtgtggagccagtcgagagcgctgtctta900
tctggtggaaagcctgggccacacaagattcaaggaattggagctggttttgttcctggg960
gtcctggatgttgacctcatcaatgaaactgtacaagtttcaagtgatgaagctatcgag1020
atggcaaaggctcttgcattgaaagaagggttgctggttggaatatcttcaggtgcagct1080
gcagcagcagctgttaggctcgctcagaggccggaaaatgaaggaaaactttttgttgtt1140
gtcttcccaagctttggtgagcggtacctttcgtcggtgctcttccagtccatcaagaag1200
gaagctgaaaacatggtggttgaatga1227
- 还没有人留言评论。精彩留言会获得点赞!