一种体外诱导人脐带间充质干细胞分化为具有胰岛素分泌功能的类胰岛团的方法与流程
本发明涉及细胞培养领域,尤其涉及一种体外诱导人脐带间充质干细胞分化为具有胰岛素分泌功能的类胰岛团的方法。
背景技术:
糖尿病分型中,以1型和2型糖尿病为主,其中1型糖尿病主要是由于自身免疫系统攻击胰腺β细胞导致机体无法合成胰岛素引起胰岛素绝对不足,而2型糖尿病主要是由于胰岛素抵抗和机体无法对胰岛素进行充分反应导致β细胞功能和结构破坏,引起胰岛素相对不足。
在糖尿病的治疗策略中主要有以下几种方法:胰岛素和胰岛素类似物、胰岛素增敏剂、胰岛素促泌剂,这三类药物都只能对症治疗,无法从根本上治疗糖尿病;胰岛和整个胰腺组织的移植手术除了供体来源不足之外,还存在严重的免疫排斥反应;胚胎干细胞或诱导性的多能干细胞治疗方式存在多向分化的成瘤性风险;近年来,同样具有分化能力且免疫原性低的各种来源的间充质干细胞在疾病治疗中应用广泛,其中脐带间充质干细胞(uc-mscs)是来源于新生儿脐带的间充质干细胞,其来源广泛且易于获取。
近年来,很多文献报导了体外诱导胚胎干细胞或间充质干细胞为类胰岛团的方法,然而大部分诱导方法步骤繁琐复杂、历时较长且分化效率不高(bai,c.,etal.(2015);kroon,e.,etal.(2008);limbert,c.,etal.(2011);moshtagh,p.r.,etal.(2013);gao,f.,etal.(2008);sun,b.,etal.(2015)),有相关专利申请诱导脐带间充质干细胞分化为胰岛素分泌型细胞的培养基和方法,申请号为cn201710678107.5和cn201510814060.1,的两个专利申请中使用的方法也是多步诱导且分化培养基中需要包含细胞因子等多种诱导分化的物质,步骤繁杂,分化效率低,不利于临床应用。
技术实现要素:
本发明的目的在于提供一种体外诱导人脐带间充质干细胞分化为具有胰岛素分泌功能的类胰岛团的方法。
为实现上述目的,本发明提供一种体外诱导人脐带间充质干细胞分化为具有胰岛素分泌功能的类胰岛团的方法,其特征在于,所述方法为,将uc-mscs细胞接种铺板使其12-36小时后达到100%汇合度,再用pbs清洗,再加入胰酶消化,再加入分化培养基,培养即可。
进一步,所述pbs为1xpbs;
进一步,所述用pbs清洗的次数为2-4次;优选的,清洗的次数为2-3次。
进一步,所述胰酶为0.05%-1%胰酶。
进一步,所述分化培养基的体积比为dmem/f-121:1+1%bsa+1xits。
进一步,所述诱导培养的时间为1-144小时。
进一步,所述培养的条件为在37℃,95%湿度的co2培养箱中培养。
本发明所述方法只用一步法就可以高效快速地将人脐带间充质干细胞分化为具有体内外功能的类胰岛团(islet-likeclusters)。所提供的诱导方案,可为于1型及中晚期2型糖尿病患者进行胰岛移植提供供体来源。
采用本发明的方法诱导后96小时,大部分细胞已经分化为类胰岛团,诱导后144小时,类胰岛团呈现淡黄色,分化效率95%-100%,dtz染色结果显示该类胰岛团可以被dtz(双硫腙)特异性地染成猩红色。显示诱导分化的类胰岛团中,胰岛特异性基因表达量明显上调。正常uc-mscs细胞在低糖(2.8mm葡萄糖)和高糖(16.7mm葡萄糖)刺激条件下分泌胰岛素量很低且无差异,而诱导分化后islet-likeclusters在高糖条件下胰岛素分泌明显增加。诱导分化的islet-likeclusters具有降低糖尿病小鼠血糖的效果,与假手术组(shamoperation)相比有显著性差异。表明利用本发明提供的诱导方法,可将人脐带间充质干细胞诱导分化为有功能的胰岛素分泌细胞,为临床进行胰岛移植提供工体来源。
附图说明
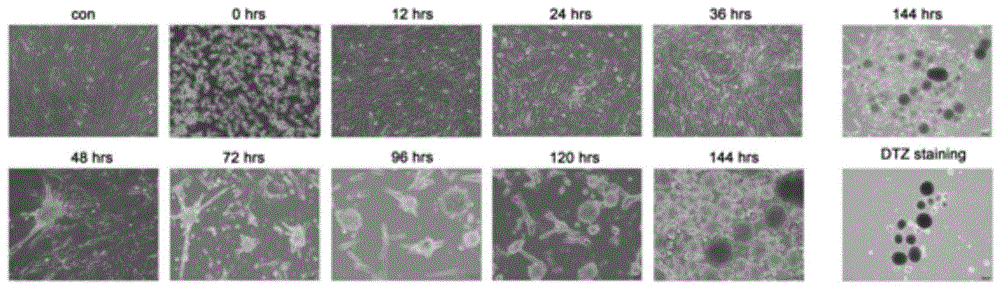
图1是体外诱导uc-mscs细胞分化后0、12、24、36、48、72、96、120、144小时的细胞形态图。
图2是体外诱导uc-mscs细胞分化后胰岛特异性基因表达情况图。
图3是体外诱导uc-mscs细胞分化后分化的islet-likeclusters(胰岛样细胞团)的体外功能实验图。
图4是构建1型糖尿病小鼠模型胰腺组织h&e和if染色结果图。
图5是为肾包膜移植后小鼠肾组织(肾包膜下)h&e和if染色结果图。
图6是为肾包膜移植后小鼠血糖情况结果图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1.细胞培养及诱导分化实验
用含有10%胎牛血清的dmem/f-121:1培养基培养人脐带间充质干细胞(uc-mscs),诱导分化前一天,将uc-mscs细胞接种至12孔板中,使其第二天达到100%汇合度,去掉培养基,1xpbs清洗三次,加入300μl0.05%-1%胰酶,之后加入含1xits和1%bsa的dmem/f-121:1分化培养基,培养于37℃,95%湿度的培养箱中,定时观察细胞分化情况。
实施例2.uc-mscs分化的类胰岛团的体外功能实验
2.1双硫腙(1mg/mldtzindmso)染色实验:细胞分化至第六天,加入dtz使其终浓度为10ug/ml,放入培养箱约10分钟,显微镜下观察染色情况。
在显微镜下观察诱导分化后0、12、24、36、48、72、96、120、144小时的细胞形态,如附图1所示,其中con代表未诱导分化时的细胞组,0、12、24、36、48、72、96、120、144hrs代表诱导分化后不同时间点(右上角的144hrs表示是在4x物镜下观察到的形态),dtzstaining染色表示对诱导分化至144hrs的类胰岛团进行双硫腙染色(4x物镜)。其余均为10x物镜观察。从图1可以看出,在诱导后96小时,大部分细胞已经分化为类胰岛团,诱导后144小时,类胰岛团呈现淡黄色,分化效率95%-100%,dtz染色结果显示该类胰岛团可以被特异性地染成猩红色。
2.2pcr检测胰岛特异性基因表达情况:
1)rna提取:细胞分化至第六天,将细胞吸取至1.5mlep管中,4℃,3000rpm离心5分钟,弃上清,加入1xpbs清洗,4℃,3000rpm离心5分钟,重复清洗一次,最终小心弃上清,在沉淀中加入trizol400μl。室温下涡旋30秒,观察细胞完全裂解后,加入80μl氯仿,再涡旋30秒,室温放置5分钟,4℃,13000rpm离心15分钟,观察到样品分层。小心将上层水相转移至新的1.5mlep管中,加入200μl预冷的异丙醇,摇匀后-20℃放置2小时,4℃,13000rpm离心15分钟,弃上清。加入200μl无rna酶的75%乙醇清洗rna,4℃,13000rpm离心15分钟,弃上清,于超净台内干燥沉淀,用无rna酶的depc水溶解rna沉淀后测定其浓度。
2)rna反转为cdna:如表1所示将rna反转为cdna,所用试剂盒为abm公司。
表1.rna反转步骤
3)pcr检测:如表2所示进行pcr实验
表2.pcr步骤表
注:正向引物和反向引物序列为:
pdx-1:
正向引物为,5'-cccatggatgaagtctaccaaa-3';seqidno:1;
反向引物为,5'-ggaactccttctccagctcta-3';seqidno:2;
pax-6:
正向引物为,5'-aggctcaaatgcgacttcagct-3';seqidno:3;
反向引物为,5'-tgttgctggcctgtcttctctgat-3';seqidno:4;
glucagon:
正向引物为,5'-acattcaccagtgactacagca-3';seqidno:5;
反向引物为,5'-ggcagcttggccttccaaataa-3';seqidno:6;
insulin:
正向引物为,5'-ggaacgaggcttcttctacaca-3';seqidno:7;
反向引物为,5'-tgttccacaatgccacgcttct-3';seqidno:8;
gapdh:
正向引物为,5'-acatcatccctgcctctact-3';seqidno:9;
反向引物为,5'-ctctcttcctcttgtgctcttg-3';seqidno:10。
制备1%琼脂糖凝胶,上样后,以110v电压跑胶,最后进行凝胶成像,观察条带强弱。
取正常uc-mscs细胞和诱导分化后144小时的islet-likeclusters样品提取rna,反转为cdna后,进行pcr检测pdx-1、pax-6、insulin、glucagon、gapdh的表达情况,如附图2所示,其中pdx-1是胰-十二指肠同源盒1,pax-6是人类配对盒基因6,glucagon是胰高血糖素,insulin是胰岛素,gapdh是甘油醛-3-磷酸脱氢酶。从图2可以看出,诱导分化的类胰岛团中,胰岛特异性基因表达量明显上调。
2.3葡萄糖刺激胰岛素分泌实验
分化至第六天的类胰岛团,小心弃上清,加入1xpbs清洗三次后,加入含2.8mm葡糖糖和0.2%bsa的krb溶液,培养箱中平衡1小时后,弃上清,用1xpbs清洗三次后,再次加入含2.8mm葡糖糖和0.2%bsa的krb溶液,刺激2分钟后,收上清于1.5mlep管中,向培养板中加入含16.7mm葡糖糖和0.2%bsa的krb溶液,刺激1小时,收上清于1.5mlep管中,暂存于4℃。
根据试剂盒说明书,使用humaninsulinimmunoassaykit(hkulikashingfacultyofmedicine)进行胰岛素检测。
结果见图3所示,其中,横坐标表示不同的葡萄糖浓度刺激,纵坐标表示胰岛素分泌量,图中#代表与uc-mscs16.7mm葡萄糖刺激条件下与2.8mm葡萄糖刺激相比,胰岛素分泌量有显著性差异,p<0.05;*代表与islet-likeclusters(胰岛样细胞团)用2.8mm葡萄糖刺激条件下胰岛素分泌量有显著性差异,p<0.05。可以看出,正常uc-mscs细胞在低糖(2.8mm葡萄糖)和高糖(16.7mm葡萄糖)刺激条件下分泌胰岛素量很低且无差异,而诱导分化后144小时的islet-likeclusters在高糖条件下胰岛素分泌明显增加。
实施例3.uc-mscs分化的类胰岛团的体内功能实验
3.11型糖尿病小鼠模型构建:购买约8周龄的c57bl/6j雄性小鼠,禁食过夜后,腹腔注射60mg/kgstz(首次禁食12小时,后4次禁食10小时),约两周后,小鼠血糖稳定至20-25mmol/l。
3.2肾包膜移植实验:每组6只小鼠,进行肾包膜移植实验,设置正常小鼠组(wt)、假手术组(shamoperation)、阳性对照组(positivecontrol)和类胰岛团组(islet-likeclusters),其中正常小鼠组(wt)表示未经任何处理的同窝对照鼠;假手术组(shamoperation)是只对小鼠进行手术而没有真正移植;阳性对照组(positivecontrol)表示移植的是来自正常小鼠分离得到的胰岛;类胰岛团组(islet-likeclusters)也即实验组,移植的是由uc-mscs体外诱导分化而来的类胰岛团。结果见图4-6。
用生理盐水配制1%戊巴比妥钠溶液,按照80mg/kg腹腔注射,待小鼠麻醉完全后,将小鼠背部毛剃干净,酒精棉球擦拭皮肤表面,用剪刀在小鼠脊椎和肋骨下缘三角区域剪开长约1cm的小口,将皮肤下肌肉同样打开一个小口,找到肾所在位置,用挤压的方式将肾暴露在皮肤外。用手术刀片在肾下缘包膜上轻轻划开一个小口,将枪尖切出一个斜面,轻轻挑开包膜缓慢插入并小心缓慢注射胰岛或类胰岛团。快速缝合手术切口,每天监测小鼠血糖。
3.3胰腺和肾组织的h&e、if染色:小鼠处死后,取肾组织和胰腺组织,1xpbs清洗三次,放入10%福尔马林缓冲盐溶液中,4℃摇床慢摇过夜,后续染色交由武汉赛维尔生物科技有限公司代做。结果见图4-5。
结果如图4所示,是构建1型糖尿病小鼠模型胰腺组织h&e和if染色,wt代表野生型空白对照小鼠,t1d代表1型糖尿病小鼠,a和b为h&e染色结果图,c和d为对应的if单染胰岛素的染色结果图。从结果可以看出,野生型空白对照小鼠(wt)胰岛(a和c)形态完整、结构致密、有较高水平的胰岛素表达,而注射了stz破坏的小鼠胰岛(b和d)皱缩、胰岛素表达量低且不致密,说明stz注射后成功破坏了小鼠胰岛,1型糖尿病小鼠模型构建成功。
图5为肾包膜移植后小鼠肾组织(肾包膜下)h&e和if染色。a,b,c为h&e染色结果图,d,e,f为对应的if单染胰岛素的染色结果图。从结果可以看出,分离的小鼠胰岛(positivecontrol)和分化的类胰岛团(islet-likeclusters)被成功移植到小鼠肾包膜下,其高表达胰岛素,而假手术组(shamoperation)不表达胰岛素。
图6为肾包膜移植后小鼠血糖情况。横坐标是肾包膜移植后不同时间,纵坐标是检测得到的血糖值,wt是野生型空白对照小鼠,未进行任何处理,shamoperation是假手术组,只对小鼠进行手术而没有真正移植,positivecontrol是阳性对照组,移植的是来自正常小鼠分离得到的胰岛,islet-likeclusters是实验组,移植的是由uc-mscs体外诱导分化而来的类胰岛团。其中*代表与假手术组(shamoperation)相比血糖有显著性差异,**p<0.01,****p<0.0001所示。每天监测小鼠血糖,可以看出,诱导分化的islet-likeclusters具有降低糖尿病小鼠血糖的效果,与假手术组(shamoperation)相比有显著性差异。可以看出,正常小鼠胰岛和分化的类胰岛团均能使1型糖尿病小鼠血糖下降。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>厦门大学
博生众康(厦门)医药生物技术股份有限公司
<120>一种体外诱导人脐带间充质干细胞分化为具有胰岛素分泌功能的类胰岛团的
新方法
<130>xmdxc-19018-cni
<160>10
<170>patentinversion3.5
<210>1
<211>22
<212>dna
<213>人工合成
<400>1
cccatggatgaagtctaccaaa22
<210>2
<211>21
<212>dna
<213>人工合成
<400>2
ggaactccttctccagctcta21
<210>3
<211>22
<212>dna
<213>人工合成
<400>3
aggctcaaatgcgacttcagct22
<210>4
<211>24
<212>dna
<213>人工合成
<400>4
tgttgctggcctgtcttctctgat24
<210>5
<211>22
<212>dna
<213>人工合成
<400>5
acattcaccagtgactacagca22
<210>6
<211>22
<212>dna
<213>人工合成
<400>6
ggcagcttggccttccaaataa22
<210>7
<211>22
<212>dna
<213>人工合成
<400>7
ggaacgaggcttcttctacaca22
<210>8
<211>22
<212>dna
<213>人工合成
<400>8
tgttccacaatgccacgcttct22
<210>9
<211>20
<212>dna
<213>人工合成
<400>9
acatcatccctgcctctact20
<210>10
<211>22
<212>dna
<213>人工合成
<400>10
ctctcttcctcttgtgctcttg22
- 还没有人留言评论。精彩留言会获得点赞!