一种芽孢杆菌及其合成纳米硒的方法与流程
本发明涉及微生物培育应用技术领域,更具体地说,涉及一种芽孢杆菌及其合成纳米硒的方法。
背景技术:
硒是生物体必需的一种微量元素,研究表明其对微生物的新陈代谢、动植物的生长发育、甚至对人类自身的健康都有着不可忽略的作用。在自然界中元素硒通常以有机硒和无机硒两种形式存在,有机硒通常以硒代氨基酸的形式存在于生物体内,参与生物体中的各种生命活动;无机硒通常是以硒酸盐(vi)、亚硒酸盐(iv)、单质硒(0)和金属硒化合物(-ii)四种形式存在于岩石、土壤、自然水体以及含硒废水等环境介质中。但通常无机硒中的硒酸盐和亚硒酸盐对生物具有较大的生物毒性,相关实验验证亚硒酸钠对大鼠的ld50为7mg/kg,硒酸钠对大鼠的ld50为1.6mg/kg。然而,在过去几十年间,由于煤矿开采、化工制造等工业活动使得seo32-以及seo42-在水体中严重富集,对生态环境造成了严重的破坏。
对于含硒废水的处理,传统的处理方法主要为物理处理法和化学处理法。物理法中常用的技术为纳滤、离子交换、反渗透等,虽然该方法已在处理城市饮用水和废水中得到了一定的应用,但是由于膜系统在使用过程中存在能耗高、运行维护费用高等问题,使其在实际应用中存在一定的局限性。化学法主要是利用诸如氧化铁等化学试剂将se(iv/vi)还原为单质硒沉淀,再进一步利用化学吸附剂吸附以达到将其彻底去除的目的,但该方法可能会使用有毒的化学试剂从而对环境造成二次污染。近年来,据文献报道某些微生物具有将seo32-和seo42-还原生成单质硒的能力。zhang等人利用嗜碱假单胞菌将seo32-还原为粒径为200nm的单斜硒纳米颗粒;dwivedi等利用pseudomonasaeruginosajs-11将seo32-还原为粒径为21nm的球形硒纳米颗粒。在此过程中,微生物能将毒性较大且对环境污染较为严重的seo32-和seo42-还原为毒性较小且对环境更为友好的se0。同时,生物合成的纳米硒具有良好的光电特性,可以广泛应用于医疗、电气和制造工业等。但目前发现的菌株大多只可在较低浓度下还原seo32-,对于能在高浓度条件下还原seo32-的菌株有待进一步开发。
技术实现要素:
本发明的目的是开发一种在高浓度条件下还原seo32-的菌株。
为了达到上述目的,本发明提供了一种芽孢杆菌,芽孢杆菌(拉丁文分类命名为bacillussp.sl),所述菌株的登记入册编号为cgmccno.19051,保藏于中国微生物菌种保藏委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,100101保藏日期为2019年11月28日。
本发明所述的芽孢杆菌,2018年于贵州省开阳县富硒茶厂的泥土样品经过7次平板稀释涂布法,将所述泥土样品涂布在lb培养基上,30±0.5℃,150±5r/min条件下培养获得菌液。所述芽孢杆菌的菌株的细胞形态为杆状,大小为3-5μm。所述lb培养基组分为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水。
所述芽孢杆菌属于革兰氏阳性菌,菌体为杆状,其16srrna基因序列的genbank登录号为mn371282。
一种芽孢杆菌合成纳米硒的方法,具体的方法如下:
s1、处理lb培养基;
所述的lb培养基在121℃高温,0.15mpa高压的条件下,灭菌20min后备用;加入碱液或酸液调配lb培养基的ph值在3.0-10.0;
s12、接种芽孢杆菌合成纳米硒;
在s11所述的lb培养基中加入终浓度分别为1mmol/l-50mmol/l的na2seo3溶液后,接入接菌量为2%(v/v)的所述芽孢杆菌,在30±0.5℃,150±5r/min条件下培养2h-11h;
优选的是,所述lb培养基的ph值在5.0-8.0。
优选的是,所述na2seo3溶液终浓度为5mmol/l-20mmol/l。
优选的是,所述接种芽孢杆菌合成纳米硒培养时间为2-8h。
本发明所述芽孢杆菌能够耐受较高浓度的seo32-,且具有将其还原为不同粒径的单质纳米硒颗粒的能力。
附图说明
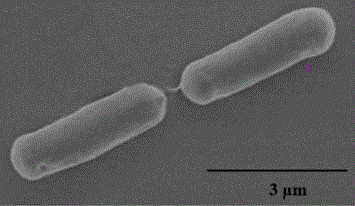
图1菌株sl的sem图。
图2菌株sl的系统发育树。
图3菌株sl在lb培养基中的生长曲线。
图4不同seo32-浓度下菌株sl对seo32-的还原率。
图5不同ph下菌株sl对seo32-的还原率。
图6菌株sl合成硒纳米硒比例尺100nm的tem图。
图7菌株sl合成硒纳米硒比例尺500nm的tem图。
图8菌株sl合成纳米硒过程中胞外eps随时间变化图。
具体实施方式
本发明提供了一种芽孢杆菌,所述芽孢杆菌的菌株登记入册编号为cgmccno.19051,保藏于中国微生物菌种保藏委员会普通微生物中心,保藏日期为2019年11月28日。
本发明所述的芽孢杆菌,2018年于贵州省开阳县富硒茶厂的泥土样品经过7次平板稀释涂布法,将所述泥土样品涂布在lb培养基上,30±0.5℃,150±5r/min条件下培养获得菌液。所述芽孢杆菌的菌株的细胞形态为杆状,大小为3-5μm。所述lb培养基组分为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水。
所述芽孢杆菌属于革兰氏阳性菌,菌体为杆状,其16srrna基因序列的genbank登录号为mn371282。
本发明还提供了一种芽孢杆菌合成纳米硒的方法,具体的方法如下:
s1、处理lb培养基;
所述的lb培养基在121℃高温,0.15mpa高压的条件下,灭菌20min后备用;加入碱液或酸液调配lb培养基的ph值在3.0-10.0;所述lb培养基的ph值在5.0-8.0时,反应体系中seo32-的还原率均达到98%以上;
s12、接种芽孢杆菌合成纳米硒;
在s11所述的lb培养基中加入终浓度分别为1mmol/l-50mmol/l的na2seo3溶液后,接入接菌量为2%(v/v)的所述芽孢杆菌,在30±0.5℃,150±5r/min条件下培养2h-11h;所述na2seo3溶液终浓度为5mmol/l-20mmol/l时,na2seo3溶液终浓度为5mmol/l其seo32-的还原率达到最大,至20mmol/l后其seo32-的还原率会随之下降。所述接种芽孢杆菌合成纳米硒培养时间为2-8h。培养2-8h时,所述芽孢杆菌的菌株处于对数生长期。
实施例1:
本发明所述芽孢杆菌菌株sl的获得:2018年于贵州省开阳县富硒茶厂的泥土样品经过7次平板稀释涂布法,将样品涂布在lb培养基(nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水)上,30±0.5℃,150±5r/min条件下培养获得菌液。菌株sl的细胞形态为杆状,大小为3-5μm。如图1所示,所述芽孢杆菌菌株sl的扫描电镜照片。
所述芽孢杆菌菌株于2019年11月28日保存于中国微生物菌种保藏管理委员会普通微生物中心(北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,100101),其保藏号为:cgmccno.19051。
实施例2:所述芽孢杆菌菌株的16srrna基因分子鉴定
提取芽孢杆菌sl的基因组dna,通过pcr扩增16srrna基因序列,利用blast程序对序列进行同源性对比,得到与其最相近的菌属为芽孢杆菌,二者16srrna基因序列相似性为100%,因此判定sl为芽孢杆菌。如图2所示,所述菌株16srrna基因的系统发育树,sl菌株的16srrna基因序列如下:
ggctcaggatgaacgctggcggcgtgcctaatacatgcaagtcgagcgaatggattaagagcttgctcttatgaagttagcggcggacgggtgagtaacacgtgggtaacctgcccataagactgggataactccgggaaaccggggctaataccggataacattttgaaccgcatggttcgaaattgaaaggcggcttcggctgtcacttatggatggacccgcgtcgcattagctagttggtgaggtaacggctcaccaaggcaacgatgcgtagccgacctgagagggtgatcggccacactgggactgagacacggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgtgagtgatgaaggctttcgggtcgtaaaactctgttgttagggaagaacaagtgctagttgaataagctggcaccttgacggtacctaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttatccggaattattgggcgtaaagcgcgcgcaggtggtttcttaagtctgatgtgaaagcccacggctcaaccgtggagggtcattggaaactgggagacttgagtgcagaagaggaaagtggaattccatgtgtagcggtgaaatgcgtagagatatggaggaacaccagtggcgaaggcgactttctggtctgtaactgacactgaggcgcgaaagcgtggggagcaaacaggattagataccctggtagtccacgccgtaaacgatgagtgctaagtgttagagggtttccgccctttagtgctgaagttaacgcattaagcactccgcctggggagtacggccgcaaggctgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatcctctgaaaaccctagagatagggcttctccttcgggagcagagtgacaggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgatcttagttgccatcattaagttgggcactctaaggtgactgccggtgacaaaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatggacggtacaaagagctgcaagaccgcgaggtggagctaatctcataaaaccgttctcagttcggattgtaggctgcaactcgcctacatgaagctggaatcgctagtaatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccacgagagtttgtaacacccgaagtcggtggggtaacctttttggagccagccgcctaaggtgggacagatgattggggtgaagtc
实施例3:所述芽孢杆菌菌株sl在lb培养基中的生长曲线
利用实施例1中的菌液,采用121℃,20min高压灭菌的lb培养基(nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水、ph6.0),30±0.5℃,150±5r/min下培养,接菌量为2%(v/v)。如图3所示,所述芽孢杆菌菌株sl的生长情况,菌株生长10±1h进入稳定期,2-8h为对数生长期。
实施例4:不同seo32-浓度下所述芽孢杆菌菌株sl对seo32-的还原率
将实施例1中的菌液,采用121℃,20min高压灭菌的lb培养基(nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水、ph6.0)并在培养基中加入终浓度分别为1、5、10、20、50mmol/l的na2seo3溶液,接菌量为2%(v/v)。培养12h后,将所得菌液分别在10000±500r/min,5±1min条件下离心,之后取1ml上清液测定反应体系中剩余的seo32-浓度。seo32-浓度采取抗坏血酸和盐酸还原法测定。seo32-在强酸溶液中能被抗坏血酸还原为单质的硒,溶液呈现橙红色,于500nm处的吸光度值与seo32-浓度成线性关系。在本实验中,将上述得到的1ml上清液加入到0.5ml4mol/l盐酸和1ml1mol/l抗坏血酸中,反应10min中后,于500nm波长下测定吸光度值,根据标准曲线(y=0.0046x+0.16908,r2=0.99)计算样品中seo32-浓度,并计算其还原率,结果如图4所示。当na2seo3浓度为5mmol/l时,其seo32-的还原率达到最大,为98.67%,说明在此浓度下菌体能够与na2seo3溶液充分接触;而随着na2seo3浓度增加到20mmol/l时,其seo32-的还原率会随之下降,但由图可知所述芽孢杆菌菌株sl对高浓度的na2seo3具有较好的耐受能力。
实施例5:不同ph下所述芽孢杆菌菌株sl对seo32-的还原率
利用naoh和hcl溶液将lb培养基(nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水)的ph分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0以及10.0,并在121℃条件下高压灭菌20min,灭菌完成后加入终浓度为1mmol/l的na2seo3溶液中,接种量为2%(v/v),培养至对数末期。随后将得到的菌在10000±500r/min,5±1min条件下离心,并取1ml上清液测定其中的seo32-剩余浓度。与实施例4相同,seo32-浓度采取抗坏血酸和盐酸还原法测定。如图5所示,当培养基ph为5.0-8.0时,反应体系中seo32-的还原率均达到98%以上,其中以ph为6.0的还原率最高,由此说明该条件为菌株sl合成纳米硒的最佳ph值;而当ph过酸或过碱时,体系中seo32-的还原率均有所下降。
实施例6:所述芽孢杆菌菌株sl合成硒纳米硒的tem图。
将实施例1中的菌液加入经过高压灭菌(121℃,20min)的lb培养基(nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l、去离子水、ph6.0),并加入终浓度为1mmol/l的na2seo3溶液培养。将最终合成的产物进行透射电镜(transmissionelectronmicroscope,tem)表征,结果如图6、图7所示。该菌株合成的纳米硒颗粒为球形,分散性较好,其平均粒径为150.47nm,最大粒径为226.00nm,最小为44.15nm。
实施例7:
如图8所示,所述芽孢杆菌菌株sl合成纳米硒过程中胞外eps随时间变化图。
胞外聚合物(extracellularpolymericsubstance,eps)是微生物在其胞外所分泌的高分子聚合物,主要由多糖和蛋白质组成。对于微生物而言,eps具有着重要的生理功能,它们不仅能富集环境中的营养成分,还能抵御杀菌剂和有毒物质对细胞的危害。
而在本实验中为了考察生物合成纳米硒过程中seo32-和se0对微生物的毒性的影响,我们选用eps作为指标进行考察。利用实施例6的方式培养菌株,并在24h内每隔4h进行取样,将取得的10ml样品在12000±500r/min,10min条件下离心,取上清液进行多糖和蛋白质浓度的测定。其中,多糖含量采用浓硫酸-苯酚法测定。多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物。实验中将1ml上清液加入1ml苯酚溶液中,摇匀,缓慢加入5ml浓硫酸,加热15±1min后冷却至室温,静置20min,于490nm波长下测定吸光度,并与绘制的多糖标准曲线(y=0.1112x+0.0542,r2=0.9995)对照,计算多糖含量。蛋白质含量采用考马斯亮蓝法测定。在酸性条件下,考马斯亮蓝g-250染料与蛋白质疏水区结合,导致最大吸收峰由465nm红移为595nm,同时颜色也由棕色变为蓝色,且其在595nm处的吸光度值与蛋白质浓度成正比。在本实验中取300μl上清液,加入1.5ml考马斯亮蓝试剂,摇匀后静置2min,以去离子水为参比,在595nm处测定吸光度,与标准曲线(y=0.0082x+0.5228,r2=0.996)对照,计算蛋白质的含量,结果如图8所示。反应12h时,体系内的eps含量最高,12h后其含量逐渐下降。该结果与菌株的生长曲线具有一致性。推测是由于在12h前,培养基中亚硒酸盐含量高,刺激菌株分泌大量eps以免受到亚硒酸盐毒性干扰。在12h后,亚硒酸盐被还原为纳米硒,毒性降低,菌株分泌的eps也随之减少。同时蛋白质作为纳米硒的封端剂被利用,培养基中的eps总含量下降。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!