一种基于三层微结构的CTC捕捉检测芯片的制作方法
本发明涉及生物检测技术领域,尤其涉及一种基于三层微芯片检测的ctc捕捉芯片。
背景技术:
循环肿瘤细胞(circulatingtumorcell,ctc),是癌细胞从原病灶部分脱落进入血液循环系统的肿瘤细胞。一般情况下,进入循环系统的肿瘤细胞绝大部分会死亡和分解,只有极少数存活下,这些细胞被称为循环肿瘤细胞ctc。尽管血液中ctc细胞数量稀少,却与癌症转移复发关系密切。研究表明,癌症致死的主要原因在于ctc细胞导致的癌症转移与恶化。因此,ctc细胞的检测成为乳腺癌、肝癌、胰腺癌、胃癌、前列腺癌、宫颈癌等恶行肿瘤诊断、术后监控、精准用药控制的重要手段与临床指标。ctc细胞富集与分子生物学检测也成为癌症特异性精准诊疗研究的新领域,与循环cdna与循环肿瘤rna一起成为癌症液体活检的三大关键靶标。2016年,国内成立了中国ctc产业联盟,中国ctc检测逐渐形成具有市场竞争力的产业链。
由于血液中ctc细胞数量稀少,1ml血液中ctc数目不超过10个,因此,快速准确有效捕捉富集ctc细胞成为ctc检测的关键与难点。根据ctc细胞的物理性质与生化性质,目前ctc捕捉的原理大体分为两类。一是利用针对肿瘤细胞表面抗原的特异性抗体epcam、ck等包被在纳米磁珠或载体表面捕捉ctc细胞;二是利用循环肿瘤细胞与正常细胞相比,尺寸大、形变性差、核质比高、折射率大的特点分离检测ctc细胞,例如8微米左右的捕捉结构、高低间隔的通道或者曲率不同的弯曲通道分离ctc细胞或者利用全内反射表面等离子体或拉曼光谱识别ctc细胞。
特异性抗体捕捉ctc细胞需要抗体标记或者使用磁性纳米颗粒,捕捉效率低、假阳性高、速度慢,并且不利于后续的分子生物学检测;因此利用物理性质富集ctc细胞,具有无标记、无损伤、快捷、低廉的优点。
技术实现要素:
本发明设计开发了一种基于三层微芯片检测的ctc捕捉芯片,本发明的发明目的是解决了成体瘤与血细胞肿瘤、ctc细胞同时捕捉与可视化抗体检测的问题,并且可以反向收集细胞,便于进行其它分子生物学检测。
本发明提供的技术方案为:
一种基于三层微芯片检测的ctc捕捉芯片,包括:
第一层注入层,其包括第一总鞘液孔、第一加样孔、多个注入区;
其中,所述多个注入区包括第一ctc捕捉区荧光孔和第一ctc捕捉区出口;
第二层负载层,其包括与所述第一总鞘液孔相连通的第二总鞘液孔、与所述第一加样孔相连通的第二加样孔和与所述注入区对应设置的多个负载区;
其中,所述负载区包括与所述第二总鞘液孔相连通的第一分鞘液孔、与所述第二加样孔相连通的第一进样孔、与所述第一ctc捕捉区荧光孔相连通的第二ctc捕捉区荧光孔和与所述第一ctc捕捉区出口相连通的第二ctc捕捉区出口;
第三层捕捉层,其包括与所述负载区对应设置的多个捕捉区;
其中,所述捕捉区包括:
第二分鞘液孔,其与所述第一分鞘液孔连通;
第二进样孔,其与所述第一进样孔连通;
螺旋分离区,其一端同时连通所述第二分鞘液孔和所述第二进样孔;
缓冲区,其一端与所述螺旋分离区的另一端连通;
ctc捕捉区,其一端与所述缓冲区的另一端连通;
ctc荧光染料孔,其同时与所述缓冲区的另一端和所述ctc捕捉区的一端连通,且与所述第二ctc捕捉区荧光孔相连通;
第三ctc捕捉区出口,其与所述ctc捕捉区的另一端连通,且与所述第二ctc捕捉区出口连通;
分离出口,其与所述缓冲区的另一端连通,用于将捕捉ctc后的废液排出。
优选的是,所述注入区还包括第一白细胞捕捉区荧光孔和第一白细胞捕捉区出口;
所述负载区还包括与所述第一白细胞捕捉区荧光孔相连通的第二白细胞捕捉区荧光孔和与所述第一白细胞捕捉区出口相连通的第二白细胞捕捉区出口;以及
所述捕捉区还包括:
白细胞捕捉区,其一端与所述分离出口连通;
白细胞荧光染料孔,其同时与所述分离出口和所述白细胞捕捉区的一端连通,且与所述第二白细胞捕捉区荧光孔相连通;
第三白细胞捕捉区出口,其与所述白细胞捕捉区的另一端连通,且与所述第二白细胞捕捉区出口连通。
优选的是,所述注入区还包括第一红细胞捕捉区出口;
所述负载区还包括与所述第一红细胞捕捉区出口相连通的第二红细胞捕捉区出口;以及
所述捕捉区还包括:
红细胞区,其一端与所述分离出口连通;
第三红细胞捕捉区出口,其与所述红细胞区的另一端连通,且与所述第二红细胞捕捉区出口连通。
优选的是,还包括:
ctc开关微阀,其为圆柱体结构,且贯穿所述ctc捕捉芯片;
所述捕捉区还包括第三ctc出样孔;
其中,所述圆柱体结构包括:
第一孔,其沿所述圆柱体轴向设置,且与所述缓冲区的另一端和所述ctc捕捉区的一端连通;
第二孔,其沿所述圆柱体轴向设置,且与所述第一孔和所述ctc荧光染料孔连通;
第三孔,其沿所述圆柱体轴向设置,且与所述缓冲区的另一端和所述ctc捕捉区的一端连通,所述第三孔与所述第一孔同轴设置在不同的水平高度;
第四孔,其沿所述圆柱体轴向设置,且与所述第三孔和所述第三ctc出样孔连通;以及
所述ctc开关微阀能够选择性的使所述缓冲区的另一端、所述ctc捕捉区的一端同时与所述ctc荧光染料孔或所述第三ctc出样孔选择性的连通;
所述注入区还包括第一ctc出样孔,所述负载区还包括第二ctc出样孔,且所述第一ctc出样孔、所述第二ctc出样孔和所述第三ctc出样孔连通。
优选的是,还包括:
白细胞开关微阀,其为圆柱体结构,且贯穿所述三层微芯片检测的ctc捕捉芯片;
所述捕捉区还包括第三白细胞出样孔;
其中,所述圆柱体结构包括:
第一孔,其沿所述圆柱体轴向设置,且与所述分离出口和所述白细胞捕捉区的一端连通;
第二孔,其沿所述圆柱体轴向设置,且与所述第一孔和所述白细胞荧光染料孔连通;
第三孔,其沿所述圆柱体轴向设置,且与所述分离出口和所述白细胞捕捉区的一端连通,所述第三孔与所述第一孔同轴设置在不同的水平高度;
第四孔,其沿所述圆柱体轴向设置,且与所述第三孔和所述第三白细胞出样孔连通;以及
所述白细胞开关微阀能够选择性的使所述分离出口、所述白细胞捕捉区的一端同时与所述白细胞荧光染料孔或所述第三白细胞出样孔选择性的连通;
所述注入区还包括第一白细胞出样孔,所述负载区还包括第二白细胞出样孔,且所述第一白细胞出样孔、所述第二白细胞出样孔和所述第三白细胞出样孔连通。
优选的是,所述ctc捕捉区包括:相连通的多个ctc捕捉微区,其成蛇形排布;和/或
所述白细胞捕捉区包括:相连通的多个白细胞捕捉微区,其成蛇形排布。
优选的是,所述ctc捕捉微区为通过长方体结构的凸起分隔成的多个反应空间,所述长方体结构的长度为375~425μm,宽度为100~150μm,高度为69~79μm。
优选的是,所述白细胞捕捉微区为通过长方体结构的凸起分隔成的多个反应空间,所述长方体结构的长度为375~425μm,宽度为100~150μm,高度为69~79μm。
优选的是,所述长方体结构之间的间隔为80~120μm。
本发明与现有技术相比较所具有的有益效果:本发明通过设计双重物理分离结构,包括一个基于惯性微流的螺旋通道细胞分层单元与一个单细胞捕捉结构阵列单元,避免了单一物理结构准确率低的缺点,不仅可以实现ctc细胞原位可视化检测,并且有利于ctc细胞富集进行后续核酸与蛋白检测;与抗体特异性富集ctc方法相比,双重物理结构捕捉ctc细胞无损伤、无标记、速度快、准确性高的优点,并且可以同时检测成体瘤与血液肿瘤,三层结构芯片可以一次性完成多个样本的检测。
附图说明
图1为本发明所述的基于三层微芯片检测的ctc捕捉芯片的结构示意图。
图2为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第一层注入层的主视图。
图3为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第一层注入层的结构示意图。
图4为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第二层负载层的主视图。
图5为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第二层负载层的结构示意图。
图6为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第三层捕捉层的主视图。
图7为本发明所述的基于三层微芯片检测的ctc捕捉芯片的第三层捕捉层的结构示意图。
图8为本发明所述的第三层捕捉层的负载区的主视图。
图9为本发明所述的第三层捕捉层的负载区的结构示意图。
图10为图9中300b的局部放大图。
图11为本发明所述的第三层捕捉层的负载区的结构示意图。
图12为图11中300c的局部放大图。
图13为本发明所述的第三层捕捉层的负载区的结构示意图。
图14为图13中300d的局部放大图。
图15a~15c为ctc开关微阀或者白细胞开关微阀的结构示意图。
图16a为ctc开关微阀或者白细胞开关微阀的主视图。
图16b为ctc开关微阀或者白细胞开关微阀的左视图。
图16c为ctc开关微阀或者白细胞开关微阀的右视图。
图16d为ctc开关微阀或者白细胞开关微阀的后视图。
图17为本发明所述的ctc开关微阀或者白细胞开关微阀使用时不同开关档示意图。
图18a为本发明所述的ctc开关微阀或者白细胞开关微阀在开关二档时液体流向示意图。
图18b为本发明所述的ctc开关微阀或者白细胞开关微阀在开关四档时液体流向示意图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
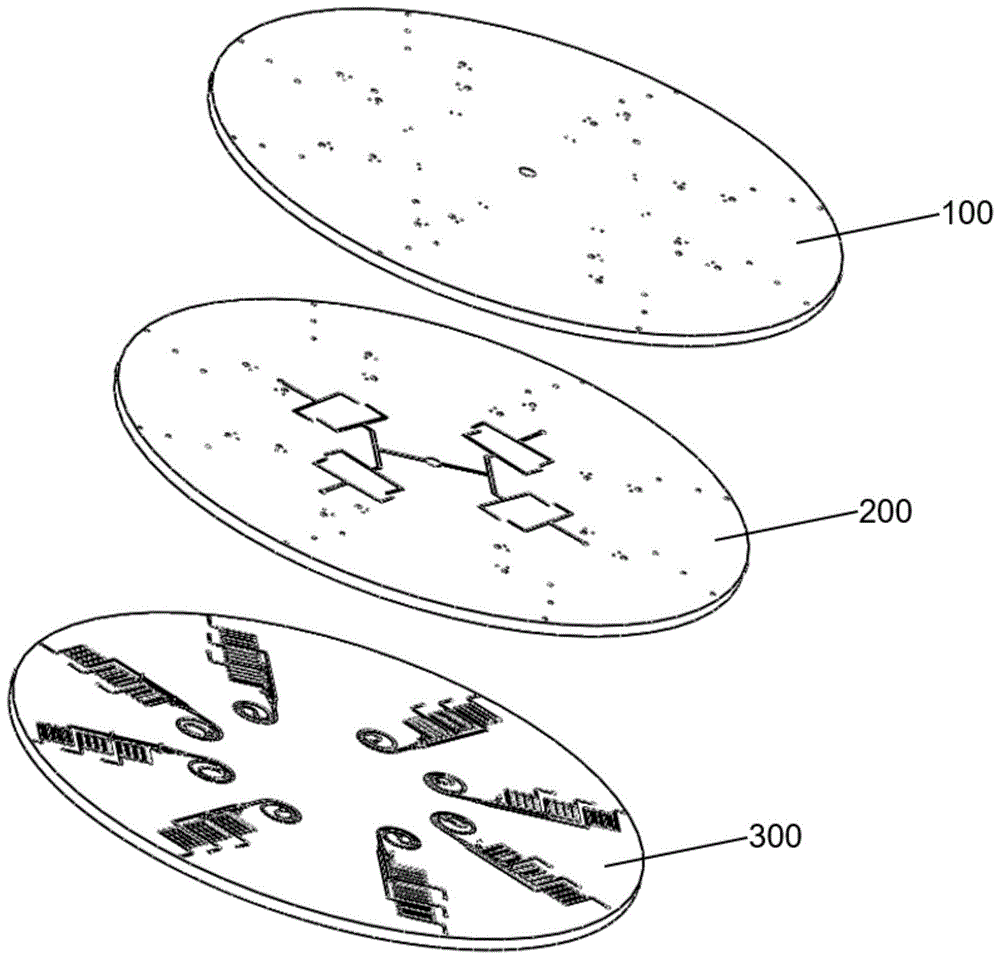
如图1所示,本发明提供了一种基于三层微芯片检测的ctc捕捉芯片,其主体结构包括三层微芯片,第一层注入层100,第二层负载层200和第三层捕捉层300,用于循环肿瘤细胞ctc和白细胞的捕捉与可视化检测。
如图2、图3所示,第一层注入层100包含第一总鞘液孔110,多个第一加样孔120和多个注入区100a;其中,每个注入区100a包括第一ctc捕捉区荧光孔130a、第一ctc出样孔130b和第一ctc捕捉区出口150a;芯片第一层注入层100由第一总鞘液孔110和第一加样孔120分别用于鞘液和样品的注入,第一ctc捕捉区出口150a用于第三层多余液的排除及压强的平衡;
如图4、图5所示,第二层负载层200包含与第一总鞘液孔110相连通的第二总鞘液孔210,多个由第一层注入层100延伸而来的多个第二加样孔220和与多个注入区100a对应设置的多个负载区200a;其中,每个负载区200a包括与第二总鞘液孔210通过逐渐分支的鞘液分流通道211连通的第一分鞘液孔212、与第二加样孔220通过分流通道232连通的第一进样孔231、与第一ctc捕捉区荧光孔130a连通的第二ctc捕捉区荧光孔230a、与第一ctc出样孔130b连通的第二ctc出样孔230b和与第一ctc捕捉区出口150a连通的第二ctc捕捉区出口250a,第二ctc捕捉区出口250a用于第三层多余液的排除及压强的平衡;
如图6~14所示,第三层捕捉层300包含与负载区200a对应设置的多个捕捉区300a,每个捕捉区300a可同时捕获与可视化检测样品中的循环肿瘤细胞ctc;其中,每个捕捉区300a均包括第二分鞘液孔310、第二进样孔320、螺旋分离区370、缓冲区380、ctc区330和分离出口;其中,ctc区330包含ctc捕捉区331,ctc荧光染料孔332a,第三ctc出样孔332b、ctc开关微阀333和第三ctc捕捉区出口350a;第二分鞘液孔310与第一分鞘液孔212连通,第二进样孔320与第一进样孔231连通,螺旋分离区370一端同时连通第二分鞘液孔310和第二进样孔320,缓冲区380一端与螺旋分离区370的另一端连通,第三ctc出样孔332b与第二ctc出样孔230b连通,ctc捕捉区331一端与缓冲区380的另一端连通,ctc荧光染料孔332a同时与缓冲区380的另一端和ctc捕捉区331的一端连通,且与第二ctc捕捉区荧光孔230相连通,第三ctc捕捉区出口350a与ctc捕捉区331的另一端连通,且与第二ctc捕捉区出口250a连通,分离出口与缓冲区380的另一端连通,用于将捕捉ctc后的废液排出;
如图15、16所示,ctc开关微阀333为圆柱体结构,且贯穿三层微芯片检测的ctc捕捉芯片,第三ctc出样孔332b能够与ctc开关微阀333连通,圆柱体结构包括孔a、a、b、b;孔a沿圆柱体轴向设置,且能够与缓冲区380的另一端和ctc捕捉区331的一端同时连通,孔a沿圆柱体轴向设置,且能够与孔a和ctc荧光染料孔332a同时连通,孔b沿圆柱体轴向设置,且能够与缓冲区380的另一端和ctc捕捉区331的一端同时连通,同时,孔a与孔b同轴设置在不同的水平高度,孔b沿圆柱体轴向设置,且能够与孔b和第三ctc出样孔332b同时连通;
如图17所示,ctc开关微阀333沿轴向垂直于三层微芯片检测的ctc捕捉芯片滑动,能够选择性的使缓冲区380的另一端、ctc捕捉区331的一端同时与ctc荧光染料孔332a或第三ctc出样孔332b选择性的连通,具体包括:
当ctc开关微阀333滑动至孔a的下方时,此时处于开关一档s1,此时ctc开关微阀333为关闭状态,ctc荧光染料孔332a和第三ctc出样孔332b与ctc捕捉区331一端、缓冲区380的另一端的通道均处于关闭状态;
当ctc开关微阀333滑动至孔a时,此时处于开关二档s2,此时ctc开关微阀333为荧光孔开放状态,荧光染料通道打开,ctc荧光染料孔332a通过孔a、a与ctc捕捉区331的一端、缓冲区380的另一端连通,通过将荧光染料加入到ctc荧光染料孔332a中,荧光染料通过该开放的荧光通道进入ctc捕捉区331,参与反应;
当ctc开关微阀333滑动至孔a和孔b之间时,此时处于开关三档s3,此时ctc开关微阀333为关闭状态,ctc荧光染料孔332a和第三ctc出样孔332b与ctc捕捉区331一端、缓冲区380的另一端的通道均处于关闭状态;
当ctc开关微阀333滑动至孔b时,此时处于开关四档s4,此时ctc开关微阀333为样品孔开放状态,样品流出通道打开,第三ctc出样孔332b通过孔b、b与ctc捕捉区331的一端、缓冲区380的另一端连通,通过第三ctc捕捉区出口350a反向通样,将反应后的反应物在ctc捕捉区331逆向流动,通过第三ctc出样孔332b将反应物回收,反应结束。
在另一种实施例中,如图2~7所示,第一层注入层100的注入区还包括第一白细胞捕捉区荧光孔140a、第一白细胞出样孔140b和第一白细胞捕捉区出口150b;第二层负载层200的负载区200a还包括与第一白细胞捕捉区荧光孔140a相连通的第二白细胞捕捉区荧光孔240a、与第一白细胞出样孔140b相连通的第二白细胞出样孔240b和与第一白细胞捕捉区出口150b相连通的第二白细胞捕捉区出口250b;第三层捕捉层300的捕捉区300a还包括白细胞区340,其包括白细胞捕捉区341、白细胞荧光染料孔342a、第三白细胞样品孔342b、白细胞开关微阀343和第三白细胞捕捉区出口350b;其中,第三白细胞出样孔342b与第二白细胞出样孔240b连通,白细胞捕捉区341一端与分离出口连通,白细胞荧光染料孔342a同时与分离出口和白细胞捕捉区341的一端连通,且与第二白细胞捕捉区荧光孔240a相连通,第三白细胞捕捉区出口350b与白细胞捕捉区341的另一端连通,且与第二白细胞捕捉区出口350b连通,用于将捕捉白细胞后的废液排出;
如图15、16所示,白细胞开关微阀343为圆柱体结构,与白细胞开关微阀333结构相同,且贯穿三层微芯片检测的ctc捕捉芯片,第三白细胞出样孔342b能够与白细胞开关微阀343连通,圆柱体结构同样包括孔a、a、b、b;孔a沿圆柱体轴向设置,且能够与分离出口和白细胞捕捉区341的一端同时连通,孔a沿圆柱体轴向设置,且能够与孔a和白细胞荧光染料孔342a同时连通,孔b沿圆柱体轴向设置,且能够与分离出口和白细胞捕捉区341的一端同时连通,同时,孔a与孔b同轴设置在不同的水平高度,孔b沿圆柱体轴向设置,且能够与孔b和第三白细胞出样孔342b同时连通;
如图17所示,白细胞开关微阀343与ctc开关微阀同样的设置方式,沿轴向垂直于三层微芯片检测的ctc捕捉芯片滑动,能够选择性的使分离出口、白细胞捕捉区341的一端同时与白细胞荧光染料孔342a或第三白细胞出样孔342b选择性的连通,具体包括:
当白细胞开关微阀343滑动至孔a的下方时,此时处于开关一档s1,此时白细胞开关微阀343为关闭状态,白细胞荧光染料孔342a和第三白细胞出样孔342b与白细胞捕捉区341一端、分离出口的通道均处于关闭状态;
当白细胞开关微阀343滑动至孔a时,此时处于开关二档s2,此时白细胞开关微阀343为荧光孔开放状态,荧光染料通道打开,白细胞荧光染料孔342a通过孔a、a与白细胞捕捉区341的一端、分离出口连通,通过将荧光染料加入到白细胞荧光染料孔342a中,荧光染料通过该开放的荧光通道进入白细胞捕捉区341,参与反应;
当白细胞开关微阀343滑动至孔a和孔b之间时,此时处于开关三档s3,此时白细胞开关微阀343为关闭状态,白细胞荧光染料孔342a和第三白细胞出样孔342b与白细胞捕捉区341一端、分离出口的通道均处于关闭状态;
当白细胞开关微阀343滑动至孔b时,此时处于开关四档s4,此时白细胞开关微阀343为样品孔开放状态,样品流出通道打开,第三白细胞出样孔342b通过孔b、b与白细胞捕捉区341的一端、分离出口连通,通过第三白细胞捕捉区出口350b反向通样,将反应后的反应物在白细胞捕捉区341逆向流动,通过第三白细胞出样孔342b将反应物回收,反应结束。
如图2~7所示,第一层注入层100的注入区还包括第一红细胞捕捉区出口150c;第二层负载层200的负载区还包括与第一红细胞捕捉区出口150c相连通的第二红细胞捕捉区出口250c;第三层捕捉层300的捕捉区还包括红细胞区360和第三红细胞捕捉区出口350c,红细胞区360一端与分离出口连通,第三红细胞捕捉区出口350c与红细胞区360的另一端连通,且与第二红细胞捕捉区出口250c连通;
如图8~14所示,在第三层捕捉层300的第二分鞘液孔310用于注入鞘液,第二进样孔320用于进入样本,两者在螺旋分离区370混合并使循环肿瘤细胞ctc、白细胞和红细胞分层,通过缓冲区380分别流入对应的区域:
首先,循环肿瘤细胞ctc通过缓冲区380后,进入ctc区330,再进入ctc捕捉区331通过微结构,捕捉ctc细胞,多余的鞘液等其他物质从第三ctc捕捉区出口350a流出,捕捉完成后,打开ctc开关微阀333,自ctc荧光染料孔332a中加入荧光染料,使ctc捕捉区331中的循环肿瘤细胞染色,便于直接观测结果;
然后,分层的白细胞对应进入白细胞区340,再进入白细胞捕捉区341通过微结构,捕捉白细胞,多余的鞘液等其他物质从第三白细胞捕捉区出口350b流出,捕捉完成后,打开白细胞开关微阀343,自白细胞荧光染料孔342a中加入荧光染料,使白细胞捕捉区341中的白细胞染色,便于直接观测结果;
最后,分层的红细胞对应进入红细胞区360,同时通过第三红细胞捕捉区出口350c流出。
在另一种实施例中,如图2~5所示,在第一层注入层100中设置4个第一加样孔120和8个注入区;在第二层负载层200设置4个第二加样孔220和8个负载区,4个第二加样孔220分别与4个第一加样孔120一一对应,8个负载区分别与8个注入区一一对应,同时,1个第二加样孔220分别与8个负载区中的2个负载区的第一进样孔231相连通,进而使4个第二加样孔220能够同时与8个负载区中的第一进样孔231相连通。
在另一种实施例中,如图8所示,ctc捕捉区331包括相连通的多个ctc捕捉微区,其成蛇形排布,每一排蛇形通道之间的间隔为100~150μm;同时,ctc捕捉微区为通过长方体结构的凸起分隔成的多个反应空间,所述长方体结构的长度为375~425μm,宽度为100~150μm,高度为69~79μm;作为一种优选,每一排蛇形通道之间的间隔为125μm,长方体结构的长度为400μm,宽度为120μm,高度为74μm。
在另一种实施例中,如图8所示,白细胞捕捉区341包括相连通的多个白细胞捕捉微区,其成蛇形排布,每一排蛇形通道之间的间隔为100~150μm;同时,ctc捕捉微区为通过长方体结构的凸起分隔成的多个反应空间,所述长方体结构的长度为375~425μm,宽度为100~150μm,高度为69~79μm;作为一种优选,每一排蛇形通道之间的间隔为125μm,长方体结构的长度为400μm,宽度为120μm,高度为74μm。
在另一种实施例中,长方体结构之间的间隔为80~120μm;作为一种优选,长方体结构之间的间隔为100μm。
在另一种实施例中,红细胞区360为u形管道区361。
在另一种实施例中,如图8所示,红细胞区360包括相连通的多个红细胞捕捉微区361,其成蛇形排布,每一排蛇形通道之间的间隔为100~150μm;同时,ctc捕捉微区为通过长方体结构的凸起分隔成的多个反应空间,所述长方体结构的长度为375~425μm,宽度为100~150μm,高度为69~79μm;作为一种优选,每一排蛇形通道之间的间隔为125μm,长方体结构的长度为400μm,宽度为120μm,高度为74μm。
本发明提供的一种基于三层微芯片检测的ctc捕捉芯片通过使样品与鞘液混合,通过离心力的作用使循环肿瘤细胞ctc,白细胞,红细胞,分离,并通过芯片的微结构捕捉循环肿瘤细胞ctc,实现对样品的检测,并可最终实现与数字化lamp芯片同时使用,直接捕捉定量检测样本中的循环肿瘤细胞ctc。
本发明提供的一种基于三层微芯片检测的ctc捕捉芯片的使用过程包括如下步骤:
步骤一、同时通过第一层注入层100的第一加样孔120与第一总鞘液孔110分别加入样品和鞘液,加入的样品与鞘液在第二层负载层200通过分液通道211和分流通道232各自分为8个,便于第三层捕捉层300对多组样片的检测,进入第三层捕捉层300的样品与鞘液,在螺旋分离区370混合并分为循环肿瘤细胞ctc层,白细胞层和红细胞层,通过缓冲区380分别流入对应的区域;
步骤二、将ctc开关微阀333滑动至孔a的下方,即调节ctc开关微阀333至开关一档s1,此时ctc开关微阀333为关闭状态,循环肿瘤细胞ctc通过缓冲区380后,进入ctc区330中的ctc捕捉区331,通过多个ctc捕捉微区捕捉ctc细胞,多余的鞘液等其他物质从第三ctc捕捉区出口350a流出;
捕捉完成后,将ctc开关微阀333滑动至孔a,即调节ctc开关微阀333至开关二档s2,此时ctc开关微阀333为荧光孔开放状态,荧光染料通道打开,通过与ctc荧光染料孔332a连通的第一ctc捕捉区荧光孔130a中加入荧光染料,使ctc捕捉区331中的循环肿瘤细胞染色,此时液体流向如图18a中箭头所示,由孔a到孔a,便于直接观测结果;
染色完成后,将ctc开关微阀333滑动至孔a和孔b之间时,即调节ctc开关微阀333至开关三档s3,此时ctc开关微阀333为关闭状态;
若需要对循环肿瘤细胞ctc做进一步检测,将ctc开关微阀333滑动至孔b,此时调节ctc开关微阀333处于开关四档s4,此时ctc开关微阀333为样品孔开放状态,样品流出通道打开,可通过第三ctc捕捉区出口350a,反向通样,此时液体流向如图18b中箭头所示,由孔b到孔b,自与第三ctc出样孔332b连通的第一ctc出样孔130b收集循环肿瘤细胞ctc,做进一步分析;
步骤三、将白细胞开关微阀343滑动至孔a的下方,即调节白细胞开关微阀343至开关一档s1,此时白细胞开关微阀343为关闭状态,白细胞进入白细胞区340中的白细胞捕捉区341,通过多个白细胞捕捉微区捕捉白细胞,多余的鞘液等其他物质从第三白细胞捕捉区出口350b流出;
捕捉完成后,将白细胞开关微阀343滑动至孔a,即调节白细胞开关微阀343至开关二档s2,此时白细胞开关微阀343为荧光孔开放状态,荧光染料通道打开,通过与白细胞荧光染料孔342a连通的第一白细胞捕捉区荧光孔140a中加入荧光染料,使白细胞捕捉区341中的白细胞染色,此时液体流向如图18a中箭头所示,由孔a到孔a,便于直接观测结果;
染色完成后,将白细胞开关微阀343滑动至孔a和孔b之间,即调节白细胞开关微阀343至开关三档s3,此时白细胞开关微阀343为关闭状态;
若需要对白细胞做进一步检测,将白细胞开关微阀343滑动至孔b,即调节白细胞开关微阀343至开关四档s4,此时白细胞开关微阀343为样品孔开放状态,样品流出通道打开,可通过第三白细胞捕捉区出口350b,反向通样,此时液体流向如图18b中箭头所示,由孔b到孔b,自与第三白细胞出样孔342b连通的第一白细胞出样孔140b收集白细胞,做进一步分析;
步骤四、分层的红细胞对应进入红细胞区360,同时通过第三红细胞捕捉区出口350c流出。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!