南极鱼hepcidin抗菌肽及其制备方法和应用与流程
本发明属于生物工程
技术领域:
,具体涉及包括两种来源于南极鱼d.mawsoni的抗菌肽dmhep_8cysv1和dmhep_8cysv2的南极鱼hepcidin抗菌肽及其制备方法和应用。
背景技术:
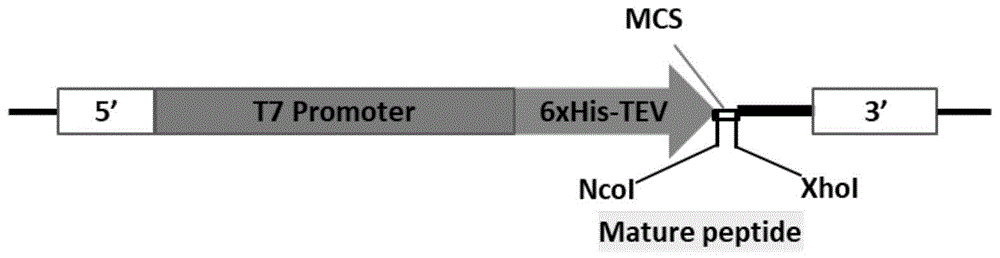
:目前,我国水产养殖业经常使用的抗生素有20种,分别来自8个类别,这些抗生素中有2/3属于既能抗革兰氏阳性菌又能抗革兰氏阴性菌的广谱抗生素。但是这些抗生素中只有一小部分被生物吸收,剩下的绝大部分都进入水环境中。这些进入到水环境的抗生素通过抑制初级生产力影响生态系统平衡和水生生物免疫力,包括抗生素耐药性。尤其是耐多种药物的细菌,成为公共健康的严重挑战,同时水环境中过量的抗生素进入食物链会威胁食品安全和人类健康。寻找既能替代抗生素抗菌功能,又不会使细菌对其产生耐药性,并且对宿主没有伤害的抗菌试剂成为当务之急。生物体内天然存在各种抗菌肽,它们不会让细菌产生耐药性,若能证明它能产生和抗生素同样的抗菌效果,将会改变水产养殖业对抗生素的高度依赖,成为替代抗菌素的首选。hepcidin是一种含有丰富半胱氨酸的小分子阳离子抗菌肽,在宿主免疫系统响应病原刺激过程中发挥重要作用。研究发现,在高等脊椎动物中成熟的hepcidin由20-25个氨基酸组成,分子内含有8个高度保守的半胱氨酸残基相互配对形成四对二硫键构成稳定的发卡结构。许多体内实验间接表明hepcidin具有抗菌的作用,如给小鼠腹腔注射细菌后几小时内,小鼠肝脏hepcidin的表达有显著的升高,表明hepcidin可能和抗菌发生有关;白鲈感染海豚链球菌后肝脏中hepcidin升高4500倍,但是其他组织hepcidin的表达量并没有受到致病菌的诱导;还有研究者用检查嗜水气单胞菌刺激过的斑马鱼血清,发现hepcidin多肽的表达量升高,使用这种血清进行抑菌圈实验发现其能够杀死大肠杆菌和嗜水气单胞菌。除此之外,也有直接证据表明hepcidin具有抗菌效果,人类hep20和hep25在体外的浓度达到30μm的时候表现出抗菌的活性;斑马鱼hepcidin成熟多肽表达纯化后和多种类型的细菌共同孵育,发现其对多种致病菌生长都有抑制作用,证明hepcidin在动物体内外具有抗菌活性。随着对南极鱼类资源的不断研究,发现其含有序列多样性的hepcidin基因。鳞头犬牙南极鱼d.mawsoni中鉴定出2种不同的8cyshepcidin序列dmhep_8cysv1和dmhep_8cysv2,分别位于d.mawsoni基因组中两个不同的位点,其中dmhep_8cysv1位于基因组中一个非常古老且保守的位点,这个位点在几乎所有鱼类中都有发现,但是dmhep_8cysv2处于一个新进化出来的位点上,属于一种新型hepcidin基因。由于dmhep_8cysv1和dmhep_8cysv2成熟多肽序列差异非常大,是否会对其抗菌功能产生影响尚未见报道。技术实现要素:为解决天然抗菌肽含量低、难提取、无法满足市场应用需求量、化学合成抗菌肽二级结构与天然抗菌肽存在差异无法保留其完整活性、以及化学合成抗菌肽技术不成熟成本高的问题,本发明提供了一种南极鱼hepcidin抗菌肽,包括两种来源于南极鱼d.mawsoni的抗菌肽dmhep_8cysv1和抗菌肽dmhep_8cysv2;所述抗菌肽dmhep_8cysv1具有下述任一氨基酸序列:(a)如seqidno:1所示的氨基酸序列,或(b)在严谨条件下与seqidno:1所示的氨基酸序列的c端序列杂交的氨基酸序列;seqidno:1所示的氨基酸序列如下:所述抗菌肽dmhep_8cysv2具有下述任一氨基酸序列:(c)如seqidno:2所示的氨基酸序列,或(d)在严谨条件下与seqidno:2所示的氨基酸序列的c端序列杂交的氨基酸序列;seqidno:2所示的氨基酸序列如下:其中,单下划线标记的是6个his标签序列,虚线下划线标记的是tev蛋白酶切割的靶序列且tev可对该位点序列进行酶切,双下划线标记的是具有抗菌活性的抗菌肽序列。根据本发明的一些实施方式,所述抗菌肽dmhep_8cysv1和抗菌肽dmhep_8cysv2中所述具有抗菌活性的抗菌肽均来源于鳞头犬牙南极鱼(dissostichusmawsoni),其氨基酸序列分别如seqidno:3和seqidno:4所示,具体为:seqidno:3所示的氨基酸序列如下:seqidno:4所示的氨基酸序列如下:进一步,编码上述氨基酸序列如seqidno:3所示的抗菌肽基因的核苷酸序列为:cagagccacctctccctgtgccgctggtgctgcaactgctgcaagggcaacaagggctgcggcttctgctgcaggttc(如seqidno:5所示);编码上述氨基酸序列如seqidno:4所示的抗菌肽基因的核苷酸序列为:cgccgtcgcaagtgtaaattttgctgcaactgctgcagcaacatctgtcaaacgtgctgcacaaggagattc(如seqidno:6所示)。根据本发明的一些实施方式,所述严谨条件是指在1×pbs(或0.1×tbs)和2%脱脂牛奶的溶液中于37℃杂交。根据本发明的一些实施方式,所述抗菌肽dmhep_8cysv1如seqidno:1所示的氨基酸序列的n端可连接或序列作为标签。根据本发明的一些实施方式,所述抗菌肽dmhep_8cysv2如seqidno:2所示的氨基酸序列的n端可连接或序列作为标签。本发明还提供了任一所述南极鱼hepcidin抗菌肽的制备方法,包括以下步骤:(1)用rt-pcr的方法从dissostichusmawsoni的肝脏组织中得到其编码区序列,分别得到核苷酸序列如seqidno:5和seqidno:6所示的南极鱼hepcidin抗菌肽基因;(2)将上述南极鱼hepcidin抗菌肽基因分别插入到原核表达载体中,构成重组质粒;(3)将重组质粒转入克隆用大肠杆菌菌株中转化宿主细胞,并对宿主细胞进行诱导表达,获得表达产物;(4)分离纯化上述表达产物,分别命名为抗菌肽dmhep_8cysv1和抗菌肽dmhep_8cysv2。本发明还提供一种重组表达载体,包含核苷酸序列如seqidno:5或seqidno:6所示的hepcidin抗菌肽基因,由其与质粒构建得到。本发明还提供一种基因工程化的宿主细胞,所述的宿主细胞选自:a)核苷酸序列如seqidno:5或seqidno:6所示的hepcidin抗菌肽基因转化或转导的宿主细胞及其后代细胞;或b)所述重组表达载体转化或转导的宿主细胞及其后代细胞。本发明还提供所述南极鱼hepcidin抗菌肽在抑制细菌生长中的应用。根据本发明的一些实施方式,所述抗菌肽dmhep_8cysv1可用于抑制大肠杆菌(e.coli)、链球菌(s.treptococcus)、嗜水气单胞菌(a.hydrophila)、金黄色葡萄球菌(s.aureus)生长;所述抗菌肽dmhep_8cysv2可用于抑制大肠杆菌、链球菌、嗜水气单胞菌、爱德华氏菌(e.tarda)、金黄色葡萄球菌生长。本发明中,南极鱼hepcidin抗菌肽来自于鳞头犬牙南极鱼(dissostichusmawsoni)这个特殊的物种,属于南极鱼类体内普遍存在8个半胱氨酸残基的hepcidin抗菌肽。利用rt-pcr的方法从dissostichusmawsoni的肝脏组织中得到其编码区序列并插入到原核表达载体中,构成重组质粒,将其转入克隆用大肠杆菌菌株中,获得可以表达南极鱼hepcidin抗菌肽的原核表达系统,经分离并纯化鉴定后得到抗菌肽dmhep_8cysv1和抗菌肽dmhep_8cysv2。本发明的抗菌肽dmhep_8cysv1对大肠杆菌(e.coli)、链球菌(s.treptococcus)、嗜水气单胞菌(a.hydrophila)以及金黄色葡萄球菌(s.aureus)均有明显的生长抑制作用,并且最小抑菌浓度分别为25μm、20μm、25μm、25μm;本发明中的抗菌肽dmhep_8cysv2重组多肽对大肠杆菌、链球菌、嗜水气单胞菌、爱德华氏菌以及金黄色葡萄球菌也都有明显的生长抑制作用,并且最小抑菌浓度分别为15μm、10μm、20μm、15μm以及15μm,两种抗菌肽均具有抗革兰氏阴性菌和革兰氏阳性菌的功能。在相同的接种条件下爱德华氏菌到达指数生长期需要的时间更长,并且dmhep_8cysv2重组多肽对其具有非常好的杀菌作用。本发明的南极鱼hepcidin抗菌肽浓度在最小抑菌浓度及以上时在37℃条件下,在1小时内能分别将100%的各种细菌杀死,表明其具有很强的抗菌功能,且抗菌效果和人类抗菌肽相比较具有显著的浓度以及杀菌强度优势,可作为抗生素的替代产品用于水产养殖中,不会对宿主造成伤害,也不会使细菌产生耐药性。附图说明图1为phis-tev原核表达载体的结构示意图。图2为抗菌肽dmhep_8cysv1和dmhep_8cyv2表达纯化后考马斯亮蓝染色。图3为抗菌肽dmhep_8cysv1和dmhep_8cyv2的特异性westernblot鉴定。图4为抗菌肽dmhep_8cyv1对多种细菌的生长抑制曲线。图5为抗菌肽dmhep_8cyv2对多种细菌的生长抑制曲线。具体实施方式下面通过实施例和对比例进一步说明本发明,这些实施例只是用于说明本发明,本发明不限于以下实施例。凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的范围,均应涵盖在本发明的保护范围中。实施例1制备抗菌肽dmhep_8cysv1和dmhep_8cyv2(1)抗菌肽基因cdna序列克隆及载体构建步骤如下:①cdna第一链合成利用trizol试剂提取鳞头犬牙南极鱼dissostichusmawsoni肝脏组织总rna,以此rna为模板,使用cdna第一链合成试剂盒反转录得到第一链cdna,具体步骤如下:a.每ep管在冰上依次加入:oligodtprimer1μl,dntpmixture1μl,totalrna1μg,补充rnasefreedh2o到总体积为10μl,缓慢混匀,65℃保温5min,使模板rna变性,提高反转录效率,然后取出ep管放置到冰上;b.在上述10μl体系ep管中依此加入:5xprimescriptⅱbuffer4μl,rnaseinhibitor0.5μl,primescriptⅱrtase1μl,补充rnasefreedh2o到总体积为20μl,缓慢混匀,42℃保温30min,95℃5min使酶失活,然后将得到的cdna保存在-20℃冰箱中。②抗菌肽dna序列pcr扩增根据hepcidin的成熟肽序列在其两端选取合适的序列设计引物,在上下游引物5’端分别加上载体phis-tev的ncoⅰ和xhoⅰ两端15bp,用做无缝连接(infusion)法连接两个线性片段时其两端的overlap区,序列如下:dmhep_8cysv1_ncoⅰ_f1(如seqidno:7所示):5’-tattttcagggcgcccagagccacctctccctgtg-3’;dmhep_8cysv1_xhoⅰ_r1(如seqidno:8所示):5’-gtggtggtgctcgagtcagaacctgcagcagaagc-3’;dmhep_8cysv2_ncoⅰ_f1(如seqidno:9所示):5’-tattttcagggcgcccgccgtcgcaagtgtaaattttg-3’;dmhep_8cysv2_xhoⅰ_r1(如seqidno:10所示):5’-gtggtggtgctcgagtcagaatctccttgtgcagc-3’;另外,在载体phis-tev的ncoⅰ和xhoⅰ序列两端设计引物用于载体部分的扩增,序列为:phis-tev-xhoⅰ-f(如seqidno:11所示):5’-ggcgccctgaaaatacaggtt-3’;phis-tev-ncoⅰ-r(如seqidno:12所示):5’-ctcgagcaccaccaccaccac-3’;用pcr的方法得到载体骨架phis-tevdna序列以及dmhep_8cyv1和dmhep_8cyv2编码序列,反应体系如下:primer0.5uleach(10um),2xphantmix10ul,cdna1ul,h2o8ul;反应程序为:预变性95℃,5min;变性95℃,30s,退火60℃,30s,延伸72℃,1-3min,34个循环;72℃,10min;12℃。得到的pcr产物进行核酸凝胶电泳,对分别符合预期5315bp、78bp、72bp条带进行切胶回收。③载体和目的片段无缝连接回收的pcr产物进行无缝连接,使用in-fusionhdcloningkit,反应体系为:插入片段50ng,载体骨架phis-tev100ng,5xin-fusionhdenzymepremix2μl,补充h2o到总体积为10μl,50℃保温15min。④连接产物转化a.取连接产物10μl,加到100μltop10感受态细胞悬液中,轻轻混匀,冰上放置30min;b.42℃水浴热激90s,静置,然后迅速取出置冰上冷却2min;c.加入800μl37℃预热的lb液体培养基(不含抗生素),混匀后37℃,220rpm,摇床培养1h,使细菌恢复正常生长状态;d.2000rpm离心5min,弃800μl上清,沉淀重悬后取适当菌液均匀涂布于含卡那抗生素的固体平板上倒置培养12~16h。⑤菌落pcr鉴定用无菌牙签从转化平板上挑取5个生长状态良好的单菌落,进行菌落pcr鉴定。将鉴定正确的单菌落,分别接种于含抗生素的5mllb液体培养基中,37℃,220rpm振荡培养4-6h后,送生工测序,选取序列正确的菌液样品进行扩大培养用于质粒提取。(2)抗菌肽dmhep_8cysv1和dmhep_8cysv2原核表达纯化及检测①重组质粒转化到bl21(de3)大肠杆菌表达型感受态菌株诱导表达a.取重组质粒各0.5μl,分别加到100μlbl21(de3)感受态中,轻轻混匀,冰上放置30min;b.42℃水浴热激90sec,静置,然后迅速取出置冰上冷却2min;c.加入800μl37℃预热的lb液体培养基(不含抗生素),混匀后37℃,220rpm,摇床培养1h,使细菌恢复正常生长状态;d.取50ul菌液均匀涂布于含卡那抗生素的板上倒置培养12~16h。e.用无菌牙签挑取两个单菌落,分别接种于5mllb液体培养基中(含50ug/ml的卡那霉素),37℃震荡培养至od=0.1。f.对照组不加诱导剂,实验组加入iptg至终浓度1mmol/l,18℃继续培养16h。②超声破菌a.5000rpm离心10min分别收集诱导表达后的菌液中的菌体,菌体用0.01mpbs(ph7.4)溶液重悬,重复洗涤2次,最后将菌体重悬在pbs溶液中;b.冰水浴下100w超声16min;c.4℃,5000rpm离心10min分别收集沉淀和上清,上清留样20μl加4xsdspageloading于95-100℃条件下加热变性10min,然后保存到-20℃下,留做sds-page电泳检测用;d.用无咪唑的8m尿素溶液重悬分散沉淀;e.冰水浴下100w超声10min,留样20μl同样加loading加热变性进行电泳检测;③sds-page凝胶蛋白电泳和考马斯亮蓝染色将样品和marker分别加入到15%的sds-page凝胶上样孔中,60v电泳3h至marker条带分离开。取出凝胶块放到去离子水中洗涤3次,每次5min,然后放到考马斯亮蓝染液中染色过夜。取出胶块用去离子水脱色至胶中空白处无色状态为止,然后对胶块进行拍照和分析,结果表明大肠杆菌表达的重组多肽存在于包涵体沉淀中。④hepcidin重组多肽原核表达纯化确定重组多肽表达后,用200ml的锥形瓶对菌液进行大量扩大培养,用来得到大量的纯化重组多肽。超声破碎的菌液沉淀经无咪唑的8m尿素溶液重悬分散沉淀,离心去除未溶解的物质,用0.22μm的滤膜对溶液进行过滤,然后过镍柱进行纯化,为使抗菌肽dmhep_8cysv1和dmhep_8cysv2便于纯化,可在其n端连接上如表1所示的标签。表1:标签的序列标签残基数目序列flag8dykddddkhis-tag6hhhhhh具体步骤如下:a.5ml去离子水洗柱,洗一次;b.5ml变性的washingbuffer平衡,平衡一次;c.上样,重复上样一次,收集穿透液并留样20μl电泳检测;d.5ml变性的washingbuffer洗涤柱子,收集洗涤液并留样20μl电泳检测;e.5ml变性的洗脱缓冲液洗脱蛋白,收集洗脱液并留样20μl电泳检测;f.5ml变性的洗脱缓冲液洗脱蛋白,收集洗脱液并留样20μl电泳检测;g.5ml去离子水洗柱,洗一次;h.5ml0.5mnaoh洗柱;i.5ml去离子水洗柱,洗三次;j.20%乙醇平衡柱子,并保存。k.穿透液、洗涤液和洗脱液放4℃冰箱保存,待电泳检测结果出来后,将含目的蛋白的洗脱液进行透析复性和超滤浓缩。若穿透液中还含有较多的目的蛋白,可作为样品进行第二次纯化。⑤蛋白透析复性表达在沉淀里的重组多肽,经ni柱纯化后,放入透析袋中,经过(6m、4m、3m、2m、1m、0m)梯度尿素缓冲液进行透析复性,每种梯度透析2h。透析缓冲液配方:5%甘油,1%l型精氨酸,0.1medta,尿素,使用1ⅹpbs溶解。⑥蛋白浓缩使用前先将浓缩管用超纯水涮洗三遍,然后在浓缩管内加入超纯水,3000rpm,离心10min,目的将滤膜彻底清洗干净。倒掉超纯水,加入待浓缩的重组多肽样品,3000rpm,离心,直至达到所需体积后停止离心,将浓缩后的重组多肽样品取出,进行电泳检测和浓度测定。浓缩管如同使用前用超纯水涮洗三遍,加入三蒸水,3000rpm,离心10min。最后加入20%乙醇,是滤膜浸泡在乙醇中,4℃保存。浓缩后的重组多肽经考马斯亮蓝染色显示纯化后的重组多肽中只有一条带,表明纯化后得到的是含有his标签的目的蛋白。⑦hepcidin重组蛋白特异性表达检测为了确定纯化后的单一条带蛋白是重组质粒过表达的产物,我们用蛋白特异性检测方法westernblot实验验证。由于重组多肽序列的n端存在histag标签序列,因此用6xhistag抗体可以对表达重组多肽进行特异性检测。weternblot实验步骤如下:a.将样品和marker分别加入到15%的sds-page凝胶上样孔中,60v电泳3h至marker条带分离开marker最下面的条带离玻璃板底部2-3cm的距离,取出凝胶块清洗干净,切掉空白以及不需要的部分胶体;b.剪取和凝胶快同样大小的0.2μm孔径的pvdf膜,放到甲醇溶液中浸泡1min,然后取出转膜夹,黑面朝下,白面朝上,往黑的那一面上放一块薄的双层滤纸,再依此放上胶块,pvdf膜和滤纸,确认膜和胶块中间没有气泡后将夹子夹上;c.然后将转膜夹放到转膜槽中,转膜夹的黑面对转膜槽的红色面,转膜夹的白色面对转膜槽的白色面,盖好盖子,在冰上或者4℃冰箱中给予80v40min的电压将胶上的蛋白转移到膜上;d.转膜结束后取出膜放到5%脱脂奶粉中室温封闭2h,或者4℃封闭过夜;e.不用洗膜直接将封闭的牛奶换成2%脱脂奶粉配置的6xhistag抗体溶液中,放在室温摇床上孵育2h;f.用1xtbst洗膜3次,每次5min;g.敷二抗,室温孵育1h;h.用1xtbst洗膜3次,每次5min;i.用ecl显影液进行显影,然后用成像仪进行拍照。结果表明,用6xhistag抗体杂到的带大小和纯化后的蛋白考马斯亮蓝染色显示出的蛋白条带大小一致,这表明纯化得到的重组多肽是转化到大肠杆菌中的重组质粒过表达产生的。实施例2重组多肽抗菌活性实验为了避免菌种污染,此实验在生物安全柜中进行,并且操作过程中使用的所有试剂耗材都是经过严格灭菌的,操作时也要避免带来污染的操作行为。①菌体的活化准备a.取冻存在-80℃的菌种,在37℃水浴下解冻,然后用接种环将菌种接种到新鲜无菌的lb培养板上,用封口膜封好培养皿,放置于37℃培养箱中培养14-16h;b.然后挑取外观与菌种特征相符合的菌落接种到新鲜的lb液体培养基中,37℃摇床,200rpm,培养14h;c.收集菌液于50ml离心管中,然后4℃2000rpm离心5min,弃去培养基;d.加入新鲜的pbs(ph7.4)重悬菌液,然后4℃2000rpm离心5min,去上清;e.重复洗涤菌液2次,然后去上清,加入预冷的新鲜lb液体培养基重悬菌体,使菌液浓度达到6x107/ml,放到冰上备用(因为在稍高的温度下菌会生长繁殖的较快,因此加样过程中菌液需要放在较低的温度下保存)。②重组多肽抑菌能力测定为了找到各种重组蛋白的最小抑菌浓度,我们用不同浓度的重组多肽和菌液共同孵育,通过菌的生长曲线判断抑菌效果,选择10μm、15μm、20μm和25μm四个不同浓度进行最小抑菌浓度测定。具体步骤如下:a.将均一的重组多肽分别用pbs稀释成20μm、30μm、40μm和50μm,放冰上备用;b.取未拆封的96孔透明板,每个孔中加入100ul稀释好的某种菌液,此时读取96孔板各孔中菌液在630nm波长的od值,记作-1h处的od值;c.然后分别向各孔加入100ul稀释好的一种重组多肽作为实验组,对照组加相同体积预冷的pbs,加样完毕后读取96孔板各孔中菌液在630nm波长的od值,记作0h处的od值;d.读数完毕后,迅速将96孔板放到37℃恒温培养箱中培养,每隔1h读一次96孔板各孔中菌液在630nm波长的od值;e.收集整理数据,根据读取的od值绘制细菌生长曲线。抑菌结果如表2所示,dmhep_8cysv重组多肽对大肠杆菌(e.coli)、链球菌(streptococcus)、嗜水气单胞菌(a.hydrophila)以及金黄色葡萄球菌(s.aureus)均有明显的生长抑制作用,并且最小抑菌浓度分别为25μm、20μm、25μm、25μm。其中金黄色葡萄球菌和链球菌属于格兰氏阳性菌,而大肠杆菌和嗜水气单胞菌属于革兰氏阴性菌。因此dmhep_8cysv1重组多肽既抗革兰氏阴性菌也抗革兰氏阳性菌。dmhep_8cysv2重组多肽对大肠杆菌、链球菌、嗜水气单胞菌、爱德华氏菌以及金黄色葡萄球菌均有明显的生长抑制作用,并且最小抑菌浓度分别为15μm、10μm、20μm、≤15μm以及15μm。爱德华氏菌属于革兰氏阴性菌。在相同的接种条件下爱德华氏菌到达指数生长期需要的时间更长,并且dmhep_8cysv2重组多肽对其具有非常好的杀菌作用。表2:两种变体hepcidin抗菌肽的最小抑菌浓度以上得到的最小抑菌浓度与人类hep25抗菌肽30μm的最小抑菌浓度相比较明显更低,说明本发明的两种重组多肽抗菌效果好,具有实际应用价值。上述对实施例的描述是为了便于该
技术领域:
的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。序列表<110>上海海洋大学<120>南极鱼hepcidin抗菌肽及其制备方法和应用<141>2020-07-03<160>12<170>siposequencelisting1.0<210>1<211>51<212>prt<213>artificialsequence<400>1metsertyrtyrhishishishishishisasptyraspileprothr151015thrgluasnleutyrpheglnglyalaglnserhisleuserleucys202530argtrpcyscysasncyscyslysglyasnlysglycysglyphecys354045cysargphe50<210>2<211>49<212>prt<213>artificialsequence<400>2metsertyrtyrhishishishishishisasptyraspileprothr151015thrgluasnleutyrpheglnglyalaargargarglyscyslysphe202530cyscysasncyscysserasnilecysglnthrcyscysthrargarg354045phe<210>3<211>26<212>prt<213>artificialsequence<400>3glnserhisleuserleucysargtrpcyscysasncyscyslysgly151015asnlysglycysglyphecyscysargphe2025<210>4<211>24<212>prt<213>artificialsequence<400>4argargarglyscyslysphecyscysasncyscysserasnilecys151015glnthrcyscysthrargargphe20<210>5<211>78<212>dna<213>artificialsequence<400>5cagagccacctctccctgtgccgctggtgctgcaactgctgcaagggcaacaagggctgc60ggcttctgctgcaggttc78<210>6<211>72<212>dna<213>artificialsequence<400>6cgccgtcgcaagtgtaaattttgctgcaactgctgcagcaacatctgtcaaacgtgctgc60acaaggagattc72<210>7<211>35<212>dna<213>artificialsequence<400>7tattttcagggcgcccagagccacctctccctgtg35<210>8<211>35<212>dna<213>artificialsequence<400>8gtggtggtgctcgagtcagaacctgcagcagaagc35<210>9<211>38<212>dna<213>artificialsequence<400>9tattttcagggcgcccgccgtcgcaagtgtaaattttg38<210>10<211>35<212>dna<213>artificialsequence<400>10gtggtggtgctcgagtcagaatctccttgtgcagc35<210>11<211>21<212>dna<213>artificialsequence<400>11ggcgccctgaaaatacaggtt21<210>12<211>21<212>dna<213>artificialsequence<400>12ctcgagcaccaccaccaccac21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1