用于递送治疗剂的脂质和组合物的制作方法
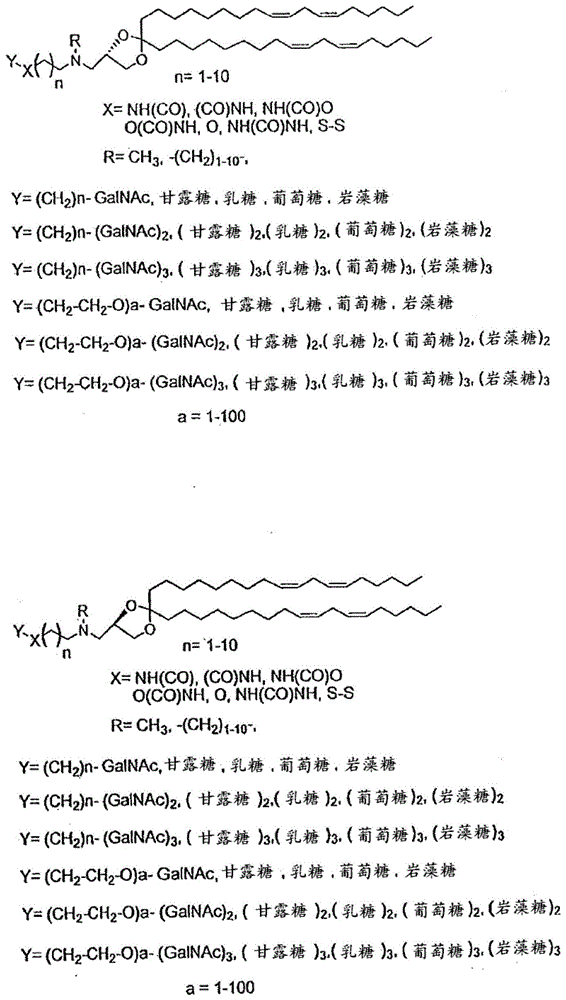
本申请是申请日为2009年11月10日,分案提交日为2015年6月23日,申请号为201510351267.x,发明名称为“用于递送治疗剂的脂质和组合物”的发明专利申请的分案申请。优先权声明本申请要求于2008年11月10日提交的u.s.s.n.61/113,179、2009年2月20日提交的u.s.s.n.61/154,350、2009年4月21日提交的u.s.s.n.61/171,439、2009年6月9日提交的u.s.s.n.61/185,438、2009年7月15日提交的u.s.s.n.61/225,898和2009年8月14日提交的u.s.s.n.61/234,098的优先权,上述每一者的内容通过引用而整体并入本文。政府支持本文中描述的工作至少部分是使用由美国国立过敏和传染病研究所给予的基金号为hhsn266200600012c的美国政府的资金进行的。因此,政府可具有本发明的某些权利。
背景技术:
:本发明涉及使用脂质颗粒的治疗剂递送领域。具体地,本发明提供了有利于体内递送核酸的阳离子脂质和包含此类脂质的脂质颗粒,以及适合于体内治疗用途的核酸-脂质颗粒组合物。此外,本发明提供了制备此类组合物的方法以及使用此类组合物将核酸引入细胞的方法,例如以用于治疗各种疾病状况。相关技术描述治疗性核酸包括,例如小型干扰rna(sirna)、微rna(mirna)、反义寡核苷酸、核酶、质粒、免疫刺激性核酸、反义物(antisense)、antagomir、antimir、微rna模拟物、supermir、u1衔接子和适体。此类核酸通过多种机制起作用。在sirna或mirna的情况下,此类核酸可通过称为rna干扰(rnai)的方法下调特定蛋白质的细胞内水平。在将sirna或mirna引入细胞质后,此类双链rna构建体可结合称为risc的蛋白质。sirna或mirna的有义链从risc复合体被移走,从而在risc内提供了可识别并结合具有针对结合的sirna或mirna的序列的互补序列的mrna的模板。在结合互补mrna后,risc复合体切割mrna并且释放切割的链。rnai可通过相应的编码蛋白质合成的mrna的靶向特异性破坏来提供特定蛋白质的下调。rnai的治疗应用极其广泛,因为可用针对靶蛋白的任意核苷酸序列来合成sirna和mirna构建体。迄今为止,sirna构建体已在体外和体内模型中显示出特异性下调靶蛋白的能力。此外,目前正在临床研究中评估sirna构建体。然而,目前sirna或mirna构建体面临的两个问题是,第一,其对血浆中的核酸酶消化的易感性和,第二,当作为游离sirna或mirna全身性施用时,其进入可在其中结合risc的细胞内区室的能力有限。可通过在分子内掺入经化学修饰的核苷酸连接体,例如硫代磷酸酯基团来稳定此类双链构建体。然而,此类化学修饰只提供有限的防核酸酶消化保护作用并且可减少构建体的活性。可通过使用载体系统诸如聚合物、阳离子脂质体或通过化学修饰构建体(例如通过共价连接胆固醇分子),来促进sirna或mirna的细胞内递送。然而,需要改进的递送系统来增加sirna和mirna分子的潜能以及减少或消除对化学修饰的需要。反义寡核苷酸和核酶也可抑制mrna翻译成蛋白。在反义构建体的情况下,此类单链脱氧核酸具有靶蛋白mrna的序列的互补序列并且可通过watson-crick碱基配对结合所述mrna。该结合阻止靶mrna的翻译和/或触发所述mrna转录物的rna酶h降解。因此,反义寡核苷酸具有起特异性作用(即,特定疾病相关蛋白的下调)的巨大潜能。迄今为止,此类化合物已在若干体外和体内模型(包括炎性疾病、癌症和hiv的模型)中显示了前景(综述于agrawal,trendsinbiotech.14:376-387(1996)中)。反义还可通过与染色体dna的特异性杂交来影响细胞活性。目前正在进行数种反义药物的人高级临床评估。此类药物的靶包括bcl2和载脂蛋白b基因及mrna产物。免疫刺激性核酸包括脱氧核糖核酸和核糖核酸。在脱氧核糖核酸的情况下,已显示某些序列或基序在哺乳动物中引发(illicit)免疫刺激。此类序列或基序包括cpg基序、富含嘧啶的序列和回文序列。脱氧核糖核酸中的cpg基序据认为被内体受体toll样受体9(tlr-9)特异性识别,然后该受体触发先天性免疫和获得性免疫刺激途径。还报导了某些免疫刺激核糖核酸序列。此类rna序列据认为通过结合toll-样受体6和7(tlr-6和tlr-7)来触发免疫激活。此外,也报导了双链rna具有免疫刺激性并且据认为其通过与tlr-3结合而被活化。关于治疗性核酸的使用的一个众所周知的问题涉及磷酸二酯核苷酸间键合的稳定性和该连接体对核酸酶的易感性。血清中外切核酸酶和内切核酸酶的存在导致具有磷酸二酯连接体的核酸的快速消化,从而治疗性核酸在血清存在的情况下或在细胞中可具有极短的半衰期。(zelphati,o.等人,antisense.res.dev.3:323-338(1993);和thierry,a.r.,等人,《generegulation:biologyofantisensernaanddna》(erickson,rp和izant,jg编辑;ravenpress,ny(1992)的第147-161页)。由于这些和其它已知的问题,目前正在研发的治疗性核酸不使用在天然核酸中发现的基本磷酸二酯化学。该问题已通过减少血清或细胞内降解的化学修饰得到部分克服。已测试了核苷酸间磷酸二酯桥(例如,使用硫代硫酸酯、甲基膦酸酯或氨基磷酸酯键)、核苷酸碱基(例如,5-丙炔基-嘧啶类)或糖(例如,2’-修饰的糖)上的修饰(uhlmanne.等人antisense:chemicalmodifications.encyclopediaofcancer,第x卷,第64-81页academicpressinc.(1997))。其它研究人员已尝试使用2’-5’糖键提高稳定性(参见,例如美国专利no.5,532,130)。已尝试了其它变化。然而,已证明这些溶液中没有一种完全令人满意,并且体内游离治疗性核酸仍然只具有有限的效力。此外,如上所述涉及的sirna和mirna,问题归于治疗性核酸穿过细胞膜的能力有限(参见,vlassov等人,biochim.biophys.acta1197:95-1082(1994))和在于与全身性毒性相关的问题,诸如补体介导的过敏反应、改变的凝固特征和血细胞减少(galbraith等人,antisensenucl.aciddrugdes.4:201-206(1994))。为了尝试提高效力,研究人员也已使用基于脂质的载体系统递送化学修饰或未修饰的治疗性核酸。在zelphati,o和szoka,f.c.,j.contr.rel.41:99-119(1996)中,作者提到阴离子(常规)脂质体、ph敏感性脂质体、免疫脂质体、融合脂质体和阳离子脂质/反义聚集体的使用。类似地,将sirna于阳离子脂质体中全身性施用,已报导此类核酸-脂质颗粒在哺乳动物(包括非人灵长类动物)中提高了靶蛋白的下调(zimmermann等人,nature441:111-114(2006))。尽管取得该进步,但本领域仍然需要适合于一般性治疗用途的改良的脂质-治疗性核酸组合物。优选地,此类组合物可以以高效率封装核酸,具有高药物:脂质比,保护封装的核酸在血清中免受降解和清除,适合于全身性递送以及提供封装的核酸的细胞内递送。此外,此类脂质-核酸颗粒应当具有良好的耐受性并且提供足够的治疗指数,以便以有效剂量的核酸进行的患者治疗不伴随针对患者的显著的毒性和/或风险。本发明提供了此类组合物,制备所述组合物的方法和使用所述组合物将核酸引入细胞(包括用于治疗疾病)的方法。技术实现要素:本发明提供了新型阳离子脂质以及包含所述阳离子脂质的脂质颗粒。此类脂质颗粒还可包含活性剂并且按照本发明的相关方法用于将所述活性剂递送至细胞。在一个方面,本发明提供了脂质和其相应的盐和其异构体,其具有如下结构:其中:r1和r2的每一次出现各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或–连接体-配体;r3为氢、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基、烷基杂环、烷基磷酸酯、烷基硫代磷酸酯、烷基二硫代磷酸酯、烷基膦酸酯、烷基胺、羟烷基、ω-氨烷基,ω-(取代的)氨烷基,ω-磷酸烷基、ω-硫代磷酸烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、杂芳基、杂环或连接体-配体;e为o、s、n(q)、c(o)、n(q)c(o)、c(o)n(q)、(q)n(co)o、o(co)n(q)、s(o)、ns(o)2n(q)、s(o)2、n(q)s(o)2、ss、o=n、芳基、杂芳基、环或杂环;以及,q为氢、烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基。在另一个方面,本发明提供了包含本发明的脂质的脂质颗粒。在某些实施方案中,脂质颗粒还包含中性脂质和能够减少颗粒聚集的脂质。在一个实施方案中,脂质颗粒主要由以下组成:(i)至少一种本发明的脂质;(ii)选自dspc、dppc、popc、dope和sm的中性脂质;(iii)固醇,例如胆固醇;和(iv)peg-脂质,例如peg-dmg或peg-dma,以约20-60%阳离子脂质:5-25%中性脂质:25-55%固醇:0.5-15%peg-脂质的摩尔比。在一个实施方案中,本发明的脂质是光学纯的。在另外的相关实施方案中,本发明包括本发明的脂质颗粒,该脂质颗粒还包含治疗剂。在一个实施方案中,所述治疗剂是核酸。在一个实施方案中,所述核酸是质粒、免疫刺激性寡核苷酸、单链寡核苷酸(例如反义寡核苷酸、antagomir)、双链寡核苷酸(例如sirna)、适体或核酶。在另一个相关的实施方案中,本发明包括含有本发明的脂质颗粒和药学上可接受的赋形剂、载体或稀释剂的药物组合物。在其它相关的实施方案中,本发明还包括调节细胞中靶基因的表达的方法,所述方法包括给细胞提供本发明的脂质颗粒或药物组合物。靶基因可以是野生型基因。在另一个实施方案中,靶基因包含一个或多个突变。在特定的实施方案中,所述方法包括特异性调节包含一个或多个突变的靶基因的表达。在特定的实施方案中,脂质颗粒包含选自免疫刺激性寡核苷酸、单链寡核苷酸(例如反义寡核苷酸、antagomir)、双链寡核苷酸(例如sirna)、适体、核酶的治疗剂。在一个实施方案中,所述核酸是编码sirna、反义寡核苷酸、适体或核酶的质粒。在本发明的一个方面,靶基因选自因子vii、eg5、pcsk9、tpx2、apob、saa、ttr、rsv、pdgfβ基因、erb-b基因、src基因、crk基因、grb2基因、ras基因、mekk基因、jnk基因、raf基因、erk1/2基因、pcna(p21)基因、myb基因、jun基因、fos基因、bcl-2基因、细胞周期蛋白d基因、vegf基因、egfr基因、细胞周期蛋白a基因、细胞周期蛋白e基因、wnt-1基因、β-连环蛋白基因、c-met基因、pkc基因、nfkb基因、stat3基因、存活素基因、her2/neu基因、sort1基因、xbp1基因、拓扑异构酶i基因、拓扑异构酶iiα基因、p73基因、p21(waf1/cip1)基因、p27(kip1)基因、ppm1d基因、ras基因、小窝蛋白i基因、mibi基因、mtai基因、m68基因、肿瘤抑制基因中的突变、p53肿瘤抑制基因和其组合。在另一个实施方案中,所述核酸是对多核苷酸或其功能变体或片段编码的质粒,使得所述多肽或其功能变体或片段的表达增加。在其它相关的实施方案中,本发明包括治疗特征在于受治疗者中多肽的过表达的疾病或紊乱的方法,所述方法包括给受治疗者提供本发明的脂质颗粒或药物组合物,其中所述治疗剂选自sirna、微rna、反义寡核苷酸和能够表达sirna、微rna或反义寡核苷酸的质粒,并且其中所述sirna、微rna或反义rna包含与编码多肽的多核苷酸特异性结合的多核苷酸或其互补序列。在另一个相关实施方案中,本发明包括治疗特征在于受治疗者中多肽的表达不足的疾病或紊乱的方法,所述方法包括给受治疗者提供本发明的药物组合物,其中所述治疗剂是对多肽或其功能变体或片段编码的质粒。在另一个实施方案中,本发明包括诱导受治疗者的免疫应答的方法,所述方法包括给受治疗者提供本发明的药物组合物,其中治疗剂是免疫刺激性寡核苷酸。在特定的实施方案中,将药物组合物与疫苗或抗原组合提供给患者。在相关实施方案中,本发明包括疫苗,所述疫苗包含本发明的脂质颗粒和与疾病或病原体关联的抗原。在一个实施方案中,脂质颗粒包含免疫刺激性核酸或寡核苷酸。在特定的实施方案中,抗原是肿瘤抗原。在另一个实施方案中,抗原是病毒抗原、细菌抗原或寄生虫抗原。本发明还包括制备本发明的脂质颗粒和药物组合物的方法以及用于制备此类脂质颗粒和药物组合物的试剂盒。在另一个方面,本发明提供了评估包括试剂(例如治疗剂或诊断剂)和本发明的脂质的组合物的方法。附图说明图1为具有共轭的靶向配体的光学纯脂质的示意图。图2为本发明的脂质的特征的示意图。图3为举例说明被施以0.05或0.005mg/kg包含不同阳离子脂质的脂质颗粒的动物中相对的fvii蛋白水平的图。图4为描述使用实施例中描述的方法进行测试的示例性脂质的ec50和pka值的表。具体实施方式本发明部分地基于阳离子脂质的发现,所述阳离子脂质当以脂质颗粒形式用于体内递送治疗剂时提供优势。具体地,如由所附实施例举例说明的,本发明提供了包含根据本发明的阳离子脂质的核酸-脂质颗粒组合物。在一些实施方案中,本文中描述的组合物提供了增加的核酸活性和/或提高的组合物体内耐受性,这可导致与之前描述的脂质-核酸颗粒组合物相比较治疗指数的显著增加。此外,公开了可提供对于某些治疗性核酸-脂质颗粒观察到的毒性改善的组合物和使用方法。在某些实施方案中,本发明特别地提供了用于递送sirna分子的改良的组合物。本文中显示此类组合物在下调蛋靶蛋白的蛋白质水平和/或mrna水平上是有效的。此外,经显示,此类改良的组合物的活性依赖于某些阳离子脂质的存在以及制剂中阳离子脂质的摩尔比可影响活性。本发明的脂质颗粒和组合物可用于多种目的,包括将缔合或封装的治疗剂体外和体内地递送至细胞。因此,本发明提供了通过将需要进行治疗的受治疗者与与适当治疗剂缔合的本发明的脂质颗粒相接触来治疗所述受治疗者的疾病或紊乱的方法。如本文中所描述的,本发明的脂质颗粒特别用于递送核酸(包括,例如sirna分子和质粒)。因此,本发明的脂质颗粒和组合物可用于通过将细胞与与核酸缔合的本发明的脂质颗粒相接触来在体外和体内调节靶基因和蛋白质的表达,所述核酸减少靶基因的表达(例如,sirna)或可用于增加期望的蛋白质的表达(例如,编码所述期望的蛋白质的质粒)。在下文中更详细地描述了本发明的阳离子脂质、以及包含所述阳离子脂质的脂质颗粒和组合物及其递送治疗剂和调节基因及蛋白质表达的用途的不同示例性实施方案。脂质本发明提供了具有某些设计特征的新型脂质。如图2中所显示的,脂质设计特征包括如下的至少一个特征:具有不同pka的头部基团,阳离子1°、2°和3°单胺、二胺和三胺、寡胺/多胺,低pka头部基团–咪唑类和吡啶、胍盐;阴离子性、两性离子性和疏水性尾部可包括对称和/或不对称链、长链和更短的链、饱和链和不饱和链;主链包括主链甘油酯和其它无环类似物,与醚、酯、磷酸酯及类似物、磺酸酯和类似物形成的环、螺环、二环和多环键,二硫化物,ph敏感性键如缩醛类和缩酮类、亚胺类和腙类以及肟类。在一个实施方案中,脂质具有如下结构之一或其盐或异构体:其中:r1和r2在每一次出现时各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或–连接体-配体;r3在每一次出现时独立地为h、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基,烷基杂环、烷基磷酸酯、烷基硫代磷酸酯、烷基二硫代磷酸酯、烷基膦酸酯、烷基胺、羟烷基、ω-氨烷基,ω-(取代的)氨烷基,ω-磷酸烷基、ω-硫代磷酸烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、杂芳基、杂环或连接体-配体;x和y各自独立地为o、s、烷基或n(q);q1在每一次出现时独立地为o或s;q2在每一次出现时独立地为o、s、n(q)、烷基或烷氧基;a1、a2、a4和a5各自独立地为o、s、ch2、chf或cf2;以及i和j为0-10。在一个实施方案中,x和y可以独立地为(co)、o(co)、o(co)n、n(co)o、(co)o、o(co)o、磺酸盐或磷酸盐。已发现,包含不饱和烷基链的阳离子脂质对于形成具有增加的膜流动性的脂质核酸颗粒是特别有用的。在一个实施方案中,r1或r2中的至少一个包含至少一个、至少两个或至少三个不饱和位置,例如双键或三键。在一个实施方案中,r1或r2中只有一个包含至少一个、至少两个或至少三个不饱和位置。在一个实施方案中,r1和r2都包含至少一个、至少两个或至少三个不饱和位置。在一个实施方案中,r1和r2包含不同的不饱和数目,例如,r1和r2之一具有一个不饱和位置并且另一个具有两个或三个不饱和位置。在一个实施方案中,r1和r2都包含相同的不饱和位置数目。在一个实施方案中,r1和r2包含不同的不饱和类型,例如r1和r2之一中的不饱和是双键并且另一个不饱和是三键。在一个实施方案中,r1和r2都包含相同的不饱和类型,例如双键或三键。在一个实施方案中,r1或r2中的至少一个包含至少一个双键和至少一个三键。在一个实施方案中,r1或r2中只有一个包含至少一个双键和至少一个三键。在一个实施方案中,r1和r2都包含至少一个双键和至少一个三键。在一个实施方案中,r1和r2都相同,例如r1和r2都为亚油酰基(c18)或r1和r2都为十七烷基-9-烯基。在一个实施方案中,r1和r2彼此不同。在一个实施方案中,r1和r2的至少一个为胆固醇。在一个实施方案中,r1和r2之一为–连接体-配体。在一个实施方案中,r1和r2之一为–连接体-配体并且配体是亲脂性的。在一个实施方案中,r1或r2中的至少一个包含至少一个其中一个或两个h被f取代的ch2,例如chf或cf2。在一个实施方案中,r1和r2都包含至少一个其中一个或两个h被f取代的ch2基团,例如chf或cf2。在一个实施方案中,r1和r2中只有一个包含至少一个其中一个或两个h被f取代的ch2基团。在一个实施方案中,r1或r2中的至少一个以ch2f、chf2或cf3终止。在一个实施方案中,r1和r2都以ch2f、chf2或cf3终止。在一个实施方案中,r1或r2中的至少一个为–(cf2)y-z”-(ch2)y-ch3,其中每一个y独立地为1-10并且z”为o、s或n(q)。在一个实施方案中,r1和r2都为–(cf2)y-z”-(ch2)y-ch3,其中每一个y独立地为1-10并且z”为o、s或n(q)。在一个实施方案中,r1或r2的至少一个为–(ch2)y-z”-(cf2)y-cf3,其中每一个y独立地为1-10并且z”为o、s或n(q)。在一个实施方案中,r1和r2都为–(ch2)y-z”-(cf2)y-cf3,其中每一个y独立地为1-10并且z”为o、s或n(q)。在一个实施方案中,r1或r2的至少一个为–(cf2)y-(cf2)y-cf3,其中每一个y独立地为1-10。在一个实施方案中,r1和r2都为–(cf2)y-(cf2)y-cf3,其中每一个y独立地为1-10。在一个实施方案中,r3选自甲基、乙基、多胺、-(ch2)h-杂芳基、-(ch2)h-n(q)2、-o-n(q)2、-(ch2)h-z’-(ch2)h-杂芳基、连接体-配体、-(ch2)h-杂环和-(ch2)h-z”-(ch2)h-杂环,其中每一个h独立地为0-13并且z”为o、s或n(q)。在一个实施方案中,配体是融合肽。在一个实施方案中,脂质为外消旋混合物。在一个实施方案中,将脂质富集在一个非对映体中,例如,脂质具有至少95%、至少90%、至少80%或至少70%的非对映体过量。在一个实施方案中,将脂质富集于一种对映体中,例如脂质具有至少95%、至少90%、至少80%或至少70%的对映体过量。在一个实施方案中,脂质是手性纯的,例如是单一旋光异构体。在一个实施方案中,脂质富集于一种旋光异构体中。在双键存在的情况下(例如,碳-碳双键或碳-氮双键),在关于双键的构型中可存在异构现象(即顺/反或e/z异构现象)。当以化学结构举例说明双键的构型时,要理解相应的异构体也可存在。存在的异构体的量可以变化,取决于异构体的相对稳定性和异构体之间转化所需的能量。因此,为了实际目的,一些双键只以单一构型存在,然而其它双键(例如,在相对稳定性相似并且转化能量较低的情况下)可以作为构型的不可分的平衡混合物存在。在一个方面,脂质是式xxxiii的化合物或其盐或异构物,其中:r1和r2在每一次出现时各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或–连接体-配体;r3为氢、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基、烷基杂环、烷基磷酸酯、烷基硫代磷酸酯、烷基二硫代磷酸酯、烷基膦酸酯、烷基胺、羟烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基、ω-硫代磷酸烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、杂芳基、杂环或连接体-配体;e为o、s、n(q)、c(o)、n(q)c(o)、c(o)n(q)、(q)n(co)o、o(co)n(q)、s(o)、ns(o)2n(q)、s(o)2、n(q)s(o)2、ss、o=n、芳基、杂芳基、环或杂环;以及,q为h、烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基。在一个实施方案中,r1和r2在每一次出现时各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30烷氧基、任选取代的c10-c30烯基、任选取代的c10-c30烯氧基、任选取代的c10-c30炔基、任选取代的c10-c30炔氧基或任选取代的c10-c30酰基。在另一个实施方案中,r3为h、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基、任选取代的烷基杂环、任选取代的杂环烷基、任选取代的烷基磷酸酯、任选取代的磷酸烷基、任选取代的烷基硫代磷酸酯、任选取代的磷酸硫代烷基、任选取代的烷基二硫代磷酸酯、任选取代的磷酸二硫代烷基、任选取代的烷基膦酸酯、任选取代的膦酰基烷基、任选取代的氨基、任选取代的烷基氨基、任选取代的二(烷基)氨基、任选取代的氨烷基、任选取代的烷基氨烷基、任选取代的二(烷基)氨烷基、任选取代的羟烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、任选取代的杂芳基、任选取代的杂环或连接体-配体。在另一个实施方案中,e为-o-、-s-、-n(q)-、-c(o)-、-n(q)c(o)-、-c(o)n(q)-、-n(q)c(o)o-、-oc(o)n(q)-、s(o)、-n(q)s(o)2n(q)-、-s(o)2-、-n(q)s(o)2-、-ss-、-o-n=、=n-o-、-c(o)-n(q)-n=、-n(q)-n=、-n(q)-o-、-c(o)s-、亚芳基、亚杂芳基、亚环烷基或亚杂环基;以及q为h、烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基。在另一个实施方案中,脂质是式xxxiii的化合物,其中e为o、s、n(q)、c(o)、n(q)c(o)、c(o)n(q)、(q)n(co)o、o(co)n(q)、s(o)、ns(o)2n(q)、s(o)2、n(q)s(o)2、ss、o=n、芳基、杂芳基、环或杂环。在一个实施方案中,脂质是式xxxiii的化合物,其中r3为氢、任选取代的c2-c10烯基、任选取代的c2-c10炔基、烷基杂环、烷基磷酸酯、烷基硫代磷酸酯、烷基二硫代磷酸酯、烷基膦酸酯、烷基胺、羟烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基、ω-硫代磷酸烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、杂芳基、杂环或连接体-配体。在另一个实施方案中,脂质是式xxxiii的化合物,其中r1和r2在每一次出现时各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或–连接体-配体。在一个实施方案中,本发明特征为式xxxviii的脂质或其盐或异构体:其中e为o、s、n(q)、c(o)、n(q)c(o)、c(o)n(q)、(q)n(co)o、o(co)n(q)、s(o)、ns(o)2n(q)、s(o)2、n(q)s(o)2、ss、o=n、芳基、杂芳基、环或杂环;q为氢、烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基;r1和r2以及rx在每一次出现时各自独立地为h、任选取代的c1-c10烷基、任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或连接体-配体,条件是r1、r2和rx的至少一个不为h;r3为氢、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基、烷基杂环、烷基磷酸酯、烷基硫代磷酸酯、烷基二硫代磷酸酯、烷基膦酸酯、烷基胺、羟烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基、ω-硫代磷酸烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、杂芳基、杂环或连接体-配体;以及n为0、1、2或3。在一些实施方案中,r1和r2中的每一个在每一次出现时各独立地为任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或连接体-配体。在一些实施方案中,rx为氢或任选取代的c1-c10烷基。在一些实施方案中,rx为任选取代的c10-c30烷基、任选取代的c10-c30烯基、任选取代的c10-c30炔基、任选取代的c10-c30酰基或连接体-配体。在一个实施方案中,r1和r2在每一次出现时各自独立地为任选取代的c10-c30烷基、任选取代的c10-c30烷氧基、任选取代的c10-c30烯基、任选取代的c10-c30烯氧基、任选取代的c10-c30炔基、任选取代的c10-c30炔氧基,或任选取代的c10-c30酰基或–连接体-配体。在一个实施方案中,r3在每一次出现时独立地为h、任选取代的c1-c10烷基、任选取代的c2-c10烯基、任选取代的c2-c10炔基、任选取代的烷基杂环、任选取代的杂环烷基、任选取代的烷基磷酸酯、任选取代的磷酸烷基、任选取代的烷基硫代磷酸酯、任选取代的磷酸硫代烷基(phosphorothioalkyl)、任选取代的烷基二硫代磷酸酯、任选取代的磷酸二硫代烷基、任选取代的烷基膦酸酯、任选取代的膦酰基烷基、任选取代的氨基、任选取代的烷氨基、任选取代的二(烷基)氨基、任选取代的氨烷基、任选取代的烷氨基烷基、任选取代的二(烷基)氨烷基、任选取代的羟烷基、任选取代的聚乙二醇(peg,mw100-40k)、任选取代的mpeg(mw120-40k)、任选取代的杂芳基、或任选取代的杂环或连接体-配体。在一个实施方案中,x和y各自独立地为-o-、-s-、烯基、-n(q)-、-c(o)-、-o(co)-、-oc(o)n(q)-、-n(q)c(o)o-、-c(o)o、-oc(o)o-、-os(o)(q2)o-或-op(o)(q2)o-。在一个实施方案中,q为氢、烷基、ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基。在一个实施方案中,q1在每一次出现时独立地为o或s。在一个实施方案中,q2在每一次出现时独立地为o、s、n(q)(q)、烷基或烷氧基。在一个实施方案中,a1、a2、a4和a5各自独立地为-o-、-s-、-ch2-、-chr5-、-cr5r5-、-chf-或-cf2-。在一个实施方案中,e为-o-、-s-、-n(q)-、-c(o)-、-c(o)n(q)-、-n(q)c(o)-、-s(o)-、-s(o)2-、-ss-、-o-n=、=n-o-、亚芳基、亚杂芳基、亚环烷基或亚杂环基。在一个实施方案中,i和j各自独立地为0-10。在一些情况中,r3为ω-氨烷基、ω-(取代的)氨烷基、ω-磷酸烷基或ω-硫代磷酸烷基;它们中的每一个被任选取代。ω-(取代的)氨烷基的实例包括2-(二甲氨基)乙基、3-(二异丙基氨基)丙基或3-(n-乙基-n-异丙基氨基)-1-甲基丙基。在一个实施方案中,x和y可独立地为-o-、-s-、烯基或-n(q)-。在一个实施方案中,阳离子脂质选自下列表1中所示的脂质。表1:本发明的一些阳离子脂质。虽然未显示脂质的所有非对映异构体,但本发明的一个方面是提供所有非对映异构体,这样手性纯的和非对映体富集的脂质也是本发明的部分。在一个实施方案中,r3为–连接体-配体。在特定的实施方案中,本发明的脂质为阳离子脂质。如本文中所使用的,术语“阳离子脂质”意指具有一个或两个脂肪酸或脂肪烷基链及氨基头部基团(包括烷氨基或二烷氨基)的那些脂质,所述脂质在生理ph下可被质子化以形成阳离子脂质。在一些实施方案中,阳离子脂质称为“氨基脂质”。其它阳离子脂质可包括具有可选的脂肪酸基团和其它二烷基氨基的脂质,包括其中烷基取代基不同的烷氨基(例如,n-乙基-n-甲氨基-、n-丙基-n-乙氨基-等)。对于其中r1和r2都为长链烷基或酰基的那些实施方案,它们可以是相同的或不同的。一般而言,为了过滤灭菌,具有更少的饱和酰基链的脂质(例如,阳离子脂质)更容易按大小分级,特别是当在约0.3微米以下对复合物按大小分级时。包含具有c10至c20范围内的碳链长度的不饱和脂肪酸的阳离子脂质是典型的。也可使用其它支架来分隔阳离子脂质的氨基(例如,阳离子脂质的氨基)与脂肪酸或脂肪烷基部分。适当的支架对于本领域技术人员来说是已知的。在某些实施方案中,本发明的阳离子脂质具有至少一个可质子化或可去质子化的基团,以便脂质在处于或低于生理ph(例如,ph7.4)下的ph下带正电荷,并且在第二ph下,优选在生理ph下或高于生理ph下是中性的。此类脂质也称为阳离子脂质。当然要理解,作为ph的函数的质子的添加或去除是平衡过程,并且带电荷的或中性的脂质是指占优势的种类的性质并且不需要全部脂质以带电荷或中性的形式存在。具有超过一个可质子化或去质子化的基团或为两性离子性的脂质不排除用于本发明。在某些实施方案中,根据本发明的可质子化的脂质(即,阳离子脂质)具有在约4至约11的范围内的可质子化基团的pka。通常,脂质,当被掺入脂质颗粒时,具有约4至约7,例如,约5至7之间,例如约5.5至6.8之间的pka。此类脂质在更低的ph配制阶段是阳离子性的,然而颗粒的大部分(虽然不是完全地)表面在约ph7.4的生理ph下被中和。在约4至7之间的范围内的pka的益处之一是至少一些与颗粒外表面缔合的核酸将在生理ph下失去其静电相互作用,并且可通过简单透析除去;因而大大降低了颗粒对清除的易感性。例如,可以通过使用cullis等人,(1986)chemphyslipids40,127-144中描述的方法,利用荧光探针2-(对-甲苯氨基)-6-萘磺酸(tns)进行脂质颗粒内脂质的pka测量。在一个实施方案中,本发明的制剂被捕获至少75%、至少80%或至少90%。在一个实施方案中,本发明的制剂还包含载脂蛋白。如本文中所使用的,术语“载脂蛋白”或“脂蛋白”是指本领域技术人员已知的载脂蛋白及其变体和片段以及指下文中描述的载脂蛋白激动剂、其类似物或片段。适当的载脂蛋白包括但不限于apoa-i、apoa-ii、apoa-iv、apoa-v和apoe以及其活性多晶型物、同种型、变体和突变体及片段或截短形式。在某些实施方案中,载脂蛋白是含巯基的载脂蛋白。“含巯基载脂蛋白”是指包含至少一个半胱氨酸残基的载脂蛋白、变体、片段或同种型。最常见的含巯基载脂蛋白是apoa-imilano(apoa-im)和apoa-iparis(apoa-ip),其包含一个半胱氨酸残基(jia等人,2002,biochem.biophys.res.comm.297:206-13;bielicki和oda,2002,biochemistry41:2089-96)。apoa-ii、apoe2和apoe3也是含巯基载脂蛋白。分离的apoe和/或其活性片段和多肽类似物,包括其重组产生的形式,描述于美国专利no.5,672,685;5,525,472;5,473,039;5,182,364;5,177,189;5,168,045;5,116,739;这些专利的公开内容通过引用并入本文。apoe3公开于weisgraber等人,“humaneapoproteinheterogeneity:cysteine-arginineinterchangesintheaminoacidsequenceoftheapo-eisoforms”,j.biol.chem.(1981)256:9077-9083;和rall,等人,“structuralbasisforreceptorbindingheterogeneityofapolipoproteinefromtypeiiihyperlipoproteinemicsubjects”,proc.nat.acad.sci.(1982)79:4696-4700中。也参见genbank登录号k00396。在某些实施方案中,载脂蛋白可以其成熟形式、以其前载脂蛋白原(preproapolipoprotein)形式或以其载脂蛋白原形式存在。也可在本发明的范围内利用apoa-i原和成熟apoa-i(duverger等人,1996,arterioscler.thromb.vasc.biol.16(12):1424-29)、apoa-imilano(klon等人,2000,biophys.j.79:(3)1679-87;franceschini等人,1985,j.biol.chem.260:1632-35)、apoa-iparis(daum等人,1999,j.mol.med.77:614-22)、apoa-ii(shelness等人,1985,j.biol.chem.260(14):8637-46;shelness等人,1984,j.biol.chem.259(15):9929-35)、apoa-iv(duverger等人,1991,euro.j.biochem.201(2):373-83)和apoe(mclean等人,1983,j.biol.chem.258(14):8993-9000)的同二聚体和异二聚体(当可行时)。在某些实施方案中,载脂蛋白可以是载脂蛋白的片段、变体或同种型。术语“片段”是指具有比天然载脂蛋白的氨基酸序列更短的氨基酸序列并且其片段保持天然载脂蛋白的活性(包括脂质结合性质)的任意载脂蛋白。所谓“变体”意指载脂蛋白的氨基酸序列的置换或改变,所述置换或改变,例如氨基酸残基的添加和缺失不会消除天然载脂蛋白的活性,包括脂质结合性质。因此,变体可包含具有与本文中提供的天然载脂蛋白大体上相同的氨基酸序列的蛋白质或肽,其中一个或多个氨基酸已用化学上相似的氨基酸保守置换。保守置换的实例包括用至少一个疏水性残基,诸如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸置换另一个。同样地,本发明涵盖,例如至少一个亲水性残基的置换,诸如,例如精氨酸与赖氨酸之间、谷氨酰胺与天冬酰胺之间、甘氨酸与丝氨酸之间的置换(参见美国专利no.6,004,925,6,037,323和6,046,166)。术语“同种型”是指具有相同、更大或部分的功能以及相似、相同或部分的序列的蛋白质,其可以是或不是相同基因的产物并且通常具有组织特异性(参见weisgraber1990,j.lipidres.31(8):1503-11;hixson和powers1991,j.lipidres.32(9):1529-35;lackner等人,1985,j.biol.chem.260(2):703-6;hoeg等人,1986,j.biol.chem.261(9):3911-4;gordon等人,1984,j.biol.chem.259(1):468-74;powell等人,1987,cell50(6):831-40;aviram等人,1998,arterioscler.thromb.vase.biol.18(10):1617-24;aviram等人,1998,j.clin.invest.101(8):1581-90;billecke等人,2000,drugmetab.dispos.28(11):1335-42;draganov等人,2000,j.biol.chem.275(43):33435-42;steinmetz和utermann1985,j.biol.chem.260(4):2258-64;widler等人,1980,j.biol.chem.255(21):10464-71;dyer等人,1995,j.lipidres.36(1):80-8;sacre等人,2003,febslett.540(1-3):181-7;weers,等人,2003,biophys.chem.100(1-3):481-92;gong等人,2002,j.biol.chem.277(33):29919-26;ohta等人,1984,j.biol.chem.259(23):14888-93和美国专利no.6,372,886)。在某些实施方案中,本发明的方法和组合物包括载脂蛋白的嵌合结构的用途。例如,载脂蛋白的嵌合结构可由与具有局部缺血再灌注保护性质的载脂蛋白结构域缔合的具有高脂质结合能力的载脂蛋白结构域组成。载脂蛋白的嵌合结构可以是包括载脂蛋白内的分开的区域(即,同源性结构)的结构,或嵌合结构可以是包括不同载脂蛋白之间的分开的区域的结构(即,异源性结构)。包含嵌合结构的组合物还可包括区段,所述区段是经设计具有特殊特征(例如,脂质结合、受体结合、酶促、酶激活、抗氧化剂或氧化还原性质)的载脂蛋白变体或区段(参见weisgraber1990,j.lipidres.31(8):1503-11;hixson和powers1991,j.lipidres.32(9):1529-35;lackner等人,1985,j.biol.chem.260(2):703-6;hoeg等人,1986,j.biol.chem.261(9):3911-4;gordon等人,1984,j.biol.chem.259(1):468-74;powell等人,1987,cell50(6):831-40;aviram等人,1998,arterioscler.thromb.vasc.biol.18(10):1617-24;aviram等人,1998,j.clin.invest.101(8):1581-90;billecke等人,2000,drugmetab.dispos.28(11):1335-42;draganov等人,2000,j.biol.chem.275(43):33435-42;steinmetz和utermann1985,j.biol.chem.260(4):2258-64;widler等人,1980,j.biol.chem.255(21):10464-71;dyer等人,1995,j.lipidres.36(1):80-8;sorenson等人,1999,arterioscler.thromb.vasc.biol.19(9):2214-25;palgunachari1996,arterioscler.throb.vasc.biol.16(2):328-38:thurberg等人,j.biol.chem.271(11):6062-70;dyer1991,j.biol.chem.266(23):150009-15;hill1998,j.biol.chem.273(47):30979-84)。本发明中利用的载脂蛋白还包括重组、合成、半合成或纯化的载脂蛋白。用于获得本发明利用的载脂蛋白或其等价物的方法在本领域内是公知的。例如,载脂蛋白可通过,例如密度梯度离心或免疫亲和层析来与血浆或天然产物分离,或可合成地、半合成地或使用本领域内技术人员已知的重组dna技术来产生(参见,例如,mulugeta等人,1998,j.chromatogr.798(1-2):83-90;chung等人,1980,j.lipidres.21(3):284-91;cheung等人,1987,j.lipidres.28(8):913-29;persson,等人,1998,j.chromatogr.711:97-109;美国专利no.5,059,528,5,834,596,5,876,968和5,721,114;以及pct公开案wo86/04920和wo87/02062)。本文中利用的载脂蛋白还包括载脂蛋白激动剂,诸如模拟apoa-i、apoa-imilano(apoa-im)、apoa-iparis(apoa-ip)、apoa-ii,apoa-iv和apoe的活性的肽和肽类似物。例如,载脂蛋白可以是美国专利no.6,004,925,6,037,323,6,046,166和5,840,688中描述的任意载脂蛋白,所述专利的内容通过引用整体并入本文。载脂蛋白激动剂肽或肽类似物可使用本领域内已知的用于肽合成的任意技术(包括例如美国专利no.6,004,925,6,037,323和6,046,166中描述的技术)来合成或制造。例如,肽可使用最初由merrifield(1963,j.am.chem.soc.85:2149-2154)描述的固相合成技术来制备。其它肽合成技术可见于bodanszky等人,peptidesynthesis,johnwiley&sons,第2版,(1976)和本领域技术人员可容易地获得的其它参考文献中。多肽合成技术的概述可见于stuart和young,solidphasepeptidesynthesis,piercechemicalcompany,rockford,ill.,(1984)中。肽还可利用如theproteins,第ii卷,第3版,neurath等人编辑,第105-237页,academicpress,newyork,n.y.(1976)中描述的溶液法来合成。用于不同的肽合成的适当保护基团描述于上文提及的文件中以及mcomie,protectivegroupsinorganicchemistry,plenumpress,newyork,n.y.(1973)中。本发明的肽还可通过从例如载脂蛋白a-i的更大部分的化学或酶促切割来制备。在某些实施方案中,载脂蛋白可以是载脂蛋白的混合物。在一个实施方案中,载脂蛋白可以是均质混合物,即,单一类型的载脂蛋白。在另一个实施方案中,载脂蛋白可以是载脂蛋白的异质混合物,即,两种或更多种不同的载脂蛋白的混合物。载脂蛋白的异质混合物的实施方案可包括,例如来自动物源的载脂蛋白和来自半合成源的载脂蛋白的混合物。在某些实施方案中,异质混合物可包含,例如apoa-i和apoa-imilano的混合物。在某些实施方案中,异质混合物可包含,例如apoa-imilano和apoa-iparis的混合物。用于本发明的方法和组合物的合适混合物对于本领域技术人员来说是显而易见的。如果载脂蛋白获自天然源,那么其可获自植物或动物源。如果载脂蛋白获自动物源,那么载脂蛋白可来自任何物种。在某些实施方案中,载脂蛋白可获自动物源。在某些实施方案中,载脂蛋白可获自人源。在本发明的优选实施方案中,载脂蛋白来源于与对其施用了载脂蛋白的个体相同的物种。脂质颗粒本发明还提供了包含一种或多种上述阳离子脂质的脂质颗粒。脂质颗粒包括但不限于脂质体。如本文中所使用的,脂质体是具有封入水性内部的含脂质膜的结构。脂质体可具有一个或多个脂质膜。本发明涵盖称为单室的单层脂质体和称为多室的多层脂质体。当与核酸复合时,脂质颗粒还可以是阳离子脂质体/dna复合物(lipoplexes),其由夹在dna层之间的阳离子脂质双层组成,如,例如felgner,scientificamerican中描述的。本发明的脂质颗粒还可包含一种或多种其它脂质和/或其它成分,诸如胆固醇。为了多种目的,诸如为了防止脂质氧化或将配体连接至脂质体表面上,可将其它脂质包含在本发明的脂质体组合物中。许多脂质的任一种可存在于本发明的脂质体中,包括两亲性、中性、阳离子性和阴离子性脂质。此类脂质可单独地或组合地使用。下文中描述可存在的其它脂质成分的具体实例。可存在于本发明的脂质颗粒中的其它成分包括双层稳定成分,诸如聚酰胺寡聚物(参见,例如,美国专利no.6,320,017)、肽、蛋白质、清洁剂、脂质衍生物,诸如偶联至磷脂酰乙醇胺的peg和共轭至神经酰胺的peg(参见,美国专利no.5,885,613)。在特定的实施方案中,脂质颗粒包括第二氨基脂质或阳离子脂质、中性脂质、固醇和脂质中的一种或多种,它们被选择用以减少形成过程中脂质颗粒的聚集,这可因阻止形成过程中电荷诱导的聚集的颗粒的立体稳定作用而引起。在形成过程中减少颗粒聚集的脂质的实例包括诸如聚乙二醇(peg)修饰的脂质、单唾液酸神经节苷酯gm1和聚酰胺寡聚物("pao")(描述于美国专利no.6,320,017中)。还可将在配制过程中阻止聚集的具有不带电荷的、亲水性的、立体屏蔽(steric-barrier)部分的其它化合物(如peg、gm1或atta)偶联至脂质以用于本发明的方法和组合物中。atta-脂质描述于,例如美国专利no.6,320,017中,peg-脂质共轭物描述于,例如美国专利nos.5,820,873、5,534,499和5,885,613中。通常,被选择用以减少聚集的脂质成分的浓度为约1至15%(按脂质的摩尔百分比计)。用于本发明的peg修饰的脂质(或脂质-聚氧化乙烯共轭物)的特定实例可具有多种“锚定”脂质部分来将peg部分固定至脂质囊泡的表面。适当的peg修饰的脂质的实例包括peg修饰的磷脂酰乙醇胺和磷脂酸、peg-神经酰胺共轭物(例如,peg-cerc14或peg-cerc20)(其描述于共同待决的ussn08/486,214,该申请以引用的方式并入本文)、peg修饰的二烷基胺和peg-修饰的1,2-二酰氧基丙-3-胺类。特别优选的是peg修饰的二酰基甘油和二烷基甘油。在其中将空间上大的部分诸如peg或atta共轭至脂质锚的实施方案中,脂质锚的选择取决于共轭物将与脂质颗粒缔合的类型。众所周知,mpeg(mw2000)-二硬脂酰磷脂酰乙醇胺(peg-dspe)将保持与脂质体缔合直至颗粒从循环内清除,可能数日。其它共轭物,诸如peg-cerc20具有相似的停留能力。然而在一些测定中,peg-cerc14在暴露于血清后,以小于60分钟的t1/2快速交换出制剂。如美国专利申请sn08/486,214中所举例说明的,至少3个特征影响交换速率:酰基链的长度、酰基链的饱和度和立体屏蔽头部基团的大小。具有这些特征的适当变化的化合物可用于本发明。对于一些治疗应用,peg修饰的脂质在体内从核酸-脂质颗粒的快速丢失是优选的,因此peg修饰的脂质将具有相对短的脂质锚。在其它治疗应用中,核酸-脂质颗粒展示更长的血浆循环寿命是优选的,因此peg修饰的脂质将具有相对更长的脂质锚。应当指出,阻止聚集的化合物不一定需要脂质共轭来发挥正常功能。溶液中的游离peg或游离atta可足以阻止聚集。如果颗粒在配制后是稳定的,则可在施用于受治疗者前透析掉peg或atta。中性脂质,当存在于脂质颗粒中时,可以是在生理ph下以不带电荷或中性两性离子形式存在的许多脂质种类的任一种。此类脂质包括,例如二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂和脑苷脂类。用于本文中描述的颗粒的中性脂质的选择通常通过考虑,例如脂质体大小和脂质体在血流中的稳定性来指导。优选地,中性脂质成分是具有两个酰基的脂质(即,二酰基磷脂酰胆碱和二酰基磷脂酰乙醇胺)。具有多种不同链长度和饱和度的酰基链基团的脂质体是可获得的或可通过公知的技术来分离或合成。在一组实施方案中,含有具有在c10至c20范围内的碳链长度的饱和脂肪酸的脂质是优选的。在另一组实施方案中,使用具有带有在c10至c20范围内的碳链长度的单或二不饱和脂肪酸的脂质。此外,可使用具有饱和和不饱和脂肪酸链的混合物的脂质。优选地,用于本发明的中性脂质是dope、dspc、popc、dppc或任意相关的磷脂酰胆碱。用于本发明的中性脂质还可由鞘磷脂、二氢鞘磷脂或具有其它头部基团,例如丝氨酸和肌醇的磷脂类组成。脂质混合物的固醇成分,当存在时,可以是常规地用于脂质体、脂质囊泡或脂质颗粒制备领域的那些固醇中的任意一种。优选的固醇是胆固醇。除了上文中明确描述的阳离子脂质外,还可将在大约生理ph下携有净正电荷的其它阳离子脂质包含在本发明的脂质颗粒中。此类阳离子脂质包括但不限于n,n-二油基-n,n-二甲基氯化铵("dodac");n-(2,3-二油基氧基)丙基-n,n-n-三乙基氯化铵("dotma");n,n-二硬脂酰基-n,n-二乙基溴化铵("ddab");n-(2,3-二油酰基氧基)丙基)-n,n,n-三乙基氯化铵("dotap");1,2-二油基氧基-3-三甲基氨基丙烷盐酸盐("dotap.cl");3-(n-(n',n'-二甲基氨基乙烷)-氨甲酰基)胆固醇("dc-chol")、n-(1-(2,3-二油基氧基)丙基)-n-2-(精胺甲酰胺基)乙基)-n,n-二甲基三氟乙酸铵("dospa")、二-十八烷基氨基甘氨酰基羧精胺("dogs"),1,2-二油基-sn-3-磷酸乙醇胺("dope")、1,2-二油酰基-3-二甲基丙胺("dodap")、n,n-二甲基-2,3-二油基氧基)丙胺("dodma")和n-(1,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵("dmrie")。此外,可使用许多阳离子脂质的商业制剂,诸如,例如,lipofectin(包括dotma和dope,可从gibco/brl获得)和lipofectamine(包括dospa和dope,可从gibco/brl获得)。在特定的实施方案中,阳离子脂质是氨基脂质。适合用于本发明的脂质颗粒的阴离子脂质包括但不限于磷脂酰甘油、心磷脂、二酰基磷脂酰丝氨酸、二酰基磷脂酸、n-十二烷酰基磷脂酰乙醇胺,、n-琥珀酰磷脂酰乙醇胺、n-戊二酰基磷脂酰乙醇胺、赖氨酰磷脂酰甘油和连接至中性脂质的其它阴离子性修饰基团。在许多实施方案中,两亲性脂质包含于本发明的脂质颗粒中。“两亲性脂质”是指其中脂质材料的疏水性部分朝向疏水相而亲水性部分朝向水相的任意适当的材料。此类化合物包括但不限于磷脂类、氨基脂类和鞘脂类。代表性磷脂类包括鞘磷脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酸、棕榈酰油酰基磷脂酰胆碱、溶血磷脂酰胆碱,溶血磷脂酰乙醇胺、二棕榈酰磷脂酰胆碱、二油酰基磷脂酰胆碱、二硬脂酰基磷脂酰胆碱或二亚油酰基磷脂酰胆碱。还可使用其它缺乏磷的化合物,诸如鞘脂类、鞘糖脂家族、二酰甘油和δ-酰氧基酸(acyloxyacid)。此外,可容易地将此类两亲性脂质与其它脂质,诸如甘油三酯类和固醇类混合。还适合包含在本发明的脂质颗粒中的是可编程的融合脂质(programmablefusionlipid)。此类脂质颗粒具有与细胞膜融合并递送其有效负荷直至给定的信号事件发生的很小倾向。这允许脂质颗粒在注射入生物体或疾病位置后,在其开始与细胞融合之前更均匀地分布。信号事件可以是,例如ph、温度、离子环境或时间的变化。在后一种情况下,融合延迟或“掩蔽(cloaking)”成分,诸如atta-脂质共轭物或peg-脂质共轭物,可随着时间简单地交换出脂质颗粒膜。当脂质颗粒适当地分布在身体中时,其已失去足够的掩蔽试剂来进行融合。对于其它信号事件,期望选择与疾病位置或靶细胞关联的信号,诸如炎症位置上的增加的温度。在某些实施方案中,期望使用对细胞类型或组织具有特异性的靶向部分来靶向本发明的脂质颗粒。之前已描述了使用多种靶向部分,诸如配体、细胞表面受体、糖蛋白、维生素(例如,核黄素)和单克隆抗体,来靶向脂质颗粒(参见,例如,美国专利nos.4,957,773和4,603,044)。靶向部分可包含完整蛋白质或其片段。靶向机制通常需要将靶向试剂以使靶向部分可获得用于与靶(例如细胞表面受体)相互作用的方式置于脂质颗粒的表面上。多种不同的靶向试剂和方法在本领域内是已知的且是可获得的,包括例如在sapra,p.和allen,tm,prog.lipidres.42(5):439-62(2003);以及abra,rm等人,j.liposomeres.12:1-3,(2002)中描述的靶向试剂。已提出具有亲水性聚合物链,诸如聚乙二醇(peg)链的表面包衣的脂质颗粒(即,脂质体)用于靶向的用途(allen,等人,biochimicaetbiophysicaacta1237:99-108(1995);defrees,等人,journaloftheamericanchemistrysociety118:6101-6104(1996);blume,等人,biochimicaetbiophysicaacta1149:180-184(1993);klibanov,等人,journalofliposomeresearch2:321-334(1992);美国专利no.5,013556;zalipsky,bioconjugatechemistry4:296-299(1993);zalipsky,febsletters353:71-74(1994);zalipsky,于stealthliposomes第9章中(lasicandmartin,eds)crcpress,bocaratonfl(1995))。在一个方法中,将用于靶向脂质颗粒的配体,诸如抗体连接至形成脂质颗粒的脂质的极性头部基团。在另一个方法中,将靶向配体连接至形成亲水性聚合物包衣的peg链的远端(klibanov,等人,journalofliposomeresearch2:321-334(1992);kirpotin等人,febsletters388:115-118(1996))。可使用用于偶联靶试剂的标准方法。例如,可使用磷脂酰乙醇胺,其可被活化以连接靶试剂或衍生的亲脂性化合物,诸如脂质衍生的博来霉素。可使用,例如掺入a蛋白的脂质体(参见,renneisen等人,j.bio.chem.,265:16337-16342(1990)和leonetti等人,proc.natl.acad.sci.(usa),87:2448-2451(1990))来构建抗体靶向的脂质体。抗体共轭物的其它实例公开于美国专利no.6,027,726,其教义以引用的方式并入本文。靶向部分的实例还可包括对细胞组分具有特异性的其它蛋白质(包括与赘生物或肿瘤结合的抗原)。可通过共价键将用作靶向部分的蛋白质与脂质体连接(参见,heath,covalentattachmentofproteinstoliposomes,149methodsinenzymology111-119(academicpress,inc.1987))。其它靶向方法包括生物素-抗生物素蛋白系统。在一个示例性实施方案中,脂质颗粒包含本发明的阳离子脂质、中性脂质(除了阳离子脂质以外)、固醇(例如,胆固醇)和peg修饰的脂质(例如,peg-dmg或peg-dma)的混合物。在某些实施方案中,脂质混合物包括或主要包括本发明的阳离子脂质、中性脂质、胆固醇和peg修饰的脂质。在其它优选的实施方案中,脂质颗粒包括或主要包括上述脂质混合物,摩尔比为约20-70%氨基脂质:5-45%中性脂质:20-55%胆固醇:0.5-15%peg-修饰的脂质。在一个实施方案中,脂质颗粒包含至少两种本文中公开的脂质。例如,阳离子脂质的混合物可用于脂质颗粒,以便混合物包含以摩尔计的20-60%的总脂质含量。在特定的实施方案中,脂质颗粒包括或主要包括由选自表1的阳离子脂质、dspc、胆固醇和peg-dmg或peg-dma,例如摩尔比为约20-60%的阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组实施方案中,用popc、dppc、dope或sm替换此类组合物中的中性脂质、dspc。治疗剂-脂质颗粒组合物和制剂本发明包括含有本发明的脂质颗粒和活性剂的组合物,其中所述活性剂与脂质颗粒缔合。在特定的实施方案中,活性剂是治疗剂。在特定的实施方案中,活性剂被封装在脂质颗粒的水性内部。在其它实施方案中,活性剂存在于脂质颗粒的一个或多个脂质层内。在其它实施方案中,活性剂结合至脂质颗粒的外或内脂质表面。如本文中使用的“完全封装的”表示颗粒中的核酸在暴露于可显著降解游离核酸的血清或核酸酶测定后不会被显著地降解。在完全封装的系统中,优选地少于25%的颗粒核酸在通常降解100%的游离核酸的治疗中降解,更优选地少于10%和最优选地少于5%的颗粒核酸被降解。可选地,完全封装可通过测定法来测定。是用于定量溶液中的寡核苷酸和单链dna的超灵敏荧光核酸染料(可从invitrogencorporation,carlsbad,ca获得)。完全封装的还提示颗粒具有血清稳定性,即,其在体内施用后未快速分解成其构成部分。如本文中使用的活性剂包括能够对细胞、组织、器官或受治疗者发挥期望的作用的任意分子或化合物。此类作用可以是,例如生物学、生理学或美容作用。活性剂可以是任意类型的分子或化合物,包括例如核酸、肽和多肽,包括例如抗体,诸如,例如多克隆抗体、单克隆抗体、抗体片段;人源化抗体、重组抗体、重组人抗体和primatizedtm抗体、细胞因子、生长因子、细胞凋亡因子、诱导分化因子、细胞表面受体和其配体;激素;和包括小有机分子或化合物的小分子。在一个实施方案中,活性剂是治疗剂或其盐或衍生物。治疗剂衍生物可以是本身具有治疗活性的或它们可以是前体药物,所述前体药物在进一步修饰后变得具有活性。因此,在一个实施方案中,与未修饰的试剂相比较,治疗剂衍生物保持一些或全部的治疗活性,然而在另一个实施方案中,治疗剂衍生物缺乏治疗活性。在不同的实施方案中,治疗剂包括任意治疗上有效的试剂或药物,诸如抗炎化合物、抗抑郁药、兴奋剂、镇痛药、抗生素、节制生育用药、退热剂、血管扩张剂、抗血管新生剂(anti-angiogenics)、细胞血管剂(cytovascular)、信号转导抑制剂、心血管药物,例如抗心律不齐药、血管收缩剂、激素和类固醇。在某些实施方案中,治疗剂是肿瘤药物,其还可称为抗肿瘤药、抗癌药、肿瘤药、抗肿瘤剂等。可根据本发明使用的肿瘤药物的实例包括但不限于阿霉素、爱克兰(alkeran)、别嘌醇、六甲蜜胺、氨磷汀、阿那曲唑、阿糖胞苷、三氧化二砷、硫唑嘌呤、贝沙罗汀、双氯乙亚硝脲(bicnu)、博来霉素、注射用白消安、口服用白消安、卡培他滨(希罗达)、卡铂、卡莫司汀、环己亚硝脲(ccnu)、塞来昔布、苯丁酸氮芥、顺铂、克拉屈滨、环孢菌素a、阿糖胞苷(cytarabine)、胞嘧啶阿拉伯糖苷(cytosinearabinoside)、柔红霉素、环磷酰胺、柔红霉素、地塞米松、右雷佐生、多西紫杉醇(dodetaxel)、多柔比星、多柔比星、dtic、表柔比星、雌莫司汀、磷酸依托泊苷、依托泊苷和vp-16、依西美坦、fk506、氟达拉滨、氟尿嘧啶、5-fu、吉西他滨(健择)、吉妥单抗-奥佐米星(gemtuzumab-ozogamicin)、醋酸戈舍瑞林、羟脲(hydrea)、羟基脲(hydroxyurea)、依达比星、异环磷酰胺、甲磺酸伊马替尼、干扰素、伊立替康(camptostar、cpt-111)、来曲唑、亚叶酸钙、克拉屈滨、亮丙瑞林、左旋咪唑、阿利维a酸(litretinoin)、甲地孕酮(megastrol)、美法仑、l-pam、美司钠、甲氨喋呤、甲氧沙林、光辉霉素、丝裂霉素、米托蒽醌、氮芥、紫杉醇、帕米膦酸盐、培加酶(pegademase)、喷司他丁、卟吩姆钠、泼尼松、利妥昔单抗(rituxan)、链佐星、sti-571、他莫昔芬、泰素帝、替莫唑胺(temozolamide)、替尼泊苷、vm-26、拓扑替康(和美新)、托瑞米芬、维甲酸、atra、戊柔比星、长春花碱(velban)、长春碱、长春新碱、vp16和长春瑞滨。可根据本发明使用的肿瘤药物的其它实例是艾力替新(ellipticin)和艾力替新类似物或衍生物、埃博霉素、细胞内激酶抑制剂和喜树碱。核酸-脂质颗粒在某些实施方案中,将本发明的脂质颗粒与核酸缔合,从而形成核酸-脂质颗粒。在特定的实施方案中,核酸被完全封装在脂质颗粒中。如本文中所使用的,术语“核酸”意指包括任意寡核苷酸或多核苷酸。包含达到50个核苷酸的片段通常称为寡核苷酸,更长的片段称为多核苷酸。在特定的实施方案中,本发明的寡核苷酸在长度上为15至50个核苷酸。在本发明的上下文中,术语“多核苷酸”和“寡核苷酸”是指由天然存在的碱基、糖和糖间(主链)键组成的核苷酸或核苷单体的聚合物或寡聚体。术语“多核苷酸”和“寡核苷酸”也包括包含非天然存在的单体的多聚体或寡聚体,或其部分,所述多聚体或寡聚体的功能相似。此类修饰的或取代的寡核苷酸因性质(诸如,例如增强的细胞吸收和在核酸酶存在的情况下增加的稳定性)而通常优于天然形式。存在于根据本发明的脂质-核酸颗粒中的核酸包括已知的任意形式的核酸。本文中使用的核酸可以是单链dna或rna或双链dna或rna或dna-rna杂交体。双链dna的实例包括结构基因、包含控制和终止区域的基因以及自主复制的系统,诸如病毒或质粒dna。双链rna的实例包括sirna和其它rna干扰试剂。单链核酸包括,例如反义寡核苷酸、核酶、微rna和形成三链的寡核苷酸。存在于本发明的脂质-核酸颗粒中的核酸可包括下述的一种或多种寡核苷酸修饰。本发明的核酸可以是不同的长度,通常取决于核酸的具体形式。例如,在特定的实施方案中,质粒或基因在长度上可以是约1,000至100,000个核苷酸残基。在特定的实施方案中,寡核苷酸在长度上可以在约10至100个核苷酸的范围内。在不同的相关实施方案中,单链、双链和三链的寡核苷酸在长度上可在约10至约50个核苷酸,约20至约50个核苷酸,约15至约30个核苷酸,约20至约30个核苷酸的范围内。在特定的实施方案中,本发明的寡核苷酸(或其链)与靶多核苷酸特异性杂交或与其互补。“可特异性杂交的”和“互补的”是用于表示互补性的充分程度(以便在dna或rna靶与寡核苷酸之间发生稳定且特异性的结合)的术语。要理解,寡核苷酸不必与其可特异性杂交的靶核酸序列100%互补。当寡核苷酸与靶的结合干扰靶分子的正常功能以引起其效用或表达的损失,并且存在充分程度的互补性以在其中期望特异性结合的条件下,即在体内测定或治疗性治疗或在体外测定的情况的生理条件下,在其中进行测试的条件下,避免寡核苷酸与非靶序列的非特异性结合时,寡核苷酸是可特异性杂交的。因此,在其它实施方案中,与其靶向或其特异性杂交的基因或mrna序列相比较,该寡核苷酸包括1、2或3个碱基置换,例如错配。rna干扰核酸在特定的实施方案中,本发明的核酸-脂质颗粒与rna干扰(rnai)分子缔合。使用rnai分子的rna干扰方法可用于中断目的基因或多核苷酸的表达。小干扰rna(sirna)基本上取代了反义odn和核酶作为正在研发中的下一代靶向寡核苷酸药物。sirna是通常16至30个核苷酸长的rna双链体,其可与称为rnai诱导的沉默复合体(risc)的细胞质多蛋白复合体缔合。加载sirna的risc介导同源mrna转录物的降解,因此可设计sirna用于以高度特异性敲低蛋白质表达。与其它反义技术不同,sirna通过进化至经非编码rna控制基因表达的天然机制起作用。这通常被认为是其活性在体外和体内比反义odn或核酶更有效力的原因。多种rnai试剂包括临床上靶向相关靶的sirna目前正在药物开发中,如例如fougerolles,a.等人,naturereviews6:443-453(2007)中所描述的。虽然首次描述的rnai分子是包含rna有义链和rna反义链的rna:rna杂交体,但现已证明dna有义链:rna反义链杂交体、rna有义链:dna反义链杂交体和dna:dna杂交体能够介导rnai(lamberton,j.s.和christian,a.t.,(2003)molecularbiotechnology24:111-119)。因此,本发明包括包含这些不同双链分子类型中的任一类型的rnai分子的使用。此外,要理解,可使用rnai分子和可以多种形式将其引入细胞。因此,如本文中所使用的,rnai分子包括能够诱导细胞的rnai反应的任意和所有分子,包括但不限于包含两个分开的链(即有义链和反义链)的双链寡核苷酸,例如,小干扰rna(sirna);包含两个由非核苷酸基连接体连接在一起的两个分开的链的双链寡核苷酸;包含形成双链区域的互补序列的发夹环的寡核苷酸,例如shrnai分子,和表达一个或多个能够单独地或与另一个多核苷酸组合地形成双链多核苷酸的多核苷酸的表达载体。如本文中所使用的“单链sirna化合物”是由单个分子构成的sirna化合物。其可包括由链内配对形成的双链区域,例如,其可以是或包括发夹或锅柄样(pan-handle)结构。单链sirna化合物相对于靶分子可以是反义的。单链sirna化合物可以充分长以便其可进入risc并且参与risc介导的靶mrna的切割。单链sirna化合物在长度上为至少14个,在其它实施方案中在长度上为至少15、20、25、29、35、40或50个核苷酸。在某些实施方案中,其在长度上少于200、100或60个核苷酸。发夹sirna化合物具有等于或至少17、18、19、29、21、22、23、24或25个核苷酸对的双链体区域。双链体区域在长度上将可以等于或小于200,100或50个核苷酸对。在某些实施方案中,双链体区域在长度上的范围是15至30、17至23、19至23和19至21个核苷酸对。发夹可具有单链悬突或末端未配对区域。在一些实施方案中,悬突在长度上为2至3个核苷酸。在一些实施方案中,悬突在发夹的有义侧并且在一些实施方案中在发夹的反义侧上。如本文中所用的“双链sirna化合物”为包括超过一条,在一些情况下超过二条,其中链间杂交可形成双链体结构的区域的链,的sirna化合物。双链sirna化合物的反义链在长度上可等于或为至少14、15、16、17、18、19、25、29、40或60个核苷酸。其在长度上可等于或少于200、100或50个核苷酸。长度范围可以为17至25、19至23和19至21个核苷酸。如本文中所使用的,术语“反义链”意指与靶分子(即靶rna)充分互补的sirna化合物的链。双链sirna化合物的有义链在长度上可等于或为至少14、15、16、17、18、19、25、29、40或60个核苷酸。其在长度上可等于或少于200、100或50个核苷酸。长度范围可以为17至25、19至23和19至21个核苷酸。双链sirna化合物的双链部分在长度上可等于或为至少14、15、16、17、18、19、20、21、22、23、24、25、29、40或60个核苷酸对。其在长度上可等于或少于200、100或50个核苷酸对。长度范围可以为15至30、17至23、19至23和19至21个核苷酸对。在许多实施方案中,sirna化合物足够大以便其可被内源性分子(例如被切丁酶(dicer))切割,以产生更小的sirna化合物,例如sirna试剂。可对有义和反义链进行选择以便双链sirna化合物在分子的一端或两端上包括单链或未配对的区域。因此,双链sirna化合物可包含有义和反义链,所述链经配对包含悬突,例如一个或两个5’或3’悬突,或1至3个核苷酸的3'悬突。悬突可以是一条链比另一条链更长的结果,或相同长度的两条链交错的结果。一些实施方案将具有至少一个3’悬突。在一个实施方案中,sirna分子的两个末端将具有3’悬突。在一些实施方案中,悬突是2个核苷酸。在某些实施方案中,双链化的区域的长度在15至30个核苷酸之间,或在长度上为,例如上述ssirna化合物范围内的18、19、20、21、22和23个核苷酸。ssirna化合物在长度和结构上与来自长dsirna的天然切丁酶加工的产物相似。还包括其中ssirna化合物的两条链是连接的,例如共价连接的实施方案。发夹或提供所需双链区的其它单链结构、和3'悬突也在本发明的范围内。本文中描述的sirna化合物,包括双链sirna化合物和单链sirna化合物可介导靶rna例如mrna,例如编码蛋白质的基因的转录物的沉默。为方便起见,此类mrna在本文中也称为待沉默的mrna。这样的基因也称为靶基因。通常,待沉默的rna是内源性基因或病原体基因。此外,还可靶向除了mrna之外的rna,例如trna和病毒rna。如本文中所使用的,短语“介导rnai”是指以序列特异性的方式沉默靶rna的能力。然而不希望受理论束缚,据认为,沉默使用rnai机器或方法和向导rna,例如21至23个核苷酸的ssirna化合物。在一个实施方案中,sirna化合物与靶rna,例如靶mrna“充分互补”,以便所述sirna化合物沉默由靶mrna编码的蛋白质的产生。在另一个实施方案中,sirna化合物与靶rna“完全互补”,例如靶rna与sirna化合物退火,例如以在精确互补的区域中形成只由watson-crick碱基对产生的杂交体。“充分互补的”靶rna可包括与靶rna完全互补的内部区域(例如,至少10个核苷酸的)。此外,在某些实施方案中,sirna化合物明确地区分单核苷酸差异。在该情况下,如果在单核苷酸差异的区域(例如,在7个核苷酸内的区域)中发现精确互补,那么sirna化合物只介导rnai。微rna微rna(mirna)是高度保守种类的小rna分子,其从植物和动物的基因组中的dna转录但不会转录成蛋白质。加工的mirna是掺入rna诱导的沉默复合体(risc)中并且已被鉴定为发育、细胞增殖、细胞凋亡和分化的关键调节剂的单链约17至25个核苷酸(nt)rna分子。据认为,它们在基因表达的调控中通过结合至特定mrna的3’非翻译区起作用。risc通过翻译抑制、转录切割或两者介导基因表达的下调。risc也在广泛的真核生物的细胞核中参与转录沉默。迄今为止得到鉴定的序列的数目是巨大的并且在不断增加,其说明性实例可见于例如:“mirbase:micrornasequences,targetsandgenenomenclature”griffiths-joness,grocockrj,vandongens,batemana,enrightaj.nar,2006,34,databaseissue,d140-d144;“themicrornaregistry”griffiths-joness.nar,2004,32,databaseissue,d109-d111;还可见于http://microrna.sanger.ac.uk/sequences/。反义寡核苷酸在一个实施方案中,核酸是针对靶多核苷酸的反义寡核苷酸。术语“反义寡核苷酸”或简单地“反义”意指包括与靶向多核苷酸序列互补的寡核苷酸。反义寡核苷酸是与选择的序列,例如靶基因mrna互补的dna或rna的单链。反义寡核苷酸据认为通过结合互补mrna来抑制基因表达。与靶mrna结合可通过阻止互补mrna链的翻译(通过与其结合)或通过导致靶mrna的降解来抑制基因表达。反义dna可用于靶向特定的互补(编码或非编码)rna。如果发生结合,则该dna/rna杂交体可被酶ran酶h降解。在特定的实施方案中,反义寡核苷酸包含约10至约50个核苷酸,更优选地约15至约30个核苷酸。术语还包括可以与期望的靶基因非精确互补的反义寡核苷酸。因此,可在其中对于反义发现非靶特异性活性或其中含有一个或多个与靶序列的错配的反义序列对于特定用途是最优选的情况下利用本发明。已证明,反义寡核苷酸是蛋白质合成的有效的且靶向的抑制剂,因此,可通过靶基因用于特异性抑制蛋白质合成。良好地确定了反义寡核苷酸用于抑制蛋白质合成的功效。例如,聚半乳糖醛酸酶和毒蕈碱2型乙酰胆碱受体的合成被针对其各自mrna序列的反义寡核苷酸抑制(美国专利5,739,119和美国专利5,759,829)。此外,已证明了关于核蛋白细胞周期蛋白、多药抗药性基因(mdg1)、icam-1、e-选择素、stk-1、纹状体gabaa受体和人egf的反义抑制的实例(jaskulski等人,science.1988年6月10日;240(4858):1544-6;vasanthakumar和ahmed,cancercommun.1989;1(4):225-32;peris等人,brainresmolbrainres.1998jun15;57(2):310-20;美国专利5,801,154;美国专利5,789,573;美国专利5,718,709和美国专利5,610,288)。此外,还已描述了抑制并且可用于治疗多种异常细胞增殖(例如癌症)的反义构建体(美国专利5,747,470;美国专利5,591,317和美国专利5,783,683)。产生反义寡核苷酸的方法在本领域内是已知的并且可容易地适于以产生靶向任意多核苷酸序列的反义寡核苷酸。特异于给定的靶序列的反义寡核苷酸序列的选择基于选择的靶序列的分析和二级结构、tm、结合能和相对稳定性的测定。可基于其形成可减少或抑制与宿主细胞中靶mrna的特异性结合的二聚体、发夹或其它二级结构的相对无能来选择反义寡核苷酸。mrna的高度优选靶区域包括在aug翻译起始密码子或其附近的那些区域和与mrna的5’区域大体互补的那些序列。例如,可以使用oligo引物分析软件v.4版(molecularbiologyinsights)和/或blastn2.0.5算法软件(altschul等人,nucleicacidsres.1997,25(17):3389-402)来进行此类二级结构分析和靶位点选择考虑。antagomirantagomir是rna样寡核苷酸,其包含用于rna酶保护和药理学性质诸如增强的组织和细胞吸收的各种修饰。其与常规rna相异于例如糖的完全2'-o-甲基化、硫代磷酸酯主链和例如3'末端上的胆固醇部分。antagomir可用于通过形成包含antagomir和内源性mirna的双链体来有效地沉默内源性mirna,从而阻止mirna诱导的基因沉默。antagomir介导的mirna沉默的实例是krutzfeldt等人,nature,2005,438:685-689中描述的mir-122的沉默,该文献的全部内容以引用的方式明确地并入本文。使用标准固相寡核苷酸合成方案来合成antagomirrna。参见美国专利申请序列no.11/502,158和11/657,341,每一个该专利申请的公开内容以引用的方式并入本文)。antagomir可包括用于寡核苷酸合成的共轭有配体的单体亚单元和单体。示例性单体描述于2004年8月10日提交的美国申请no.10/916,185中。antagomir可具有zxy结构,诸如描述于2004年3月8日提交的pct申请no.pct/us2004/07070中。可将antagomir与两亲性部分复合。使用寡核苷酸试剂的的示例性两亲性部分描述于2004年3月8日提交的pct申请no.pct/us2004/07070中。适体适体是以高亲和力和特异性结合特定的目的分子的核酸或肽分子(tuerk和gold,science249:505(1990);ellington和szostak,nature346:818(1990))。已成功地产生了结合从大蛋白质至小有机分子的许多不同实体的dna或rna适体。参见eaton,curr.opin.chem.biol.1:10-16(1997),famulok,curr.opin.struct.biol.9:324-9(1999),以及hermann和patel,science287:820-5(2000)。适体可以是基于rna或dna的,并且可包括核糖开关(riboswitch)。核糖开关是mrna分子的一部分,其可直接地结合小靶分子并且其与靶的结合影响基因的活性。因此,取决于其靶分子的存在与否,包含核糖开关的mrna直接地参与调控其自身的活性。通常,通过重复循环的体外选择或等价地selex(指数富集性配体系统进化)以结合不同分子靶,诸如小分子、蛋白质、核酸和甚至细胞、组织和生物体来对适体进行工程改造。适体可通过任何已知的方法(包括合成、重组和纯化方法)来制备,并且可单独地使用或与对相同靶具有特异性的其它适体组合地使用。此外,如在本文中更详尽地描述的,术语“适体”明确地包括“次级适体”,其包含将两个或更多个已知的适体与给定的靶相比较而衍生的共有序列。核酶根据本发明的另一个实施方案,将核酸-脂质颗粒与核酶缔合。核酶是rna分子复合物,其具有拥有内切核酸酶活性的特定催化结构域(kim和cech,procnatlacadsciusa.1987年12月;84(24):8788-92;forster和symons,cell.1987年4月24日;49(2):211-20)。例如,大量核酶以高度的特异性(通常只切割寡核苷酸底物中的数个磷酸酯中的一个)加速磷酸酯转移反应(cech等人,cell.1981年12月;27(3pt2):487-96;michel和westhof,jmolbiol.1990dec5;216(3):585-610;reinhold-hurekandshub,nature.1992年5月14日;357(6374):173-6)。该特异性归功于在化学反应之前底物通过特异性碱基配对相互作用结合核酶的内部向导序列(internalguidesequence)(“igs”)的要求。目前已知至少6个基本种类的天然发生的酶rna。每一个种类可在生理条件下催化rna反式磷酸二酯键的水解(从而切割其它rna分子)。一般地,酶核酸通过首先结合靶rna起作用。这样的结合通过酶促核酸的靶结合部分发生,所述靶结合部分紧靠分子的用于切割靶rna的酶促部分。因此,酶促核酸首先识别,然后通过互补碱基配对结合靶rna,一旦结合正确的位置,就酶促切割靶rna。这样的靶rna的策略性切割将破坏其指导编码的蛋白质的合成的能力。在酶促核酸已结合并且切割其rna靶后,其从该rna释放以寻找另一个靶并且可重复地结合和切割新靶。可在例如锤头、发夹、丁型肝炎病毒、i型内含子或rna酶prna(与rna指导序列结合的)或链孢霉vsrna基序中形成酶促核酸分子。锤头基序的具体实例由rossi等人,nucleicacidsres.1992年9月11日;20(17):4559-65描述。发夹基序的实例由hampel等人(欧洲专利申请公开案no.ep0360257),hampel和tritz,biochemistry1989年6月13日;28(12):4929-33;hampel等人,nucleicacidsres.1990年1月25日;18(2):299-304以及美国专利5,631,359描述。丁型肝炎病毒基序的实例由perrotta和been,biochemistry.1992dec1;31(47):11843-52描述;rna酶p基序的实例由guerrier-takada等人,cell.1983年12月;35(3pt2):849-57描述;链孢霉vsrna核酶基序由collins(saville和collins,cell.1990年5月18日;61(4):685-96;saville和collins,procnatlacadsciusa.1991年10月1日;88(19):8826-30;collins和olive,biochemistry.1993年3月23日;32(11):2795-9)描述;以及i型内含子的实例描述于美国专利4,987,071。根据本发明使用的酶促核酸分子的重要特征是它们具有与一个或多个靶基因dna或rna区域互补的特异性底物结合位置和它们在该底物结合位置内或其周围具有赋予分子rna切割活性的核苷酸序列。因此核酶构建体不必限定于本文中提及的特定基序。产生靶向任意多核苷酸序列的核酶的方法在本领域内是已知的。核酶可如国际专利申请公开案wo93/23569和国际专利申请公开案wo94/02595(该专利申请各自通过引用明确地并入本文)中所述进行设计,并且可被合成以进行体外和体内测试,如本文中所描述的。可通过改变核酶结合臂的长度或化学合成具有修饰的核酶来最优化核酶的活性,所述修饰防止其被血清核酸酶消化(参见,例如,国际专利申请公开案wo92/07065;国际专利申请公开案wo93/15187;国际专利申请公开案wo91/03162;欧洲专利申请公开案.92110298.4;美国专利5,334,711;和国际专利申请公开案wo94/13688,其描述了可对酶促rna分子的糖部分进行的各种化学修饰),增强其在细胞中的功效以及除去茎ii碱基以缩短rna合成时间和减少化学需要。免疫刺激性寡核苷酸与本发明的脂质颗粒缔合的核酸可以是免疫刺激性的,包括当给受治疗者施用时能够诱发免疫应答的免疫刺激性寡核苷酸(iss;单链或双链的),所述受治疗者可以是哺乳动物或其它患者。iss包括例如导致发夹二级结构的某些回文序列(参见yamamotos.,等人(1992)j.immunol.148:4072-4076)或cpg基序以及其它已知的iss特征(例如多-g结构域,参见wo96/11266)。免疫应答可以是先天性免疫应答或适应性免疫应答。免疫系统被分成脊椎动物的更先天性免疫系统和获得性适应性免疫系统(acquiredadaptiveimmunesystem),其后者进一步分成体液细胞成分。在具体的实施方案中,免疫应答可以是粘膜免疫应答。在具体的实施方案中,免疫刺激性核酸只有当与脂质颗粒组合施用时才具有免疫刺激性,当以其“游离形式”施用时,其不具有免疫刺激性。根据本发明,这样的寡核苷酸被认为是免疫刺激性的。当不需要免疫刺激性核酸特异性结合并且减少靶多核苷酸的表达以引发免疫应答时,免疫刺激性核酸被认为是非序列特异性的。因此,某些免疫刺激性核酸可包含相应于天然存在的基因或mrna的区域的序列,但它们仍然可被认为是非序列特异性免疫刺激性核酸。在一个实施方案中,免疫刺激性核酸或寡核苷酸包含至少一个cpg二核苷酸。寡核苷酸或cpg二核苷酸可以未被甲基化或被甲基化。在另一个实施方案中,免疫刺激性核酸包含至少一个具有甲基化胞嘧啶的cpg二核苷酸。在一个实施方案中,核酸包含单个cpg二核苷酸,其中所述cpg二核苷酸中的胞嘧啶被甲基化。在具体的实施方案中,核酸包含序列5'taacgttgaggggcat3'。在可选的实施方案中,核酸包含至少两个cpg二核苷酸,其中cpg二核苷酸中的至少一个胞嘧啶被甲基化。在其它实施方案中,存在于序列中的cpg二核苷酸中的每一个胞嘧啶被甲基化。在另一个实施方案中,核酸包含多个cpg二核苷酸,其中至少一个所述cpg二核苷酸包含甲基化胞嘧啶。在一个具体的实施方案中,核酸包含序列5'ttccatgacgttcctgacgt3'。在另一个具体的实施方案中,核酸序列包含序列5'tccatgacgttcctgacgt3',其中以粗体标示的两个胞嘧啶被甲基化。在特定的实施方案中,odn选自由odn#1、odn#2、odn#3、odn#4、odn#5、odn#6、odn#7、odn#8和odn#9组成的odn,如下所显示的。表3.示例性免疫刺激性寡核苷酸(odn)"z"表示甲基化胞嘧啶残基。odn14为15-mer寡核苷酸并且odn1是具有添加至5'末端使odn1成为16-mer的胸苷的相同寡核苷酸。未检测到odn14与odn1之间的生物学活性差异,其都展示相似的免疫刺激活性(mui等人,2001)适合用于本发明的组合物和方法的寡核苷酸(odn)的另外特定的核酸序列描述raney等人,journalofpharmacologyandexperimentaltherapeutics,298:1185-1192(2001)中。在某些实施方案中,本发明的组合物和方法中使用的odn具有磷酸二酯("po")主链或硫代磷酸酯("ps")主链,和/或cpg基序中至少一个甲基化胞嘧啶残基。诱饵寡核苷酸因为转录因子甚至在周围基因dna不存在的情况下识别其相对短的结合序列,所以可将具有特定转录因子的共有结合序列的短寡核苷酸用作在活细胞中操纵基因表达的工具。该策略包括细胞内递送此类“诱饵寡核苷酸”,然后该诱饵寡核苷酸被靶因子识别并结合。转录因子的dna结合位置被诱饵占据使得转录因子不能随后结合至靶基因的启动子区域。诱饵可用作治疗剂,抑制被转录因子激活的基因的表达,或上调因转录因子的结合而被抑制的基因。利用诱饵寡核苷酸的实例可见于mann等人,j.clin.invest.,2000,106:1071-1075中,该文献的全部内容通过引用明确地引入本文。supermirsupermir是指核糖核酸(rna)或脱氧核糖核酸(dna)或两者或其修饰物的单链、双链或部分双链寡聚物或聚合物,其具有大体上与mirna相同并且相对于其靶为反义的核苷酸序列。该术语包括由天然存在的核碱基、糖和共价核苷酸间(主链)键组成并且包含至少一个功能相似的非天然存在的部分的寡核苷酸。此类修饰的或取代的寡核苷酸因期望的性质,诸如,例如增强的细胞吸收、增强的对核酸靶的亲和力和在核酸酶存在的情况下增加的稳定性,而优于天然形式。在优选的实施方案中,supermir不包括有义链,在另一个优选的实施方案中,supermir不自身杂交(self-hybridize)至显著的程度。本发明中表征的supermir可具有二级结构,但其在生理条件下基本上是单链的。基本上为单链的supermir是达到少于约50%(例如,少于约40%、30%、20%、10%或5%)的supermir与其本身形成双链体的程度的单链。supermir可包括发夹区段,例如,优选在3’末端可自身杂交并且形成双链体区域,例如至少1、2、3或4个,优选少于8、7、6或n个核苷酸(例如5个核苷酸)的双链体区域的序列。双链体区域可通过连接体,例如核苷酸连接体例如3、4、5或6个dt(例如修饰的dt)进行连接。在另一个实施方案中,supermir与更短的寡核苷酸(例如在长度上为5、6、7、8、9或10个核苷酸),例如在supermir的3’和5’末端的一端或两端或在一个末端和非末端或中间形成双链体。mirna模拟物mirna模拟物代表一类可用于模拟一个或多个mirna的基因沉默能力的分子。因此,术语“微rna模拟物”是指合成的非编码rna(即mirna不是通过从内源性mirna的来源纯化获得),其能够进入rnai途径和调节基因表达。可将mirna模拟物设计为成熟分子(例如单链的)或模拟前体(例如,pri-mirna或前体mirna)。mirna模拟物可由包括寡核苷酸的核酸(修饰的或修饰的核酸)组成,所述寡核苷酸包括但不限于rna、修饰的rna、dna、修饰的dna、锁核酸或2'-o,4'-c-亚乙基-桥连核酸(ena)或上述的任意组合(包括dna-rna杂交体)。此外,mirna模拟物可包含共轭物,其可影响递送、细胞内区室化、稳定性、特异性、功能性、链利用(strandusage)和/或潜能。在一个设计中,mirna模拟物是双链分子(例如,具有在长度上为约16至约31个核苷酸的双链体区域)并且包含一个或多个与给定mirna的成熟链具有同一性的序列。修饰可包括在分子的一条链或两条链上的2'修饰(包括2'-o甲基修饰和2'f修饰)和核苷酸间修饰(例如硫代磷酸酯修饰),所述修饰增加核酸稳定性和/或特异性。此外,mirna模拟物可包含悬突。悬突可包括任一条链的3'或5'末端上的1至6个核苷酸并且可被修饰以增加稳定性或功能性。在一个实施方案中,mirna模拟物包含16至31个核苷酸的双链体区域和一个或多个下列化学修饰模式:有义链包含核苷酸1和2(从有义寡核苷酸的5'末端计数)和全部c和u的2'-o-甲基修饰;反义链修饰可包含全部c和u的2'f修饰,寡核苷酸的5'末端的磷酸化以及与2个核苷酸的3'悬突连接的稳定的核苷酸间连接。antimir或mirna抑制剂.术语“antimir”、“微rna抑制剂”、“mir抑制剂”或“抑制剂”是同义的并且是指干扰特定mirna的能力的寡核苷酸或经修饰的寡核苷酸。一般地,抑制剂是天然的核酸或修饰核酸,包括包含rna、修饰的rna、dna、修饰的dna、锁核酸(lna)或上述的任意组合的寡核苷酸。修饰包括2'修饰(包括2'-o烷基修饰和2'f修饰)和核苷酸间修饰(例如,硫代磷酸酯修饰),其可影响递送、稳定性、特异性、细胞内区室化或潜能。此外,mirna抑制剂可包含可影响递送、细胞内区室化、稳定性、和/或潜能的共轭物。抑制剂可采取多种构型,包括单链、双链(rna/rna或rna/dna双链体)和发夹设计,通常,微rna抑制剂包含一个或多个与待靶向的mirna的成熟链互补或部分互补的序列或序列的部分,此外,mirna抑制剂还可包含位于为成熟mirna的反向互补序列的序列的5'和3'的另外序列。另外的序列可以是在成熟mirna所源自的前体mirna(pri-mirna)中邻近成熟mirna的序列的反向互补序列,或另外的序列可以是任意序列(具有a、g、c或u的混合物)。在一些实施方案中,另外序列中的一个或两个是能够形成发夹的任意序列。因此,在一些实施方案中,作为mirna的反向互补序列的序列通过发夹结构在5'侧和3'侧上侧翼连接。微rna抑制剂,当为双链时,可包括相反链上的核苷酸之间的错配。此外,可将微rna抑制剂连接至共轭物部分以促进抑制剂至细胞内的吸收。例如,可将微rna抑制剂连接至胆固醇基5-(双(4-甲氧基苯基)(丙基)甲氧基)-3羟基戊基氨基甲酸酯),这允许微rna抑制剂被动吸收至细胞内。微rna抑制剂,包括发夹mirna抑制剂,详细地描述于vermeulen等人,“double-strandedregionsareessentialdesigncomponentsofpotentinhibitorsofriscfunction”,rna13:723-730(2007)以及wo2007/095387和wo2008/036825中,所述每一篇文献的全部内容通过引用并入本文。本领域的技术人员可从数据库中选择期望的mirna的序列并且设计用于本文公开的方法的抑制剂。u1衔接子u1衔接子抑制polya位点并且是具有与靶基因的末端外显子中的位点互补的靶结构域和结合u1snrnp的u1小核rna组分的‘u1结构域’的双功能寡核苷酸(goraczniak等人,2008,naturebiotechnology,27(3),257-263,该文献的全部内容通过引用并入本文)。u1snrnp是主要用于通过结合pre-mrna外显子-内含子边界指导剪接体形成的早期步骤的核糖核蛋白复合体(brown和simpson,1998,annurevplantphysiolplantmoibiol49:77-95)。u1snrna碱基对的5'末端的核苷酸2至11与premrna的5'ss结合。在一个实施方案中,本发明的寡核苷酸为u1衔接子。在一个实施方案中,可将u1衔接子与至少一种其它sirna试剂组合施用。寡核苷酸修饰未修饰的寡核苷酸在一些应用中不是最适合的,例如未修饰的寡核苷酸可易于被例如细胞核酸酶降解。核酸酶可水解核酸磷酸二酯键。然而,寡核苷酸的化学修饰可赋予改进的性质,例如可使寡核苷酸变得对核酸酶更稳定。由于寡核苷酸是亚单元或单体的聚合物,因此下文中描述的许多修饰在寡核苷酸内重复的位置上发生,例如,碱基、糖、磷酸部分或磷酸部分的非桥氧的修饰。不必对给定的核苷酸中的所有位置进行一致地修饰,事实上可将超过一个的上述修饰掺入单个寡核苷酸中或甚至掺入寡核苷酸中的单个核苷。在一些情况下,修饰可在寡核苷酸中的全部受试位置上发生,但在许多情况,事实上大多数情况下,并非如此。例如,修饰可以只在3’或5’末端位置上发生,可以只在内部区域发生,可以只在末端区域中(例如在寡核苷酸的末端核苷酸上的位置或在寡核苷酸的最后2、3、4、5或10个核苷酸中)发生。修饰可以在双链区域、单链区域或两者中发生。修饰可以只在双链寡核苷酸双链区中发生或可只在双链寡核苷酸的单链区中发生。例如,在非桥氧位置上的硫代磷酸酯修饰可只在一个或两个末端上发生,可只在末端区域(例如在末端核苷酸上的位置或在链的最后2、3、4、5或10个核苷酸中)发生,或可在双链和单链区域中、特别是在末端上发生。5’末端可被磷酸化。本文中描述的修饰可以是唯一的修饰,或多个核苷酸上包括的唯一修饰类型,或可将修饰与本文中描述的一个或多个其它修饰组合。还可将本文中描述的修饰组合至寡核苷酸上,例如寡核苷酸的不同核苷酸具有本文中描述的不同修饰。在一些实施方案中,特别优选地,例如为了增强稳定性,在悬突中包含特定的核碱基,或在单链悬突中例如在5’或3’悬突或两者中包含经修饰的核苷酸或核苷酸替代物。例如,可期望地在悬突中包含嘌呤核苷酸类。在一些实施方案中,3’或5’悬突中的全部或一些碱基可被修饰,例如以本文描述的修饰。修饰可包括,例如使用核糖的2’oh基团上的修饰,例如使用脱氧核糖核苷酸,例如使用脱氧胸苷(替代核糖核苷酸),以及使用磷酸基团中的修饰,例如硫代磷酸酯修饰。悬突不需要与靶序列同源。在下文中更详细地论述具体的修饰。磷酸基团磷酸基团是带负电荷的种类。电荷均匀地分布在两个非桥氧原子上。然而,可通过用不同的取代基取代氧之一来修饰磷酸基团。对rna磷酸主链的这种修饰的一个结果可以是寡核苷酸对核溶解性(nucleolytic)分解的抗性增加。因此虽然不希望受理论束缚,但在一些实施方案中,可以期望引入改变,所述改变导致不带电荷的连接体或具有非对称电荷分布的带电荷的连接体。修饰的磷酸基团的实例包括硫代磷酸酯、磷酸硒酸酯(phosphoroselenate)、硼烷代磷酸酯(boranophosphates)、硼烷代磷酸酯、氢膦酸酯、氨基磷酸酯、烷基或芳基膦酸酯和磷酸三酯。在某些实施方案中,磷酸酯主链部分中的非桥连磷酸酯氧原子之一可被如下任一个取代:s、se、br3(r为氢、烷基、芳基)、c(即烷基、芳基等)、h、nr2(r为氢、烷基、芳基)或or(r为烷基或芳基)。未修饰的磷酸基团中的磷原子是非手性的。然而,用上述原子或原子基团之一取代非桥氧之一使得磷原子成为手性的;换句话说,以该方式修饰的磷酸基团中的磷原子是立体基因中心(stereogeniccenter)。立体基因的磷原子可具有“r”构型(本文中为rp)或“s”构型(本文中为sp)。二硫代磷酸酯用硫取代了两个非桥氧。二硫代磷酸酯中心的磷是非手性的,这排除寡核苷酸非对映异构体的形成。因此,虽然不希望受理论束缚,但可期望消除手性中心例如二硫代磷酸酯形成的对两个非桥氧的修饰,因为它们不能产生非对映体混合物。因此,非桥氧可独立地为s、se、b、c、h、n或or(r是烷基或芳基)的任意一个。还可通过用氮(桥连氨基磷酸酯)、硫(桥连硫代磷酸酯)和碳(桥连亚甲基膦酸酯)取代桥氧(即将磷酸盐连接至核苷的氧)来修饰磷酸酯连接体。可在任一连接氧(linkingoxygen)上或在两个连接氧上进行取代。当桥氧是核苷的3’-氧时,使用碳的取代是优选的。当桥氧是核苷的5’-氧时,使用氮的取代是优选的。磷酸基团的取代可利用不含磷连接基团取代磷酸基团。虽然不希望受理论束缚,但据认为,由于带电荷的磷酸二酯基团是核水解性降解中的反应中心,因此其利用中性结构模拟物的取代应当赋予增加的核酸酶稳定性。再次地,虽然不希望受理论束缚,但在一些实施方案中可以期望引入其中带电荷的磷酸基团被中性部分取代的改变。可取代磷酸基团的部分的实例包括膦酸甲酯、羟氨基、硅氧烷、碳酸酯、羧甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷连接体、磺酸酯、磺酰胺、硫甲缩醛(thioformacetal)、甲缩醛(formacetal)、肟、亚甲基亚氨基、亚甲基甲基亚氨基、亚甲基亚肼基、亚甲基二甲基亚肼基和亚甲氧基甲基亚氨基。优选的取代包括亚甲基羰基氨基和亚甲基甲基亚氨基。其中至少一个连接至磷酸酯的氧已被取代或磷酸基团已被非磷基团取代的修饰的磷酸酯连接也称为“非磷酸二酯主链连接”。核糖磷酸主链的取代还可构建寡核苷酸-模拟支架,其中磷酸酯连接体和核糖被抗核酸酶核苷或核苷酸替代物取代。虽然不希望受理论束缚,但据认为重复地带电荷的主链的不存在减少了与识别聚阴离子的蛋白质(例如,核酸酶)的结合。再次地,虽然不希望受理论束缚,但在一些实施方案中可以期望引入其中碱基由中性替代主链拴系的改变。实例包括吗啉基(mophilino)、环丁基、吡咯烷和肽核酸(pna)核苷替代物。优选的替代物是pna替代物。糖修饰修饰的rna可包括核糖核酸的全部或一些糖基团的修饰。例如,可用许多不同的“氧”或“脱氧”取代基来修饰或取代2′羟基(oh)。虽然不受理论束缚,但由于羟基可以不再去质子化以形成2′-醇盐离子,因此可预期增加的稳定性。2′-醇盐可通过对连接体磷原子进行分子内亲核攻击来催化降解。再次地,虽然不希望受理论束缚,但对于一些实施方案可期望引入其中不可能在2′位置上形成醇盐的改变。“氧”-2′羟基修饰的实例包括烷氧基或芳氧基(or,例如r=h、烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、o(ch2ch2o)nch2ch2or;其中2′羟基例如通过亚甲基桥连接至相同核糖的4′碳的“锁”核酸(lna);o-amine(amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺、聚氨基(polyamino))和氨基烷氧基、o(ch2)namine(例如,amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺、聚氨基)。值得注意的是只含有甲氧基乙基(moe)、(och2ch2och3,peg衍生物)的寡核苷酸表现出可与利用稳定硫代磷酸酯修饰进行修饰的寡核苷酸相当的核酸酶稳定性。“脱氧”修饰包括氢(即脱氧核糖糖类,其对部分dsrna的悬突部分具有特别意义);卤素(例如,氟);氨基(例如nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基、二杂芳氨基或氨基酸);nh(ch2ch2nh)nch2ch2-amine(amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基)、-nhc(o)r(r=烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氰基;巯基;烷基-硫基-烷基;硫代烷氧基;和烷基、环烷基、芳基、烯基和炔基,其可任选取代有例如氨基官能度。优选的取代基是2′-甲氧基乙基、2′-och3、2′-o-烯丙基、2′-c-烯丙基和2′-氟。糖基还可包含一个或多个具有与核糖中相应的碳的立体化学构型相反的立体化学构型的碳。因此,寡核苷酸可包括含有例如阿拉伯糖作为糖的核苷酸。单体可在糖的1’位置上具有α连接,例如,α-核苷类。寡核苷酸还可包括“无碱基”糖,其在c-1′上缺乏核碱基。此类无碱基糖还可在一个或多个组成性糖原子上进一步包含修饰。寡核苷酸还可包含一个或多个以l型存在的糖,例如l型核苷。末端修饰可修饰寡核苷酸的3′和5′末端。此类修饰可在分子的3′末端、5′末端或两个末端。它们可包括完整末端磷酸或磷酸基团的一个或多个碳原子的修饰或取代。例如,可将寡核苷酸的3′和5′末端共轭至其它功能性分子实体,诸如标记部分例如,荧光基团(例如,芘、tamra、荧光素、cy3或cy5染料)或保护基团(基于例如硫磺、硅、硼或酯)。可通过磷酸基团和/或连接体将功能性分子实体连接至糖。连接体的末端原子可连接至或取代磷酸基团的连接原子或糖的c-3′或c-5′o、n、s或c基团。可选地,连接体可连接至或取代核苷酸替代物(例如,pna)的末端原子。当连接体/磷酸-功能性分子实体-连接体/磷酸酯阵列被插入于dsrna的两条链之间时,该阵列可置换发夹型rna试剂中的发夹rna环。用于调节活性的末端修饰包括利用磷酸酯或磷酸酯类似物的5’末端的修饰。例如,在优选的实施方案中,dsrna的反义链是5’磷酸化的或在5’引物末端上包含磷酰基类似物。5'-磷酸修饰包括与risc介导的基因沉默相容的修饰。适合的修饰包括:5'-单磷酸酯((ho)2(o)p-o-5');5'-二磷酸酯((ho)2(o)p-o-p(ho)(o)-o-5');5'-三磷酸酯((ho)2(o)p-o-(ho)(o)p-o-p(ho)(o)-o-5');5'-鸟苷帽(7-甲基化的或非甲化的)(7m-g-o-5'-(ho)(o)p-o-(ho)(o)p-o-p(ho)(o)-o-5');5'-腺苷帽(appp)和任意的修饰的或未修饰的核苷酸帽结构(n-o-5'-(ho)(o)p-o-(ho)(o)p-o-p(ho)(o)-o-5');5'-单硫代磷酸酯(硫代磷酸酯;(ho)2(s)p-o-5');5'-单二硫代磷酸酯(二硫代磷酸酯;(ho)(hs)(s)p-o-5')、5'-硫代磷酸酯((ho)2(o)p-s-5');氧/硫取代的单磷酸酯、二磷酸酯和三磷酸酯的任意其它组合(例如,5'-α-硫代三磷酸酯、5'-γ-硫代三磷酸酯等)、5'-氨基磷酸酯((ho)2(o)p-nh-5'、(ho)(nh2)(o)p-o-5')、5'-烷基膦酸酯(r=烷基=甲基、乙基、异丙基、丙基等,例如rp(oh)(o)-o-5'-、(oh)2(o)p-5'-ch2-)、5'-烷基醚膦酸酯(r=烷基醚=甲氧基甲基(meoch2-)、乙氧基甲基等,例如rp(oh)(o)-o-5'-)。末端修饰还可用于监控分布,并且在这样的情况下,待添加的优选基团包括荧光基团例如荧光素或alexa染料,例如alexa488。末端修饰还可用于增强吸收,对此有用的修饰包括胆固醇。末端修饰还可用于将rna试剂交联至另一个部分;对此有用的修饰包括丝裂霉素c。核碱基腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶是在rna中发现的最常见的碱基。可修饰或取代此类碱基以提供具有改进的性质的rna。例如,可用此类碱基或用合成的和天然核碱基(例如肌苷、胸腺嘧啶、黄嘌呤、次黄嘌呤、nubularine、异鸟嘌呤核苷(isoguanisine)或杀结核菌素)以及上述修饰的任意一个来制备抗核酸酶寡核糖核苷酸。可选地,可使用任意上述碱基的取代的或修饰的类似物,例如本文中描述的“稀有碱基”、“修饰的碱基”、“非天然碱基”和“通用碱基”。实例包括但不限于2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物、5-卤代尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮基尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、5-卤代尿嘧啶、5-(2-氨丙基)尿嘧啶、5-氨基烯丙基尿嘧啶、8-卤素、氨基、硫羟基、硫代烷基、羟基和其它8-取代的腺嘌呤和鸟嘌呤、5-三氟甲基和其它5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤、5-取代的嘧啶类、6-氮杂嘧啶类以及n-2、n-6和o-6取代的嘌呤类,包括2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶、二氢尿嘧啶、3-脱氮-5-氮杂胞嘧啶、2-氨基嘌呤、5-烷基尿嘧啶、7-烷基鸟嘌呤、5-烷基胞嘧啶、7-脱氮腺嘌呤、n6,n6-二甲基腺嘌呤、2,6-二氨基嘌呤、5-氨基-烷基-尿嘧啶、n3-甲基尿嘧啶、取代的1,2,4-三唑类、2-吡啶酮、5-硝基吲哚、3-硝基吡咯、5-甲氧基尿嘧啶、尿嘧啶-5-氧乙酸、5-甲氧基羰基甲基尿嘧啶、5-甲基-2-硫尿嘧啶、5-甲氧基羰基甲基-2-硫尿嘧啶、5-甲基氨基甲基-2-硫尿嘧啶、3-(3-氨基-3-羧丙基)尿嘧啶、3-甲基胞嘧啶、5-甲基胞嘧啶、n4-乙酰基胞嘧啶、2-硫胞嘧啶、n6-甲基腺嘌呤、n6-异戊基腺嘌呤、2-甲硫基-n6-异戊烯基腺嘌呤、n-甲基鸟嘌呤或o-烷基化碱基。其它嘌呤和嘧啶类包括美国专利no.3,687,808中公开的嘌呤和嘧啶类,conciseencyclopediaofpolymerscienceandengineering,第858-859页,kroschwitz,j.i.编辑johnwiley&sons,1990中公开的嘌呤和嘧啶类和由englisch等人,angewandtechemie,国际版,1991,30,613公开的嘌呤和嘧啶类。阳离子基团对寡核苷酸的修饰还可包括将一个或多个阳离子基团至磷酸酯或修饰的磷酸酯主链部分的糖、碱基和/或磷原子的连接。可将阳离子基团连接至能够在天然、稀有或通用的碱基上取代的任意原子。优选的位置是不干扰杂交,即不干扰碱基配对所需的氢键合相互作用的位置。可以,例如通过糖的c2’位置或环状或非环状糖替代物中的类似位置来连接阳离子基团。阳离子基团可包括,例如质子化的氨基,其来源于,例如o-amine(amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺、聚氨基);氨基烷氧基,例如,o(ch2)namine、(例如,amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺、聚氨基);氨基(例如nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基、二杂芳氨基或氨基酸);或nh(ch2ch2nh)nch2ch2-amine(amine=nh2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基)。寡核苷酸内的安置(placement)可以优选地在特定的位置上,例如在链的内部位置或在寡核苷酸的5’或3’上将一些修饰包含在寡核苷酸上。寡核苷酸上修饰的优选的定位可赋予试剂优选的性质。例如,特定修饰的优选定位可赋予最佳基因沉默性质或增加的对内切核酸酶或外切核酸酶活性的抗性。寡核苷酸的一个或多个核苷酸可具有2’-5’键。寡核苷酸的一个或多个核苷酸可具有反向键,例如3’-3’、5’-5’、2’-2’或2’-3’键。双链寡核苷酸可包含至少一个5’-尿苷-腺嘌呤-3’(5’-ua-3’)二核苷酸(其中尿苷是2’-修饰的核苷酸),或末端5’-尿苷-鸟嘌呤-3’(5’-ug-3’)二核苷酸(其中5’-尿苷是2’-修饰的核苷酸),或末端5’-胞苷-腺嘌呤-3’(5’-ca-3’)二核苷酸(其中5’-胞苷是2’-修饰的核苷酸),或末端5’-尿苷-尿苷-3’(5’-uu-3’)核苷酸(其中5’-尿苷是2’-修饰的核苷酸),或末端5’-胞苷-胞苷-3’(5’-cc-3’)核苷酸(其中5’-胞苷是2’-修饰的核苷酸),或末端5’-胞苷-尿苷-3’(5’-cu-3’)核苷酸(其中5’-胞苷是2’-修饰的核苷酸),或末端5’-尿苷-胞苷-3’(5’-uc-3’)核苷酸(其中5’-尿苷是2’-修饰的核苷酸)。包含这些修饰的双链寡核苷酸针对内切核酸酶活性是特别稳定的。一般参考文献可利用固相合成法来合成根据本发明使用的寡核糖核苷酸类和寡核糖核苷,参见例如"oligonucleotidesynthesis,apracticalapproach",ed.m.j.gait,irlpress,1984;"oligonucleotidesandanalogues,apracticalapproach",ed.f.eckstein,irlpress,1991(特别是第1章,寡脱氧核糖核苷酸合成的现代机制辅助法(modernmachine-aidedmethodsofoligodeoxyribonucleotidesynthesis),第2章,寡核糖核苷酸的合成(oligoribonucleotidesynthesis),第3章,2'-o—甲基寡核糖核苷酸:合成和应用(2'-o—methyloligoribonucleotide-s:synthesisandapplications),第4章,硫代磷酸酯寡核苷酸(phosphorothioateoligonucleotides),第5章,寡核苷酸二硫代磷酸酯的合成(synthesisofoligonucleotidephosphorodithioates),第6章,寡-2'-脱氧核糖核苷甲基膦酸酯的合成(synthesisofoligo-2'-deoxyribonucleosidemethylphosphonates),和第7章,含修饰碱基的寡脱氧核苷酸(oligodeoxynucleotidescontainingmodifiedbases))。其它特别有用的合成方法、试剂、阻断基团和反应条件描述于martin,p.,helv.chim.acta,1995,78,486-504;beaucage,s.l.和iyer,r.p.,tetrahedron,1992,48,2223-2311以及beaucage,s.l.和yer,r.p.,tetrahedron,1993,49,6123-6194中,或其中提及的参考文献。在本文中可使用wo00/44895、wo01/75164或wo02/44321中描述的修饰。本文中所列的全部出版物、专利和公布的专利申请的公开内容据此以引用的方式并入本文。磷酸基团参考文献亚膦酸酯寡核糖核苷酸的制备描述于美国专利no.5,508,270中。烷基膦酸酯寡核糖核苷酸的制备描述于美国专利no.4,469,863中。亚磷酰胺寡核糖核苷酸的制备描述于美国专利no.5,256,775或美国专利no.5,366,878中。硫代磷酸酯寡核糖核苷酸的制备描述于美国专利no.5,023,243中。硼烷代磷酸寡核糖核苷酸的制备描述于美国专利nos.5,130,302和5,177,198中。3'-脱氧-3'-氨基磷酰胺酯寡核糖核苷酸的制备描述于美国专利no.5,476,925中。3'-脱氧-3'-亚甲基膦酸酯寡核糖核苷酸的制备描述于an,h等人j.org.chem.2001,66,2789-2801中。硫桥连的核苷酸的制备描述于sproat等人nucleosidesnucleotides1988,7,651和crosstick等人tetrahedronlett.1989,30,4693中。糖基参考文献对2'修饰的修饰可见于verma,s.等人annu.rev.biochem.1998,67,99-134和在其中的所有参考文献中。对核糖的特定修饰可见于下列参考文献中:2'-氟(kawasaki等人,j.med.chem.,1993,36,831-841)、2'-moe(martin,p.helv.chim.acta1996,79,1930-1938)、“lna”(wengel,j.acc.chem.res.1999,32,301-310)。磷酸基的安置的参考文献亚甲基甲基亚氨基连接的寡核糖核苷(在本文中也被标识为mmi连接的寡核糖核苷)、亚甲基二甲基亚肼基连接的寡核糖核苷(在本文中也被标识为mdh连接的寡核糖核苷)和亚甲基羰基氨基连接的寡核苷(在本文中也被标识为酰胺-3连接的寡核糖核苷)和亚甲基氨基羰基连接的寡核糖核苷(在本文中也标识为酰胺-4连接的寡核糖核苷)以及具有例如交替的mmi和po或ps键的混合主链化合物可如美国专利no.5,378,825,5,386,023,5,489,677和公布的pct申请pct/us92/04294和pct/us92/04305(分别以wo92/20822wo和92/20823公布)中的描述进行制备。可如美国专利no.5,264,562和5,264,564中所描述的制备甲缩醛和硫甲缩醛连接的寡核糖核苷。可如美国专利no.5,223,618中的描述来制备环氧乙烷连接的寡核糖核苷。硅氧烷取代描述于cormier,j.f.等人nucleicacidsres.1988,16,4583中。碳酸酯取代描述于tittensor,j.r.j.chem.soc.c1971,1933中。羧甲基取代描述于edge,m.d.等人j.chem.soc.perkintrans.11972,1991中。氨基甲酸酯取代描述于stirchak,e.p.nucleicacidsres.1989,17,6129中。磷酸酯-核糖主链的取代的参考文献可如美国专利no.5,359,044中的描述来制备环丁基糖替代化合物。可如美国专利no.5,519,134中的描述来制备吡咯烷糖替代物。可如美国专利nos.5,142,047和5,235,033和其它相关专利公开内容中的描述来制备吗啉代糖替代物。肽核酸(pna)本身是已知的并且可按照peptidenucleicacids(pna):synthesis,propertiesandpotentialapplications,bioorganic&medicinalchemistry,1996,4,5-23中提及的不同方法的任一方法进行制备。它们还可按照美国专利no.5,539,083进行制备。.末端修饰的参考文献末端修饰描述于manoharan,m.等人antisenseandnucleicaciddrugdevelopment12,103-128(2002)和在其中的参考文献中。核碱基的参考文献可如美国专利no.5,459,255中所述制备n-2取代的嘌呤核苷amidites。可如美国专利no.5,457,191中所述制备3-脱氮嘌呤核苷amidites。可如美国专利no.5,614,617中所述制备5,6-取代的嘧啶核苷amidites。可如美国专利no.5,484,908中所述制备5-丙炔基嘧啶核苷amidites。连接体术语“连接体”意指连接化合物的两个部分的有机部分。连接体通常包括直接键合或原子,诸如氧或硫、单元(诸如nr1、c(o)、c(o)nh、so、so2、so2nh)或原子链诸如如取代的或未取代的烷基、取代的或未取代的烯基、取代的或未取代的炔基、芳烷基、芳烯基、芳炔基、杂芳烷基、杂芳烯基、杂芳炔基、杂环烷基、杂环烯基、杂环炔基、芳基、杂芳基、杂环基、环烷基、环烯基、烷芳基烷基、烷芳基烯基、烷芳基炔基、烯基芳基烷基、烯基芳基烯基、烯基芳基炔基、炔基芳基烷基、炔基芳基烯基、炔基芳基炔基、烷基杂芳基烷基、烷基杂芳基烯基、烷基杂芳基炔基、烯基杂芳基烷基、烯基杂芳基烯基、烯基杂芳基炔基、炔基杂芳基烷基、炔基杂芳基烯基、炔基杂芳基炔基、烷基杂环基烷基、烷基杂环基烯基、烷基杂环基炔基、烯基杂环基烷基、烯基杂环基烯基、烯基杂环基炔基、炔基杂环基烷基、炔基杂环基烯基、烃基杂环基炔基、烷芳基、烯基芳基、炔基芳基、烷基杂芳基、烯基杂芳基、炔基杂芳基,其中一个或多个亚甲基可被o、s、s(o)、so2、n(r1)2、c(o)、可切割的连接基团、取代的或未取代的芳基、取代的或未取代的杂芳基、取代的或未取代的杂环基中断或终止;其中r1为氢、酰基、脂肪族或取代的脂肪族。.在一个实施方案中,连接体是–[(p-q-r)q-x-(p’-q’-r’)q’]q”-t-,其中:p、r、t、p’、r’和t在每一次出现时各自独立地不存在:co、nh、o、s、oc(o)、nhc(o)、ch2、ch2nh、ch2o;nhch(ra)c(o)、-c(o)-ch(ra)-nh-、ch=n-o、或杂环基;q和q’在每一次出现时各自独立地不存在:-(ch2)n-、-c(r1)(r2)(ch2)n-、-(ch2)nc(r1)(r2)-、-(ch2ch2o)mch2ch2-或-(ch2ch2o)mch2ch2nh-;x不存在或为可切割的连接基团;ra为氢或氨基酸侧链;r1和r2在每一次出现时各自独立地为h、ch3、oh、sh或n(rn)2;rn在每一次出现时各自独立地为h、甲基、乙基、丙基、异丙基、丁基或苄基;q、q’和q”在每一次出现时各自独立地为0-20并且其中重复单元可以相同或不同;n在每一次出现时独立地为1至20;和m的每一次出现独立地为0至50。在一个实施方案中,连接体包括至少一个可切割的连接基团。在某些实施方案中,连接体是分支的连接体。分支的连接体的分支点可以为至少三价,但可以为四价、五价或六价原子,或提供此类多价的基团。在某些实施方案中,分支点为-n、-n(q)-c、-o-c、-s-c、-ss-c、-c(o)n(q)-c、-oc(o)n(q)-c、-n(q)c(o)-c或-n(q)c(o)o-c;其中q在每一次出现时独立地为h或任选取代的烷基。在其它实施方案中,分支点是甘油或甘油衍生物。可切割的连接基团可切割的连接基团是在细胞外充分稳定但在进入靶细胞后被切割以释放通过连接体结合在一起的两个部分。在优选的实施方案中,可切割的连接基团在靶细胞中或在第一参照条件(其可,例如被选择用以模拟或代表细胞内条件)下被切割比在受治疗者的血液中或在第二参照条件(其可,例如被选择用以模拟或代表在血液或血清中可见的条件)下快至少10倍或更多,优选地至少100倍。可切割的连接基团对切割剂,例如ph、氧化还原电位或降解分子的存在是易感的。通常,与在血清或血液中相比较,切割剂以更高的水平或活性更普遍地存在或发现于细胞内。此类降解试剂的实例包括:被选择用于特定底物或不具有底物特异性的氧化还原试剂,包括,例如存在于细胞中的氧化或还原酶或还原试剂诸如硫醇,其可通过还原来降解可氧化还原切割的连接基团;酯酶;内体或可产生酸性环境的试剂,例如导致5或更低的ph的试剂;可通过用作广义酸水解或降解酸可切割的连接基团的酶、肽酶(其可以是底物特异性的)和磷酸酶。可切割的连接基团,诸如二硫键可对ph易感。人血清的ph为7.4,而平均细胞内ph略低,在约7.1至7.3的范围内。内体具有更酸的ph(在5.5至6.0的范围内),溶酶体具有甚至更酸的ph(约5.0)。一些连接体具有在优选ph下被切割的可切割的连接基团,从而在细胞内将阳离子脂质从配体释放,或进入期望的细胞区室。连接体可包括可被特定酶切割的可切割的连接基团。掺入连接体的可切割连接基团的类型可取决于待靶向的细胞。例如,可通过包括酯基团的连接体将肝靶向配体连接至阳离子脂质。肝细胞富含酯酶,因而连接体在肝细胞中比在不富含酯酶的细胞类型中被更有效率地切割。富含酯酶的其它细胞类型包括肺、肾皮质和睾丸的细胞。当靶向富含肽酶的细胞类型,例如肝细胞和滑膜细胞时,可使用包含肽键的连接体。一般地,候选可切割的连接基团的适合性可通过测试降解试剂(或条件)以切割候选连接基团的能力进行评估。还期望也测试候选可切割的连接基团在血液中或当与其它非靶组织接触时抗切割的能力。因此可测定对第一与第二条件之间的切割的相对易感性,其中所述第一条件被选择用以表示靶细胞中的切割,所述第二条件被选择用以表示其它组织或生物液体,例如血液或血清中的切割。可在无细胞系统、细胞、细胞培养物、器官或组织培养物或完整动物中执行评估。其可用于在无细胞或培养物条件下进行初始评估和通过在完整动物中的进一步评估来验证。在优选的实施方案中,有用的候选化合物在细胞中(或在被选择用以模拟细胞内条件的体外条件下)被切割比在血液或血清(或在被选择用以模拟细胞外条件的体外条件下)中快至少2、4、10或100倍。可氧化还原切割的连接基团一类可切割的连接基团是在还原或氧化时被切割的可氧化还原切割的连接基团。可还原切割的连接基团的实例是二硫化物连接基团(-s-s-)。为了确定候选可切割的连接基团是否是适当的“可还原切割的连接基团”或例如适合于与特定的irna部分和特定的靶向试剂一起使用,可参阅本文中描述的方法。例如,可通过与二硫苏糖醇(dtt)或其它还原剂(使用本领域内已知的试剂)一起温育来评估候选物,其模拟可在细胞,例如靶细胞中观察到的切割速率。还可在选择用以模拟血液或血清条件的条件下评估候选物。在优选的实施方案中,候选化合物在血液中被切割至多10%。在优选的实施方案中,有用的候选化合物在细胞中(或在被选择用以模拟细胞内条件的体外条件下)被降解比在血液(或在被选择用以模拟细胞外条件的体外条件下)中要快至少2、4、10或100倍。可在被选择用以模拟细胞内介质的条件下使用标准酶动力学测定法来测定候选化合物的切割速率,并且将其与被选择用以模拟细胞外介质的条件相比较。基于磷酸酯的可切割的连接基团可利用降解或水解磷酸基的试剂来切割基于磷酸酯的可切割连接基团。细胞中可切割磷酸基团的试剂的实例是酶,诸如细胞中的磷酸酶。基于磷酸酯的连接基团的实例是-o-p(o)(ork)-o-、-o-p(s)(ork)-o-、-o-p(s)(srk)-o-、-s-p(o)(ork)-o-、-o-p(o)(ork)-s-、-s-p(o)(ork)-s-、-o-p(s)(ork)-s-、-s-p(s)(ork)-o-、-o-p(o)(rk)-o-、-o-p(s)(rk)-o-、-s-p(o)(rk)-o-、-s-p(s)(rk)-o-、-s-p(o)(rk)-s-、-o-p(s)(rk)-s-。优选的实施方案是-o-p(o)(oh)-o-、-o-p(s)(oh)-o-、-o-p(s)(sh)-o-、-s-p(o)(oh)-o-、-o-p(o)(oh)-s-、-s-p(o)(oh)-s-、-o-p(s)(oh)-s-、-s-p(s)(oh)-o-、-o-p(o)(h)-o-、-o-p(s)(h)-o-、-s-p(o)(h)-o-、-s-p(s)(h)-o-、-s-p(o)(h)-s-、-o-p(s)(h)-s-。优选的实施方案是-o-p(o)(oh)-o-。这些候选物可使用与上述方案类似的方法进行评估。酸可切割的连接基团酸可切割的连接基团是可在酸性条件下被切割的连接基团。在优选的实施方案中,在具有约6.5或更低(例如,约6.0、5.5、5.0或更低)的ph下的酸性环境中,或利用可用作广义酸的试剂诸如酶来切割酸可切割的连接基团。在细胞中,特定的低ph细胞器,诸如内体和溶酶体可提供用于酸可切割的连接基团的切割环境。酸可切割的连接基团的实例包括但不限于腙类、酯和氨基酸的酯。酸可切割的基团可具有通式-c=nn-、c(o)o或-oc(o)。优选的实施方案是当连接至酯(烷氧基)的氧的碳是芳基、取代的烷基或叔烷基,诸如二甲基戊基或叔丁基。这些候选物可使用与上述方法类似的方法进行评估。基于酯的连接基团可利用酶,诸如细胞中的酯酶和酰胺酶来切割基于酯的可切割连接基团。基于酯的可切割连接基团的实例包括但不限于亚烷基、亚烯基和亚炔基的酯。酯可切割的连接基团具有通式-c(o)o-或-oc(o)-。这些候选物可使用与上述方法类似的方法进行评估。基于肽的切割基团利用酶,诸如细胞中的肽酶和蛋白酶来切割基于肽的可切割的连接基团。基于肽的可切割的连接基团是在氨基酸之间形成以产生寡肽(例如,二肽、三肽等)和多肽的肽键。基于肽的可切割基团不包括酰胺基(-c(o)nh-)。酰胺基团可在任意亚烷基、亚烯基或亚炔基之间形成。肽键是特殊类型的在氨基酸之间形成以产生肽和蛋白质的酰胺键。基于肽的切割基团通常限定于在氨基酸之间形成以产生肽和蛋白质的肽键(即,酰胺键)并且不包括完整的酰胺官能团。基于肽的可切割连接基团具有通式–nhchrac(o)nhchrbc(o)-,其中ra和rb是两个相邻氨基酸的r基团。这些候选物可使用与上述方法类似的方法进行评估。配体可将许多种实体偶联至本发明的寡核苷酸和脂质。优选的部分是配体,其可通过居间系链(interveningtether)优选地直接或间接地进行共价偶联。在优选的实施方案中,配体改变其中已掺入所述配体的分子的分布、靶向或寿命。在优选的实施方案中,配体提供了,例如与不存在此种配体的种类相比较增强的对选择靶,例如分子、细胞或细胞类型、区室(例如细胞或器官区室、组织、器官或身体的部位)的亲和力。提供增强的对选择靶的亲和力的配体也称为靶向配体。用于共轭至本发明的脂质的优选配体是靶向配体。一些配体可具有溶内体性质。溶内体配体促进内体的裂解和/或本发明的组合物或其成分从细胞的内体至细胞质的运输。溶内体配体可以是显示ph依赖性膜活性和融合性(fusogenicity)的聚阴离子肽或拟肽类(peptidomimetic)。在某些实施方案中,溶内体配体在内体ph下呈现其活性构象。“活性”构象是其中溶内体配体促进内体的裂解和/或将本发明的组合物或其成分从细胞的内体运输至细胞质的构象。示例性溶内体配体包括gala肽(subbarao等人,biochemistry,1987,26:2964-2972)、eala肽(vogel等人,j.am.chem.soc.,1996,118:1581-1586)和其衍生物(turk等人,biochem.biophys.acta,2002,1559:56-68)。在某些实施方案中,溶内体成分可包含响应于ph的变化而经历电荷或质子化的变化的化学基团(例如,氨基酸)。溶内体成分可以是线性的或分支的。基于肽的溶内体配体的示例性一级序列示于表4中。表4:具有溶内体活性的肽的列表。n,正亮氨酸参考文献subbaraoetal.,,biochemistry,1987,26:2964-2972.vogeletal.,j.am.chem.soc.,1996,118:1581-1586turk,m.j.,reddy,j.a.etal.(2002).characterizationofanovelph-sensitivepeptidethatenhancesdrugreleasefromfolate-targetedliposomesatendosomalphs.biochim.biophys.acta1559,56-68.plank,c.oberhauser,b.mechtler,k.koch,c.wagner,e.(1994).theinfluenceofendosome-disruptivepeptidesongenetransferusingsyntheticvirus-likegenetransfersystems,j.biol.chem.26912918–12924.mastrobattista,e.,koning,g.a.etal.(2002).functionalcharacterizationofanendosome-disruptivepeptideanditsapplicationincytosolicdeliveryofimmunoliposome-entrappedproteins.j.biol.chem.277,27135-43.oberhauser,b.,plank,c.etal.(1995).enhancingendosomalexitofnucleicacidsusingph-sensitiveviralfusionpeptides.deliv.strategiesantisenseoligonucleotidether.247-66.优选配体可改善运输、杂交和特异性性质并且还可提高所得的天然或修饰的寡核苷酸或聚合物分子(包含本文中描述的单体和/或天然或修饰的核糖核苷酸的任意组合)的核酸酶抗性。配体一般可包括治疗调节剂,例如用以增强吸收;诊断化合物或报告基团,例如用以监控分布;交联剂;和赋予核酸酶抗性的部分。一般实例包括脂质、类固醇、维生素、糖、蛋白质、肽、聚胺和拟肽类。配体可包括天然存在的物质,诸如蛋白质(例如,人血清白蛋白(hsa)、低密度脂蛋白(ldl)、高密度脂蛋白(hdl)或球蛋白);碳水化合物(例如,葡聚糖、支链淀粉、壳多糖、壳聚糖、菊糖、环糊精或透明质酸);或脂质。配体还可以是重组或合成的分子,诸如合成的聚合物,例如合成的聚氨基酸、寡核苷酸(例如,适体)。聚氨基酸的实例包括聚氨基酸为多聚赖氨酸(pll)、聚l-天冬氨酸、聚l-谷氨酸、苯乙烯-马来酸酐共聚物、聚(l-丙交酯-共-乙交酯)共聚物、二乙烯基醚-马来酸酐共聚物、n-(2-羟丙基)甲基丙烯酰胺共聚物(hmpa)、聚乙二醇(peg)、聚乙烯醇(pva)、聚氨酯、聚(2-乙基丙烯酸)、n-异丙基丙烯酰胺聚合物或聚磷嗪(polyphosphazine)。聚胺的实例包括:聚乙稀亚胺、聚赖氨酸(pll)、精胺、亚精胺、聚胺、假肽(pseudopeptide)-聚胺、拟肽(peptidomimetic)聚胺、树枝状聚合物聚胺(dendrimerpolyamine)、精氨酸、脒、鱼精蛋白、阳离子脂质、阳离子卟啉、聚胺的季盐或α螺旋肽。配体还可包括靶向基团,例如,细胞或组织靶向剂,例如凝集素、糖蛋白、脂质或蛋白质,例如抗体,其结合特定细胞类型,诸如肾细胞。靶向基团可以是促甲状腺素、促黑素细胞激素、凝集素、糖蛋白、表面活性蛋白a、粘蛋白糖(mucincarbohydrate)、多价乳糖、多价半乳糖、n-乙酰基-半乳糖胺、n-乙酰基-葡糖胺、多价葡糖胺、多价岩藻糖、糖基化聚氨基酸、多价半乳糖、转铁蛋白、二膦酸盐、多聚谷胺酸、多聚天冬氨酸、脂质、胆固醇、类固醇、胆汁酸、叶酸、维生素b12、生物素、rgd肽、rgd肽模拟物或适体。表5显示靶向配体和其结合的受体的一些实例。表5:靶向配体和其结合的受体配体的其它实例包括染料、嵌入剂(例如吖啶类)、交联剂(例如补骨脂素、丝裂霉素c)、卟啉类(tppc4、德克萨斯卟啉、sapphyrin)、多环芳香烃(例如,吩嗪、二氢吩嗪)、人工内切核酸酶类(例如edta)、亲脂性分子例如胆固醇、胆酸、金刚烷乙酸、1-芘丁酸、双氢睾酮、1,3-双-o(十六烷基)甘油、香叶基氧己基、十六烷基甘油、龙脑、薄荷醇、1,3-丙二醇、十七烷基、棕榈酸、肉豆蔻酸、o3-(油酰基)石胆酸、o3-(油酰基)胆烯酸、二甲氧基三苯甲基或吩噁嗪)和肽共轭物(例如,触角足(antennapedia)肽、tat肽)、烷化剂、磷酸酯、氨基、巯基、peg(例如,peg-40k)、mpeg、[mpeg]2、聚氨基、烷基、取代的烷基、放射标记的标志物、酶、半抗原(例如生物素)、转运/吸收促进剂(例如,阿司匹林、维生素e、叶酸)、合成的核糖核酸酶类(例如,咪唑、二咪唑、组胺、咪唑族、吖啶-咪唑共轭物、四氮杂大环的eu3+复合物)、二硝基苯基、hrp或ap。配体可以是蛋白质,例如糖蛋白,或肽(例如具有对于协同配体的特异性亲和力的分子),或抗体(例如结合特定的细胞类型,诸如癌细胞、内皮细胞或骨细胞的抗体)。配体还可以包括激素和激素受体。它们还可包括非肽种类,诸如脂质、凝集素、碳水化合物、维生素、辅因子、多价乳糖、多价半乳糖、n-乙酰半乳糖胺、n-乙酰基-葡糖胺(gulucosamine)多价甘露糖、多价岩藻糖或适体。配体可以是,例如脂多糖、p38map激酶的激活剂或nf-κb的激活剂。配体可以是可通过破坏细胞的细胞骨架,例如通过破坏细胞的微管、微丝和/或中间纤维来增加irna试剂进入细胞内的吸收的物质,例如药物。药物可以是,例如分类单位(taxon)、长春新碱、长春碱、松胞菌素、诺考达唑、japlakinolide、红海海绵素a、鬼笔环肽、swinholidea、indanocine或肌基质蛋白(myoservin)。例如,配体可以通过激活炎症应答来增加irna试剂进入细胞内的吸收。可具有这样的效应的示例性配体包括肿瘤坏死因子α(tnfα)、白细胞介素-1β或γ-干扰素。在一个方面,配体是脂质或基于脂质的分子。这样的脂质或基于脂质的分子优选地结合血清蛋白,例如人血清白蛋白(hsa)。has结合配体允许共轭物分布至靶组织,例如身体的非肾靶组织。例如,靶组织可以是肝,包括肝的实质细胞。可结合has的其它分子也可用作配体。例如,可使用neproxin或阿斯匹林。脂质或基于脂质的配体可以(a)增加对降解共轭物的抗性,(b)增加靶向或运输至靶细胞或细胞膜和/或(c)可用于调节与血清蛋白质,例如has的结合。基于脂质的配体可用于调节,例如控制共轭物结合至靶组织。例如,与has更牢固地结合的脂质或基于脂质的配体不太可能被靶向肾,从而不太可能被从身体清除。与has结合不太牢固的脂质或基于脂质的配体可用于将共轭物靶向肾。在优选的实施方案中,基于脂质的配体结合has。优选地,其以充足的亲和力结合has以便共轭物优选地被分布至非肾组织。然而,优选亲和力未强至使得has-配体结合不可逆转。在另一个优选的实施方案中,基于脂质的配体微弱地或根本不结合has,以便共轭物优选地被分布至肾。还可使用靶向肾细胞的其它部分来代替或补充基于脂质的配体。在另一个方面,配体是部分,例如维生素,其可被靶细胞吸收,例如正在增殖的细胞。此类配体对于治疗特征在于不期望的细胞增殖(例如恶性或非恶性类型的细胞,例如癌细胞)的紊乱是特别有用的。示例性维生素包括维生素a、e和k。其它示例性维生素包括b族维生素,例如叶酸、b12、核黄素、生物素、吡哆醛或被癌细胞吸收的其它维生素或营养物。还包括的是has、低密度脂蛋白(ldl)和高密度脂蛋白(hdl)。在另一个方面,配体是细胞渗透剂,优选螺旋细胞渗透剂。优选地,试剂是两亲性的。示例性试剂是肽,诸如tat或antennopedia。如果试剂是肽,其可以被修饰,包括拟肽、反演体(invertomer)、非肽或假肽连接,和d-氨基酸的使用。螺旋剂优选地是α螺旋剂,其优选地具有亲脂相和疏脂相。配体可以是肽或拟肽。拟肽(在本文中也称为寡聚拟肽)是能够折叠成与天然肽相似的轮廓分明的三维结构的分子。肽或拟肽部分可以为约5至50个氨基酸长,例如约5、10、15、20、25、30、35、40、45或50个氨基酸长(例如参见表6)。表6.示例性细胞渗透肽。肽或拟肽可以是,例如细胞渗透肽、阳离子肽、两亲性肽或疏水性肽(例如,主要由tyr、trp或phe组成)。肽部分可以是树状多肽、限制性肽(constrainedpeptide)或交联肽。在另一个选择中,肽部分可包括疏水性膜易位序列(mts)。示例性的含疏水性mts肽是具有氨基酸序列aavallpavllallap的rfgf。含疏水性mts的rfgf类似物(例如,氨基酸序列aallpvllaap)也可以是靶向部分。肽部分可以是“递送”肽,其可携带大的极性分子,包括肽、寡核苷酸和蛋白质穿过细胞膜。例如,已发现来自hivtat蛋白(grkkrrqrrrppq)和果蝇触角足蛋白(rqikiwfqnrrmkwkk)的序列能够用作递送肽。肽或拟肽可由dna的随机序列编码,诸如从噬菌体展示文库或一珠一化合物(one-bead-one-compound)(oboc)组合文库(lam等人,nature,354:82-84,1991)鉴定的肽。优选地通过掺入的单体单元拴系至irna试剂的肽或拟肽是细胞靶向肽,诸如精氨酸-甘氨酸-天冬氨酸(rgd)-肽或rgd模拟物。肽部分在长度上可在约5个氨基酸至约40个氨基酸的范围内。肽部分可具有结构修饰,诸如以增加稳定性或指导构象性质。可利用下文中描述的任意结构修饰。rgd肽部分可用于靶向肿瘤细胞,诸如内皮肿瘤细胞或乳腺癌细胞(zitzmann等人,cancerres.,62:5139-43,2002)。rgd肽可促进irna试剂靶向至多种其它组织(包括肺、肾、脾或肝)的肿瘤(aoki等人,cancergenetherapy8:783-787,2001)。优选地,rgd肽可促进irna试剂靶向至肾。rgd肽可以是线性的或环状的,并且可被修饰,例如被糖基化或甲基化以促进靶向至特定组织。例如,糖基化的rgd肽可将irna试剂递送至表达αvβ3的肿瘤细胞(haubner等人,jour.nucl.med.,42:326-336,2001)。可使用靶向在增殖细胞中富集的标志物的肽。例如,含rgd的肽和拟肽可靶向癌细胞,特别是展示αvβ3整联蛋白的细胞。因此,可使用rgd肽、含rgd的环肽、包括d氨基酸的rgd肽以及合成的rgd模拟物。除了rgd外,可使用靶向αvβ3整联蛋白配体的其它部分。通常,此类配体可用于控制增殖细胞和血管生成。靶向pecam-1、vegf或其它癌基因(例如本文中描述的癌基因)的该类型配体的优选共轭物。“细胞渗透肽”能够渗透细胞,例如,微生物细胞诸如细菌或真菌细胞,或哺乳动物细胞诸如人细胞。微生物细胞渗透肽可以是,例如α-螺旋线性肽(例如,ll-37或ceropinp1)、含二硫键的肽(例如,α-防卫素、β-防卫素或细菌素)或只含一个或两个主要氨基酸的肽(例如,pr-39或indolicidin)。细胞渗透肽还可包括核定位信号(nls)。例如,细胞渗透肽可以是二分两亲性肽,诸如mpg,其来源于hiv-1gp41和sv40大t抗原的nls的融合肽结构域(simeoni等人,nucl.acidsres.31:2717-2724,2003)。在一个实施方案中,拴系至irna试剂和/或载体寡聚物的靶向肽可以是两亲性α-螺旋肽。示例性两亲性α-螺旋肽包括但不限于天蚕素(cecropin)、lycotoxin、摩西鱼毒肽(paradaxin)、buforin、cpf、铃蟾抗菌肽-样肽(blp)、导管素(cathelicidin)、角毒素(ceratotoxin)、柄海鞘(s.clava)肽、盲鳗肠道抗菌肽(hfiap)、爪蟾抗菌肽(maginine)、brevinin-2、蛙皮抑菌肽、蜂毒肽、pleurocidin、h2a肽类、非洲爪蟾肽、esculentinis-1和caerins。许多因子优选地被认为保持螺旋稳定性的完整性。例如,可利用最大数目的螺旋稳定化残基(例如,leu、ala或lys),可利用最少数目的螺旋去稳定化残基(例如,脯氨酸或环状单体单元)。可考虑加帽残基(cappingresidue)(例如gly是示例性n-加帽残基)和/或可将c-末端酰胺化用于提供额外h键以稳定螺旋。相隔i±3或i±4个位置的、具有相反电荷的残基之间的盐桥的形成可提供稳定性。例如,阳离子残基,诸如赖氨酸、精氨酸、高精氨酸、鸟氨酸或组氨酸可与阴离子残基谷氨酸或天冬氨酸形成盐桥。肽和拟肽配体包括这样的配体,所述配体具有天然存在或修饰的肽,例如d或l肽;α、β或γ肽;n-甲基肽;氮杂肽;具有一个或多个酰胺,即键被一个或多个尿素、硫脲、氨基甲酸酯或磺酰脲键取代的的肽;或环肽类。靶向配体可以是能够靶向特定受体的任意配体。实例为:叶酸、galnac、半乳糖、甘露糖、甘露糖-6p、糖簇例如galnac簇、甘露糖簇、半乳糖簇或适体。簇是两个或更多个糖单元的组合。靶向配体还包括整联蛋白受体配体、趋化因子受体配体、转铁蛋白、生物素、5-羟色胺受体配体、psma、内皮缩血管肽、gcpii,生长抑素,ldl和hdl配体。配体还可基于核酸,例如适体。适体可以是未修饰的或具有本文中公开的修饰的任意组合。内体释放剂包括咪唑类、聚咪唑或寡咪唑类、pei、肽、融合肽、聚羧酸酯、聚阳离子、掩蔽的寡或聚阳离子或阴离子、缩醛类、聚缩醛、缩酮/聚酮类、原酸酯、具有掩蔽或非掩蔽的阳离子或阴离子电荷的聚合物、具有掩蔽或非掩蔽的阳离子或阴离子电荷的树状大分子。pk调节剂代表药代动力学调节剂。pk调节剂包括亲脂体、胆酸、类固醇、磷脂类似物、肽、蛋白结合剂、peg、维生素等。示例性的pk调节剂包括但不限于胆固醇、脂肪酸、胆酸、石胆酸、二烷基甘油酯类、二酰基甘油酯、磷脂类、鞘脂类、萘普生、布洛芬、维生素e、生物素等。还已知包含许多硫代磷酸酯键的寡核苷酸与血清蛋白结合,因而在主链中包含多个硫代磷酸酯键的短寡核苷酸(例如约5个碱基、10个碱基、15个碱基或20个碱基的寡核苷酸)作为配体(例如,作为pk调节配体)也属于本发明。此外,结合血清成分(例如血清蛋白)的适体作为pk调节配体也属于本发明。属于本发明的其它配体描述于如下共同待决的申请中:2004年8月10日提交的ussn:10/916,185;2004年9月21日提交的ussn:10/946,873;2007年8月3日提交的ussn:10/833,934;2005年4月27日提交的ussn:11/115,989和2007年11月21日提交的ussn:11/944,227,为了所有目的以引用的方式整体并入。当存在两个或更多个配体时,配体可都具有相同的性质,都具有不同的性质或一些配体具有相同的性质而其它配体具有不同的性质。例如,配体可具有靶向性质,具有溶内体活性或具有pk调节性质。在优选的实施方案中,全部配体都具有不同性质。可将配体偶联至寡核苷酸的不同位置例如,3’末端、5’末端和/或在内部位置。在优选的实施方案中,通过居间系链将配体连接至寡核苷酸。当将所述单体掺入正在生长的链内时,配体或拴系的配体可存在于所述单体上。在一些实施方案中,可在已将“前体”单体掺入正在生长的链后,通过将配体偶联至所述“前体”单体来掺入配体。例如,可将具有,例如端氨基系链(amino-terminatedtether)(即,不具有连接的配体),例如tap-(ch2)nnh2的单体掺入正在生长的有义或反义链。在随后的操作中,即在将前体单体掺入链后,随后可通过将配体的亲电基团与前体单体的系链的末端亲核基团的偶联来将具有亲电基团(例如五氟苯酯或醛基)的配体连接至前体单体。对于双链寡核苷酸,可将配体连接至一条链或两条链。在一些实施方案中,双链irna试剂包含共轭至有义链的配体。在其它实施方案中,双链irna试剂包含共轭至反义链的配体。在一些实施方案中,可将配体共轭至核碱基、糖部分或核酸分子的核苷间键。与嘌呤核碱基或其衍生物的共轭可在任意位置上发生,包括内环和外环原子。在一些实施方案中,将嘌呤核碱基的2-,6-,7-或8-位置连接至共轭物部分。与嘧啶核碱基或其衍生物的共轭也可在任意位置上发生。在一些实施方案中,嘧啶核碱基的2-,5-和6-位置可用共轭物部分取代。与核苷的糖部分的共轭可在任意碳原子上发生。可与共轭物部分连接的糖部分的示例性碳原子包括2'、3'和5'碳原子。还可将1'位置连接至共轭物部分,诸如在无碱基残基中。核苷间键还可具有共轭物部分。对于含磷键(例如,磷酸二酯、硫代硫酸酯、二硫代磷酸酯、氨基磷酰酯等),可直接将共轭物部分连接至磷原子或与磷原子结合的o、n或s原子。对于含胺或酰胺的核苷间键(例如,pna),可将共轭物部分连接至胺或酰胺的氮原子或相邻的碳原子。存在许多用于制备寡聚化合物的共轭物的方法。通常,通过将寡聚化合物上的反应基团(例如,oh、sh、胺、羧基、醛等)与共轭物部分上的反应基团的接触来将寡聚化合物连接至共轭物部分。在一些实施方案中,一个反应基团是亲电的并且另一个是亲核的。例如,亲电基团可以是含羰基官能度并且亲电基团可以是胺或硫醇基。用于共轭核酸和具有或不具有连接基团的相关寡聚化合物的方法详尽地描述于参考文献,诸如例如manoharaninantisenseresearchandapplications,crooke和lebleu编辑,crcpress,bocaraton,fla.,1993,第17章,其以引用的方式全文并入本文。教导寡核苷酸共轭物的制备的代表性美国专利包括但不限于美国专利no.4,828,979;4,948,882;5,218,105;5,525,465;5,541,313;5,545,730;5,552,538;5,578,717,5,580,731;5,580,731;5,591,584;5,109,124;5,118,802;5,138,045;5,414,077;5,486,603;5,512,439;5,578,718;5,608,046;4,587,044;4,605,735;4,667,025;4,762,779;4,789,737;4,824,941;4,835,263;4,876,335;4,904,582;4,958,013;5,082,830;5,112,963;5,214,136;5,082,830;5,112,963;5,149,782;5,214,136;5,245,022;5,254,469;5,258,506;5,262,536;5,272,250;5,292,873;5,317,098;5,371,241,5,391,723;5,416,203,5,451,463;5,510,475;5,512,667;5,514,785;5,565,552;5,567,810;5,574,142;5,585,481;5,587,371;5,595,726;5,597,696;5,599,923;5,599,928;5,672,662;5,688,941;5,714,166;6,153,737;6,172,208;6,300,319;6,335,434;6,335,437;6,395,437;6,444,806;6,486,308;6,525,031;6,528,631;6,559,279;这些专利各自以引用的方式并入本文。核酸-脂质颗粒的特征在某些实施方案中,本发明涉及用于产生脂质封装的核酸颗粒(其中核酸被封装在脂质层内)的方法和组合物。使用多个生物物理学参数表征此类掺入siran寡核苷酸的核酸-脂质颗粒,所述参数包括:(1)药物脂质比;(2)封装效率;和(3)颗粒大小。期望高药物脂质比、高封装效率、良好的核酸酶抗性以及血清稳定性和可控的颗粒大小,通常直径小于200nm。此外,核酸聚合物的性质是非常重要的,因为为了赋予核酸酶抗性而进行的核酸的修饰增加了治疗剂的成本,然而在许多情况下只提供有限的抗性。除非另外说明,否则在本说明书中如下计算这些标准:核酸脂质比是确定的制剂体积中的核酸的量除以相同体积中脂质的量。这可基于每摩尔的摩尔数或基于每重量的重量数或基于每摩尔的重量数。对于最终的即可施用的制剂,在已应用透析、层析法和/或酶(例如,核酸酶)降解除去尽可能多的外部核酸后,计算核酸:脂质比;封装效率是指起始混合物的药物脂质比除以最终的施用感受态制剂(administrationcompetentformulation)的药物脂质比。这是相对效率的量度。关于绝对效率的量度,也可计算加入起始混合物(结束于施用感受态制剂)的核酸的总量。在配制过程中损失的脂质的量也是可以计算的。效率是对配制的浪费和消耗的量度;以及大小表示形成的颗粒的大小(直径)。大小分布可在nicompmodel370亚微米粒度仪上使用准弹性光散射(quasi-elasticlightscattering)(qels)来测定。200nm以下的颗粒对于分布至新形成血管的(渗漏的)组织(诸如肿瘤和炎症的部位)而言是优选的。药物组合物本发明的脂质颗粒,特别地当与治疗剂缔合时,可配制为药物组合物,例如,其还包含根据施用途径和标准药学实践选择的药学上可接受的稀释剂、赋形剂或载体,诸如生理盐水或磷酸盐缓冲液。在特定的实施方案中,包含本发明的脂质-核酸颗粒的药物组合物按照标准技术来制备,并且还包含药学上可接受的载体。通常,将生理盐水用作药学上可接受的载体。其它适当的载体包括,例如水、缓冲用水、0.9%盐水、0.3%甘氨酸等,包括用于增加稳定性的糖蛋白,诸如白蛋白、脂蛋白、球蛋白等。在包含盐水或其它含盐载体的组合物中,优选地在脂质颗粒形成后加入载体。因此,在形成脂质-核酸组合物后,可将组合物稀释至药学上可接受的载体,例如生理盐水中。可通过常规的公知灭菌技术对所得的药物制剂进行灭菌。然后包装水溶液以待使用或在无菌条件下将其过滤并且冻干,在施用之前将冻干的制剂与无菌水溶液组合。组合物可包含如接近生理条件所需的药学上可接受的辅助物质,诸如ph调节剂和缓冲剂、张力调节剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙等。此外,脂质悬液可包含脂质保护剂,其保护脂质在贮存中免受自由基和脂质-超氧化破坏。亲脂性自由基淬灭剂,诸如α-生育酚和水溶性铁特异性螯合剂(诸如铁草胺)是适当的。药物制剂中脂质颗粒或脂质-核酸颗粒的浓度可广泛地变化,即按重量计从少于约0.01%,通常约或至少约0.05-5%至多达10至30%,并且将按照选择的特定施用模式,主要依据流体体积、粘度等进行选择。例如,可增加浓度以降低与治疗相关的流体负载。这在患有动脉粥样硬化相关充血性心力衰竭或严重高血压的患者中是特别理想的。可选地,可稀释由刺激性脂质组成的复合物以降低浓度,从而在施用的部位减轻炎症。在一组实施方案中,核酸可具有连接的标记并且可用于诊断(通过指示互补核酸的存在)。在该情况下,施用的复合物的量将取决于所使用的特定标记、待诊断的疾病状态和临床医生的判断,但其通常可在约0.01至约50mg/千克体重之间,优选约0.1至约5mg/kg体重之间。如上所指出的,本发明的脂质-治疗剂(例如,核酸)颗粒可包括聚乙二醇(peg)-修饰的磷脂类、peg-神经酰胺或神经节苷脂gm1-修饰的脂质或有效地阻止或限制聚集的其它脂质。此类成分的添加不仅仅防止复合物聚集。相反,其还可提供用于增加循环寿命和增加脂质-核酸组合物至靶组织的递送的方法。本发明还以试剂盒形式提供了脂质-治疗剂组合物。试剂盒通常由经划分用以容纳试剂盒的不同成分的容器组成。试剂盒将包括优选地以脱水或浓缩的形式的本发明的颗粒或药物组合物,以及用于其再水化或稀释和施用的说明书。在某些实施方案中,颗粒包含活性剂,然而在其它实施方案中,它们不包含活性剂。生产方法本发明的方法和组合物利用某些阳离子脂质,它们的合成、制备和表征描述于下文和所附的实施例中。此外,本发明提供了制备脂质颗粒(包括与治疗剂,例如核酸缔合的脂质颗粒)的方法。在本文描述的方法中,将脂质的混合物与核酸的缓冲水溶液组合来产生含有封装在脂质颗粒中的核酸的中间混合物,其中所述封装的核酸以约3wt%至约25wt%,优选地5至15wt%的核酸/脂质比存在。可任选地对中间混合物的大小分级以获得脂质封装的核酸颗粒,其中脂质部分是优选地具有30至150nm,更优选地约40至90nm的直径的单室囊泡。然后使ph升高以中和至少一部分脂质-核酸颗粒上的表面电荷,从而提供至少部分地表面中和的脂质封装的核酸组合物。如上所述,几种此类阳离子脂质是在低于氨基的pka的ph下带电荷的并且在高于pka的ph下大体上中性的氨基脂质。此类阳离子脂质称为可滴定的阳离子脂质并且可利用两步法将其用于本发明的制剂。第一,可在核酸存在的情况下在较低的ph下用可滴定的阳离子脂质和其它囊泡成分来形成脂质囊泡。用这种方式,囊泡将封装和捕获核酸。第二,可通过将介质的ph升高至高于存在的可滴定的阳离子脂质的pka的水平,即升高至生理ph或更高,来中和新形成的囊泡的表面电荷。该方法的特别有利的方面包括任何表面吸附的核酸的轻易除去和所得的具有中性表面的核酸递送载体。具有中性表面的脂质体或脂质颗粒期望可避免从循环中的快速清除和避免与阳离子脂质体制剂相关的某些毒性。关于此类可滴定的阳离子脂质在核酸-脂质颗粒的配制中的这些用途的其它详细内容提供于美国专利6,287,591和美国专利6,858,225,该专利以引用的方式并入本文。还要指出的是,以该方式形成的囊泡提供了具有高核酸含量的均一囊泡大小的制剂。此外,所述囊泡具有约30至约150nm,更优选地约30至约90nm的范围内的大小。不期望受任何具体理论的束缚,据认为非常高的核酸封装效率是在低ph下的静电作用的结果。在酸性ph(例如ph4.0)下,载体表面带电荷并且通过静电作用结合部分核酸。当用更中性的缓冲液(例如,ph7.5)交换外部酸性缓冲液时,脂质颗粒或脂质体的表面被中和,从而使任何外部核酸被除去。关于配制方法的更详细的信息记载于各种出版物(例如,美国专利6,287,591和美国专利6,858,225)中。鉴于以上所述,本发明提供了制备脂质/核酸制剂的方法。在本文中描述的方法中,将脂质的混合物与核酸的缓冲水溶液组合以产生含有封装在脂质颗粒中的核酸的中间混合物,例如其中所述封装的核酸以约10wt%至约20wt%的核酸/脂质比存在。可任选地对中间混合物的大小进行分级以获得其中脂质部分是优选地具有30至150nm,更优选地约40至90nm的直径的单层囊泡的脂质封装的核酸颗粒。然后使ph升高以中和脂质-核酸颗粒上的至少一部分表面电荷,因而提供至少部分表面中和的脂质封装的核酸组合物。在某些实施方案中,脂质的混合物包括至少两种脂质成分:本发明的第一脂质成分,其选自具有这样pka的脂质(使得在低于该pka的ph下脂质为阳离子的并且在高于该pka的ph下为中性),和第二脂质成分,其选自在脂质-核酸颗粒形成过程中阻止颗粒聚集的脂质。在特定的实施方案中,氨基脂质是本发明的新型阳离子脂质。在制备本发明的核酸-脂质颗粒中,脂质的混合物通常是有机溶剂中的脂质溶液。然后可将该脂质混合物进行干燥以形成薄膜或冻干以形成粉剂(然后用水性缓冲液进行水化以形成脂质体)。可选地,在优选的方法中,可将脂质混合物溶解在水混溶的醇(例如乙醇)中,将该乙醇溶液加入水性缓冲液中,从而导致自发性脂质体形成。在大多数实施方案中,将醇以其可商购获得的形式进行使用。例如,乙醇可以以无水乙醇(100%)或以95%的乙醇(其余部分为水)的形式来使用。该方法更详细地描述于美国专利5,976,567中。在一个示例性的实施方案中,脂质的混合物是醇溶剂中的阳离子脂质、中性脂质(除了阳离子脂质以外)、固醇(例如,胆固醇)和peg修饰的脂质(例如,peg-dmg或peg-dma)的混合物。在优选的实施方案中,脂质混合物主要包括醇(更优选乙醇)中的阳离子脂质、中性脂质、胆固醇和peg-修饰的脂质。在其它优选的实施方案中,第一溶液包括摩尔比为约20-70%阳离子脂质:5-45%中性脂质:20-55%胆固醇:0.5-15%peg-修饰的脂质的上述脂质混合物。在其它优选的实施方案中,第一溶液主要包括选自表1的脂质、dspc、胆固醇和peg-dmg或peg-dma,更优选地摩尔比为约20-60%阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组优选的实施方案中,用popc、dppc、dope或sm替代此类组合物中的中性脂质。根据本发明,将脂质混合物与可包含核酸的缓冲水溶液组合。缓冲水溶液通常为其中缓冲剂的ph低于脂质混合物中的低于可质子化脂质的pka的溶液。适当的缓冲剂的实例包括柠檬酸盐、磷酸盐、醋酸盐和mes。特别优选的缓冲剂是柠檬酸盐缓冲剂。优选的缓冲剂在可1至1000mm的阴离子的范围内,取决于待封装的核酸的化学性质,并且缓冲液浓度的最优化对于获得高装载水平可以是非常重要的(参见,例如,美国专利6,287,591和美国专利6,858,225)。可选地,可使用利用氯化物、硫酸盐等酸化至ph5-6的纯水。在该情况下,可以适当地加入5%葡萄糖,或另一种非离子溶质(当将颗粒进行透析以除去乙醇时所述非离子溶质可平衡跨颗粒膜的渗透势),增加ph或与药学上可接受的载体(诸如生理盐水)混合。缓冲液中核酸的量可变化,但通常为约0.01mg/ml至约200mg/ml,更优选地为约0.5mg/ml至约50mg/ml。将脂质的混合物和治疗性核酸的缓冲水溶液组合以提供中间混合物。中间混合物通常是具有封装核酸的脂质颗粒的混合物。此外,中间混合物还可包含因带负电荷的核酸与脂质颗粒表面上的带正电荷的脂质(氨基脂质或组成可质子化的第一脂质成分的其它脂质在具有低于脂质上可质子化基团的pka的ph的缓冲液中带正电荷)的离子吸引而附着至脂质颗粒(脂质体或脂质囊泡)的表面的部分核酸。在一组优选的实施方案中,脂质的混合物是脂质的醇溶液并且调整每一种溶液的体积以便在组合后,所得的醇含量为约20%体积至约45%体积。组合混合物的方法可包括多种方法中的任意一种,这通常取决于产生的制剂的规模。例如,当总体积为约10-20ml或更少时,可将溶液在试管中组合并且使用涡旋搅拌器搅拌在一起。可在适当的生产规模玻璃器具中进行大规模加工。任选地,可将通过组合脂质混合物和治疗剂(核酸)的缓冲水溶液而产生的脂质封装的治疗剂(例如,核酸)复合物进行大小分级以获得期望的大小范围和脂质颗粒大小的相对窄分布。优选地,将本文中提供的组合物进行大小分级以获得约70至约200nm,更优选地约90至约130nm的平均直径。几种技术可用于将脂质体的大小分级至期望的大小。一种大小分级的方法描述于美国专利no.4,737,323中,该专利以引用的方式并入本文。通过水浴或探针超声对脂质体悬液的超声处理产生大小逐渐减小至小于约0.05微米的小单室囊泡(suv)。匀化(homogenization)是依赖于将大脂质体片段化成更小的脂质体的剪切能的另一种方法。在典型的匀化方法中,通过标准乳液匀化器(homogenizer)来再循环多室囊泡,直至观察到选择的脂质大小(通常在约0.1至0.5微米之间)。在两种方法中,可通过常规激光束粒度测定来监控粒度分布。对于本文中的某些方法,利用挤压以获得均一的囊泡大小。脂质体组合物通过小孔聚碳酸酯膜或不对称陶瓷膜的挤压导致相对明确界定的大小分布。典型地,将悬液通过膜进行循环1次或更多次直至获得想要的脂质体复合物大小分布。可将脂质体进行挤压通过连续更小孔的膜,以获得脂质体大小的逐渐减小。在一些情况下,可在不进行任何大小分级的情况下使用形成的脂质-核酸组合物。在特定的实施方案中,本发明的方法还包括中和脂质-核酸组合物的脂质部分上的至少一些表面电荷的步骤。通过至少部分地中和表面电荷,使未封装的核酸从脂质颗粒表面游离并且可使用常规技术将其从组合物中除去。优选地,通过缓冲液的交换从所得的组合物除去未封装的和表面吸附的核酸。例如,用hepes-缓冲盐水(hbsph约7.5)溶液替代柠檬酸盐缓冲液(ph约4.0,用于形成组合物)导致脂质表面的中和并且核酸从表面释放。然后使用标准方法通过层析来除去释放的核酸,然后转移至具有高于所使用脂质的pka的ph的缓冲液中。任选地,可通过在水性缓冲液中的水化来形成脂质囊泡(即,脂质颗粒),并在加入核酸之前使用上述任意方法对脂质囊泡进行大小分级。如上所述,水性缓冲液应当具有低于氨基脂质的pka的ph。然后可将核酸溶液加入至这些大小分级的、预先形成的囊泡。为了使核酸封装到此类“预先形成的”囊泡中,混合物应当包含醇,诸如乙醇。在乙醇的情况下,其应当以约20%(w/w)至约45%(w/w)的浓度存在。此外,取决于脂质囊泡的组合物和核酸的性质,可能必需将水性缓冲液-乙醇混合物中预先形成的囊泡和核酸的混合物升温至约25℃至约50℃的温度。对于本领域技术人员显而易见的是,最优化封装方法以在脂质囊泡中获得期望水平的核酸将需要操作变量(例如乙醇浓度和温度)。在实施例中提供适用于核酸封装的条件的实例。一旦将核酸封装在预先形成的囊泡内,可增加外部ph以至少部分地中和表面电荷。然后可如上所述除去未封装的和表面吸附的核酸。使用方法可将本发明的脂质颗粒用于在体外或体内将治疗剂递送至细胞。在特定的实施方案中,治疗剂是使用本发明的核酸-脂质颗粒递送至细胞的核酸。虽然下面的使用本发明的脂质颗粒和相关药物组合物的各种方法的描述被核酸-脂质颗粒相关的的描述所例证,但要理解,此类方法和组合物可被容易地修改以用于递送治疗任何疾病或紊乱的任意治疗剂,所述疾病或紊乱将得益于这种治疗。在某些实施方案中,本发明提供了将核酸引入细胞的方法。用于引入细胞的优选核酸是sirna、免疫刺激性寡核苷酸、质粒、反义核酸和核酶。此类方法可通过将本发明的颗粒或组合物与细胞相接触一段足以使细胞内递送发生的时间来执行。本发明的组合物可被吸附至几乎任何细胞类型。一旦被吸附,核酸-脂质颗粒可被部分细胞胞吞,与细胞膜交换脂质,或与细胞融合。复合物的核酸部分的转移或掺入可通过这些途径中的任一途径发生。在意图限定本发明的范围,据认为在颗粒通过胞吞作用被摄取进细胞的情况下,所述颗粒然后与内体膜相互作用,可能通过形成非双层相导致内体膜的失稳定作用,从而导致封装的核酸被引入到细胞质中。类似地,在颗粒与细胞质膜直接融合的情况下,当融合发生时,脂质体膜被整合进细胞膜并且脂质体的内容物与细胞内液体合并。细胞与脂质-核酸组合物之间的接触当在体外进行时,将在生物学相容的培养基中发生。取决于具体的应用,组合物的浓度可广泛地变化,但通常在约1μmol至约10mmol之间。在某些实施方案中,用脂质-核酸组合物对细胞的处理通常将在生理温度下(约37℃)进行约1至24小时,优选地约2至8小时的时间。对于体外应用,可将核酸递送至生长在培养基中的任意细胞,无论是植物来源的或是动物来源的,无论是脊椎动物或是无脊椎动物的细胞,以及任何组织或类型的细胞。在优选的实施方案中,细胞是动物细胞,更优选地是哺乳动物细胞,最优选地是人细胞。在一组实施方案中,将脂质-核酸颗粒悬液加至60至80%融汇的具有约103至约105个细胞/ml,更优选地约2×104个细胞/ml的细胞密度的铺板细胞。加至细胞的悬液的浓度优选地为约0.01至20μg/ml,更优选地约1μg/ml。在另一个实施方案中,本发明的脂质颗粒可用于将核酸递送至细胞或细胞系(例如,肿瘤细胞系)。此类细胞系的非限定性实例包括:hela(atcccatn:ccl-2),kb(atcccatn:ccl-17),hep3b(atcccatn:hb-8064),skov-3(atcccatn:htb-77),hct-116(atcccatn:ccl-247),ht-29(atcccatn:htb-38),pc-3(atcccatn:crl-1435),a549(atcccatn:ccl-185),mda-mb-231(atcccatn:htb-26)。典型的应用包括使用公知的方法以提供sirna的细胞内递送以敲低或沉默特定细胞靶。可选地,应用包括编码治疗上有用的多肽的dna或mrna序列的递送。以这种方式,通过供给缺少的或不存在的基因产物来为遗传疾病提供治疗(即,关于杜兴肌营养不良,参见kunkel,等人,brit.med.bull.45(3):630-643(1989),和关于囊性纤维化,参见goodfellow,nature341:102-103(1989))。本发明组合物的其它用途包括将反义寡核苷酸引入细胞(参见,bennett等人,mol.pharm.41:1023-1033(1992))。可选地,本发明的组合物还可被用于使用本领域技术人员已知的方法在体内将核酸递送至细胞。关于dna或mrna序列的递送,zhu等人,science261:209-211(1993)(以引用的方式并入本文)描述了使用dotma-dope复合物的巨细胞病毒(cmv)-氯霉素乙酰转移酶(cat)表达质粒的静脉内递送。hyde等人,nature362:250-256(1993)(以引用的方式并入本文)描述了使用脂质体将囊性纤维化跨膜传导调节蛋白(cftr)基因递送至气道上皮和小鼠肺的肺泡。brigham等人,am.j.med.sci.298:278-281(1989)(以引用的方式并入本文)描述了用编码细胞内的酶氯霉素乙酰转移酶(cat)的功能性原核生物基因体内转染小鼠的肺。因此,可将本发明的组合物用于传染性疾病的治疗。关于体内施用,药物组合物优选地通过胃肠外施用,即关节内、静脉内、腹膜内、皮下或肌内来施用。在特定的实施方案中,通过快速浓注经静脉内或腹膜内施用药物组合物。对于一个实例,参见stadler等人,美国专利no.5,286,634,该专利以引用的方式并入本文。还在straubringer等人,methodsinenzymology,academicpress,newyork.101:512-527(1983);mannino等人,biotechniques6:682-690(1988);nicolau等人,crit.rev.ther.drugcarriersyst.6:239-271(1989),和behr,acc.chem.res.26:274-278(1993)中论述了细胞内核酸递送。还在例如rahman等人,美国专利no.3,993,754;sears,美国专利no.4,145,410;papahadjopoulos等人,美国专利no.4,235,871;schneider,美国专利no.4,224,179;lenk等人,美国专利no.4,522,803;和fountain等人,美国专利no.4,588,578中描述了其它的施用基于脂质的治疗剂的方法。在其它方法中,可通过将药物制剂直接用于组织来将药物制剂与靶组织接触。可通过局部、“打开的”或“关闭的”操作进行应用。对于“局部的”,其意指药物制剂直接应用于暴露于环境的组织,诸如皮肤、口咽、外耳道等。“打开的”操作是包括切开患者皮肤并直接使下面的被施加药物制剂的组织可见的那些操作。这通常通过手术操作,诸如接近肺的开胸术、接近腹腔内脏的开腹术或接近靶组织的其它直接手术。“关闭的”操作是不直接使得内部靶组织可见,但通过皮肤中的小伤口插入仪器而接近内部靶组织的侵入性方法。例如,可通过针头灌洗而将制剂施用于腹膜。同样地,可在腰椎穿刺过程中通过输注,随后通过如通常在脊椎麻醉或脊髓的甲泛醣胺成像中所实践的对患者的适当定位,将药物制剂施用于脑膜或脊髓。可选地,可通过内窥装置施用制剂。还可在吸入肺的气溶胶中(参见brigham等人,am.j.sci.298(4):278-281(1989))或通过在疾病部位直接注射(culver,humangenetherapy,maryannliebert,inc.,publishers,newyork.第70-71页(1994))来施用脂质-核酸组合物。.可在多种宿主中实践种本发明的方法。优选宿主包括哺乳动物物种,诸如人、非人灵长类动物、狗、猫、牛、马、绵羊及类似物种。本发明的脂质-治疗剂颗粒的剂量将取决于治疗剂对脂质的比率并且施用医生基于患者的年龄、体重和状况的意见。在一个实施方案中,本发明提供了调节靶多核苷酸或多肽的表达的方法。此类方法通常包括将细胞与本发明的脂质颗粒接触,所述脂质颗粒与能够调节靶多核苷酸或靶多肽的表达的核酸缔合。如本文中所使用的,术语“调节”是指改变靶多核苷酸或靶多肽的表达。在不同的实施方案中,调节可表示增加或增强,或它可表示减少或降低。测量靶多核苷酸或靶多肽的表达水平的方法在本领域内是已知的和可获得的,并且包括例如利用逆转录聚合酶链式反应(rt-pcr)和免疫组织化学技术的方法。在特定的实施方案中,靶多核苷酸或靶多肽的表达水平与适当的对照值相比较增加或减少10%、20%、30%、40%、50%或大于50%。例如,如果期望多肽的表达增加,那么核酸可以是包括编码期望多肽的多核苷酸的表达载体。在另一方面,如果期望多核苷酸或多肽的表达减少,那么核酸可以是例如反义寡核苷酸、sirna或微rna,它们包含与编码靶多肽的多核苷酸特异性杂交,从而破坏靶多核苷酸或靶多肽的表达的多核苷酸序列。可选地,核酸可以是表达这种反义寡核苷酸、sirna或微rna的质粒。在一个特定的实施方案中,本发明提供了调节细胞对多肽的表达的方法,该方法包括给细胞提供包括或主要包括选自表1的脂质、dspc、胆固醇和peg-dmg或peg-dma(例如,以约20-60%阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma的摩尔比)的脂质颗粒,其中所述脂质颗粒与能够调节多肽的表达的核酸缔合。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组实施方案中,用popc、dppc、dope或sm替代这些组合物中的中性脂质。在特定的实施方案中,治疗剂选自sirna、微rna、反义寡核苷酸和能够表达sirna、微rna或反义寡核苷酸的质粒,并且其中sirna、微rna或反义rna包含与编码多肽的多核苷酸或其补体特异性结合以便减少所述多核苷酸的表达的多核苷酸。在其它实施方案中,核酸是对多肽或其功能性变体或片段编码的质粒,使得增加所述多肽或其功能性变体或片段的表达。在相关的实施方案中,本发明提供了治疗特征在于受治疗者中多肽的过表达的疾病或紊乱的方法,包括给受治疗者提供本发明的药物组合物,其中所述治疗剂选自sirna、微rna、反义寡核苷酸和能够表达sirna、微rna或反义寡核苷酸的质粒,并且其中sirna、微rna或反义rna包含编码多肽的多核苷酸或其补体特异性结合的多核苷酸。在一个实施方案中,药物组合物包含由或基本上由选自表1的脂质、dspc、胆固醇和peg-dmg或peg-dma(例如,以约20-60%阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma的摩尔比)组成的脂质颗粒,其中所述脂质颗粒与治疗性核酸缔合。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组实施方案中,用popc、dppc、dope或sm替代这些组合物中的中性脂质。在另一个相关实施方案中,本发明包括治疗特征在于受治疗者中多肽的表达不足的疾病或紊乱的方法,包括给受治疗者提供本发明的药物组合物,其中所述治疗剂是对所述多肽或其功能性变体或片段编码的质粒。在一个实施方案中,药物组合物包含由或基本上由选自表1的脂质、dspc、胆固醇和peg-dmg或peg-dma(例如,以约20-60%阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma的摩尔比)组成的脂质颗粒,其中所述脂质颗粒与治疗性核酸缔合。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组实施方案中,用popc、dppc、dope或sm替代这些组合物中的中性脂质。本发明还提供了诱发受治疗者的免疫应答的方法,包括给受治疗者提供本发明的药物组合物,其中所述治疗剂是免疫刺激性寡核苷酸。在某些实施方案中,免疫应答是体液或粘膜免疫应答。在一个实施方案中,药物组合物包含由或基本上由选自表1的脂质、dspc、胆固醇和peg-dmg或peg-dma(例如,以约20-60%阳离子脂质:5-25%dspc:25-55%胆固醇:0.5-15%peg-dmg或peg-dma的摩尔比)组成的脂质颗粒,其中所述脂质颗粒与治疗性核酸缔合。在特定的实施方案中,摩尔脂质比为约40/10/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)、35/15/40/10(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)或52/13/30/5(阳离子脂质/dspc/胆固醇/peg-dmg或peg-dma的摩尔百分比)。在另一组实施方案中,用popc、dppc、dope或sm替代这些组合物中的中性脂质。在其它实施方案中,将药物组合物与疫苗或抗原一起提供给受治疗者。因此,本发明本身提供了包含本发明的脂质颗粒的疫苗,所述脂质颗粒包含免疫刺激性寡核苷酸并且还与需要免疫应答的抗原缔合。在特定的实施方案中,所述抗原是肿瘤抗原或与感染剂诸如病毒、细菌或寄生虫关联。多种肿瘤抗原、感染剂抗原和与其它疾病关联的抗原在本领域内是公知的并且此类抗原的实例描述于本文中引用的参考文献中。适合用于本发明的抗原的实例包括但不限于多肽抗原和dna抗原。抗原的具体实例是甲型肝炎、乙型肝炎、天花、脊髓灰质炎、炭疽、流感、斑疹伤寒、破伤风、麻疹、轮状病毒、白喉、百日咳、肺结核和风疹抗原。在优选的实施方案中,抗原是乙型肝炎重组抗原。在其它方面,抗原是甲型肝炎重组抗原。在另一个方面,抗原是肿瘤抗原。此类肿瘤相关抗原的实例是muc-1、ebv抗原和与伯基特淋巴瘤关联的抗原。在其它方面,抗原是酪氨酸酶相关的蛋白肿瘤抗原重组抗原。本领域技术人员了解适合用于本发明的其它抗原。适合用于本发明的肿瘤相关抗原包括突变和非突变的分子,所述分子可以是单个肿瘤类型的标志,为几种类型的肿瘤所共有和/或与正常细胞相比较只在肿瘤细胞中表达或过表达。除了蛋白质和糖蛋白外,还记录了糖类、神经节苷脂类、糖脂类和粘蛋白类的肿瘤特异性表达模式。用于所述受治疗者癌症疫苗的示例性肿瘤相关抗原包括癌基因、肿瘤抑制基因和具有对于肿瘤细胞是独特的突变或重排的其它基因的蛋白质产物、再活化的胚胎基因产物、癌胚抗原、组织特异性(但非肿瘤特异性)分化抗原、生长因子受体、细胞表面糖残基、外源病毒蛋白和许多其它自身蛋白质。肿瘤相关抗原的具体实施方案包括,例如突变的抗原,诸如rasp21原癌基因、肿瘤抑制基因p53和bcr-abl癌基因的蛋白质产物以及cdk4、mum1、caspase8和β连环蛋白;过表达的抗原,诸如半乳糖凝集素4、半乳糖凝集素9、碳酸酐酶、醛缩酶a、prame、her2/neu、erbb-2和ksa、癌胚抗原,诸如α胎儿球蛋白(afp)、人绒毛膜促性腺素(hcg);自身抗原,诸如癌胚抗原(cea)和黑色素细胞分化抗原,诸如mart1/melana、gp100、gp75、酪氨酸酶、trp1和trp2;前列腺相关抗原,诸如psa、pap、psma、psm-p1和psm-p2;再活化的胚胎基因产物,诸如mage1、mage3、mage4、gage1、gage2、bage、rage和其它癌症睾丸抗原,诸如ny-eso1、ssx2和scp1;粘蛋白类,诸如muc-1和muc-2;神经节苷脂类,诸如gm2、gd2和gd3、中性糖脂和糖蛋白类,诸如lewis(y)和globo-h;和糖蛋白类,诸如tn、thompson-freidenreich抗原(tf)和stn。本文中还包括作为肿瘤相关抗原的是完整细胞和肿瘤细胞裂解物以及其免疫原性部分,以及在用于抗b细胞淋巴瘤的b淋巴细胞的单克隆增殖上表达的免疫球蛋白特异型。病原体包括但不限于传染剂,例如感染哺乳动物,更具体地感染人的病毒。传染性病毒的实例包括但不限于:逆转录病毒科(例如,人免疫缺陷病毒,诸如hiv-1(也称为htlv-iii、lav或htlv-iii/lav、或hiv-iii;和其它分离株,诸如hiv-lp;微小核糖核酸病毒科(例如,脊髓灰质炎病毒、甲型肝炎病毒;肠道病毒、人柯萨奇病毒、鼻病毒、埃可病毒);杯状病毒科(例如,引起胃肠炎的菌株);披膜病毒科(例如,马脑炎病毒、风疹病毒);黄病毒科(例如,登革病毒、脑炎病毒、黄热病病毒);冠状病毒科(coronoviridae)(例如,冠状病毒);弹状病毒科(rhabdoviradae)(例如,水泡性口炎病毒、狂犬病病毒);冠状病毒科(coronaviridae)(例如,冠状病毒);弹状病毒科(rhabdoviridae)(例如,水泡性口炎病毒、狂犬病病毒);丝状病毒科(例如,埃博拉病毒);副粘液病毒科(例如,副流感病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒);正粘病毒科(例如流感病毒);布尼亚病毒科(例如,汉坦病毒、bunga病毒、静脉病毒和内罗病毒(nairovirus));沙粒病毒科(arenaviridae)(出血热病毒);呼肠孤病毒科(例如,呼肠孤病毒、环状病毒(orbiviurs)和轮状病毒);双rna病毒科;肝dna病毒科(乙型肝炎病毒);微小dna病毒科(微小病毒);乳多空病毒科(乳头状瘤病毒、多瘤病毒);腺病毒科(大多数腺病毒);疱疹病毒科、单纯疱疹病毒(hsv)1型和2型、水痘带状疱疹病毒、巨细胞病毒(cmv)、疱疹病毒;痘病毒科(天花病毒、痘苗病毒、痘病毒);和虹彩病毒科(例如,非洲猪瘟病毒);和未分类的病毒(例如,海绵样脑病的病原因子)、丁型肝炎的因子(据认为是乙型肝炎病毒的缺陷性卫星病毒)、非甲型肝炎、非乙型肝炎的因子(第1类=内部传递的;2类=肠胃外传播的(即丙型肝炎);诺瓦克病毒和相关病毒,以及星状病毒)。此外,革兰阴性和革兰阳性细菌在脊椎动物中充当抗原。此类革兰阳性细菌包括但不限于巴斯德菌属(pasteurella)物种、葡萄球菌属(staphylococci)物种和链球菌属(streptococcus)物种。革兰阴性细菌包括但不限于大肠杆菌(escherichiacoli)、假单胞菌属(pseudomonas)物种和沙门菌属(salmonella)物种。传染性细菌的具体实例包括但不限于:幽门螺杆菌(helicobacterpyloris)、博氏疏螺旋体(boreliaburgdorferi、嗜肺军团菌(legionellapneumophilia)、分枝杆菌属(例如,结核分枝杆菌(m.tuberculosis)、鸟分枝杆菌(m.avium)、胞内分枝杆菌(m.intracellulare)、堪萨斯分枝杆菌(m.kansaii)、戈登氏分枝杆菌(m.gordonae))、金黄色葡萄球菌(staphylococcusaureus)、淋病奈瑟氏菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏菌(neisseriameningitidis)、单核细胞增多性李斯特菌(listeriamonocytogenes)、酿脓链球菌(streptococcuspyogenes)(a组链球菌(groupastreptococcus))、无乳链球菌(streptococcusagalactiae)(b组链球菌)、链球菌(草绿色组)、粪链球菌(streptococcusfaecalis)、牛链球菌(streptococcusbovis)、链球菌属(厌氧种)、肺炎链球菌(streptococcuspneumoniae)、病原性弯曲杆菌属(campylobactersp.)、肠球菌属(enterococcussp.)、流感嗜血杆菌(haemophilusinfuenzae)、炭疽杆菌(bacillusantracis)、白喉棒状杆菌(corynebacteriumdiphtheriae)、棒状杆菌属(corynebacteriumsp.)、红斑丹毒丝菌(erysipelothrixrhusiopathiae)、产气荚膜梭菌(clostridiumperfringers)、破伤风梭菌(clostridiumtetani)、产气肠杆菌(enterobacteraerogenes)、肺炎克雷伯氏杆菌(klebsiellapneumoniae)、多杀巴斯德氏菌(pasturellamultocida)、拟杆菌属(bacteroidessp.)、具核梭杆菌(fusobacteriumnucleatum)、念珠状链杆菌(streptobacillusmoniliformis)、苍白密螺旋体(treponemapallidium)、细弱密螺旋体(treponemapertenue)、钩端螺旋体属(leptospira)、立克次氏体(rickettsia)和衣氏放线菌(actinomycesisraelli)。病原体的其它实例包括但不限于感染哺乳动物,更具体地感染人的传染性真菌。传染性真菌的实例包括但不限于:新型隐球菌(cryptococcusneoformans)、荚膜组织胞浆菌(histoplasmacapsulatum)、粗球孢子菌(coccidioidesimmitis)、皮炎芽生菌(blastomycesdermatitidis)、沙眼衣原体(chlamydiatrachomatis)、白色念珠菌(candidaalbicans)。传染性寄生虫的实例包括疟原虫属,诸如链状疟原虫、三日疟原虫、卵形疟原虫和间日疟原虫。其它传染性生物体(即,原生动物)包括鼠弓形体(toxoplasmagondii)。在一个实施方案中,本发明的制剂可用于沉默或调节靶基因,诸如但不限于fvii、eg5、pcsk9、tpx2、apob、saa、ttr、rsv、pdgfβ基因、erb-b基因、src基因、crk基因、grb2基因、ras基因、mekk基因、jnk基因、raf基因、erk1/2基因、pcna(p21)基因、myb基因、jun基因、fos基因、bcl-2基因、cyclind基因、vegf基因、egfr基因、细胞周期蛋白a基因、细胞周期蛋白e基因、wnt-1基因、β-连环蛋白基因、c-met基因、pkc基因、nfkb基因、stat3基因、存活素基因、her2/neu基因、sort1基因、xbp1基因、拓扑异构酶i基因、拓扑异构酶iiα基因、p73基因、p21(waf1/cip1)基因、p27(kip1)基因、ppm1d基因、ras基因、小窝蛋白i基因、mibi基因、mtai基因、m68基因、肿瘤抑制基因、p53肿瘤抑制基因基因、p53家族成员dn-p63、prb肿瘤抑制基因、apc1肿瘤抑制基因、brca1肿瘤抑制基因、pten肿瘤抑制基因、mll融合基因、bcr/abl融合基因、tel/aml1融合基因、ews/fli1融合基因、tls/fus1融合基因、pax3/fkhr融合基因、aml1/eto融合基因、αv-整联蛋白基因、flt-1受体基因、微管蛋白基因、人乳头状瘤病毒基因、人乳头状瘤病毒复制所需的基因、人免疫缺陷性病毒基因、人免疫缺陷性病毒复制所需的基因、甲型肝炎病毒基因、甲型肝炎病毒复制所需的基因、乙型肝炎病毒基因、乙型肝炎病毒复制所需的基因、丙型肝炎病毒基因、丙型肝炎病毒复制所需的基因、丁型肝炎病毒基因、丁型肝炎病毒复制所需的基因、戊型肝炎病毒基因、戊型肝炎病毒复制所需的基因、己型肝炎病毒基因、己型肝炎病毒基复制所需的基因、庚型肝炎病毒基因、庚型肝炎病毒复制所需的基因、辛型肝炎病毒基因、辛型肝炎病毒复制所需的基因、呼吸道合胞病毒基因、呼吸道合胞病毒复制所需的基因、单纯疱疹性病毒基因、单纯疱疹性病毒复制所需的基因、疱疹巨细胞病毒基因、疱疹巨细胞病毒复制所需的基因、疱疹eb病毒基因、疱疹eb病毒复制所需的基因、卡波氏肉瘤相关的疱疹病毒基因、卡波氏肉瘤相关的疱疹病毒复制所需的基因、jc病毒基因、jc病毒复制所需的人基因、粘液病毒基因、粘液病毒基因复制所需的基因、鼻病毒基因、鼻病毒复制所需的基因、冠状病毒基因、冠状病毒复制所需的基因、西尼罗病毒基因、西尼罗病毒复制所需的基因、圣路易斯脑炎(st.louisencephalitis)基因、圣路易斯脑炎复制所需的基因、蜱传脑炎病毒基因、蜱传脑炎病毒复制所需的基因、墨累河谷脑炎病毒基因、墨累河谷脑炎病毒复制所需的基因、登革热病毒基因、登革热病毒基因复制所需的基因、猿猴病毒40基因、猿猴病毒40复制所需的基因、人嗜t淋巴细胞病毒基因、人嗜t淋巴细胞病毒复制所需的基因、moloney鼠白血病病毒基因、moloney鼠白血病病毒复制所需的基因、脑心肌炎病毒基因、脑心肌炎病毒复制所需的基因、麻疹病毒基因、麻疹病毒复制所需的基因、水痘带状疱疹病毒基因、水痘带状疱疹病毒复制所需的基因、腺病毒基因、腺病毒复制所需的基因、黄热病毒基因、黄热病毒复制所需的基因、脊髓灰质炎病毒、脊髓灰质炎病毒复制所需的基因、痘病毒基因、痘病毒复制所需的基因、疟原虫基因、疟原虫基因复制所需的基因、溃疡分枝杆菌(mycobacteriumulcerans)基因、溃疡分枝杆菌复制所需的基因、结核分枝杆菌(mycobacteriumtuberculosis)基因、结核分枝杆菌复制所需的基因、麻风分枝杆菌(mycobacteriumleprae)基因、麻风分枝杆菌复制所需的基因、金黄色葡萄球菌(staphylococcusaureus)基因、金黄色葡萄球菌复制所需的基因、肺炎链球菌基因、肺炎链球菌复制所需的基因、酿脓链球菌(streptococcuspyogenes)基因、酿脓链球菌复制所需的基因、肺炎衣原体基因、肺炎衣原体复制所需的基因、肺炎支原体基因、肺炎支原体复制所需的基因、整联蛋白基因、选择蛋白基因、补体系统基因、趋化因子基因、趋化因子受体基因、gcsf基因、gro1基因、gro2基因、gro3基因、pf4基因、mig基因、前血小板碱性蛋白基因、mip-1i基因、mip-1j基因、rantes基因、mcp-1基因、mcp-2基因、mcp-3基因、cmbkr1基因、cmbkr2基因、cmbkr3基因、cmbkr5v、aif-1基因、i-309基因、离子通道的成分的基因、神经递质受体的基因、神经递质配体的基因、淀粉样蛋白家族基因、早老素基因、hd基因、drpla基因、sca1基因、sca2基因、mjd1基因、cacnl1a4基因、sca7基因、sca8基因、loh细胞中发现的等位基因或多形基因的一个等位基因。定义“烷基”意指含有1至24个碳原子的直链或支链、非环状或环状、饱和脂肪族烃。代表性饱和直链烷基包括甲基、乙基、正丙基、正丁基、正戊基、正己基等;而饱和分支的烷基包括异丙基、仲丁基、异丁基、叔丁基、异戊基等。代表性饱和环烷基包括环丙基、环丁基、环戊基、环己基等;而不饱和环烷基包括环戊烯基和环己烯基等。“烯基”意指如上定义的烷基,其包含至少一个相邻碳原子之间的双键。烯基包括顺式和反式异构体。代表性直链和支链烯基包括乙烯基、丙烯基、1-丁烯基、2-丁烯基、异丁烯基、1-戊烯基、2-戊烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基、2,3-二甲基-2-丁烯基等。“炔基”意指如上定义的任意烷基或烯基,其额外地包含至少一个相邻碳之间的三键。代表性直链和支链的炔基包括乙炔基、丙炔基、1-丁炔基、2-丁炔基、1-戊炔基、2-戊炔基、3-甲基-1丁炔基等。术语“酰基”是指氢、烷基、部分饱和的或完全饱和的环烷基,部分饱和的或完全饱和的杂环、芳基和杂芳基取代的羰基。例如,酰基包括基团,诸如(c1-c20)烷酰基(例如,甲酰基、乙酰基、丙酰基、丁酰基、戊酰、己酰基、叔丁基乙酰基等)、(c3-c20)环烷基羰基(例如,环丙基羰基、环丁基羰基、环戊基羰基、环己基羰基等)、杂环羰基(例如,吡咯烷基羰基、吡咯烷-2-酮-5-羰基、哌啶基羰基、哌嗪基羰基、四氢呋喃基羰基等)、芳酰基(例如,苯酰基)和杂芳酰基(例如,苯硫基-2-羰基、苯硫基-3-羰基、呋喃基-2-羰基、呋喃基-3-羰基、1h-吡咯甲酰基-2-羰基、1h-吡咯甲酰基-3-羰基、苯并[b]苯硫基-2-羰基等)。术语“芳基”是指芳香族单环、二环或三环烃环系统,其中任意环原子可被取代的。芳基部分的实例包括但不限于苯基、萘基、蒽基和芘基。“杂环”意指5至7元单环、或7至10元二环、杂环,其为饱和的、不饱和的或芳香族的,并且包含1或2个独立地选自氮、氧和硫的杂原子,并且其中氮和硫杂原子可任选地被氧化,并且氮杂原子可任选地被季铵化,包括其中任意上述杂环融合至苯环的二环。可通过任意杂原子或碳原子连接杂环。杂环包括如下定义的杂芳基。杂环包括吗啉基、吡咯烷酮、吡咯烷基、哌啶基、哌嗪基、乙内酰脲基、戊内酰胺基、环氧乙烷基、氧杂环丁烷基、四氢呋喃基、四氢吡喃基、四氢吡啶基、四氢吡啶基、四氢嘧啶基、四氢苯硫基、四氢噻喃基、四氢嘧啶基、四氢苯硫基、四氢噻喃基等。术语“杂芳基”是指具有1至3个杂原子(如果是单环)、1至6个杂原子(如果是二环)或1至9个杂原子(如果是三环)的芳香族5-8元单环、8至12元二环或11至14元三环环系统,所述杂原子选自o、n或s(例如,碳原子和如果为单环、二环或三环则分别地1至3、1至6或1至9个n、o或s的杂原子),其中任意环原子可被取代。本文中描述的杂芳基还可包含共用共同的碳-碳键的稠环。术语“烷基杂环基”是指其中至少一个环原子被烷基、烯基或炔基取代的杂芳基。术语"取代的"是指用指定的取代基的自由基取代给定的结构中的一个或多个氢自由基,所述取代基包括但不限于:卤素、烷基、烯基、炔基、芳基、杂环基、硫氢基、烷硫基、氧基、硫氧基、芳硫基、烷硫基烷基、芳硫基烷基、烷基磺酰基、烷基磺酰基烷基、芳基磺酰基烷基、烷氧基、芳氧基、芳烷基、氨基羰基、烷氨基羰基、芳氨基羰基、烷氧基羰基、芳氧基羰基、卤代烷基、氨基、三氟甲基、氰基、硝基、烷氨基、芳氨基、烷氨基烷基、芳氨基烷基、氨基烷氨基、羟基、烷氧基烷基、羧烷基、烷氧基羰基烷基、氨基羰基烷基、酰基、芳烷基氧基羰基、羧酸、磺酸、磺酰基、膦酸、芳基、杂芳基、杂环基和脂肪族。应理解,取代基可被进一步取代。示例性取代基包括氨基、烷氨基、二烷氨基和环氨基化合物。“卤素”意指氟、氯、溴和碘。术语“烷基胺”和“二烷基胺”分别是指–nh(烷基)和–n(烷基)2自由基。术语“烷基磷酸酯”是指–o-p(q')(q")-o-r,其中q'和q"各自独立地为o、s、n(r)2、任选取代的烷基或烷氧基;并且r为任选取代的烷基、ω-氨烷基或ω-(取代的)氨烷基。术语“烷基硫代磷酸酯”是指其中q'或q"的至少一个是s的烷基磷酸酯。术语“烷基膦酸酯”是指其中至少一个q'或q"的至少一个是烷基的烷基磷酸酯。术语“羟烷基”是指–o-烷基自由基。术语“烷基杂环”是指其中至少一个亚甲基已被杂环取代的烷基。术语“ω-氨烷基”是指–烷基-nh2自由基。术语“ω-(取代的)氨烷基是指其中n上的至少一个h已被烷基取代的ω-氨烷基。术语“ω-磷酸烷基”是指–烷基-o-p(q')(q")-o-r,其中q'和q"各自独立地为o或s并且r为任选取代的烷基。术语“ω-硫代磷酸烷基”是指其中q'或q"的至少一个是s的ω-磷酸烷基。在一些实施方案中,本发明的方法可能需要使用保护基团。保护基团法对于本领域技术人员来说是公知的(参见例如,protectivegroupsinorganicsynthesis,green,t.w.等人,wiley-interscience,newyorkcity,1999)。简言之,本发明的说明书中的保护基团是减少或消除官能团的不期望的反应性的任意基团。可将保护基团加至官能团以在某些反应中掩蔽其反应性,然后除去以露出原始官能团。在一些实施方案中,使用“醇保护基团”。“醇保护基团”是减少或消除醇官能团的不期望的反应性的任意基团。可使用本领域内公知的技术添加和除去保护基团。本发明的化合物可利用已知的有机合成技术来制备,包括在实施例中更详细地描述的方法。实施例实施例1:十八烷基-9,12-二烯甲磺酸酯2的合成方案1向二氯甲烷(100ml)中的醇溶液1(26.6g,100mmol)中加入三乙胺(13.13g,130mmol),使该溶液在冰浴中冷却。向该冷溶液中逐滴加入二氯甲烷(60ml)中的甲磺酰氯溶液(12.6g,110mmol),在完成加入后,使反应混合物升温至环境温度并且搅拌过夜。反应混合物的tlc显示反应完成。用二氯甲烷(200ml)稀释反应混合物,用水(200ml)、饱和nahco3(200ml)、盐水(100ml)洗涤,然后干燥(naso4)。浓缩有机层以获得粗制产物,使用0-10%et2o的己烷溶液通过柱层析(硅胶)来纯化所述产物。合并纯产物级分,并浓缩以获得为无色油的纯产物2(30.6g,89%)。1hnmr(cdcl3,400mhz)=5.42-5.21(m,4h),4.20(t,2h),3.06(s,3h),2.79(t,2h),2.19-2.00(m,4h),1.90-1.70(m,2h),1.06-1.18(m,18h),0.88(t,3h)。13cnmr(cdcl3)=130.76,130.54,128.6,128.4,70.67,37.9,32.05,30.12,29.87,29.85,29.68,29.65,29.53,27.72,27.71,26.15,25.94,23.09,14.60。ms:c19h36o3s的分子量:计算值344.53,实测值343.52(m-h-)。18-溴-十八烷基-6,9-二烯3的合成将甲磺酸酯2(13.44g,39mmol)溶解在无水乙醚(500ml)中,在氩气气氛下向其中加入mgbr.et2o复合物(30.7g,118mmol),在氩气气氛下回流混合物26小时,之后tlc显示反应完成。用乙醚(200ml)稀释反应混合物,将冰冷水(200ml)加入该混合物,并将层进行分离。用1%含水k2co3(100ml)、盐水(100ml)来洗涤有机层,然后干燥(无水na2so4)。浓缩有机层提供了粗制产物,使用0-10%et2o的己烷溶液通过柱层析(硅胶)来纯化所述产物,从而分离为无色油的溴化物3(12.6g,94%)。1hnmr(cdcl3,400mhz)=5.41-5.29(m,4h),4.20(d,2h),3.40(t,j=7hz,2h),2.77(t,j=6.6hz,2h),2.09-2.02(m,4h),1.88-1.00(m,2h),1.46-1.27(m,18h),0.88(t,j=3.9hz,3h)。13cnmr(cdcl3)=130.41,130.25,128.26,128.12,34.17,33.05,31.75,29.82,29.57,29.54,29.39,28.95,28.38,27.42,27.40,25.84,22.79,14.28.18-氰基-十八烷基-6,9-二烯4的合成向乙醇(90ml)中的甲磺酸酯溶液(3.44g,10mmol)中加入水中(10ml)的kcn溶液(1.32g,20mmol),将混合物回流30分钟。之后,反应混合物的tlc显示反应完成,此后向反应混合物中加入乙醚(200ml),然后加入水。用乙醚萃取反应混合物,用水(100ml)、盐水(200ml)洗涤合并的有机层,并干燥。有机层的浓缩提供粗制产物,通过柱层析(0-10%et2o的己烷溶液)来纯化所述产物。将纯产物4分离为无色油(2g,74%)。1hnmr(cdcl3,400mhz)=5.33-5.22(m,4h),2.70(t,2h),2.27-2.23(m,2h),2.00-1.95(m,4h),1.61-1.54(m,2h),1.39-1.20(m,18h),0.82(t,3h)。13cnmr(cdcl3)=130.20,129.96,128.08,127.87,119.78,70.76,66.02,32.52,29.82,29.57,29.33,29.24,29.19,29.12,28.73,28.65,27.20,27.16,25.62,25.37,22.56,17.10,14.06。ms:c19h33n的分子量:计算值275.47,实测值276.6(m-h-).三十七烷基-6,9,28,31-四烯-19-酮7的合成向直火烘干的500ml2nrb烧瓶中加入新活化的镁粒(0.144g,6mmol),所述烧瓶配备有磁搅拌棒和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将溴化物3(1.65g,5mmol)溶解在无水乙醚(10ml)中,通过注射器将其逐滴加入至烧瓶。注意到放热反应(以确认/加速格氏试剂形成,加入2mg的碘,立即观察到脱色,从而确认格氏试剂的形成),乙醚开始回流。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却。将氰化物4(1.38g,5mmol)溶解在无水乙醚(20ml)中,边搅拌边将其逐滴加入至反应混合物中。观察到放热反应,将反应混合物在环境温度下搅拌过夜。通过逐滴加入10ml丙酮然后加入冰冷的水(60ml)来淬灭反应。用含水h2so4(10%体积,200ml)来处理反应混合物直至溶液变得均一,并且将层分离。用乙醚(2x100ml)来萃取水相。干燥(na2so4)合并的乙醚层,将其浓缩以获得粗制产物,通过柱(硅胶,0-10%乙醚的己烷溶液)层析来纯化所述产物。蒸发所述纯产物级分以提供为无色油的纯酮7(2g,74%)。1hnmr(cdcl3,400mhz)δ=5.33-5.21(m,8h),2.69(t,4h),2.30(t,4h),2.05-1.95(m,8h),1.55-1.45(m,2h),1.35-1.15(m,18h),0.82(t,3h)。13cnmr(cdcl3)δ=211.90,130.63,130.54,128.47,128.41,43.27,33.04,32.01,30.93,29.89,29.86,29.75,29.74,27.69,26.11,24.35,23.06,14.05。ms.c37h66o的分子量:计算值526.92,实测值528.02(m+h+)。实施例2:酮7的选择性合成化合物6b的合成向直火烘干的500mlrb烧瓶中加入新活化的镁粒(2.4g,100mmol),所述烧瓶配备有磁搅拌棒、添加漏斗(additionfunnel)和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将溴化物3(26.5g,80.47mmol)溶解在无水乙醚(50ml)中,并将其加入添加漏斗。在剧烈搅拌下将约5ml该乙醚溶液加入至镁粒。注意到放热反应(以确认/加速格氏试剂形成,加入5mg的碘,立即观察到脱色,从而确认格氏试剂的形成),乙醚开始回流。逐滴加入剩余的溴化物溶液,同时通过在水中冷却烧瓶在温和回流下保持反应。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却。将甲酸乙酯(2.68g,36.2mmol)溶解在无水乙醚(40ml)中,然后转移至添加漏斗,并边搅拌边将其逐滴加入至反应混合物中。观察到放热反应,反应混合物开始回流。在反应引发后,以液流形式快速加入剩余的甲酸酯的醚溶液,将反应混合物在环境温度下再搅拌1小时的时间。通过逐滴加入10ml丙酮,然后加入冰冷的水(60ml)来淬灭反应。用含水h2so4(10%体积,300ml)来处理反应混合物直至溶液变得均一,并且将层离。用乙醚(2x100ml)来萃取水相。干燥(na2so4)合并的乙醚层,将其浓缩以获得粗制产物,通过柱(硅胶,0-10%乙醚的己烷溶液)层析纯化所述产物。浓缩极性略低的级分以获得甲酸酯6a(1.9g),蒸发纯产物级分以提供为无色油的纯产物6b(14.6g,78%)。化合物7的合成向ch2cl2(60ml)中的醇6b溶液(3g,5.68mmol)加入新活化的4a分子筛(50g),在20分钟的时间内向该溶液中分批加入粉末状pcc(4.9g,22.7mmol),将混合物再搅拌1小时(注意:由于长反应时间导致更低的收率,因此为了获得良好的收率必需仔细监控反应),每10分钟一次进行反应物混合物的tlc(5%乙醚的己烷溶液)。在反应完成后,将反应混合物通过一层硅胶来过滤,用ch2cl2(400ml)来洗涤残留物。将滤液浓缩,并通过柱层析(硅胶,1%et2o的己烷溶液)来进一步纯化所获得的粗制产物,从而将纯产物7(2.9g,97%)分离为无色油。1hnmr(cdcl3,400mhz)=5.33-5.21(m,8h),2.69(t,4h),2.30(t,4h),2.05-1.95(m,8h),1.55-1.45(m,2h),1.35-1.15(m,18h),0.82(t,3h)。13cnmr(cdcl3)=211.90,130.63,130.54,128.47,128.41,43.27,33.04,32.01,30.93,29.89,29.86,29.75,29.74,27.69,26.11,24.35,23.06,14.05。ms:c37h66o的分子量:计算值526.92,实测值528.02(m+h+)。实施例3:不对称酮25和27的合成方案3三十七烷基-6,9,28-三烯-19-酮25的合成向干燥的50ml2nrb烧瓶中加入新活化的镁粒(132mg,0.0054mmol),所述烧瓶配备有磁搅拌棒和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将溴化物24(1.8g,0.0054mmol)溶解在无水乙醚(10ml)中,通过注射器将其逐滴加入至烧瓶。注意到放热反应(用二溴乙烷起始的反应),并且乙醚开始回流。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却至10-15℃。将氰化物4(0.5g,0.0018mmol)溶解在干燥thf(5ml)中,边搅拌边将其逐滴加入反应中。观察到放热反应,将反应混合物回流(在70℃下)12小时,并用氯化铵溶液进行淬灭。然后用25%hcl溶液对其进行处理直至溶液变得均一,并且将层分离。用乙醚萃取水相。干燥合并的乙醚层,将其浓缩以获得粗制产物,通过柱层析来纯化所述产物。蒸发纯产物级分以提供为无色油的纯酮25。收率:0.230g(24%)。1h-nmr(cdcl3,400mhz):δ=5.37-5.30(m,6h),2.77-2.74(t,2h),2.38-2.34(t,4h),2.05-1.95(m,8h),1.56-1.52(m,4h),1.35-1.25(m,脂族质子),0.89-0.85(t,6h)。ir(cm-1):2924,2854,1717,1465,1049,721。三十七烷基-6,9-二烯-19-酮27的合成向直火烘干的500ml2nrb烧瓶中加入新活化的镁粒(0.144g,6mmol),所述烧瓶配备有磁搅拌棒和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将商购可得的溴化物26(2.65g,5mmol)溶解在无水乙醚(10ml)中,通过注射器将其逐滴加入至烧瓶。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却。将氰化物4(1.38g,5mmol)溶解在无水乙醚(20ml)中,边搅拌边将其逐滴加入至反应混合物中。观察到放热反应,将反应混合物在环境温度下搅拌过夜。通过逐滴加入10ml丙酮然后加入冰冷的水(60ml)来淬灭反应。用含水h2so4(10%体积,200ml)来处理反应混合物直至溶液变得均一,并且将层分离。用乙醚(2x100ml)来萃取水相。干燥(na2so4)合并的乙醚层,将其浓缩以获得粗制产物,通过柱层析来纯化所述产物,从而提供为无色油的纯酮27。1h-nmr(cdcl3,400mhz):δ=5.42-5.30(m,4h),2.79-2.78(t,2h),2.40-2.37(t,4h),2.08-2.03(m,4h),1.58-1.54(m,4h),1.36-1.26(brm,脂族质子),0.91-0.87(t,6h)。ir(cm-1):2924,2854,1716,1465,1375,721。实施例4:具有c12链的不对称酮的合成。方案4向干燥的50ml2nrb烧瓶中加入新活化的镁粒(175mg,0.0072mmol),所述烧瓶配备有磁搅拌棒和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将溴化物28(1.5g,0.006mol)溶解在无水乙醚(7ml)中,将其通过注射器逐滴加入烧瓶。注意到放热反应(用二溴乙烷起始的反应),乙醚开始回流。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却至10-15℃。将氰化物4(1g,0.0036mol)溶解在无水乙醚(7ml)中,边搅拌边将其逐滴加入至反应中。观察到放热反应,将反应混合物回流12小时,用氯化铵溶液进行淬灭。然后用25%hcl溶液对其进行处理直至溶液变得均一,并且将层分离。用乙醚来萃取水相。干燥合并的乙醚层,将其浓缩以获得粗制产物,通过柱层析来纯化所述产物。蒸发纯产物级分以提供为无色油的纯酮29。收率:0.65g(26%)。1h-nmr(δppm):5.388-5.302(m,4h),2.77-2.74(t,2h),2.38-2.34(t,4h),2.04-2.01(m,4h),1.34-1.18(m,36h),0.89-0.85(m6h)。ir(cm-1):3009,2920,2851,1711(c=o),1466,1376,1261。实施例5:具有c10链31的不对称酮的合成方案5向干燥的50ml2nrb烧瓶中加入新活化的镁粒(266mg,0.0109mol),所述烧瓶配备有磁搅拌棒和回流冷凝器。用氩气对该装置进行除气和冲洗,通过注射器将10ml无水乙醚加入烧瓶。将溴化物(2.43g,0.0109mol)溶解在无水乙醚(7ml)中,将其通过注射器逐滴加入烧瓶。注意到放热反应(用二溴乙烷起始的反应),乙醚开始回流。在加入完成后,将反应混合物在35℃下保持1小时,然后在冰浴中冷却至10-15℃。将氰化物(1g,0.0036mol)溶解在无水乙醚(7ml)中,边搅拌边将其逐滴加入至反应中。观察到放热反应,在环境温度下搅拌反应混合物2小时。向反应混合物中加入thf(4ml),将其升温至45-50℃进行4小时,直至氰基衍生物被完全消耗。通过逐滴加入3ml丙酮,然后加入冰冷的水来淬灭反应。用25%hcl溶液来处理反应混合物直至溶液变得均一,并且将层分离。用乙醚来萃取水相。干燥合并的乙醚层,将其浓缩以获得粗制产物,通过柱层析来纯化所述产物。蒸发纯产物级分以提供为无色油的纯酮。收率:0.93gms(61%)。1h-nmr(δppm):5.37-5.302(m,4h),2.77-2.74(t,2h),2.38-2.34(t,4h),2.05-2.00(m,4h),1.55-1.52(m,2h),1.35-1.24(m,34h),0.89-0.84(m6h)。ir(cm-1):3009,2925,2854,1717(c=o),1465,1376。实施例6:具有胆固醇33的不对称酮的合成方案6使用与用于合成酮31的方法相似的方法,氯化胆固醇转化成相应的氯化镁,然后加入至亚油酰基氰化物提供了酮33。实施例7:具有胆固醇35的不对称酮的合成方案7用3-溴丙胺处理氯甲酸胆固醇酯提供了溴化物34,溴化物34被转化成相应的格氏试剂34a,在用亚油酰基氰化物处理后提供了收率良好的相应的不对称酮35。实施例8:不对称酮40的合成方案8化合物37的合成在室温、氮气气氛下向500ml装有lialh4(1.02g,0.0269mol)的两颈rbf中加入无水thf(20ml)。在室温下搅拌悬液1小时,然后冷却至0℃。向该混合物中缓慢加入无水thf(50ml)中的化合物1溶液(5g,0.01798mol),从而维持内部温度0℃。在加入完成后,将反应混合物升温至环境温度并且搅拌1小时。利用tlc来监控反应的进展。在完成反应后,将混合物冷却至0℃,并用含水na2so4的饱和溶液进行淬灭。将反应混合物搅拌30分钟,将形成的固体通过硅藻土床进行过滤,用乙酸乙酯(100ml)洗涤。将滤液和洗出液进行组合,并在旋转蒸发器上进行蒸发以提供无色液体的化合物37,其就此用于下一阶段而无需任何纯化。收率:(4.5g,95%);1hnmr(400mhz,cdcl3)δ=5.39-5.28(m,6h),3.64-3.61(t,2h),2.81-2.78(t,4h),2.10-2.01(m,4h),1.59-1.51(m,2h),1.29-1.22(m,脂族质子),0.98-0.94(t,3h)。化合物38的合成将化合物37(14g,0.0530mol)溶解于500ml两颈rbf中的dcm(300ml)中并冷却至0℃。在惰性气氛下向该溶液中缓慢地加入三乙胺(29.5ml,0.2121mol)。然后搅拌反应混合物10至15分钟,缓慢地向其加入甲磺酰氯(6.17ml,0.0795mol))。在完成加入后,允许反应混合物升温至环境温度,搅拌20小时。利用tlc来监控反应。完成后,用水(200ml)搅拌数分钟来稀释反应混合物,分离有机层。用盐水(1x70ml)来进一步洗涤有机相,在na2so4上进行干燥,在旋转蒸发器上除去溶剂以获得为褐色油的粗化合物38,其即可用于下一反应。收率:(17g,93%)1hnmr(400mhz,cdcl3)δ=5.39-5.31(m,6h),4.22-4.19(t,2h),2.99(s,3h),2.81-2.78(m,4h),2.08-2.01(m,4h),1.75.1.69(m,2h),1.39-1.29(m,脂族质子),0.98-0.94(t,3h)。化合物39的合成将甲磺酸酯38(10g,0.2923mol)溶解于1000ml两颈rbf中的(300ml)无水乙醚中,在氮气气氛下向其加入mgbr2.et2o复合物(22.63g,0.0877mol)。然后将所得的混合物加热至回流26小时。在完成反应后(通过tlc),用乙醚(300ml)和冰冷的水(200ml)来稀释反应混合物,分离出乙醚层。然后用1%含水k2co3(100ml)洗涤有机层,接着用盐水(80ml)洗涤有机层。然后在na2so4上进行干燥有机相,真空条件下蒸发掉溶剂以产生粗制材料,使用0-1%乙酸乙酯的己烷溶液作为洗脱系统在硅胶(60-120目)上进行层析,以产生为油的期望化合物39。收率:(7g,73%)1hnmr(400mhz,cdcl3)δ=5.39-5.31(m,6h),3.41-3.37(t,2h),2.81-2.78(m,4h),2.08-2.02(m,4h),1.86-1.80(m,2h),1.42-1.29(m,脂族质子),0.98-0.94(t,3h)。不对称酮40的合成向配备有磁搅拌棒和回流冷凝器的直火干燥的500ml两颈rbf中加入新活化的镁粒(0.88g,0.03636mol)。用氩气对该装置进行除气和冲洗,并将乙醚(150ml)加入其中。在开始引发反应时加入数滴50ml乙醚中的溴代化合物4(11.89g,0.03636mol)(注意:也加入催化剂量的1,2-二溴乙烷以加速格氏试剂的形成)。在引发后,向回流醚溶液中缓慢地加入剩余的溴代化合物溶液。在完成加入后,将反应混合物在40℃下回流1.5小时。然后将其冷却至10℃,逐滴加入30ml无水乙醚中的亚油酰基氰化物4(5g,0.01818mol),然后将所得的混合物加热至回流,在40℃下20小时。通过tlc来监控反应的进展。在完全消耗氰基衍生物40后(通过tlc),将混合物冷却至室温,用30ml丙酮然后用(50ml)冰水进行淬灭。用10%hcl溶液来进一步酸化该溶液,分离出醚层。用二乙醚(2x100ml)进一步萃取水相。在无水na2so4上干燥后除去溶剂提供了粗制酮,使用0-5%乙醚的己烷溶液作为洗脱系统通过硅胶柱层析(100-200目)进行纯化,以产生为浅黄色油的标题化合物40。收率:(4.8g,50.5%)1hnmr(400mhz,cdcl3)δ=5.38-5.28(m,10h),2.80-2.74(m,6h),2.38-2.34(t,4h),2.08-2.00(m,8h),1.55-1.52(m,4h),1.35-1.26(m,脂族质子),0.98-0.94(t,3h),0.89-0.85(t,3h)。hplc-98.04%。实施例9:寡核苷酸的合成在aktaoligopilot合成仪上来合成全部寡核苷酸。将商购可得的可控孔玻璃固相载体(controlledporeglasssolidsupport)(dt-cpg,primesynthesis)和具有标准保护基团的rna亚磷酰胺、5’-o-二甲氧基三苯甲基n6-苯甲酰基-2’-叔丁基二甲基甲硅烷基-腺苷-3’-o-n,n’-二异丙基-2-氰基乙基亚磷酰胺、5’-o-二甲氧基三苯甲基-n4-乙酰基-2’-叔丁基二甲基甲硅烷基-胞苷-3’-o-n,n’-二异丙基-2-氰基乙基亚磷酰胺、5’-o-二甲氧基三苯甲基-n2-异丁基-2’-叔丁基二甲基甲硅烷基-鸟苷-3’-o-n,n’-二异丙基-2-氰基乙基亚磷酰胺和5’-o-二甲氧基三苯甲基-2’-叔丁基二甲基甲硅烷基-尿苷-3’-o-n,n’-二异丙基-2-氰基乙基亚磷酰胺(piercenucleicacidstechnologies)用于寡核苷酸合成。2’-f亚磷酰胺、5’-o-二甲氧基三苯甲基-n4-乙酰基-2’-氟-胞苷-3’-o-n,n’-二异丙基-2-氰基乙基-亚磷酰胺和5’-o-二甲氧基三苯甲基-2’-氟-尿苷-3’-o-n,n’-二异丙基-2-氰基乙基-亚磷酰胺购自(promega)。除了鸟苷(以10%thf/anc(v/v)中的0.2m浓度使用)外,所有亚磷酰胺以乙腈(ch3cn)中的0.2m浓度使用。使用16分钟的偶联/再循环时间。活化剂是5-乙基硫代四唑(0.75m,americaninternationalchemicals),对于po-氧化,使用碘/水/吡啶,和使用2,6-二甲基吡啶/acn(1:1v/v)中的ps-氧化pads(2%)。使用含有相应配体的固相载体来合成3’-配体共轭的链。例如,从羟基脯氨醇-胆固醇亚磷酰胺执行胆固醇单元在序列中的引入。将胆固醇通过6-氨基己酸酯键来拴系至反式-4-羟基脯氨醇以获得羟基脯氨醇-胆固醇部分。从相应的quasar-570(cy-3)来合成5’-末端cy-3和cy-5.5(荧光基团)标记的sirna,亚磷酰胺购自biosearchtechnologies。通过使用适当保护的配体-亚磷酰胺结构单元来实现配体与5’-末端或内部位置的共轭。在5-(乙基硫)-1h-四唑活化剂存在的情况下,将0.1m的无水ch3cn中的亚磷酰胺溶液偶联至固体结合的寡核苷酸,进行15分钟。使用如(1)报导的标准碘-水或通过利用叔丁基过氧化氢/乙腈/水(10:87:3)处理共轭的寡核苷酸(进行10分钟的氧化等待时间)来执行核苷酸间亚磷酸酯至磷酸酯的氧化。通过使用硫转移试剂,诸如ddtt(购自amchemicals)、pads和/或beaucage试剂将亚磷酸酯氧化成硫代磷酸酯来引入硫代磷酸酯。在室内合成胆固醇亚磷酰胺,将其以0.1m二氯甲烷溶液的浓度使用。胆固醇亚磷酰胺的偶联时间为16分钟。在合成完成后,将载体转移至100ml玻璃瓶(vwr)中。通过80ml的乙醇氨[氨:乙醇(3:1)]的混合物在55℃下进行6.5小时对碱基和磷酸基团脱保护的同时,从载体切割寡核苷酸。将瓶在冰上短暂冷却,然后将乙醇氨混合物过滤至新的250ml瓶中。用乙醇/水(1:1v/v)的2x40ml部分洗涤cpg。然后通过旋转蒸发将混合物体积减小至约30ml。然后将混合物在冰上冷冻,在speedvac上真空干燥。将干燥的残留物再悬浮于26ml三乙胺、三乙胺三氢氟酸盐(tea.3hf)或吡啶-hf和dmso(3:4:6)中,在60℃下加热90分钟以除去2’位置上的叔丁基二甲基三苯甲基(tbdms)基团。然后用50ml的20mm乙酸钠来淬灭反应,并将ph调至6.5,并且贮存在冰箱中直至纯化。在纯化之前利用高效液相色谱(hplc)来分析寡核苷酸,缓冲液和柱子的选择取决于序列和/或共轭的配体的性质。利用反相制备hplc来纯化配体共轭的寡核苷酸。在内部填充的tsk凝胶柱上通过离子交换hplc来纯化未共轭的寡核苷酸。缓冲液为20mm的10%ch3cn中的磷酸钠(ph8.5)(缓冲液a)和20mm的10%ch3cn,1mnabr中的磷酸钠(ph8.5)(缓冲液b)。将含有全长寡核苷酸的级分进行混合、脱盐并冻干。将约0.15od的脱盐的寡核苷酸在水中稀释至150μl,然后用移液至专用小瓶中以用于cge和lc/ms分析。最后利用lc-esms和cge来分析化合物。为了制备sirna,将等摩尔量的有义和反义链在95℃下于1xpbs中加热5分钟,然后缓慢冷却至室温。利用hplc分析来验证双链体的完整性。表7.用于luc和fvii靶向的sirna双链体注意:l8为小写字母为2’-o-甲基修饰的核苷酸,*为硫代磷酸酯主链键,fn为2’-氟核苷酸,dn为2’-脱氧核苷酸。实施例10:用于sirna的血清稳定性测定通过“全染色(stainsall)”法来执行用于最初基于序列的稳定性选择的中等通量测定。为了执行该测定,将sirna双链体在37℃下于90%人血清中进行温育。在不同的时间点(在第0分钟、15、30、60、120和240分钟)来淬灭反应混合物的样品,将其经历电泳分析(图1)。在一段时间过程中rna的切割提供了关于sirna双链体对血清核酸酶降解的易感性的信息。将放射性标记的dsrna和血清稳定性测定用于进一步表征sirna切割事件。首先,用32p在有义链或反义链上5’末端标记sirna双链体。将标记的sirna双链体在37℃下与90%人血清一起温育,除去溶液的样品,并且在递增的时间点上淬灭样品。利用电泳分析样品。实施例11:使用阳离子脂质衍生的脂质体的fvii体内评估体内啮齿类动物因子vii和apob的沉默实验c57bl/6小鼠(charlesriverlabs,ma)和sprague-dawley大鼠(charlesriverlabs,ma)通过尾静脉注射以0.01ml/g的体积接受盐水或期望制剂中的sirna。在施用后不同的时间点上,通过异氟烷吸入来麻醉动物,通过眼窝后放血(retroorbitalbleed)将血液收集入血清分离管。按照制造商的方案使用生色测定(coasetfactorvii,diapharmagroup,oh或biophenfvii,aniaracorporation,oh)来测定样品的因子vii蛋白的血清水平。使用从盐水处理的动物收集的血清来生成标准曲线。在其中评估肝mrna水平的实验中,在施用后不同的时间点上,杀死动物,收获肝,将其快速冷冻于液氮中。将冷冻的肝组织研磨成粉末。制备组织裂解物,使用分支dna测定(quantigeneassay,panomics,ca)来测定因子vii和apob的肝mrna水平。实施例12:1,2-二-o-烷基-sn3-氨基甲酰甘油酯(peg-dmg)的制备iva的制备将1,2-二-o-十四烷基-sn-甘油酯ia(30g,61.80mmol)和n,n’-二琥珀酰亚胺基碳酸酯(dsc,23.76g,1.5eq)置于二氯甲烷(dcm,500ml)中并且在冰水混合物中进行搅拌。向搅拌的溶液中加入三乙胺(tea,25.30ml,3当量),然后允许反应混合物在环境温度下搅拌过夜。通过tlc来监控反应进程。用dcm(400ml)来稀释反应混合物,用水(2x500ml)、含水nahco3溶液(500ml)来洗涤有机层,然后进行标准操作(work-up)。将获得的残留物在环境温度和高真空下干燥过夜。在干燥后,将以此获得的粗制碳酸酯iia溶解在二氯甲烷(500ml)中,并冰浴搅拌。在氩气气氛下向搅拌的溶液中加入mpeg2000-nh2(iii,103.00g,47.20mmol,购自nofcorporation,japan)和无水吡啶(py,80ml,过量)。然后允许反应混合物在环境温度下搅拌过夜。在真空下除去溶剂和挥发物,将残留物溶解在dcm(200ml)中,并装载在填充于乙酸乙酯中的硅胶柱上。最初用乙酸乙酯来洗脱柱子,然后用5至10%甲醇的二氯甲烷溶液的梯度洗脱,从而提供为白色固体的期望peg-脂质iva(105.30g,83%)。1hnmr(cdcl3,400mhz)=5.20-5.12(m,1h),4.18-4.01(m,2h),3.80-3.70(m,2h),3.70-3.20(m,-o-ch2-ch2-o-,peg-ch2),2.10-2.01(m,2h),1.70-1.60(m,2h),1.56-1.45(m,4h),1.31-1.15(m,48h),0.84(t,j=6.5hz,6h)。ms范围实测值:2660-2836。ivb的制备将1,2-二-o-十六烷基-sn-甘油酯ib(1.00g,1.848mmol)和dsc(0.710g,1.5当量)一起置于二氯甲烷(20ml)中,并在冰水混合物中冷却至0℃。加入三乙胺(1.00ml,3eq),并将反应搅拌过夜。通过tlc跟踪反应,用dcm稀释,用水(2次)、nahco3溶液洗涤,并在硫酸钠上进行干燥。减压除去溶剂,将所得的iib的残留物在高真空下维持过夜。将该化合物直接用于下一反应而无需进一步纯化。在氩气气氛下将mpeg2000-nh2iii(1.50g,0.687mmol,购自nofcorporation,japan)和iib(0.702g,1.5当量)溶解在二氯甲烷(20ml)中。将反应冷却至0℃。加入吡啶(1ml,过量),并将反应搅拌过夜。通过tlc来监控反应。在真空下除去溶剂和挥发物,通过层析(首先乙酸乙酯,然后5-10%meoh/dcm作为梯度洗脱)来纯化残留物,从而获得为白色固体的需要的化合物ivb(1.46g,76%)。1hnmr(cdcl3,400mhz)=5.17(t,j=5.5hz,1h),4.13(dd,j=4.00hz,11.00hz,1h),4.05(dd,j=5.00hz,11.00hz,1h),3.82-3.75(m,2h),3.70-3.20(m,-o-ch2-ch2-o-,peg-ch2),2.05-1.90(m,2h),1.80-1.70(m,2h),1.61-1.45(m,6h),1.35-1.17(m,56h),0.85(t,j=6.5hz,6h)。ms范围实测值:2716-2892。ivc的制备见1,2-二-o-十八烷基-sn-甘油酯ic(4.00g,6.70mmol)和dsc(2.58g,1.5当量)一起置于二氯甲烷(60ml)中,并在冰水混合物中冷却至0℃。加入三乙胺(2.75ml,3eq),并将反应搅拌过夜。通过tlc跟踪反应,用dcm稀释,用水(2次)、nahco3溶液洗涤,并在硫酸钠上进行干燥。减压除去溶剂,将残留物在高真空下维持过夜。将该化合物直接用于下一反应而无需进一步纯化。在氩气气氛下将mpeg2000-nh2iii(1.50g,0.687mmol,购自nofcorporation,japan)和iic(0.760g,1.5当量)溶解在二氯甲烷(20ml)中。将反应冷却至0℃。加入吡啶(1ml,过量),并将反应搅拌过夜。通过tlc来监测反应。在真空下除去溶剂和挥发物,并通过层析(首先乙酸乙酯,然后5-10%meoh/dcm作为梯度洗脱)来纯化残留物,从而获得为白色固体的需要的化合物ivv(0.92g,48%)。1hnmr(cdcl3,400mhz)δ=5.22-5.15(m,1h),4.16(dd,j=4.00hz,11.00hz,1h),4.06(dd,j=5.00hz,11.00hz,1h),3.81-3.75(m,2h),3.70-3.20(m,-o-ch2-ch2-o-,peg-ch2),1.80-1.70(m,2h),1.60-1.48(m,4h),1.31-1.15(m,64h),0.85(t,j=6.5hz,6h)。ms范围实测值:2774-2948。实施例13:2005的合成:在氩气气氛下向dcm(400ml)中的2004溶液(50g,95mmol)中加入tea(53ml,378mmol)和dmap(1.2g,9.5mmol),并在室温、氩气气氛下搅拌。将反应物质冷却至-5℃,在低于-5℃的温度下缓慢加入dcm(100ml)中的甲磺酰氯溶液(15ml,190mmol),在加入后使其升温至室温。30分钟(tlc)后,用冰冷的水(20ml)来淬灭反应物质。分离有机层,用1nhcl(30ml)、水、盐水洗涤,经硫酸钠干燥,减压蒸发以获得为黄色液体的纯产物(55g,95.5%)。1hnmr(400mhz,cdcl3):δ0.89(t,6h,j=6.8),1.2-1.5(m,36h),1.67(m,4h),2.05(q,8h,j1=6.8,j2=6.8),2.77(t,4h,j=6.4),2.99(s,3h),4.71(m,1h)和5.36(m,8h)。2006的合成:在氩气气氛下向dmf(500ml)中的2005溶液(50g,82mmol)中加入nan3(27g,410mmol),并加热至70℃并且维持该温度4小时(tlc)。用水稀释混合物,用乙酸乙酯(3x250ml)萃取混合物。用水、盐水洗涤有机层,经na2so4干燥,减压蒸发以获得粗制产物,使用己烷/乙醚作为洗脱剂通过硅胶层析来纯化所述产物。所述产物用2%的乙醚/己烷进行洗脱以获得为浅黄色液体的2006(36g,86%)。1hnmr(400mhz,cdcl3):δ0.90(t,8h),1.30(m,36h),1.49(t,4h,j=6.4hz)2.04(q,8h,j1=7.6,j2=14hz),2.77(t,4h,j=6.4hz),3.22(m,1h),5.34(m,8h)。13cnmr(400mhz,cdcl3):δ14.1,22.5,25.6,26.1,27.2,29.2,29.3,29.45,29.65,31.5,34.1,63.1,127.9,和130.1.ir(kbr):2098。实施例14:2007的合成:在室温下向二甲基甲酰胺(500ml)中的2005溶液(76g,125mmol)中加入水合硫氢化钠(35g,625mmol)。将反应混合物加热至70℃达2小时(tlc)。然后将其冷却至室温,用水(7v)稀释,用乙醚(3x5v)萃取。用水(2x3v)、盐水溶液(2x3v)洗涤合并的醚层,经硫酸钠干燥,减压蒸发以获得粗制产物,使用己烷作为洗脱剂通过硅胶层析来纯化所述产物,获得产物2007(43.6g,64%)。ms:c37h68s的分子量计算值544.50,实测值:545.51(m+h)。2008的合成:在0℃下向二氯甲烷(400ml)中的aldrithiol溶液(20.2g,92mmol)中加入溴化苄(11ml,92mmol)。在0℃下搅拌15分钟后,将其升温至室温,并搅拌15分钟。将反应混合物冷却回0℃,加入二氯甲烷(100ml)中的2007溶液(50g,92mmol),然后加入二异丙基乙胺(16ml,92mmol)。加入后,将其加热至回流2小时(tlc)。然后其用二氯甲烷(10v)进行稀释,用水(2x10v)、盐水溶液(2x10v)洗涤,经硫酸钠干燥,减压蒸发以获得粗制产物,使用3%乙醚/己烷通过硅胶层析来纯化所述粗制产物,从而获得为浅黄色液体的纯产物(35g,58%)。1hnmr(400mhz,cdcl3):δ0.89(t,6h,j1=6.4hz,j2=7.2hz),1.25-1.42(m,38h),1.56-1.63(m,2h),2.05(q,8h,j1=6.4hz,j2=14hz),2.78(t,5h,j1=6.4hz,j2=6hz),5.30-5.42(m,8h),7.06(t,1h,j1=5.2hz,j2=6.8hz),7.62(t,1h,j1=7.6hz,j2=7.6hz),7.76(d,1h,j=8hz),8.42(d,1h,j=4.4hz)。13cnmr(100mhz,cdcl3):22.6,25.6,26.7,27.2,29.2,29.3,29.5,29.6,31.5,33.74,52.9,119.9,120.4,127.9,128,130.1,130.2,136.7,149.3,161.5。ms:c42h71ns2的分子量:计算值653.50,实测值:654.49(m+h)。实施例15:2009(alny-138)的合成:将dmf中的2005溶液(5g,8mmol)和二甲胺-40%含水溶液置于密封管中。将反应混合物在90℃下加热20小时(tlc)。然后将其冷却至室温,倒入水中,用乙酸乙酯萃取(3x50ml)。用水和盐水洗涤有机层,经na2so4干燥,然后蒸发以提供为浅褐色液体的纯产物(2.00g,45%)。1hnmr(400mhz,cdcl3):δ0.89(t,6h,j=6.8),1.2-1.4(m,40h),2.05(q,8h,j1=6.8hz,j2=6.8hz),2.2(s,6h),2.77(t,4h,j=6.4hz),5.35(m,8h)。13cnmr(400mhz,cdcl3):δ14.1,22.5,22.6,27.1,27.2,29.3,29.5,29.57,29.63,29.67,30.0,31.5,32.5,40.5,64.0,127.9和130.1ms:c39h73n的分子量:计算值555.57,实测值:556.55(m+h)。实施例16:2010的合成:在氩气气氛下向甲苯中的2004溶液(30g,56.8mmol)中加入n-羟基酞酰亚胺(13.9g,85mmol)和tpp(22.30g,85mmol)。将反应物质冷却至–5℃,向其加入tea(11.84ml),然后加入dead(13.14ml)。将反应物质在室温下搅拌12小时(tlc)。然后将其通过硅藻土层进行过滤。减压蒸发滤液以获得粗制产物,通过硅胶层析来纯化所述粗制产物以提供纯产物,用3%乙醚和己烷来洗脱所述产物以获得为浅黄色液体的产物2010(22.90g,60.50%)。1hnmr(400mhz,cdcl3):δ0.90(6h,t,j=7.2hz),1.2-1.4(34h,m),1.66-1.70(4h,m),2.03-2.08(8h,m),2.78(4h,t,j=12.8hz),4.22(1h,m),5.29-5.43(8h,m),7.74-7.76(2h,m),7.83-7.85(2h,m)。13cnmr(100mhz,cdcl3):δ14.3,22.5,24.9,25.6,27.2,27.20,29.3,29.3,29.5,29.5,29.6,29.7,31.5,32.4,88.3,123.3,127.9,129.0,130.1,134.3,164.3。ms:c45h71no3的分子量:计算值673.54,实测值:674.55(m+h)。实施例17:实施例18:实施例19:3-(二甲氨基)-n-((11z,14z)-2-((9z,12z)-十八烷基-9,12-二烯基)二十碳-11,14-二烯基)丙酰胺(alny-201)的合成方案1在室温下向dcm中的n,n-二甲基氨基丙酸盐酸盐(1,0.198g,1.3mmol,1.0当量)的搅拌的悬液中加入hbtu(0.59g,1.56mmol,1.2当量)和dipea(0.71ml,3.9mmol,3.0当量)。搅拌10分钟后,在室温下逐滴加入dcm中的胺溶液(2,0.7g,1.3mmol,1.0当量),持续搅拌直至反应完成。用dcm稀释反应混合物,用饱和nahco3溶液、然后用盐水洗涤,分离有机层并经mgso4干燥,浓缩并使用dcm:meoh(5%)作为梯度通过硅胶柱层析来纯化,获得纯油状化合物3,收率为70%。1hnmr(400mhz,cdcl3)δ7.18(brs,1h),5.47-5.19(m,8h),3.18-3.07(m,4h),2.76(t,j=6.5,4h),2.70(s,6h),2.60(t,j=6.0,2h),2.04(q,j=6.8,9h),1.48(brs,1h),1.40-1.14(m,43h),0.88(t,j=6.8,6h)。c43h80n2o的分子量计算值:640.6,实测值641.5。新的二亚油烯基衍生物的合成化合物1化合物2化合物3化合物4化合物5化合物6实验细节化合物1(alny-192)向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯溶液(5.50g,21.5mmol)中逐滴加入3-二甲氨基-1-丙醇(2.43g,23.6mmol))。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.822ml,5.90mmol)和aln-san-30(2.08g,3.93mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,以获得化合物1(1.66g,2.53mmol,64%,rf=0.22,用5%meoh的ch2cl2溶液)。1hnmr(cdcl3,400mhz)δ5.30-5.41(m,8h),4.37(d,j=8.0hz,1h),4.09(t,j=6.0hz,2h),3.57(brs,1h),2.78(t,j=6.0hz,4h),2.33(t,j=8.0hz,2h),2.23(s,6h),2.02-2.06(m,8h),1.76-1.80(m,2h),1.27-1.45(m,40h),0.89(t,j=8.0hz,6h)。13cnmr(cdcl3,100mhz)δ156.5,130.4,130.3,128.2,128.1,63.2,56.6,51.4,45.7,35.7,31.7,29.9,29.8,29.7,29.6,29.5,27.7,27.5,27.4,26.0,25.8,22.8,14.3。c43h81n2o2(m+h)+的分子量:计算值657.63,实测值657.5。化合物2(alny-200)向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯(5.50g,21.5mmol)溶液中逐滴加入3-二甲氨基-1-丙醇(2.43g,23.6mmol)。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.697ml,5.00mmol)和aln-san-033(1.71g,3.15mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,以产生化合物2(1.14g,1.70mmol,54%,rf=0.13,用5%meoh的ch2cl2溶液)。c44h83n2o2(m+h)+的分子量:计算值671.65,实测值671.5。化合物3(alny-175)向装有etoh(50ml)的烧瓶中加入二甲氨基乙基肼二盐酸盐(1.00g,5.70mmol)和alny-san-003(2.00g,3.80mmol)。将混合物在60℃下加热16小时。加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(ch2cl2:meoh:nh3水溶液=95:5:0.5,rf=0.29)来纯化粗制产物,得到化合物3(1.78g,2.91mmol,76%)。c41h78n3(m+h)+的分子量:计算值612.62,实测值612.5。化合物4(alny-187)将etoh(10ml)中的3-二甲氨基-丙酸肼(ryanscientific,500mg,3.89mmol)和etoh(20ml)中的二亚油烯基酮(1.74g,3.31mmol)混合在一起。向溶液中加入乙酸(0.038ml,0.662mmol),将反应混合物在65℃下加热5小时。加入et3n(0.5ml)后,蒸发反应混合物。用ch2cl2和nahco3饱和水溶液萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(ch2cl2:meoh:nh3水溶液=95:5:0.5,rf=0.30)来纯化粗制产物,得到化合物4(1.40g,2.19mmol,66%)。c42h78n3o(m+h)+的分子量:计算值640.61,实测值640.5。化合物5(alny-149)用ch2cl2(36ml)和etoh(4ml)中的一水合肼(0.424ml,5.60mmol)来处理aly-san-031(2.36g,3.50mmol)2小时。过滤所得的白色沉淀后,浓缩滤液。用et2o和nahco3饱和水溶液萃取残留物,经mgso4干燥有机层,过滤并且浓缩。将粗制材料用于下一步骤而无需进一步纯化。rf:0.44(10%etoac的己烷溶液)。c37h70no(m+h)+的分子量:计算值544.55,实测值544.2。将氨氧基化合物溶解在etoh(30ml)中,向该溶液中加入4-(二甲氨基)丁-2-酮(matrixscientific,500mg,4.34mmol)和乙酸(0.040ml,0.70mmol)。在室温下搅拌反应混合物14小时。在加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(己烷:etoac=1:1)来纯化粗制产物,得到为e/z-异构体混合物的化合物5(1.90g,2.96mmol,85%,2个步骤,rf=0.39,0.21,用己烷:etoac=1:1显色)。c43h81n2o(m+h)+的分子量:计算值641.63,实测值641.5。化合物6(alny-202)向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯溶液(5.50g,21.5mmol)中逐滴加入3-二甲氨基-1-丙醇(2.37g,23.6mmol))。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.822ml,5.90mmol)和aln-san-30(2.07g,3.93mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,得到化合物6。c42h79n2o2(m+h)+的分子量:计算值643.61,实测值643.5。本发明的化合物还可通过下列文献(这些文献的全部内容据此并入本文)中描述的操作进行合成:1.schlueter,urs;lu,jun;fraser-reid,bert.syntheticapproachestoheavilylipidatedphosphoglyceroinositides.organicletters(2003),5(3),255-2572.king,j.f.;allbutt,a.d.can.j.chem.1970,48,1754-17693.mach,mateusz;schlueter,urs;mathew,felix;fraser-reid,bert;hazen,kevinc.comparingn-pentenylorthoestersandn-pentenylglycosidesasalternativeglycosyldonors.tetrahedron(2002),58(36),7345-7354.实施例20:使用体内啮齿类动物因子vii沉默模型测定含有不同阳离子脂质的脂质颗粒制剂的效率因子vii(fvii)(凝血级联中的重要蛋白)在肝(肝细胞)中合成并且被分泌到血浆中。血浆中的fvii水平可通过简单的基于板的比色测定来测定。这样,fvii代表了用于测定sirna-介导的肝细胞源蛋白质的下调以及监测核酸脂质颗粒和sirna的血浆浓度和组织分布的方便模型。小写字母为2’ome修饰并且nf为2’f修饰的核碱基,dt为脱氧胸苷,s为硫代磷酸酯。测试下列阳离子脂质:使用如美国临时专利申请61/228,373中描述的在线混合方法,将上文显示的阳离子脂质用于配制含ad-1661双链体的脂质体。使用下列摩尔比:50%阳离子脂质/10%二硬脂酰磷脂酰胆碱(dspc)/38.5%胆固醇/1.5%peg-dmg(1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰基甘油(平均peg分子量为2000)来配制脂质颗粒。c57bl/6小鼠(charlesriverlabs,ma)通过尾静脉注射接受盐水或配制的sirna。在施用后不同的时间点时,通过眼窝后放血来收集血清样品。使用生色测定(biophenfvii,aniaracorporation,oh)来测定样品中因子vii蛋白的血清水平。为了测定因子vii的肝mrna水平,处死动物,收获肝,并快速冷冻于液氮中。从冷冻的组织来制备组织裂解物,使用分支dna测定(quantigeneassay,panomics,ca)来定量因子vii的肝mrna水平。在c57bl/6小鼠中静脉内(推注)注射后第48小时评估fviisirna处理的动物中fvii的活性。按照制造商的说明书,使用商购可得的用于测定血清或组织中的蛋白质水平的试剂盒在微板规模上来测量fvii。与未处理的对照小鼠相比较,测得fvii减少,将结果表示为残留fvii的百分比。将两个剂量水平(0.05和0.005mg/kgfviisirna)用于每一个新型脂质体组合物的筛选。图3显示举例说明施以0.05或0.005mg/kg含有不同阳离子脂质的脂质颗粒的动物中相对fvii蛋白水平的图。实施例21:使用预先形成的囊泡的sirna制剂使用预先形成的囊泡法来产生含有阳离子脂质的颗粒。将阳离子脂质、dspc、胆固醇和peg-脂质分别以40/10/40/10的摩尔比溶解于乙醇中。在混合下向含水缓冲液(50mm柠檬酸盐,ph4)中加入脂质混合物,得到分别为30%(vol/vol)和6.1mg/ml的终乙醇和脂质浓度,在挤压前,使混合物在室温下平衡2分钟。使用lipexextruder(northernlipids,vancouver,bc)将含水脂质在22℃下挤压通过两个堆叠的80nm孔径的滤器(nuclepore)直至获得如通过nicomp分析测定的70至90nm的囊泡直径。这通常需要1至3次通过。对于一些不形成小囊泡的阳离子脂质混合物,用更低的ph缓冲剂(50mm柠檬酸盐,ph3)使脂质混合物水化以质子化dspc头部基团上的磷酸基团,帮助形成稳定的70-90nm囊泡。边混合边以约5ml/分钟的速度向预平衡至35℃的囊泡加入fviisirna(溶解在含30%乙醇的50mm柠檬酸盐水溶液(ph4)中)。在达到0.06(wt/wt)的终靶sirna/脂质比率后,将混合物在35℃下再温育30分钟以允许囊泡再组织和封装fviisirna。然后除去乙醇,通过透析或切向流渗滤用pbs(155mmnacl,3mmna2hpo4,1mmkh2po4,ph7.5)来替换外部缓冲液。在使用大小排阻旋转柱或离子交换旋转柱除去未封装的sirna后,测定最终的封装的sirna对脂质的比率。实施例22:新型脂质制剂的效率的体内测定最初在施以0.1、0.3、1.0和5.0mg/kg的7至9周龄、15至25g的雌性c57bl/6小鼠中评估测试制剂的fvii敲低,每个处理组3只小鼠。全部研究包括接受磷酸缓冲盐溶液(pbs,对照组)或基准制剂的动物。将制剂在即将测试前于pbs中稀释至适当的浓度。将小鼠称重,计算适当的给药体积(10μl/g体重)。通过侧尾静脉来静脉内施用测试制剂和基准制剂以及pbs(对照动物)。24小时后,通过腹膜内注射氯胺酮/赛拉嗪来麻醉动物,通过心脏穿刺将500-700μl血液采集至血清分离管(bdmicrotainer)内。在15℃以2,000xg来离心血液10分钟,然后收集血清并将其于-70℃下贮存直至分析。在37℃下解冻血清样品30分钟,将其稀释于pbs中,将其等分到96孔测定板中。按照制造商的说明书使用生色测定(biophenfvii试剂盒,hyphenbiomed)来评估因子vii水平,在配备有405nm波长滤光器的微板读数器中测量吸光度。定量血浆fvii水平,使用从对照动物的血清的混合样品产生的标准曲线来计算ed50(与对照动物相比较导致血浆fvii水平降低50%的剂量)。在独立的研究中,以更低的剂量范围来再次测试显示高水平的fvii敲低(ed50<<0.1mg/kg)的那些目标制剂,从而确认潜能并确立ed50。图4提供了描述使用本方法测试的示例性化合物的ec50的表。实施例22a:配制的脂质的pka的测定基本上如(eastman等人1992biochemistry31:4262–4268)所描述的,使用荧光探针2-(对甲苯氨基)-6-萘磺酸(tns)来测定不同的可离子化的阳离子脂质的pka,所述荧光探针在水中是无荧光的,但当与膜结合时其变得略有荧光。将由阳离子脂质/dspc/ch/peg-c-domg(40:10:40:10摩尔比)组成的囊泡在范围为2至11的不同ph的缓冲液(130mmnacl,10mmch3coonh4,10mmmes,10mmhepes)中稀释至0.1mm。向稀释的囊泡中加入tns水溶液的等分试样(最终为1m),在30秒的平衡期后,分别在321nm和445nm的激发和发射波长来测量含tns溶液的荧光。通过使用商业绘图程序igorpro将所测量的的荧光对溶液ph作图并且将数据与sigmodial曲线拟合来测定含有阳离子脂质的囊泡的pka。图4提供了描述使用本方法测试的示例性化合物的pka的表。实施例23:酰胺连接的脂质的合成在室温下向dcm中的n,n-二甲基氨基丙酸盐酸盐(1,0.198g,1.3mmol,1.0当量)的搅拌悬液中加入hbtu(0.59g,1.56mmol,1.2当量)和dipea(0.71ml,3.9mmol,3.0当量)。在搅拌10分钟后,在室温下逐滴加入dcm中的胺(2,0.7g,1.3mmol,1.0当量)溶液,并且继续搅拌直至反应完成。用dcm来稀释反应混合物,用饱和nahco3溶液、然后用盐水进行洗涤,分离有机层,经mgso4干燥,浓缩并使用dcm:meoh(5%)作为梯度通过硅胶柱层析进行纯化,获得纯油状化合物3(alny-201),收率为70%。1hnmr(400mhz,cdcl3)δ7.18(brs,1h),5.47-5.19(m,8h),3.18-3.07(m,4h),2.76(t,j=6.5,4h),2.70(s,6h),2.60(t,j=6.0,2h),2.04(q,j=6.8,9h),1.48(brs,1h),1.40-1.14(m,43h),0.88(t,j=6.8,6h)。13cnmr(101mhz,cdcl3)δ172.26,130.41,130.36,128.17,128.15,77.54,77.22,76.90,55.70,43.85,43.02,37.90,31.99,31.74,30.25,29.92,29.86,29.81,29.57,27.47,27.42,26.84,25.85,22.79,14.29。c43h80n2o的分子量:计算值640.6,实测值641.5。实施例24:氨基甲酸酯和尿素连接的脂质的合成化合物1033方案1阶段-1:编号化学品/试剂和溶剂分子量摩尔数当量质量1醇10305280.095150g2dcm500ml3三乙胺(tea)101.20.378453ml4dmap122.170.00950.11.2g5甲磺酰氯114.550.19215ml在氩气气氛下向dcm(400ml)中的醇1030溶液中加入tea和dmap,并且在室温、氩气气氛下搅拌。将反应物质冷却至-5℃,在低于-5℃的温度下缓慢加入dcm(100ml)中的甲磺酰氯溶液,在加入后使其升温至室温。30分钟后(tlc),用冰冷的水(20ml)来淬灭反应物质。分离有机层,用1nhcl(30ml)、水、盐水洗涤,经硫酸钠干燥,减压蒸发以获得黄色液体的纯产物1031(55g,收率:95.5%)。hplc:99.8%;1hnmr(400mhz,cdcl3):δ0.89(t,6h,j=6.8hz),1.2-1.5(m,36h),1.67(m,4h),2.05(q,8h,j=6.8hz),2.77(t,4h,j=6.4hz),2.99(s,3h),4.71(m,1h)和5.36(m,8h)。13cnmr(100mhz,cdcl3):δ14.0,22.5,24.9,25.6,27.2,29.2,29.3,29.4,29.5,29.6,31.5,34.4,38.6,45.9,84.3,127.9,128.0,130.0,130.1。阶段-2:编号化学物质/试剂和溶剂分子量摩尔数当量质量1甲磺酸酯10316060.0165110g2二甲基甲酰胺(dmf)100ml3氰化钠490.033021.617g在氩气气氛下缓慢地向dmf中的氰化钠溶液中加入dmf中的阶段-1产物,然后加热至55℃达24小时(hplc)。然后将其冷却至室温,用水稀释,然后用乙酸乙酯萃取(数次)。用水、盐水洗涤合并的有机层,经硫酸钠干燥,减压蒸发以获得粗制产物,使用1%乙醚/己烷作为洗脱剂通过硅胶层析来纯化所述粗制产物,以提供为浅黄色液体的纯产物1032(5.8g,收率:62%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.25(m,38h),1.52(m,4h),2.03(q,8h,j=6.8hz),2.47(m,1h),2.76(t,4h,j=6.4hz),5.32(m,8h)。阶段-3:编号化学物质/试剂和溶剂分子量摩尔数当量质量1腈10325380.009715.2g2氢化铝锂380.038741.5g3四氢呋喃(thf)52ml在0℃、氩气气氛下向干燥thf中的氢化铝锂悬液中逐滴加入thf中的阶段-2产物。然后使其升温至室温(rt)并且在室温下搅拌20小时(tlc)。将其冷却至0℃,用硫酸钠的饱和溶液进行淬灭。将淬灭的物质通过硅藻土床过滤,用乙酸乙酯洗涤。减压蒸发合并的滤液以获得粗制产物,使用10%乙酸乙酯的己烷溶液通过硅胶层析来纯化所述粗制产物,从而提供为浅褐色液体的纯产物1033(3.7g,收率:71%),hplc:93.8%.1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.27(m,48h),2.03(q,8h,j=6.8hz),2.60(d,2h,j=4.0hz),2.76(t,4h,j=6.4hz),5.31(m,8h)。13cnmr(100mhz,cdcl3):δ14.1,22.6,25.6,26.8,27.1,27.2,29.3,29.5,29.6,30.1,31.5,40.9,45.2,128.0,130.1.lc-ms:543(m+)。方案2化合物1003(alny-192)向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯(5.50g,21.5mmol)溶液中逐滴加入3-二甲氨基-1-丙醇(1001,2.43g,23.6mmol)。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.822ml,5.90mmol)和aln-san-30(2.08g,3.93mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%的ch2cl2中的meoh)来纯化粗制产物,从而提供化合物1003(1.66g,2.53mmol,64%,rf=0.22,利用5%meoh的ch2cl2溶液)。1hnmr(cdcl3,400mhz)δ5.30-5.41(m,8h),4.37(d,j=8.0hz,1h),4.09(t,j=6.0hz,2h),3.57(brs,1h),2.78(t,j=6.0hz,4h),2.33(t,j=8.0hz,2h),2.23(s,6h),2.02-2.06(m,8h),1.76-1.80(m,2h),1.27-1.45(m,40h),0.89(t,j=8.0hz,6h)。13cnmr(cdcl3,100mhz)δ156.5,130.4,130.3,128.2,128.1,63.2,56.6,51.4,45.7,35.7,31.7,29.9,29.8,29.7,29.6,29.5,27.7,27.5,27.4,26.0,25.8,22.8,14.3。c43h81n2o2(m+h)+的分子量:计算值657.63,实测值657.5。化合物1004(alny-200)向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯(5.50g,21.5mmol)溶液中逐滴加入3-二甲氨基-1-丙醇(1001,2.43g,23.6mmol)。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.697ml,5.00mmol)和胺1033(1.71g,3.15mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,从而提供化合物1004(1.14g,1.70mmol,54%,rf=0.13,用5%meoh的ch2cl2溶液)。c44h83n2o2(m+h)+的分子量:计算值671.65,实测值671.5。方案3化合物1007向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯(5.50g,21.5mmol)溶液中逐滴加入2-二甲氨基-1-丙醇(1005,2.37g,23.6mmol)。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.822ml,5.90mmol)和aln-san-30(2.07g,3.92mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,得到化合物1007(1.78g,2.77mmol,71%,2个步骤,rf=0.26,用5%meoh的ch2cl2溶液显色)。c42h79n2o2(m+h)+的分子量:计算值643.61,实测值643.5。化合物1008向ch2cl2(200ml)中的n,n'-二琥珀酰亚胺基碳酸酯(5.50g,21.5mmol)溶液中逐滴加入2-二甲氨基乙醇(1005,2.37ml,23.6mmol)。在室温下搅拌所得的混合物过夜。取出50ml溶液,加入et3n(0.697ml,5.00mmol)和1033(440mg,0.812mmol),在室温下搅拌反应混合物过夜。用ch2cl2稀释反应混合物,用nahco3饱和水溶液洗涤。经无水mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(0-5%meoh的ch2cl2溶液)来纯化粗制产物,得到化合物8(332mg,0.505mmol,62%,rf=0.30,用5%meoh的ch2cl2溶液)。c43h81n2o2(m+h)+的分子量:计算值657.63,实测值657.5。实施例25:胍盐连接的脂质的合成胍盐类似物2064的合成2063的合成:在0℃下向dmf/乙酸乙酯混合物中的2058溶液(6.7g,0.0112mol)中加入双-boc-s-甲基异硫脲(3.4g,0.0118mol)和三乙胺(3.5ml,0.246mol)。在0℃下向均质溶液中加入hgcl2(3.3g,0.0123mol),在室温下搅拌1小时。tlc显示起始材料不存在。然后用乙酸乙酯(100ml)来稀释反应物质。通过硅藻土层过滤,用乙酸乙酯洗涤。用水(2x150ml)和盐水(200ml)洗涤滤液。再次将混浊有机层通过硅藻土层/230-400目硅胶/硅藻土进行过滤。减压蒸发滤液以获得粗制产物,使用dcm/己烷作为洗脱剂通过中性氧化铝层析来纯化所述粗制产物。产物在40%dcm的己烷溶液中得到洗脱,为黄色液体(收率5.2g,55%)。1hnmr(400mhz,cdcl3):0.89(t,6h,j=6.8hz),1.27-1.46(m,43h),1.49(s,9h),1.50(s,9h),2.02(q,8h,j1=6.8hz,j2=6.8hz),2.12(d,2h,j=7.2hz),2.16(s,3h),2.46(t,2h,j=5.6hz),2.77(t,4h,j=6hz),3.47(m,2h),5.30(m,8h),8.67(s,1h),11.48(9s,1h)。2064(alny-139)的合成:在0℃下向10mldcm中的2063溶液(5.2g,0.0062mol)缓慢加入60mldcm中的10mltfa。加入后,在室温下搅拌反应物质3小时。tlc显示不存在起始材料。在真空下除去过量tfa,以获得为褐色粘稠液体的需要的产物(5.3g,78%)。1hnmr(400mhz,cdcl3):0.89(t,6h,j=6.8hz),1.27-1.46(m,44h),1.78(s,1h),2.02(q,8h,j1=6.4hz,j2=6.8hz),2.77(t,4h,j=6.4hz),2.86(s,3h),2.92-3.01(m,2h),3.27-3.39(m,2h),3.76-3.9(m,2h),5.30(m,8h),7.12(m,2h),8.41(m,1h),10.02(m,3h)。13cnmr(100mhz,cdcl3):14.0,22.5,25.6,25.8,26.0,27.17,27.19,27.6,29.3,29.33,29.5,29.6,31.0,31.5,33.9,36.3,41.0,54.1,55.2,62.0,62.19,111.4,114.3,117.1,119.9,127.9,127.95,130.1,130.2,152.1,155.0,157.4,161.2,161.6,161.96,162.3.ms:1093(四tfa盐)。实施例26:肟和腙连接的脂质的合成方案1实验细节化合物5006(alny-175):向装有etoh(50ml)的烧瓶中加入二甲氨基乙基肼二盐酸盐(1.00g,5.70mmol)和酮5005(2.00g,3.80mmol)。将混合物在60℃下加热16小时。在加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液来萃取残留物,在mgso4上干燥有机层,过滤并且浓缩。通过硅胶柱层析(ch2cl2:meoh:nh3水溶液=95:5:0.5,rf=0.29)来纯化粗制产物,得到化合物3(1.78g,2.91mmol,76%)。c41h78n3(m+h)+的分子量:计算值612.62,实测值612.5。化合物5007(alny-187):将etoh(10ml)中的3-二甲氨基-丙酸肼(ryanscientific,500mg,3.89mmol)和etoh(20ml)中的二亚油醇酮5005(1.74g,3.31mmol)混合在一起。向该溶液中加入乙酸(0.038ml,0.662mmol),将反应混合物在65℃下加热5小时。在加入et3n(0.5ml)后,蒸发反应混合物。用ch2cl2和nahco3饱和水溶液来萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(ch2cl2:meoh:nh3水溶液=95:5:0.5,rf=0.30)来纯化粗制产物,得到化合物5007(1.40g,2.19mmol,66%)。c42h78n3o(m+h)+的分子量:计算值640.61,实测值640.5。方案2.化合物5008b:在氩气气氛下向甲苯中的5008a溶液(30g,56.8mmol)中加入n-羟基酞酰亚胺(13.9g,85mmol)和tpp(22.30g,85mmol)。将反应物质冷却至-5℃,向其中加入tea(11.84ml),然后加入dead(13.14ml)。允许该反应物质在室温下搅拌12小时(tlc)。然后通过硅藻土层进行过滤。减压蒸发滤液以获得粗制产物,通过硅胶层析来纯化所述粗制产物以得到纯产物,其在3%乙醚和己烷上进行洗脱以获得为浅黄色液体的产物5008b(22.90g,60.50%)。1hnmr(400mhz,cdcl3):δ0.90(6h,t,j=7.2hz),1.2-1.4(34h,m),1.66-1.70(4h,m),2.03-2.08(8h,m),2.78(4h,t,j=12.8hz),4.22(1h,m),5.29-5.43(8h,m),7.74-7.76(2h,m),7.83-7.85(2h,m)。13cnmr(100mhz,cdcl3):δ14.3,22.5,24.9,25.6,27.2,27.20,29.3,29.3,29.5,29.5,29.6,29.7,31.5,32.4,88.3,123.3,127.9,129.0,130.1,134.3,164.3。ms:c45h71no3的分子量:计算值673.54,实测值:674.55(m+h)。5010(aly-san-031):(2.36g,3.50mmol),用ch2cl2(36ml)和etoh(4ml)中的一水合肼(0.424ml,5.60mmol)进行处理2小时。在过滤所得的白色沉淀后,浓缩滤液。用et2o和nahco3饱和水溶液来萃取残留物,经mgso4干燥有机层,过虑并且浓缩。将粗制5008用于下一步骤而无需进一步纯化。rf=0.44(10%etoac的己烷溶液)。c37h70no(m+h)+的分子量:计算值544.55,实测值544.2。将化合物5008溶解在etoh(30ml)中,向该溶液中加入4-(二甲氨基)丁-2-酮(matrixscientific,500mg,4.34mmol)和乙酸(0.040ml,0.70mmol)。在室温下搅拌反应混合物14小时。在加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液来萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(己烷:etoac=1:1)来纯化粗制产物,得到为e/z-异构体混合物的化合物5010(1.90g,2.96mmol,85%,2个步骤,rf=0.39,0.21,用己烷:etoac=1:1显色)。c43h81n2o(m+h)+的分子量:计算值641.63,实测值641.5。化合物5009:将化合物5006(800mg,1.47mmol)溶解在etoh(15ml)中,将(二甲氨基)丙酮(aldrich,0.220ml,1.91mmol)和乙酸(0.017ml,0.294mmol)加入该溶液,然后在室温下搅拌反应混合物14小时。在加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液来萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(己烷:etoac=9:1)来纯化粗制产物,得到化合物5009(868mg,1.38mmol,94%,rf=0.22,用己烷:etoac=9:1显色)。c42h79n2o(m+h)+的分子量:计算值627.62,实测值627.5。化合物5011:将化合物5006(1.09g,2.00mmol)溶解在etoh(20ml)中。将1-甲基-4-哌啶酮(aldrich,0.320ml,2.60mmol)和乙酸(0.40ml,0.400mmol)加入该溶液,然后在室温下搅拌反应混合物14小时。在加入et3n(0.5ml)后,蒸发反应混合物。用et2o和nahco3饱和水溶液来萃取残留物,经mgso4干燥有机层,过滤并且浓缩。通过硅胶柱层析(ch2cl2:meoh:nh4oh=97:3:0.3)来纯化粗制产物,得到化合物5011(1.11g,1.74mmol,87%,rf=0.20,用ch2cl2:meoh:nh4oh=97:3:0.3显色)。c43h79n2o(m+h)+的分子量:计算值639.62,实测值639.5。实施例27:其它脂质合成化合物2056(alny-181)的合成2051的合成:在氩气气氛下向dcm(400ml)中的2004溶液(50g,95mmol)中加入tea(53ml,378mmol)和dmap(1.2g,9.5mmol),然后在室温、氩气气氛下搅拌。将反应物冷却至-5℃,在低于-5℃的温度下缓慢加入dcm(100ml)中的甲磺酰氯溶液(15ml,190mmol),在加入后,允许其升温至室温。30分钟后(tlc),用冰冷的水(20ml)来淬灭反应物。分离有机层,用1nhcl(30ml)、水、盐水洗涤,经硫酸钠干燥,减压蒸发以获得为黄色液体的纯产物(55g,95.5%)。1hnmr(400mhz,cdcl3):δ0.89(t,6h,j=6.8),1.2-1.5(m,36h),1.67(m,4h),2.05(q,8h,j1=6.8,j2=6.8),2.77(t,4h,j=6.4),2.99(s,3h),4.71(m,1h)和5.36(m,8h)。2052的合成:向dmf中的氰化钠(1.70g,0.0330mol)的搅拌的溶液中缓慢地加入dmf(100ml)中的化合物2051(10g,0.0165mol),将其加热至55℃达24小时(tlc)。然后将其冷却至室温,用水稀释,用乙酸乙酯萃取数次。用水、盐水洗涤合并的有机层,经硫酸钠干燥,减压蒸发以获得粗制产物,使用1%乙醚/己烷通过硅胶层析来纯化所述粗制产物,得到为浅黄色液体的产物(5.80g,62%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.25(m,38h),1.52(m,4h),2.03(q,8h,j=6.8hz,j=6.8hz),2.47(m,1h),2.76(t,4h,j=6.4hz),5.32(m,8h)。2053的合成:在0℃、氩气气氛下向lah在thf(52ml)中的冷冻悬液(1.50g,0.0387mol)中逐滴加入thf中的化合物2052(5.2g,0.0097mol)。加入后,允许其升温至室温并且搅拌20小时(tlc)。将其冷却至0℃,用硫酸钠饱和溶液(10ml)、然后用乙酸乙酯进行淬灭。将其通过硅藻土床进行过滤,用乙酸乙酯洗涤。减压蒸发合并的有机滤液以获得粗制产物,使用10%乙酸乙酯的己烷溶液通过硅胶层析来纯化所述粗制产物,获得为浅褐色液体的产物(3.70g,71%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.27(m,48h),2.03(q,8h,6.8hz,6.8hz),2.60(d,2h,j=4.0hz),2.76(t,4h,j=6.4hz),5.31(m,8h)。13cnmr(100mhz,cdcl3):δ14.1,22.6,25.6,26.8,27.1,27.2,29.3,29.5,29.6,30.1,31.5,40.9,45.2,128.0,130.1。质量543(m+)。2054的合成:在0℃、氩气气氛下向dcm(450ml)中的化合物2053溶液(45g,0.083mol)中逐滴加入2,6-二甲基吡啶(19.3ml,0.166mol),然后逐滴加入氯甲酸苄酯(12.1ml,0.0847mol)。然后将其升温至20℃,在该温度下搅拌1小时(tlc)。然后用dcm(200ml)进行稀释,用10%柠檬酸(2x200ml)、水、盐水洗涤,经无水硫酸钠干燥,减压蒸发以获得粗制产物,使用3%乙醚/己烷通过硅胶层析来纯化所述粗制产物,获得为浅褐色液体的终产物(36g,64%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6hz),1.28(m,44h),2.02(q,8h,j1=6.8hz,j2=6.8hz),2.76(t,4h,j=6.4hz),3.11(t,2h,j=5.6hz),4.67(s,1h),5.18(s,2h),5.30(m,8h),7.31(m,4h)。2055的合成:在0℃、氩气气氛下向thf(360ml)中的氢化铝锂悬液(4.05g,0.1066mol)中逐滴加入thf中的2054溶液(36g,0.0533mol)。在加入后,允许其升温至室温并且搅拌15小时(tlc)。将反应物冷却至0℃,用硫酸钠饱和溶液、然后用乙酸乙酯进行淬灭。将其通过硅藻土床进行过滤,用乙酸乙酯洗涤。将合并的滤液进行蒸发,使用100%甲醇通过硅胶进行纯化,获得终产物(26g,87%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.27(m,42h),2.03(q,8h,j1=6.8hz,j2=6.8hz),2.45(s,3h),2.49(d,2h,j=6hz),2.76(t,4h,j=6.4hz),5.30(m,8h)。2055a的合成:在氩气气氛下将化合物2055(4g,0.0072mol)溶解在dcm(40ml)中并冷却至0℃。向该溶液中逐滴加入2,6-二甲基吡啶(1.7ml,0.0144mol),然后加入氯甲酸苄酯(1.0ml,0.0074mol)。然后允许其升温至20℃,搅拌1小时(tlc)。然后用dcm(200ml)对其进行稀释,用10%柠檬酸(2x200ml)、水和盐水进行洗涤。经无水硫酸钠干燥有机层,减压蒸发以获得粗制产物,使用3%乙醚/己烷通过硅胶来纯化所述粗制产物,获得终产物(3.80g,76%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.20(m,44h),2.02(q,8h,j1=6.8hz,j2=6.8hz),2.76(t,4h,j=6.4hz),2.89(d,3h,j=6hz),3.14(m,2h),5.12(s,2h),5.30(m,8h),7.26(m,4h).2056的合成:在0℃、氩气气氛下向thf中的氢化铝锂悬液(0.52g,0.0138mol)中逐滴加入thf(38ml)中的2055a溶液(3.80g,0.0055mol)。加入后,允许其升温至室温,搅拌15小时(tlc)。将反应物冷却至0℃,用饱和硫酸钠溶液、然后用乙酸乙酯进行淬灭。将整个物质通过硅藻土床进行过滤,用乙酸乙酯洗涤。减压蒸发合并的滤液以获得粗制产物,使用100%甲醇通过硅胶层析来纯化所述粗制产物,获得为无色液体的终产物(2.20g,70%)。1hnmr(400mhz,cdcl3):δ0.87(t,6h,j=6.8hz),1.21(m,44h),2.03(q,8h,j=6.8hz,j=6.4hz),2.18(s,6h),2.76(t,4h,j=6.4hz),5.30(m,8h)。13cnmr(100mhz,cdcl3):δ14.0,22.4,25.5,26.5,27.0,27.1,29.2,29.4,29.6,30.0,31.4,32.1,35.6,45.9,64.8,127.8,130.0.elsd:99.0%质量:570.2(m+)。2062(alny-141)的合成:2061的合成:在0℃、氩气气氛下向100mldcm的2055溶液(5g,0.0089mol)中加入nabh(oac)3(2.30g,0.0106mol)。搅拌20分钟。将700mldcm中的乙醛(1.70g,0.0082mol)在45分钟内缓慢地加入至反应物。在加入后,将反应物在室温下搅拌15至20分钟。tlc显示起始物质不存在。用饱和nahco3(2x500ml)和水(500ml)来洗涤反应物质。用dcm(500ml)再萃取水层。用盐水(500ml)洗涤合并的有机层。经na2so4干燥有机层,过滤并且浓缩。通过硅胶层析和己烷/乙醚作为洗脱剂来纯化粗制产物。用8%乙醚的己烷溶液洗脱的产物为褐色液体(收率,6.40g,96%)。1hnmr:(400mhz,cdcl3):0.89(t,6h,j=7.2hz),1.26-1.43(m,40h),1.85(m,1h),2.06(q,8h,j1=6.8hz,j2=6.8hz),2.15(s,2h),2.20(s,3h),2.45(m,2h),2.77(t,4h,j=6hz),2.95(s,3h),3.35(m,2h),5.12(s,2h),5.32(m,8h),7.35(m,5h)。2062的合成:在0℃、氩气气氛下向thf中的氢化铝锂的悬液(0.751g,0.0198mol)中逐滴加入thf中的2061溶液(5.7g,0.0076mol)。加入后,允许其升温至室温并且搅拌15小时(tlc)。将反应物冷却至0℃,用硫酸钠饱和溶液(50ml)、然后乙酸乙酯(100ml)进行淬灭。将其通过硅藻土床进行过滤,用乙酸乙酯洗涤。减压蒸发合并的滤液以获得粗制产物,使用dcm/乙酸乙酯/氯仿/甲醇作为洗脱剂通过硅胶层析来纯化所述粗制产物。用3%氯仿的甲醇溶液洗脱为褐色液体的产物(3.80g,80%)。1hnmr:(400mhz,cdcl3):0.89(t,6h,j=6.8hz),1.26-1.37(m,40h),1.42(m,1h),2.06(q,8h,j1=6.8hz,j2=6.8hz),2.15(d,2h,j=7.2hz),2.20(s,3h),2.29(s,6h),2.45(s,4h),2.78(t,4h,j=6.4hz),5.36(m,8h)。13cnmr:(100mhz,cdcl3):14.1,22.6,25.6,26.6,27.2,27.22,28.9,29.3,29.6,29.7,30.1,31.5,32.2,35.8,43.2,45.7,56.2,57.2,63.3,127.9,130.2.hplcelsd:100%。质量:627.53。可组合上述不同的实施方案以提供其它实施方案。本说明书中提及的和/或申请数据表中所列出的全部美国专利、美国专利申请公开案、非美国专利、非美国专利申请和非专利出版物以引用的方式全文并入本文。如果必要,可修改实施方案的方面以利用各专利、申请和出版物的概念来提供进一步的实施方案。根据上述详细说明对实施方案做出这些和其它改变。通常,在下面的权利要求中,使用的术语不应当被解释为将权利要求限制在本说明书和权利要求中所公开的具体实施方案中,而是应当被解释为包括所有可能的实施方案以及这样的权利要求所赋予权力的等同物的全部范围。因此,权利要求不受本公开内容的限制。序列表<110>阿布特斯生物制药公司<120>用于递送治疗剂的脂质和组合物<130>a2038-7187wo<140>pct/us2009/063931<141>2009-11-10<150>61/234,098<151>2009-08-14<150>61/225,898<151>2009-07-15<150>61/185,438<151>2009-06-09<150>61/171,439<151>2009-04-21<150>61/154,350<151>2009-02-20<150>61/113,179<151>2008-11-10<160>73<170>patentinversion3.5<210>1<211>16<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>1taacgttgaggggcat16<210>2<211>16<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>2taacgttgaggggcat16<210>3<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>3tccatgacgttcctgacgtt20<210>4<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>4tccatgacgttcctgacgtt20<210>5<211>16<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>5taagcatacggggtgt16<210>6<211>24<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>6gatgctgtgtcggggtctccgggc24<210>7<211>24<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>7tcgtcgttttgtcgttttgtcgtt24<210>8<211>24<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>8tcgtcgttttgtcgttttgtcgtt24<210>9<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>9tccaggacttctctcaggtt20<210>10<211>18<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>10tctcccagcgtgcgccat18<210>11<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>11tgcatcccccaggccaccat20<210>12<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>12gcccaagctggcatccgtca20<210>13<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>13gcccaagctggcatccgtca20<210>14<211>15<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>14ggtgctcactgcggc15<210>15<211>16<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>15aaccgttgaggggcat16<210>16<211>24<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>16tatgctgtgccggggtcttcgggc24<210>17<211>18<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>17gtgccggggtcttcgggc18<210>18<211>18<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>18ggaccctcctccggagcc18<210>19<211>18<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>19tcctccggagccagactt18<210>20<211>15<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>20aacgttgaggggcat15<210>21<211>15<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>21ccgtggtcatgctcc15<210>22<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>22cagcctggctcaccgccttgg21<210>23<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>23cagccatggttccccccaac20<210>24<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>24gttctcgctggtgagtttca20<210>25<211>18<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>25tctcccagcgtgcgccat18<210>26<211>15<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>26gtgctccattgatgc15<210>27<211>33<212>rna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>27gaguucugaugaggccgaaaggccgaaagucug33<210>28<211>15<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>28aacgttgaggggcat15<210>29<211>16<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>29caacgttatggggaga16<210>30<211>20<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<400>30ttccatgacgttcctgacgt20<210>31<211>29<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>31alaalaleuglualaleualaglualaleuglualaleualagluala151015leuglualaleualaglualaalaalaalaglyglycys2025<210>32<211>30<212>prt<213>人工序列<220><223>人工序列说明:合成多肽<400>32alaalaleualaglualaleualaglualaleualaglualaleuala151015glualaleualaglualaleualaalaalaalaglyglycys202530<210>33<211>15<212>prt<213>人工序列<220><223>人工序列说明:合成多肽<400>33alaleuglualaleualaglualaleuglualaleualagluala151015<210>34<211>22<212>prt<213>甲型流感病毒(influenzaavirus)<400>34glyleupheglualailegluglypheilegluasnglytrpglugly151015metiletrpasptyrgly20<210>35<211>23<212>prt<213>甲型流感病毒<400>35glyleupheglyalailealaglypheilegluasnglytrpglugly151015metileaspglytrptyrgly20<210>36<211>24<212>prt<213>甲型流感病毒<400>36glyleupheglualailegluglypheilegluasnglytrpglugly151015metileaspglytrptyrglycys20<210>37<211>22<212>prt<213>甲型流感病毒<400>37glyleupheglualailegluglypheilegluasnglytrpglugly151015metileaspglyglycys20<210>38<211>35<212>prt<213>人工序列<220><223>人工序列说明:合成多肽<400>38glyleupheglyalaleualaglualaleualaglualaleualaglu151015hisleualaglualaleualaglualaleuglualaleualaalagly202530glysercys35<210>39<211>34<212>prt<213>人工序列<220><223>人工序列说明:合成多肽<400>39glyleupheglualailegluglypheilegluasnglytrpglugly151015leualaglualaleualaglualaleuglualaleualaalaglygly202530sercys<210>40<211>21<212>prt<213>甲型流感病毒<220><221>mod_res<222>(17)..(17)<223>norleucine<400>40glyleupheglualailegluglypheilegluasnglytrpglugly151015leuileaspglylys20<210>41<211>20<212>prt<213>甲型流感病毒<220><221>mod_res<222>(17)..(17)<223>norleucine<400>41glyleupheglualailegluglypheilegluasnglytrpglugly151015leuileaspgly20<210>42<211>16<212>prt<213>果蝇(drosophilasp.)<400>42argglnilelysiletrppheglnasnargargmetlystrplyslys151015<210>43<211>13<212>prt<213>人类免疫缺陷病毒1<400>43glyarglyslysargargglnargargargproprogln1510<210>44<211>27<212>prt<213>人类免疫缺陷病毒1<400>44glyalaleupheleuglytrpleuglyalaalaglyserthrmetgly151015alatrpserglnprolyslyslysarglysval2025<210>45<211>18<212>prt<213>小鼠<400>45leuleuileileleuargargargilearglysglnalahisalahis151015serlys<210>46<211>26<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>46glytrpthrleuasnseralaglytyrleuleulysileasnleulys151015alaleualaalaleualalyslysileleu2025<210>47<211>18<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>47lysleualaleulysleualaleulysalaleulysalaalaleulys151015leuala<210>48<211>9<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>48argargargargargargargargarg15<210>49<211>10<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>49lysphephelysphephelysphephelys1510<210>50<211>37<212>prt<213>人类<400>50leuleuglyaspphephearglysserlysglulysileglylysglu151015phelysargilevalglnargilelysasppheleuargasnleuval202530proargthrgluser35<210>51<211>31<212>prt<213>猪蛔虫(ascarissuum)<400>51sertrpleuserlysthralalyslysleugluasnseralalyslys151015argilesergluglyilealailealaileglnglyglyproarg202530<210>52<211>30<212>prt<213>人类<400>52alacystyrcysargileproalacysilealaglygluargargtyr151015glythrcysiletyrglnglyargleutrpalaphecyscys202530<210>53<211>36<212>prt<213>人类<400>53asphistyrasncysvalserserglyglyglncysleutyrserala151015cysproilephethrlysileglnglythrcystyrargglylysala202530lyscyscyslys35<210>54<211>12<212>prt<213>未知<220><223>未知部分描述:未知的bactenecin肽(unknownbactenecinpeptide)<400>54arglyscysargilevalvalileargvalcysarg1510<210>55<211>42<212>prt<213>野猪(susscrofa)<400>55argargargproargproprotyrleuproargproargpropropro151015phepheproproargleuproproargileproproglyphepropro202530argpheproproargpheproglylysarg3540<210>56<211>13<212>prt<213>未知<220><223>未知部分的描述:未知的indolicidin肽(unknownindolicidinpeptide)<400>56ileleuprotrplystrpprotrptrpprotrpargarg1510<210>57<211>16<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>57alaalavalalaleuleuproalavalleuleualaleuleualapro151015<210>58<211>11<212>prt<213>人工序列<220><223>人工序列说明:合成肽<400>58alaalaleuleuprovalleuleualaalapro1510<210>59<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>59cuuacgcugaguacuucgatt21<210>60<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>60ucgaaguacucagcguaagtt21<210>61<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>61cuuacgcugaguacuucgatt21<210>62<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>62ucgaaguacucagcguaagtt21<210>63<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>63cuuacgcugaguacuucgatt21<210>64<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>64ucgaaguacucagcguaagtt21<210>65<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>65cuuacgcugaguacuucgatt21<210>66<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>66ucgaaguacucagcguaagtt21<210>67<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>67ggaucaucucaagucuuactt21<210>68<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>68guaagacuugagaugaucctt21<210>69<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>69ggaucaucucaagucuuactt21<210>70<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>70guaagacuugagaugaucctt21<210>71<211>4<212>prt<213>人工序列<220><223>人工序列说明:合成寡核苷酸peptide<400>71glualaleuala1<210>72<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>72ggaucaucucaagucuuactt21<210>73<211>21<212>dna<213>人工序列<220><223>人工序列说明:合成寡核苷酸<220><223>组合dna/rna分子描述:合成寡核苷酸<400>73guaagacuugagaugaucctt21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1