Sorbicillinoids化合物及其制备方法与应用与流程
本发明涉及药物化合物技术领域,具体涉及一种sorbicillinoids化合物及其制备方法与应用。
背景技术:
肿瘤是当今严重威胁人类健康的疾病之一。据统计,2018年全球有1810万肿瘤新发病例,960万患者因肿瘤死亡。耐药性是肿瘤临床治疗的重大难题,增强治疗敏感性或克服耐药性是肿瘤领域亟须攻克的难题。但这些药物往往作用靶点单一、毒副反应较大且治疗耐药过程中容易产生继发耐药甚至多药耐药,导致肿瘤治疗的难度进一步增大。因此,寻找高效、低毒、广谱的逆转肿瘤耐药方法或药物已成为当今肿瘤领域的研究热点及难点。
天然产物是指从自然界中的植物、动物以及微生物中得到的具有生物学活性的化学小分子。许多天然产物来源的活性小分子作为活性前体化合物在新药研发的过程中起着不可替代的作用。海洋微生物由于生存在特殊的海洋环境中(高压,低温,缺氧,黑暗),其体内往往具有特殊的代谢途径从而产生结构新颖的次级代谢产物。一些来自深海的生物碱类化合物、萜类化合物、黄酮类化合物等可表现出强的抗肿瘤活性。
sorbicillinoids化合物是一类六酮代谢产物的家族,它们具有高度多样的生物活性,分离自海洋和陆地来源的真菌。其中许多成员有复杂的二聚或三聚结构,这些化合物的另一个结构特征是c1’-c6’山梨醇侧链。自1948年cram等人首次报道以来,人们对sorbicillinoids化合物进行了广泛的研究。这些化合物独特的结构特征和生物活性使其成为开发新型药物的潜在化合物。在过去的几十年里,多个sorbicillinoids化合物已经在不同的生物试验中进行了筛选,这些研究大多集中在细胞毒性、抗氧化、抗病毒和抗癌活性上。因此,分离并筛选新的sorbicillinoids化合物并研究其抗肿瘤活性在对于抗癌药物的研发具有重要意义。
技术实现要素:
本发明的目的在于提供一种sorbicillinoids化合物及其制备方法与应用,本发明提供的sorbicillinoids化合物分离自青霉菌penicilliumallii-sativi的发酵产物,其具有显著的抗肿瘤活性,有潜力用于抗癌药物的制备和研发。
为此,本发明的第一方面提供一种sorbicillinoids化合物,其为式(i)或式(ii)所示的化合物或其盐:
其中,所述r1、r2各自独立地选自甲基或氢;
本发明的第二方面,提供所述sorbicillinoids化合物的制备方法,包括以下步骤:
s1、将青霉菌penicilliumallii-sativi进行发酵培养,得到发酵物;所述青霉菌penicilliumallii-sativi保藏于中国海洋微生物菌种保藏管理中心(marineculturecollectionofchina,mccc),保藏编号为mccc3a00580;
s2、将步骤s1得到的发酵物进行萃取,所得萃取物经分离纯化,得到所述sorbicillinoids类化合物。
进一步,步骤s2包括:
s21、将步骤s1得到的发酵物进行萃取发酵物用乙酸乙酯萃取,取有机萃取物进行层析,分别使用石油醚,二氯甲烷和甲醇进行洗脱;浓缩二氯甲烷层,得到粗提物;
s22、将步骤s21得到的粗提物用正相硅胶柱色谱进行分离,用石油醚-乙酸乙酯体系进行梯度洗脱,依次得到8个粗馏分:fr.1~fr.8;
s23、将步骤s22得到的粗馏分fr.3先使用ods柱色谱进行分离,再使用水-甲醇体系进行梯度洗脱依次得到三段粗馏分:fr.3-1、fr.3-2、fr.3-3;
s24、将步骤s23得到的粗馏分fr.3-2用正相柱色谱和葡聚糖凝胶柱分离后得到式1化合物和式2化合物;
进一步,步骤s24中正相柱色谱所用流动相为石油醚-乙酸乙酯,石油醚和乙酸乙酯的体积比为3:1。
进一步,步骤s24中葡聚糖凝胶柱所用流动相为甲醇。
进一步,所述步骤s2还包括以下步骤:
s25、将步骤s23得到的粗馏分fr.3-3用正相柱色谱和葡聚糖凝胶柱分离后得到式3化合物;
进一步,步骤s25中正相柱色谱所用流动相为二氯甲烷-甲醇,二氯甲烷和甲醇的体积比为50:1。
进一步,步骤s25中葡聚糖凝胶柱所用流动相为甲醇。
进一步,所述步骤2还包括以下步骤:
s26、将步骤s22得到的粗馏分fr.8经过ods柱色谱和正相柱色谱分离纯化得到式4化合物和式5化合物;
进一步,步骤s26中ods柱色谱所用流动相为甲醇-水,其中甲醇的浓度梯度为5%→100%。
进一步,步骤s26中正相柱色谱所用流动相为二氯甲烷-甲醇,二氯甲烷和甲醇的体积比为30:1。
进一步,步骤s1中,所述青霉菌penicilliumallii-sativi的发酵培养条件包括:将菌丝体接到含有pdb的培养液中,经培养获得种子液;将所述种子液接种到发酵培养基中,于28℃静态培养25~35天;所述发酵培养基包括5~10%(w/v)的大米和10~15%(v/v)的海水。
进一步,步骤s1中,所述菌丝体通过以下步骤制备得到:将青霉菌penicilliumallii-sativi在pda平板上于25℃培养3~4天,获得所述菌丝体。
本发明的第三方面,提供所述sorbicillinoids化合物或其盐在制备以下产品中的应用:1)肿瘤细胞增殖抑制剂;2)预防和/或治疗肿瘤疾病的药物。
进一步,所述肿瘤细胞包括乳腺癌细胞、肺癌细胞、肝癌细胞、食管癌细胞、结直肠癌细胞和前列腺癌细胞;优选为结直肠癌细胞、肝癌细胞。
进一步,所述肿瘤疾病包括肺癌、乳腺癌、肝癌、食管癌、结直肠癌和前列腺癌;优选为结直肠癌、肝癌。
与现有技术相比,本发明具有以下优点:
本发明提供了新的sorbicillinoids化合物,其分离自深海青霉菌penicilliumallii-sativi的发酵液。本发明还提供了相应的从发酵液中分离所述化合物的方法,该制备方法具有环保、步骤简单、产品纯度高等优点。本发明经细胞毒性实验验证了所述sorbicillinoids化合物的抗癌作用,并且进一步通过细胞周期分析、主要标志物分析,证明了所述化合物通过抑制肿瘤细胞增殖来达到抗癌效果。本发明提供的sorbicillinoids化合物在制备抗癌药物方面具有良好的应用前景。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:
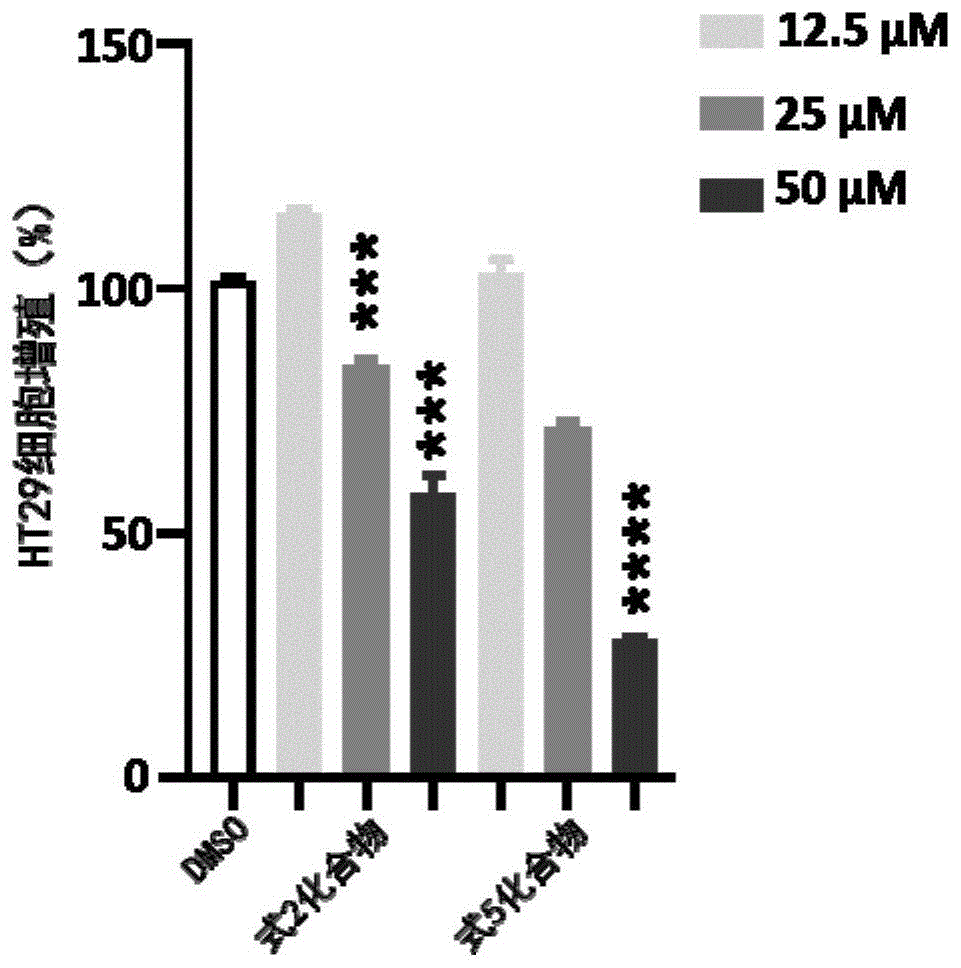
图1为本发明提供的化合物对ht29的增殖抑制结果;
图2为本发明提供的化合物对huh-7的增殖抑制结果;
图3为经本发明提供的化合物作用后ht29的细胞周期的流式分析结果;
图4为用式2化合物处理ht29细胞后的westernblot检测结果;
图5为用式5化合物处理ht29细胞后的westernblot检测结果。
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
实施例1sorbicillinoids类化合物的制备
(1)将青霉菌penicilliumallii-sativi(保藏编号mccc3a00580)在pda平板上于25℃培养3天;然后将新鲜的菌丝体接到含有400mlpdb的培养液中;24h后,将10ml种子液接种到1l的三角烧瓶中(100瓶),每瓶中有80g大米和120ml3%的海水,在28℃下静态培养30天;
(2)将步骤(1)得到的发酵物用乙酸乙酯萃取三次,减压蒸发掉有机溶剂,得到有机萃取物(200g);将这些萃取物过正相柱层析柱,分别使用石油醚,二氯甲烷和甲醇进行洗脱;浓缩二氯甲烷层,得到粗提物(63.0g);
(3)将步骤(2)得到的粗提物使用正相硅胶柱色谱进行分离,用石油醚-乙酸乙酯体系进行梯度洗脱,得到8个粗馏分(fr.1~fr.8);
(4)将步骤(3)中的粗馏分fr.3(5.5g)先使用ods柱色谱进行分离,使用水-甲醇体系进行梯度洗脱得到三段粗馏分(fr.3-1、fr.3-2、fr.3-3)。fr.3-2(211.4mg)使用正相柱色谱(石油醚-乙酸乙酯,3:1)和葡聚糖凝胶柱(纯甲醇)分离后得到式1化合物(23.2mg)和式2化合物(4.5mg)。fr.3-3(150.6mg)使用正相柱色谱(二氯甲烷-甲醇,50:1)和葡聚糖凝胶柱(纯甲醇)分离后得到式3化合物(4.4mg);
(5)将步骤(3)中的粗馏分fr.8(15g)经过ods柱色谱(甲醇-水:5%→100%)和正相柱色谱(二氯甲烷-甲醇,30:1)分离纯化得到式4化合物(20.3mg)和式5化合物(16.5mg),
(6)将上述步骤中得到的式1、2、3、4、5化合物分别用1d、2dnmr图谱以及高分辨质谱分析确定化合物的平面结构,然后利用ecd计算等确定其绝对构型,详述如下:
式1化合物为黄色油状。根据其在高分辨质谱中的主离子峰确定其分子式为c24h30o6。1h、13cnmr数据(表1)以及dept和hmbc图谱显示24个碳信号,包括5个甲基,3个亚甲基,7个次甲基和9个季碳,经过详细的二维数据确定了化合物的平面结构,最后利用noe图谱和ecd计算确定了式1化合物的相对及绝对构型,并命名为sorbiallisatola。
式2化合物的分子式为c23h28o6,1h、13cnmr数据(表1)显示有23个碳,包括4个甲基,3个亚甲基,7个次甲基和9个季碳。这些信号与式1化合物非常接近,仅比其少了一个甲氧基。通过详细的1d、2dnmr解析,最终确定式2化合物的结构,并命名为sorbiallisatolb。
其他三个化合物通过对比参考文献的nmr核磁、旋光、质谱等理化数据,分别确定为:sohirnonea(式3化合物),2',3'-dihydrosorbicillin(式4化合物)和sorbicillin(式5化合物)。
表1式1、式2化合物1hnmr(400mhz,dmso-d6)和13cnmr数据(100mhz,dmso-d6)
实施例2抗肿瘤活性检测
本实施例选择两株肿瘤细胞,结直肠癌细胞(ht29)和肝癌细胞(huh-7)。以式2、式5化合物为例,通过检测化合物样品对这些肿瘤细胞的抑制率,从而检测实施例1制备得到的化合物的抗肿瘤活性。
本实施例设置以下3组:
阴性对照组:等量培养液,千分之一dmso,含细胞,不加入式2或式5
化合物;
空白对照组:等量培养液,不含细胞,且不加入式2或式5化合物;
实验组:向细胞培养液分别加入式2、式5化合物;
具体步骤包括:
(1)细胞经常规消化后,于培养基中重悬并吹打成单细胞悬液,然后以每孔2000-5000个细胞接种到96孔板,每孔体积200μl;
(2)37℃,5%co2的培养箱中培养24h,然后分别加入不同浓度的式2、式5化合物处理细胞;
(3)继续培养48h后,每孔加10μl5mg/mlmtt(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-diphenytetrazoliumromide),37℃避光反应3h;小心吸弃上清液后,每孔加入150μldmso,振荡10min,使结晶物充分融解;
(4)酶标仪测定570nm光吸收值,然后根据公式(i)计算抑制率,
结果如图1、图2所示(**p<0.01,***p<0.001,****p<0.0001与dmso空白组相比),式2化合物和式5化合物对结直肠癌细胞ht29和肝癌细胞huh-7的生长均有显著的抑制作用,并且表现出明显的浓度依赖性。这些结果表明实施例1制备得到的这些化合物具有抗肿瘤功能,有非常良好的开发成为抗肿瘤药物的前景。
实施例3细胞周期检测
用诺考达唑(nocodazole)(50ng/ml,12h)、式2化合物(50μm,48h)、式5化合物(30μm,48h)分别处理ht29细胞,然后用胰蛋白酶收集,用70%乙醇溶液在4℃下干燥过夜。去除乙醇溶液后,用pbs缓冲液清洗细胞两次,并用dapi(购自sigma-aldrich,用pbs按照1:10000的比例稀释后使用)标记10min。最后,用pb450-a流式细胞仪测量荧光,进行细胞周期fcm分析,检测结果如图3所示,第一个深黑色峰表示细胞处于g0-g1期,第二个浅灰色峰表示细胞处于g2-m期。
由图3可知,本发明提供的化合物通过在g2-m期阻断细胞周期,从而显著抑制了肿瘤细胞的复制。
实施例4m期标志蛋白检测
用诺考达唑(nocodazole)(50ng/ml,12h)、式2化合物(5、10、30、50μm,48h)、式5化合物(2.5、5、10、30μm,48h)分别处理ht29细胞,然后收集细胞进行westernblot分析,用式2化合物处理ht29细胞后的westernblot结果见图4所示,用式5化合物处理ht29后的westernblot结果见图5所示。
组蛋白h3(p-h3)的磷酸化修饰发生在有丝分裂和减数分裂的特定时期和染色体位置,p-h3可作为m期的标记蛋白之一;cyclinb1蛋白在细胞周期调控中也起重要作用,cyclinb1的过表达可促进g2/m期转化。由图4-5可知,本发明提供的化合物可显著增加p-h3和cyclinb1的蛋白表达,且呈剂量依赖型,这进一步证实了本发明提供的化合物确实诱导了m期阻滞。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!