噁嗪类化合物在制备近红外荧光探针中的应用的制作方法
本发明涉及一类噁嗪化合物在生物专一性识别检测中的新应用。
背景技术:
目前,荧光探针在生物、医疗等领域中发挥的巨大作用,逐渐成为人们的研究热门。从荧光染料分子被发现之初到现在的两百多年间,人们已经取得了众多研究成果。发展较为成熟的荧光染料包括菁类染料、氟硼吡咯、香豆素、罗丹明、荧光素、尼罗蓝等,人们通过在其母体环上连接一系列官能团进行修饰,合成了多种具有检测功能的荧光探针分子,用于目标分子实现可视化监测。荧光染料分子已被应用于发光材料及传感器、环境污染检测、生物研究、医疗诊断等众多领域。值得一提的是,荧光探针在医疗健康方面发挥着重要作用。它们可以进入细胞,对细胞内各种亚细胞结构进行标识定位,直观的区分正常细胞及病变细胞,从而确定病症根源,有利于针对性治疗疾病。生物体的遗传信息大都记录于脱氧核糖核酸(DNA)及核糖核酸(RNA)上,因此核酸的一系列生物活动是否正常对生物体维持正常生命便显得尤为重要。若核酸的转录及复制等过程发生异常,便会对生物体的健康产生极大威胁,因此实现对核酸的实时监测,对各种重大疾病的预防及治疗具有实际意义。
核糖核酸(RNA)在一个正常细胞的一生中处于绝对重要的地位,在细胞的编码、解码、调控、基因的表达等过程中发挥着无可替代的作用。核糖核酸(RNA)连同脱氧核糖核酸(DNA)一同构成生物重要大分子核酸,二者相互依存,不可分割。他们与生物体维持正常生命一切活动均有十分密切的关系。例如,DNA上记录着生物体必要的遗传信息,而DNA大部分存在与细胞核中,要传递这些遗传信息则必须要通过RNA。生物细胞通过腺嘌呤(G)、鸟嘌呤(A)、尿嘧啶(U)和胞嘧啶(C)之间的互补配对关系,由DNA转录为信使核糖核酸(m-RNA),由转运核糖核酸(t-RNA)转运所需氨基酸,在核糖体(r-RNA)上进行蛋白质的组装来表达遗传信息,以此指导细胞中各个细胞器协同作用合成维持生命活性的各种必须蛋白质。蛋白质的合成过程充分表达了RNA分子在细胞中发挥着极其重要的作用,而DNA、RNA及蛋白质三者成为构成各种生命形式必要的三大高分子物质。并且,目前已知许多病毒编码遗传信息并不是贮存与DNA上,而是记录于单链的RNA上为其基因组。
有研究表明,许多严重的疾病跟RNA行为异常有关。神经退行性疾病如老年痴呆症,作为一种复杂的神经性紊乱,已证明与蛋白质和RNA分子之间的相互作用有关;线粒体RNA代谢若发生缺陷则有可能发展为心肌症、线粒体肌症及铁粒幼红细胞性贫血等;癌症的发生也与RNA的异常转录与表达有关。因此,检测RNA分子在不同状态下的转录及表达的其情况成为这些重大疾病病理学研究的一大热点,这些研究对医疗诊断具有重要意义,截至目前,在这一方向,人们已经取得了一定成果,一些核酸荧光探针以其在细胞中进行成像的突出优点被逐渐开发出来(Stevens N.,O’Connor N.A.,Vishwasra H.,et al.,J.Am.Chem.Soc.,2008,130,7182-7183.O’Connor N.A.,Stevens N.,Samaroo D.,et al.,Chem.Commun.,2009,2640-2642.Li Z.,Sun S.,Yang Z.,et al.,Biomaterials,2013,34,6473-6481.Song G.,Miao F.,Sun Y.,et al.,Sens.Actuators B Chem.,2012,173,329-337.Liu Y.,Zhang W.,Sun Y.,et al.,Dyes and Pigments,2014,103,191-201.)。但是,当前报道的探针中,普遍存在染色浓度大,孵育时间长,探针细胞毒性大等尚待改进的不足。
技术实现要素:
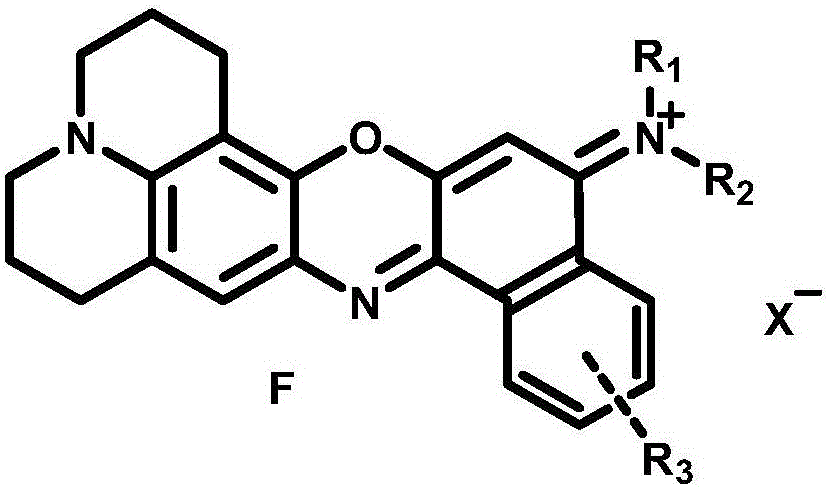
本发明公开一类噁嗪类化合物在制备近红外荧光探针中的应用,所述的噁嗪类化合物具有通式F的结构:
通式F中,
所述的R1、R2和R3各自独立地选自氢和C1-20的取代或未取代烷基;
所述的取代烷基由下述基团任意取代:卤素、羟基、烷氧基(醚)、醛基、羰基、胺基、羧基、酯基、酰胺基、硝基或磺酸基;
所述的X选自磷酸根,硫酸根,硫酸氢根,硝酸根,氯负离子,溴负离子,碘负离子或高氯酸根。
本发明中所述及的具有通式F的噁嗪类化合物对RNA分子具有特异性响应,能够快速进入细胞,与细胞核内RNA分子迅速结合并发出较强信号的荧光。无论在体外实验还是在固定细胞或活细胞实验中,均对RNA体现较好的专一性识别标记。进一步通过一系列性能测试,发现该探针分子在水体系中具有近红外的最大吸收波长(约665nm)及最大发射波长(约695nm),长波长的激发及发射波长光能量较低,对组织细胞的损伤较小,并且光透过性好,组织细胞的自发荧光对其干扰较小。并且在多种不同的有机溶剂中的荧光量子产量与其相应的荧光强度相应。所述的化合物具有一定水平的水溶性,同时具有良好的细胞膜通透性,并且生物毒性、光毒性、光漂白性均较低。其光谱范围与生物样品的光谱范围有足够大的差异。再者,所述化合物具有较好的光稳定性、也能够在生理pH值条件下稳定存在,有利于其应用于生物体内发挥荧光探针功能。本发明也是基于此将所述的具有通式F的噁嗪类化合物应用于制备近红外荧光探针,该近红外荧光探针产品可以仅仅包含通式F的噁嗪类化合物中的一种或多种,或者含有所述噁嗪类化合物的混合物,也可以是包括所述噁嗪类化合物及检测用试剂的试剂盒。
附图说明
本发明附图12幅:
图1是探针化合物F-1的结构式。
图2是探针化合物F-1在乳腺癌细胞(MCF-7)中的标记实验结果(实施例2)。将F-1-DMSO溶液加入到含有2mL培养基的MCF-7细胞中震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图2(a)F-1通道;图2(b)为细胞明场图;图2(c)为(a)与(b)混合通道。
图3是探针化合物F-1在活体昆明鼠中的标记实验(实施例3)。活体昆明鼠注射10%水合氯醛(10mg/Kg)麻醉,再吸入适量异氟醚加深麻醉并轻度抑制呼吸(将运动及呼吸伪影减少到最低),F-1-DMSO溶液用纯PBS稀释1000倍后注射入活体昆明鼠腹部。将活体昆明鼠置于小动物成像仪中,采取仰卧位置于固定板上进行成像。
图4是探针化合物F-2在体外PBS中对RNA的响应(实施例5)。将F-2-DMSO溶液加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(F-2-DMSO溶液加入PBS中)荧光强度的比值为纵坐标作图。
图5是探针化合物F-2在肝癌细胞(HepG2)中标记实验(实施例6)。将F-2-DMSO溶液加入到含有培养基的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342与商业化染料RNASelectTM于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图5(a)为商业化染料Hoechst-33342通道;图5(b)为商业化染料RNASelectTM通道;图5(c)为F-2通道;图5(d)为(a)与(b)混合通道;图5(e)为(a)与(c)混合通道;图5(f)为(b)与(c)混合通道。
图6为探针化合物F-2在饥饿培养肝癌细胞(HepG2)中的标记实验(实施例7)。将F-2-DMSO溶液分别加入到含有培养基的正常培养(10%FBS,12h)与饥饿培养(1%FBS,12h)的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图6(a)为正常培养细胞的商业化染料Hoechst-33342通道;图6(b)为正常培养细胞的F-2通道;图6(c)为(a)与(b)混合通道;图6(d)为饥饿培养细胞的商业化染料Hoechst-33342通道;图6(e)为饥饿培养细胞的F-1通道;图6(f)为(d)与(e)混合通道。
图7为探针化合物F-2在Actinomycin D处理肝癌细胞(HepG2)中标记实验(实施例8)。将F-2-DMSO溶液分别加入到含有2mL正常培养基与含Actinomycin D浓度为2μg/ml的培养基(孵育4h)的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图7(a)为正常培养细胞的商业化染料Hoechst-33342通道;图7(b)为正常培养细胞的F-2通道;图7(c)为(a)与(b)混合通道;图7(d)为Actinomycin D处理细胞的商业化染料Hoechst-33342通道;图7(e)为Actinomycin D处理细胞的F-2通道;图7(f)为(d)与(e)混合通道。
图8为探针化合物F-2在经消化酶处理固定肝癌细胞(HepG2)中的标记实验(实施例9)。将F-2-DMSO溶液分别加入含2mL PBS未经消化酶处理和经消化酶消化处理的固定细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图8(a)为未经消化酶处理固定细胞的商业化染料Hoechst-33342通道;8(b)为未经消化酶处理固定细胞的F-2通道;图8(c)为(a)与(b)混合通道;图8(d)为经DNA消化酶处理固定细胞的商业化染料Hoechst-33342通道;图8(e)为经DNA消化酶处理固定细胞的F-2通道;图8(f)为(d)与(e)混合通道;图8(g)为经RNA消化酶处理固定细胞的商业化染料Hoechst-33342通道;图8(h)为经RNA消化酶处理固定细胞的F-2通道;图8(i)为(g)与(h)混合通道。
图9为探针化合物F-2在正常肝细胞(7702)中的标记实验(实施例10)。将F-2-DMSO溶液分别加入到含有2mL培养基的7702细胞和HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图9(a)为HepG2细胞的商业化染料Hoechst-33342通道;图9(b)为HepG2细胞的F-2通道;图9(c)为(a)与(b)混合通道;图9(d)为7702细胞的商业化染料Hoechst-33342通道;图9(e)为7702细胞的F-2通道;图9(f)为(d)与(e)混合通道。
图10是探针化合物F-3在乳腺癌细胞(MCF-7)中的标记实验(实施例12)。将F-3-DMSO溶液加入到含有2mL培养基的MCF-7细胞中震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。图10(a)F-3通道;图10(b)为细胞明场图;图10(c)为(a)与(b)混合通道。
图11是探针化合物CM-1在体外PBS中对RNA的响应(实施例14)。将CM-1-DMSO溶液加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(CM-1-DMSO溶液加入PBS中)荧光强度的比值为纵坐标作图。
图12是探针化合物CM-2在体外PBS中对RNA的响应(实施例16)。将CM-2-DMSO溶液加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(CM-2-DMSO溶液加入PBS中)荧光强度的比值为纵坐标作图。
具体实施方式
除另有说明外,本文中使用的术语具有以下含义。
本文中使用的术语“烷基”包括直链烷基和支链烷基。如提及单个烷基如“丙基”,则只特指直链烷基,如提及单个支链烷基如“异丙基”,则只特指支链烷基。例如,“C1-6烷基”包括C1-4烷基、C1-3烷基、甲基、乙基、正丙基、异丙基和叔丁基。类似的规则也适用于本说明书中使用的其它基团。
本文中使用的术语“卤素”包括氟、氯、溴和碘。
本发明公开一类噁嗪类化合物在制备近红外荧光探针中的应用,所述的噁嗪类化合物具有通式F的结构:
在现有技术中,尽管有类似化合物被报导过,但从未发现该类化合物具有特异的RNA染色特性。经过研究,上述通式F所定义的化合物之所以能能够实现RNA的特异性染色,推测与其结构有关:RNA中的碱基会与噁嗪环中的氮原子相结合形成稳定的络合物;而分子中的久洛尼定部分的两个柔性碳骨架,由于其空间位阻较大,使分子不能进入DNA(脱氧核糖核酸)的沟槽与DNA结合,故通式结构内的化合物分子具有良好的RNA选择性。这也可用于解释,为何结构与通式F相似但不相同的化合物分子无法成功实现目标RNA的标记。
R1、R2和R3可选择的基团范围甚广。其可以各自独立地选自氢和C1-20的取代或未取代烷基;这其中的烷基既包括直链烷基,也包括支链烷基;如选择应用于取代烷基,则所述的取代烷基可由下述基团任意取代:卤素、羟基、烷氧基、醛基、羰基、胺基、羧基、酯基、酰胺基、硝基或磺酸基。更为具体的实施方式中,上述通式F中所述的R1、R2和R3各自独立地选自氢和C1-14的取代或未取代烷基。更优选自氢和C1-10的取代或未取代烷基。
另一具体的实施方式中,通式F中所述的R1和R2的其中之一是氢。
更加优选的,所述的R3也是氢。
另一具体的实施方式中,上述本发明的应用中,通式F中所述的X选自磷酸根,硫酸根,硫酸氢根,硝酸根,氯负离子,溴负离子,碘负离子或高氯酸根。
对各化合物的RNA特异性识别能力进行甄别和比较的基础上,本发明提供的最优选的实施方式中,下述9个化合物在制备近红外荧光探针中得以应用,所述的化合物选自F-1、F-2、F-3、F-4、F-5、F-6、F-7、F-8和F-9:
本发明的噁嗪类化合物对RNA分子具有特异性响应,能够快速进入细胞,与细胞核内RNA分子迅速结合并发出较强信号的荧光。无论在体外实验还是在固定细胞或活细胞实验中,均对RNA体现较好的专一性识别标记。进一步通过一系列性能测试,发现该探针分子在水体系中具有近红外的最大吸收波长(约665nm)及最大发射波长(约695nm),长波长的激发及发射波长光能量较低,对组织细胞的损伤较小,并且光透过性好,组织细胞的自发荧光对其干扰较小。并且在多种不同的有机溶剂中的荧光量子产量与其相应的荧光强度相应。并且该类化合物具有一定水平的水溶性,同时具有良好的细胞膜通透性,并且生物毒性、光毒性、光漂白性均较低。其光谱范围与生物样品的光谱范围有足够大的差异。再者,该类化合物具有较好的光稳定性、也能够在生理pH值条件下稳定存在,有利于其应用于生物体内发挥荧光探针功能。
基于此,本发明所述的应用更为具体的实施方式是将本发明所述的噁嗪类化合物用于制备RNA靶向荧光探针类的近红外荧光探针产品,用于细胞或组织中RNA的荧光成像。
上文中所述及的具有通式F的化合物,其制备方法已为现有技术所公开,因此本领域技术人员应当能够结合相关领域的技术信息及有机合成的基本理论和技术来完成本发明所述化合物的获得。本说明书中描述的下述噁嗪类化合物的制备方法提供该类化合物合成的一种具体方案,但不应当理解为对其的限定。
本发明中所述及的噁嗪类化合物通过下述方法合成:使用芳胺或其衍生物形成的偶氮化合物与8-羟基久洛尼定在含酸DMF中缩合,制备得到目标噁嗪染料。该合成方法工艺简洁,转化率高。更为具体的,本发明通式化合物F合成路线可以表示为:
上述路线所表示的通式F的化合物的制备方法包括如下步骤:
(1)盐酸酸化体系中,氯化对硝基重氮苯与式I的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,制备式II化合物;
(2)式II化合物与8-羟基久洛里啶按照摩尔比1:1在酸性DMF中于135~145℃条件下反应2~4小时制备通式F的化合物。
本发明所述的以噁嗪为母体的近红外荧光探针具备以下优点:
所述化合物具有一定水平的水溶性,同时具有良好的细胞膜通透性。
所述化合物对于RNA分子具有专一性、特异性识别;
所述化合物具有优异的荧光性能,应用于生物样品成像时具有低的生物光漂白、光损伤和生物毒性,并且产生的荧光信号可以穿透较深的生物组织;
所述化合物部分分子的荧光发射波长大于600nm,可用于动物活体成像;
所述化合物用于肿瘤与肿瘤细胞和组织的标记,可以实现很好的RNA标记,并能避免外在的环境因素对荧光强度的干扰;
所述化合物毒副性小,原料易得,结构简单,易于制备,易产业化;
鉴于此,本发明所述的近红外荧光探针化合物可用于肿瘤与非肿瘤细胞和组织标记。除了以本文中所述的形式直接用于肿瘤与非肿瘤细胞和组织的染色外,含有本发明的近红外荧光探针化合物的组合物也可以用于肿瘤细胞和组织的染色。所述组合物中应当包含有效量的本发明所提供的双光子荧光探针化合物之一。另外,还可以包含生物样品染色所需要的其它组分,例如溶剂、pH调节剂等。这些组分都是本行业内已知的。上述组合物可以以水溶液形式存在,或者可以以临用前用水配制为溶液的其它合适形式存在。
本发明还提供使用上述本发明的近红外荧光探针化合物标记肿瘤细胞和组织生物样品的方法,该方法包括使所述化合物与生物样品接触的步骤。本文中使用的术语“接触”可包括在溶液或固相中接触。
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
实施例1:制备探针化合物F-1
(1)中间体1-II的合成
盐酸酸化体系中,氯化对硝基重氮苯与1-I的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后得到砖红色固体粉末粗产品得式1-II的化合物,收率95%。
(2)化合物F-1的合成
将上述反应(1)制备得到的中间体1-II与8-羟基久洛里定加入到含有DMF的圆底烧瓶中,滴入1mL高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经柱色谱分离提纯得具金属光泽的深蓝色针状晶体目标探针化合物F-1,收率78.2%。
1H NMR(400MHz,DMSO-d6)δ9.40(d,J=5.3Hz,1H),8.64(d,J=8.0Hz,1H),8.42(d,J=8.3Hz,1H),7.88(t,J=7.6Hz,1H),7.79(t,J=7.6Hz,1H),7.38(s,1H),6.93(s,1H),5.08(t,J=4.9Hz,1H),3.82–3.67(m,4H),3.58(d,J=4.7Hz,4H),2.83(dt,J=12.2,5.9Hz,4H),1.98(d,J=4.8Hz,4H).
实施例2:探针化合物F-1在乳腺癌细胞(MCF-7)中的标记实验
使用实施例1中合成的化合物F-1,将F-1-DMSO溶液加入到含有2mL培养基的MCF-7细胞中震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图2所示,其中:图2(a)F-1通道;图2(b)为细胞明场图;图2(c)为(a)与(b)混合通道。可见F-1分子能够对细胞着色。
实施例3:探针化合物F-1在活体昆明鼠中的标记实验
活体昆明鼠注射10%水合氯醛(10mg/Kg)麻醉,再吸入适量异氟醚加深麻醉并轻度抑制呼吸(将运动及呼吸伪影减少到最低),F-1-DMSO溶液用纯PBS稀释1000倍后注射入活体昆明鼠腹部。将活体昆明鼠置于小动物成像仪中,采取仰卧位置于固定板上进行成像。结果如图3所示,可见F-1分子能够对活体生物样本着色成像。
实施例4:制备探针化合物F-2
(1)中间体2-II的合成
盐酸酸化体系中,氯化对硝基重氮苯与2-I的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后得到砖红色固体粉末粗产品得式2-II的化合物,收率95%。
(2)化合物F-2的合成
将上述反应(1)制备得到的中间体2-II与8-羟基久洛里定加入到含有DMF的圆底烧瓶中,滴入1mL高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经柱色谱分离提纯得具金属光泽的深蓝色针状晶体目标探针化合物F-2,收率74.4%。
1H NMR(400MHz,DMSO-d6)δ9.17(s,1H),8.38(d,J=8.1Hz,1H),8.23(d,J=8.3Hz,1H),7.77(t,J=7.5Hz,1H),7.68(t,J=7.6Hz,1H),7.09(s,1H),6.58(s,1H),3.54(d,J=5.7Hz,6H),2.78(t,J=5.9Hz,2H),2.61(t,J=5.9Hz,2H),1.94(d,J=5.1Hz,4H),1.35(t,J=7.1Hz,3H).
实施例5:探针化合物F-2在体外PBS中对RNA的响应
使用实施例4合成的化合物F-2,将F-2-DMSO溶液分别加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(F-2-DMSO溶液加入到纯PBS中)荧光强度的比值为纵坐标作图,如图4所示,可见化合物F-2对RNA有较好的响应,对DNA不响应。
实施例6:探针化合物F-2在肝癌细胞(HepG2)中的标记实验
使用实施例4合成的化合物F-2,将F-2-DMSO溶液加入到含有培养基的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342与商业化染料RNASelectTM于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图5所示,图5(a)为商业化染料Hoechst-33342通道;图5(b)为商业化染料RNASelectTM通道;图5(c)为F-2通道;图5(d)为(a)与(b)混合通道;图5(e)为(a)与(c)混合通道;图5(f)为(b)与(c)混合通道。可见F-2分子能够对细胞着色。
实施例7:探针化合物F-2在饥饿培养肝癌细胞(HepG2)中的标记实验
使用实施例4合成的化合物F-2,将F-2-DMSO溶液分别加入到含有培养基的正常培养(10%FBS,12h)与饥饿培养(1%FBS,12h)的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图6,其中:图6(a)为正常培养细胞的商业化染料Hoechst-33342通道;图6(b)为正常培养细胞的F-2通道;图6(c)为(a)与(b)混合通道;图6(d)为饥饿培养细胞的商业化染料Hoechst-33342通道;图6(e)为饥饿培养细胞的F-1通道;图6(f)为(d)与(e)混合通道。可见饥饿细胞中RNA分布与含量均少于正常培养细胞中的RNA。
实施例8:探针化合物F-2在Actinomycin D处理肝癌细胞(HepG2)中的标记实验
使用实施例4合成的化合物F-2,将F-2-DMSO溶液分别加入到含有2mL正常培养基与含Actinomycin D浓度为2μg/ml的培养基(孵育4h)的HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图7所示,其中:图7(a)为正常培养细胞的商业化染料Hoechst-33342通道;图7(b)为正常培养细胞的F-2通道;图7(c)为(a)与(b)混合通道;图7(d)为Actinomycin D处理细胞的商业化染料Hoechst-33342通道;图7(e)为Actinomycin D处理细胞的F-2通道;图7(f)为(d)与(e)混合通道。可见Actinomycin D处理细胞中RNA分布与含量均少于正常培养细胞中的RNA。
实施例9:探针化合物F-2在经消化酶处理固定肝癌细胞(HepG2)中的标记实验
对于固定细胞实验,细胞先要用4%的甲醛处理。在对比DNA和RNA选择性的测试中,DNA水解酶和RNA水解酶分别与固定细胞在37℃条件下孵育。随后,PBS缓冲液洗去水解酶,用于染色。
使用实施例4合成的化合物F-2,将F-2-DMSO溶液分别加入含2mL PBS未经消化酶处理和经消化酶消化处理的固定细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图8所示,其中:图8(a)为未经消化酶处理固定细胞的商业化染料Hoechst-33342通道;8(b)为未经消化酶处理固定细胞的F-2通道;图8(c)为(a)与(b)混合通道;图8(d)为经DNA消化酶处理固定细胞的商业化染料Hoechst-33342通道;图8(e)为经DNA消化酶处理固定细胞的F-2通道;图8(f)为(d)与(e)混合通道;图8(g)为经RNA消化酶处理固定细胞的商业化染料Hoechst-33342通道;图8(h)为经RNA消化酶处理固定细胞的F-2通道;图8(i)为(g)与(h)混合通道。可见F-2能够对固定细胞着色。
实施例10:探针化合物F-2在正常肝细胞(7702)中的标记实验
使用实施例4合成的化合物F-2,将F-2-DMSO溶液分别加入到含有2mL培养基的7702细胞和HepG2细胞中(细胞预先在37℃,5%CO2下将加入商业化染料Hoechst-33342于培养基中孵育20分钟。然后,PBS震荡漂洗5min×3,再加入细胞培养基)震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。结果如图9所示,其中:图9(a)为HepG2细胞的商业化染料Hoechst-33342通道;图9(b)为HepG2细胞的F-2通道;图9(c)为(a)与(b)混合通道;图9(d)为7702细胞的商业化染料Hoechst-33342通道;图9(e)为7702细胞的F-2通道;图9(f)为(d)与(e)混合通道。可见正常细胞中RNA分布与含量均少于癌细胞中的RNA。
实施例11:制备尼罗兰衍生物F-3
(1)中间体3-II的合成
盐酸酸化体系中,氯化对硝基重氮苯与3-I的化合物按照摩尔比1:1在25~35℃条件下反应0.5~2小时,反应完毕,经过抽滤洗涤操作后得到砖红色固体粉末粗产品得式3-II的化合物,收率94%。
(2)化合物F-3的合成
将上述反应(1)制备得到的中间体3-II与8-羟基久洛里定加入到含有DMF的圆底烧瓶中,滴入1mL高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经柱色谱分离提纯得具金属光泽的深蓝色针状晶体目标探针化合物F-3,收率55.9%。
1H NMR(400MHz,DMSO-d6)δ9.33(s,1H),8.61(d,J=8.1Hz,1H),8.39(d,J=8.3Hz,1H),7.87(t,J=7.6Hz,1H),7.77(t,J=7.6Hz,1H),7.34(s,1H),6.86(s,1H),4.06(q,J=7.1Hz,2H),3.58(s,6H),3.35(s,1H),2.94–2.69(m,4H),2.35(t,J=7.3Hz,2H),1.97(d,J=4.4Hz,4H),1.75(dd,J=14.4,7.2Hz,2H),1.63(dd,J=14.8,7.3Hz,2H),1.54–1.39(m,2H),1.17(t,J=7.1Hz,3H).
实施例12:探针化合物F-3在乳腺癌细胞(MCF-7)中的标记实验
使用实施例11合成的化合物F-3,将F-3-DMSO溶液加入到含有2mL培养基的MCF-7细胞中震荡,用激光共聚焦显微镜成像。选取代表性区域,用油镜(60×)观察,重复三次。如图10所示,其中:图10(a)F-3通道;图10(b)为细
胞明场图;图10(c)为(a)与(b)混合通道。可见F-3分子能够对细胞着色。
实施例13:制备对比化合物CM-1
将中间体2-II与N,N-二甲基对氨基苯酚加入到含有DMF的圆底烧瓶中,滴入1mL高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经柱色谱分离提纯得具金属光泽的深蓝色针状晶体目标探针化合物CM-1,收率45.9%。
1H NMR(400MHz,DMSO-d6)δ9.17(s,1H),8.38(d,J=8.1Hz,1H),8.23(d,J=8.3Hz,1H),7.77(t,J=7.5Hz,1H),7.68(t,J=7.6Hz,1H),7.09(s,1H),6.58(s,1H),3.54(q,J=7.2Hz,2H),2.85(s,6H)1.35(t,J=7.1Hz,3H).
实施例14:对比化合物CM-1在体外PBS中对RNA的响应
使用实施例13合成的化合物CM-1,将CM-1-DMSO溶液分别加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(CM-1-DMSO溶液加入到纯PBS中)荧光强度的比值为纵坐标作图,如图11所示,可见对比化合物CM-1对RNA与DNA不具备区分性能。
实施例15:制备对比化合物CM-2
将中间体2-II与N,N-二甲基对氨基苯酚加入到含有DMF的圆底烧瓶中,滴入1mL高氯酸溶液。滴加完毕,体系搅拌2.5h后停止反应,经柱色谱分离提纯得具金属光泽的深蓝色针状晶体目标探针化合物CM-2,收率53.7%。
1H NMR(400MHz,DMSO-d6)δ9.17(s,1H),8.38(d,J=8.1Hz,1H),8.23(d,J=8.3Hz,1H),7.77(t,J=7.5Hz,1H),7.68(t,J=7.6Hz,1H),7.09(s,1H),6.58(s,1H),3.58(m,4H),1.38(m,9H).
实施例16:对比化合物CM-2在体外PBS中对RNA的响应
使用实施例15合成的化合物CM-2,将CM-2-DMSO溶液分别加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度。以核酸含量为横坐标,溶液荧光强度与对照溶液(CM-2-DMSO溶液加入到纯PBS中)荧光强度的比值为纵坐标作图,如图12所示,可见对比化合物CM-2对RNA与DNA不具备区分性能。
实施例17:化合物F-4至F-9分别测试在体外PBS中对RNA的响应
参照化合物F通式的合成方法,选用相应取代基的中间原料物,制备化合物F-4至F-9。将制备得到化合物的DMSO溶液分别加入到含有不同浓度酵母RNA与小牛胸腺DNA的PBS溶液中,振荡,分别测试溶液的荧光强度,可见对比化合物F-4至F-9对RNA具有响应效果。
- 还没有人留言评论。精彩留言会获得点赞!