本发明涉及药物化学及药理学领域,特别涉及一种石莼b3s型硫酸寡糖化合物及其制备方法和免疫调节活性。
背景技术:
海洋中蕴藏着极其丰富的生物资源,海藻是海洋生物资源的重要组成部分。海藻中含有丰富的多糖,海藻多糖的生物活性是研究的热点之一。截止目前的研究,海藻多糖已被证实对细胞具有免疫调节作用、抗肿瘤作用、抗突变作用、诱导细胞分化、抗病毒等多种功效。
石莼聚糖是一种水溶性的复杂阴离子硫酸化多糖,存在于海洋绿藻的细胞壁中。石莼聚糖中两种主要的二糖重复单元是石莼聚糖醛酸3-硫酸酯a型(a3s)和石莼聚糖醛酸3-硫酸酯b型(b3s),其糖基序列分别为[→4)-β-d-glca-(1→4)-α-l-rha3s-(1→]和[→4)-α-l-idoa-(1→4)-α-l-rha3s-(1→]。石莼聚糖具有多种备受关注的生物学功能,如抗肿瘤、抗病毒、降血脂、抗凝血和免疫调节等活性。
机体的免疫功能是通过免疫系统来实现的,而免疫系统是一个极其复杂而重要的生理体系。在免疫系统中,以巨噬细胞为主的吞噬作用是防御微生物入侵和肿瘤发生的第一道防线,是机体发挥特异性免疫的重要基础。免疫调节活性主要是指激活巨噬细胞,增强吞噬能力,诱导免疫调节剂如细胞因子和no,调节相关信号通路等。
石莼聚糖的组分复杂且具有微观不均一性,从而限制了其在构效关系研究和新药开发中的应用。因此,目前亟需获得结构单一和纯净的石莼聚糖用于新药的研发。石莼b3s型硫酸化多糖是由负电荷的l-艾杜糖醛酸和负电荷的l-鼠李糖3-硫酸酯通过α-1,4糖苷键连接的独特二糖重复单元。尽管其结构独特并具有多种生物活性,但目前尚没有关于石莼b3s型硫酸聚糖的化学合成的文献报道。
因此,为了进一步研究石莼b3s型硫酸聚糖的构效关系,并进而扩大石莼b3s型硫酸聚糖的应用,有必要提出一种石莼b3s型硫酸寡糖化合物及其制备方法,并从巨噬细胞入手,对石莼b3s型硫酸聚糖在体外水平的免疫调节活性进行测试分析,进而应用于免疫调节药物的开发。
技术实现要素:
本发明的目的在于提供一种可应用于免疫调节的石莼b3s型硫酸寡糖化合物及其制备方法,该寡糖化合物作用于raw264.7细胞可提高其吞噬活性且对增殖活性无影响,可用于开发免疫调节药物。
为了达到上述目的,根据本发明的一方面,提供一种石莼b3s型硫酸寡糖化合物,该b3s型硫酸寡糖化合物通过l-艾杜糖醛酸和l-鼠李糖之间的α-1,4糖苷键连接而成,其结构式(i)如下所示:
n为1~5,基团l为-(ch2)m-nh2,-(ch2)m-n3,或者-(ch2)m-sh。
为了达到上述目的,根据本发明的一方面,提供一种石莼b3s型硫酸寡糖化合物的制备方法,包括步骤:基于金催化的糖基炔烯酸酯给体的糖苷化反应构建l-艾杜糖醛酸砌块和l-鼠李糖砌块之间的α-1,4糖苷键,组成寡糖骨架;经硫酸化修饰和脱保护基反应获得石莼b3s型硫酸寡糖类化合物(i)。
在一些实施例中,所述l-鼠李糖砌块的合成中,以l-鼠李糖为原料,经过全乙酰后的产物通过2-甲基-5-叔丁基苯硫酚处理后得到鼠李糖硫苷;鼠李糖硫苷再经过脱乙酰基操作后,将其2,3位羟基用丙叉保护基保护得到丙叉化合物;丙叉化合物的4位羟基用乙酰丙酰基保护得到全保护的硫苷;接着在酸性条件下脱除其丙叉保护基得到二醇;在三丁基锡醚的介导下,将二醇的3位羟基用对甲氧苄基保护得到2位羟基裸露的硫苷;然后,将其2位羟基用苯甲酰基保护得到正交保护的硫苷;最后脱除其乙酰丙酰基得到l-鼠李糖受体砌块。
在一些实施例中,所述l-艾杜糖醛酸砌块的合成中,正交保护的l-艾杜糖醛酸硫苷在nis和三氟甲磺酸的条件下与(z)-碘代丙烯酸反应后,通过sonogashira偶联与1-己炔反应得到l-艾杜糖醛酸炔烯酸酯给体砌块。
在一些实施例中,所述α-1,4连接的糖苷键的构建中,以l-艾杜糖醛酸炔烯酸酯给体和l-鼠李糖受体作为糖基砌块,以二氯甲烷或甲苯为溶剂,在金催化剂的催化下,加入干燥剂分子筛和添加剂三氟甲磺酸,在室温下进行糖苷化反应得到二糖。所得二糖产物用氟化氢吡啶脱除其4位tbs保护基后可得到二糖受体。所得二糖产物在nis和三氟甲磺酸的条件下与(z)-碘代丙烯酸反应后,通过sonogashira偶联与1-己炔反应得到二糖炔烯酸酯给体。将此二糖炔烯酸酯给体与二糖受体不断重复上述金催化糖苷化反应、tbs保护基脱除反应和炔烯酸酯给体形成反应,获得由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的寡糖骨架。
在一些实施例中,所述由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的寡糖骨架的硫酸化修饰和脱保护是先在nis和三氟甲磺酸的条件下与连接臂连接得到还原端含有连接臂的寡糖骨架,反应中,反应体系包括所述糖基炔烯酸酯给体、路易斯酸与催化剂,其中,所述糖基炔烯酸酯给体、路易斯酸与催化剂的摩尔比为1:(0.1~0.3):(0.1~0.3),路易斯酸为三甲基硅基三氟甲磺酸酯、三氟化硼乙醚或三氟甲磺酸,催化剂为ph3pauotf、ph3pauntf2、sphosauotf或sphosauntf2。然后,在将其tbs保护基转化为乙酰基并将pmb保护基脱除后,以三氧化硫三乙胺复合物为硫酸化试剂,以吡啶为溶剂,55℃反应至完全得到硫酸化修饰的寡糖骨架;最后的脱保护基操作包含皂化反应和氢化反应,其中皂化反应以氢氧化锂、氢氧化钾和双氧水为皂化试剂,以四氢呋喃、水为混合溶剂,室温反应至完全;氢化反应以氢氧化钯/碳为催化剂,氢气氛围中,室温反应至完全得到石莼b3s型硫酸寡糖化合物。
根据本发明的另一方面,石莼b3s型硫酸寡糖类化合物对raw264.7细胞的增殖活性无影响。
根据本发明的另一方面,石莼b3s型硫酸寡糖类化合物能增加raw264.7细胞的吞噬活性。
根据本发明的另一方面,石莼b3s型硫酸寡糖类化合物的使用浓度为0~500μg/ml。
在一些实施例中,鼠源巨噬细胞raw264.7购自中国科学院典型培养物保藏中心细胞库(中国上海)。细胞培养条件:使用含有10%fbs的dmem培养基,于37℃,5%co2和95%空气的潮湿环境中培养。
在一些实施例中,采用的石莼b3s型硫酸寡糖类化合物使用灭菌后的超纯水溶解,并经0.22μm滤膜过滤,分装后保存于-20℃。在实验之前用dmem培养基将石莼b3s型硫酸寡糖类化合物稀释至所需浓度。
在一些实施例中,采用mtt比色法检测石莼b3s型硫酸寡糖类化合物对raw264.7细胞增殖率的影响。
在一些实施例中,采用中性红吞噬实验检测石莼b3s型硫酸寡糖类化合物对巨噬细胞raw264.7吞噬能力的影响。
在一些实施例中,实验数据统计采用平均值±标准偏差(sd)表示,所有实验重复三次及以上。使用graphpadprism8.0.1软件作图,组间比较采用t检验,显著性差异用*p<0.05,**p<0.01,***p<0.001表示。
在本发明中,提供了一种石莼b3s型硫酸寡糖类化合物,并为其大量快速获得提供了一条实用高效的合成路线,是石莼b3s型硫酸寡糖类化合物的首次合成。提供的石莼b3s型硫酸寡糖类化合物对raw264.7细胞具有免疫增强功能,可用于免疫调节药物的开发。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例。
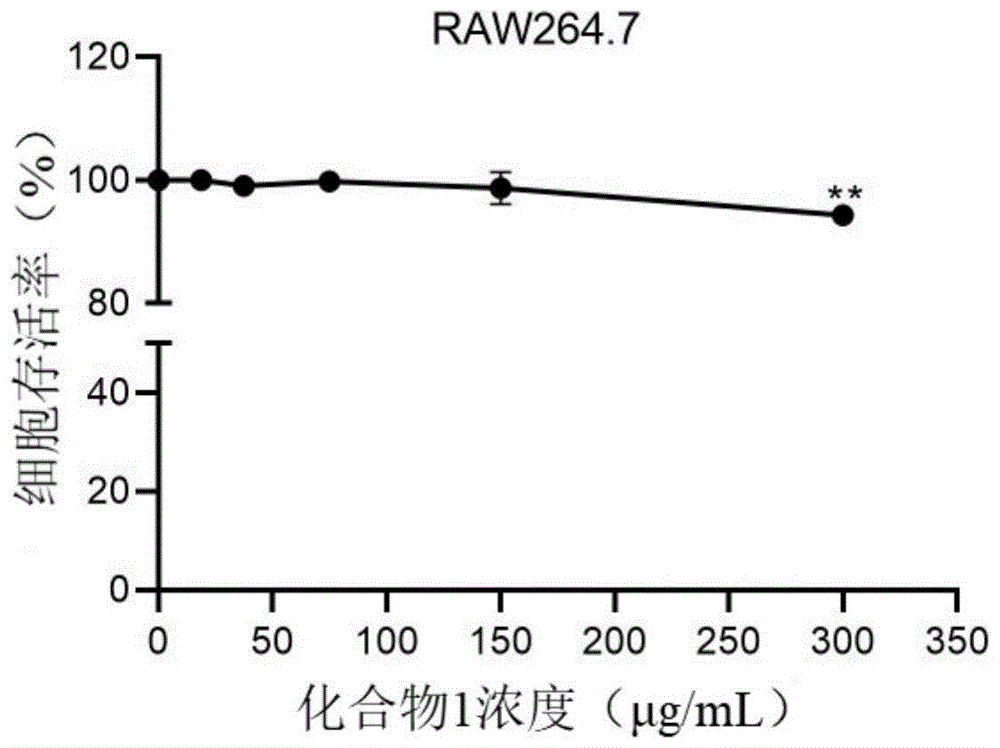
图1为本发明实施例1中不同浓度石莼b3s型硫酸四糖化合物作用于巨噬细胞raw264.7细胞后细胞存活率数据图。
图2为本发明实施例2中不同浓度石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7吞噬率数据图。
具体实施方式
以下结合具体实施方式,对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。
实施例1.石莼b3s型硫酸寡糖化合物
在本实施例中,提供一种石莼b3s型硫酸寡糖化合物,尤其是石莼b3s型硫酸四糖化合物的制备方法,所述b3s型硫酸四糖化合物具有化合物1所示的结构:
上述b3s型硫酸四糖化合物的制备方法包括:提供l-鼠李糖受体砌块,由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成四糖骨架,四糖骨架与连接臂连接得到还原端含有连接臂的寡糖骨架,以及经一系列化学反应得到b3s型硫酸四糖化合物1。
其中,所述l-鼠李糖受体砌块的合成路线为:
所述l-鼠李糖受体砌块的制备方法,包括以下步骤:
将化合物2的2,3位羟基用丙叉保护基保护得到丙叉化合物;丙叉化合物的4位羟基用乙酰丙酰基保护得到全保护的硫苷;接着在酸性条件下脱除其丙叉保护基得到二醇;在三丁基锡醚的介导下,将二醇的3位羟基用对甲氧苄基保护得到2位羟基裸露的硫苷;然后,将其2位羟基用苯甲酰基保护得到正交保护的硫苷;最后脱除其乙酰丙酰基得到l-鼠李糖受体砌块。
所述由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的四糖骨架的合成路线为:
所述由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的四糖骨架的制备方法,包括以下步骤:
以正交保护的l-艾杜糖醛酸硫苷9在nis和三氟甲磺酸的条件下与(z)-碘代丙烯酸反应后,通过sonogashira偶联与1-己炔反应得到l-艾杜糖醛酸炔烯酸酯给体砌块。然后,以l-艾杜糖醛酸炔烯酸酯给体和l-鼠李糖受体作为糖基砌块,以二氯甲烷或甲苯为溶剂,在金催化剂的催化下,加入干燥剂分子筛和添加剂三氟甲磺酸,在室温下进行糖苷化反应得到二糖。所得二糖产物用氟化氢吡啶脱除其4位tbs保护基后可得到二糖受体。所得二糖产物在nis和三氟甲磺酸的条件下与(z)-碘代丙烯酸反应后,通过sonogashira偶联与1-己炔反应得到二糖炔烯酸酯给体。将此二糖炔烯酸酯给体与二糖受体重复一次上述金催化糖苷化反应即可获得由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的四糖骨架。
所述石莼b3s型硫酸四糖化合物1的合成路线为:
所述石莼b3s型硫酸四糖化合物1的制备方法,包括以下步骤:
在nis和三氟甲磺酸的条件下,将由l-艾杜糖醛酸砌块和l-鼠李糖砌块组装成的四糖骨架与连接臂连接得到还原端含有连接臂的寡糖骨架。然后,在将其tbs保护基转化为乙酰基并将pmb保护基脱除后,以三氧化硫三乙胺复合物为硫酸化试剂,以吡啶为溶剂,55℃反应至完全得到硫酸化修饰的寡糖骨架;最后的脱保护基操作包含皂化反应和氢化反应,其中皂化反应以氢氧化锂、氢氧化钾和双氧水为皂化试剂,以四氢呋喃、水为混合溶剂,室温反应至完全;氢化反应以氢氧化钯/碳为催化剂,氢气氛围中,室温反应至完全得到b3s型硫酸四糖化合物1。
在本实施例中,所述b3s型硫酸四糖化合物1的制备方法具体包括以下几个步骤。
1.化合物3的制备步骤
取4.3g(15.9mmol)化合物2于圆底烧瓶中,加入43mldmf使其溶解,加入3.9ml(31.8mmol)2,2-二甲氧基丙烷和609mg(3.2mmol)对甲苯磺酸,室温搅拌反应过夜。tlc(石油醚:乙酸乙酯=1:1)显示反应完全,加入三乙胺淬灭反应,二氯甲烷萃取,饱和氯化钠溶液洗涤,合并有机相,无水硫酸钠干燥,过滤并旋干滤液,硅胶柱层析(石油醚:乙酸乙酯=6:1→3:1),得到化合物3(4.7g,97%)。1hnmr(400mhz,cdcl3)δ7.59(d,j=2.0hz,1h),7.22(dd,j=2.0,8.0hz,1h),7.14(d,j=8.0hz,1h),5.74(s,1h),4.40(d,j=5.6hz,1h),4.17–4.07(m,2h),3.50–3.45(m,1h),2.48(d,j=3.6hz,1h),2.40(s,3h),1.55(s,3h),1.39(s,3h),1.30(s,9h),1.24(d,j=6.4hz,3h);13cnmr(100mhz,cdcl3)δ149.8,136.7,132.2,130.2,129.8,125.0,109.9,83.0,78.6,77.1,75.5,67.1,34.6,31.5,28.4,26.6,20.3,17.3;hrms(esi)m/zcalcdforc20h30o4sna[m+na]+389.1762,found389.1760.
2.化合物4的制备步骤
取4.7g(12.8mmol)化合物3于圆底烧瓶中,加入40ml二氯甲烷使其溶解,加入1.7g(20.3mmol)4-二甲氨基吡啶,将体系移至0℃,缓慢加入2.1ml(20.3mmol)乙酰丙酸和3.1ml(20.3mmol)二异丙基碳二亚胺,移至室温继续搅拌反应。tlc(石油醚:乙酸乙酯=6:1)显示反应完全,加入饱和碳酸氢钠淬灭反应,二氯甲烷萃取体系,合并有机相,用无水硫酸钠干燥,过滤旋干,硅胶柱层析(石油醚:乙酸乙酯=9:1→6:1),得到4(5.9g,99%)。1hnmr(600mhz,cdcl3)δ5.57(d,j=1.8hz,1h),7.22(dd,j=1.8,7.8hz,1h),7.15(d,j=7.8hz,1h),5.74(s,1h),4.94(dd,j=7.8,9.6hz,1h),4.40(d,j=5.4hz,1h),4.26(dd,j=4.8,7.8hz,1h),4.24–4.19(m,1h),2.91–2.85(m,1h),2.73–2.66(m,2h),2.61–2.56(m,1h),2.40(s,3h),2.19(s,3h),1.57(s,3h),1.37(s,3h),1.30(s,9h),1.14(d,j=6.6hz,3h);13cnmr(150mhz,cdcl3)δ206.6,172.2,149.9,136.7,132.0,130.2,129.9,125.2,110.2,83.1,77.0,75.7,75.2,65.9,38.1,34.7,31.5,30.0,28.2,27.9,26.8,20.3,17.0;hrms(esi)m/zcalcdforc25h36o6sna[m+na]+487.2130,found487.2131.
3.化合物5的制备步骤
取5.9g(12.7mmol)化合物4溶于69ml的80%乙酸溶液中,70℃加热回流,tlc(二氯甲烷:甲醇=25:1)显示反应完全,加入饱和碳酸氢钠淬灭反应,二氯甲烷萃取体系,合并有机相,用无水硫酸钠干燥,过滤旋干,硅胶柱层析(二氯甲烷:甲醇=50:1→40:1),得到5(5.3g,98%)。1hnmr(600mhz,cdcl3)δ7.58(d,j=1.8hz,1h),7.21(dd,j=1.8,7.8hz,1h),7.13(d,j=7.8hz,1h),5.48(d,j=1.2hz,1h),4.97(t,j=9.6hz,1h),4.34–4.30(m,1h),4.27(dd,j=1.2,3.0hz,1h),4.02(dd,j=3.6,9.6hz,1h),3.47(brs,1h),2.95(brs,1h),2.89–2.80(m,2h),2.66–2.56(m,2h),2.38(s,3h),2.21(s,3h),1.30(s,9h),1.23(d,j=6.6hz,3h);13cnmr(150mhz,cdcl3)δ207.8,173.6,150.0,136.4,132.9,130.1,129.3,124.9,87.0,75.9,72.8,70.8,67.1,38.5,34.7,31.5,30.0,28.4,20.3,17.5;hrms(esi)m/zcalcdforc22h32o6sna[m+na]+447.1817,found447.1818.
4.化合物6的制备步骤
将482mg(1.14mmol)化合物5溶于22ml甲苯中,加入698μl(1.37mmol)的三丁基锡醚,110℃反应1h,降温至60℃,加入232μl(1.71mmol)对甲氧苄氯和632mg(1.71mmol)四丁基碘化铵后,升至110℃下反应过夜,tlc(石油醚:乙酸乙酯=1:1)显示反应完全,直接旋干体系,硅胶柱层析tlc(石油醚:乙酸乙酯=8:1→4:1)得到6(504mg,81%)。1hnmr(400mhz,cdcl3)δ7.57(d,j=1.6hz,1h),7.28(d,j=8.8hz,2h),7.20(dd,j=2.0,8.0hz,1h),7.13(d,j=8.0hz,1h),6.91(d,j=8.4hz,2h),5.50(d,j=1.2hz,1h),5.10(t,j=9.6hz,1h),4.62(d-like,j=11.6hz,1h),4.55(d-like,j=11.6hz,1h),4.29–4.22(m,2h),3.82–3.79(m,4h),2.77–2.73(m,2h),2.58–2.50(m,2h),2.37(s,3h),2.20(s,3h),1.29(s,9h),1.19(d,j=6.0hz,3h);13cnmr(100mhz,cdcl3)206.5,172.2,159.7,150.0,136.3,132.8,130.1,129.8,129.7,129.4,124.9,114.2,86.6,73.1,71.8,70.4,67.7,55.5,38.0,34.7,31.5,30.0,28.2,20.3,17.5;hrms(esi)m/zcalcdforc30h40o7sna[m+na]+567.2392,found567.2393.
5.化合物7的制备步骤
将1.0g(1.84mmol)化合物6溶于3.5ml的无水吡啶中,加入61mg(0.5mmol)的4-二甲氨基吡啶搅拌使其溶解,然后氩气保护并将反应体系转移至0℃下,缓慢加入627μl(5.4mmol)的苯甲酰氯,逐渐恢复至室温下反应。反应5h后,tlc(石油醚:乙酸乙酯=2:1)显示反应完全,加水淬灭反应,乙酸乙酯萃取并合并有机相,依次用1m盐酸溶液,饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤有机相,用无水硫酸钠干燥有机相,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=10:1→8:1),得到7(1.0g,84%)。1hnmr(600mhz,cdcl3)δ8.07(d,j=7.2hz,2h),7.58–7.55(m,2h),7.44(t,j=7.8hz,2h),7.25–7.22(m,3h),7.15(d,j=7.8hz,1h),6.86(d,j=8.4hz,2h),5.81(dd,j=1.2,3.0hz,1h),5.47(d,j=1.8hz,1h),5.22(t,j=9.6hz,1h),4.64(d-like,j=12.0hz,1h),4.46(d-like,j=12.0hz,1h),4.39–2.59(m,2h),2.52–2.46(m,1h),2.43(s,3h),2.19(s,3h),1.30(s,9h),1.28(d,j=6.0hz,3h);13cnmr(150mhz,cdcl3)δ206.6,172.2,165.9,159.5,150.0,137.0,133.5,132.4,130.4,130.3,130.1,129.9,129.8,129.7,128.6,125.5,113.9,86.0,74.6,73.2,71.2,71.0,68.2,55.4,38.0,34.6,31.5,30.0,28.1,20.5,17.7;hrms(esi)m/zcalcdforc37h44o8sna[m+na]+671.2655,found671.2654.
6.化合物8的制备步骤
将1.7g(2.62mmol)化合物7溶于22ml的吡啶-乙酸混合溶剂(吡啶:乙酸=3:1)中,然后氩气保护并将反应体系转移至0℃下,加入1.2g(13mmol)的乙酸肼,逐渐恢复至室温下反应。反应4h后,tlc(石油醚:乙酸乙酯=3:1)显示反应完全,加入丙酮淬灭反应,乙酸乙酯萃取并合并有机相,依次用1m盐酸溶液,饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤有机相,无水硫酸钠干燥有机相,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=6:1→4:1),得到8(1.3g,90%)。1hnmr(600mhz,cdcl3)δ8.08(dd,j=1.2,7.8hz,2h),7.60–7.57(m,2h),7.46(t,j=7.8hz,2h),7.26–7.23(m,3h),7.16(d,j=7.8hz,1h),6.85(d,j=8.4hz,2h),5.88(dd,j=1.8,3.0hz,1h),5.50(d,j=1.2hz,1h),4.76(d-like,j=10.8hz,1h),4.46(d-like,j=10.8hz,1h),4.34–4.29(m,1h),3.87(dd,j=3.0,9.6hz,1h),3.79–3.76(m,4h),2.45(s,3h),1.40(d,j=6.0hz,3h),1.32(s,9h);13cnmr(150mhz,cdcl3)δ165.9,159.7,149.9,137.1,133.5,132.6,130.5,130.2,130.1,130.0,129.9,129.6,128.6,125.4,114.2,86.2,78.0,72.3,71.2,70.7,69.6,55.4,34.6,31.5,20.5,18.0;hrms(esi)m/zcalcdforc32h38o6sna[m+na]+573.2287,found573.2288.
7.化合物10的制备步骤
将509mg(0.82mmol)化合物9与243mg(1.23mmol)的(z)-3-碘代丙烯酸溶于20ml的干燥二氯甲烷中,加入800mg的ms分子筛,氩气保护下,室温搅拌30min,加入369mg(1.64mmol)n-碘代丁二酰亚胺和10.8μl(0.12mmol)三氟甲磺酸,室温下搅拌反应。反应1h后,tlc(石油醚:乙酸乙酯=6:1)显示反应完全,加入三乙胺淬灭反应,过滤收集滤液,饱和硫代硫酸钠洗涤滤液,收集有机相,无水硫酸钠干燥,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=15:1→10:1),得到(z)-碘代丙烯酸酯(515mg,90%)。将上述515mg(0.74mmol)(z)-碘代丙烯酸酯溶于51ml的乙腈-四氢呋喃的混合溶剂(乙腈:四氢呋喃=2:1)中,加入141mg(0.74mmol)碘化亚铜和28mg(0.04mmol)三苯基膦氯化钯搅拌溶解,氩气保护下置换空气3次,依次加入205μl(1.48mmol)三乙胺和101μl(0.89mmol)1-己炔,室温下搅拌反应过夜。tlc(石油醚:乙酸乙酯=6:1)显示反应完全,饱和氯化铵溶液淬灭反应,二氯甲烷萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=15:1→10:1),得到10(410mg,85%)。1hnmr(600mhz,cdcl3)δ8.07(dd,j=1.2,8.4hz,2h),7.57–7.54(m,1h),7.41(t,j=7.8hz,2h),7.36(d,j=7.2hz,2h),7.33–7.30(m,2h),7.28–7.26(m,1h),6.56(s,1h),6.21(dt,j=2.4,11.4hz,1h),6.00(d,j=11.4hz,1h),5.17(t,j=2.4hz,1h),4.90(d,j=2.4hz,1h),4.84(d-like,j=12.0hz,1h),4.71(d-like,j=12.0hz,1h),4.12(t,j=3.0hz,1h),3.86(m,1h),3.79(s,3h),2.42(td,j=2.4,7.2hz,1h),1.57–1.52(m,2h),1.45–1.39(m,2h),0.91(t,j=7.2hz,3h),0.67(s,9h),-0.10(s,3h),-0.32(s,3h);13cnmr(100mhz,cdcl3)δ169.6,165.8,162.5,137.7,133.5,130.3,129.5,128.6,128.4,128.2,128.1,126.3,126.1,106.2,92.4(1jc1,h1=174.6hz),78.0,74.2,72.5,71.3,68.9,67.4,52.3,30.5,25.6,22.2,20.0,17.9,13.8,-4.3,-5.6;hrms(esi)m/zcalcdforc36h46o9sina[m+na]+673.2809,found673.2808.
8.化合物11的制备步骤
将405mg(0.62mmol)化合物10和225.6mg(0.41mmol)化合物8溶于15ml无水二氯甲烷中,加入650mg的ms分子筛,氩气保护下搅拌30min,加入0.82ml的三苯基膦金三氟甲磺酸盐的二氯甲烷溶液(0.05mmol/ml),加入3.6μl(0.041mmol)的三氟甲磺酸,室温下搅拌反应。tlc(甲苯:乙酸乙酯=12:1)显示反应完全,加入三乙胺淬灭反应,过滤除去ms分子筛,滤液直接旋干,硅胶柱层析(甲苯:乙酸乙酯=30:1→20:1),得到11(389.6mg,91%)。1hnmr(600mhz,cdcl3)δ8.06(m,2h),7.98(m,2h),7.59–7.57(m,2h),7.52(t,j=7.2hz,1h),7.48–7.44(m,4h),7.39(t,j=7.8hz,2h),7.35(t,j=7.8hz,2h),7.30(t,j=7.2hz,1h),7.22(dd,j=1.8,7.8hz,1h),7.16(d,j=7.8hz,1h),7.03(d,j=8.4hz,2h),6.44(d,j=8.4hz,2h),5.83(t,j=1.8hz,1h),5.70(s,1h),5.47(d,j=1.2hz,1h),5.14(s,1h),4.93(d,j=11.4hz,1h),4.90(d,j=1.8hz,1h),4.74(d,j=11.4hz,1h),4.59(d,j=10.8hz,1h),4.39–4.34(m,2h),4.10(brs,1h),4.02–3.97(m,2h),3.77(m,4h),3.46(s,3h),2.46(s,3h),1.38(d,j=6.6hz,3h),1.30(s,9h),0.62(s,9h),-0.11(s,3h),-0.36(s,3h);13cnmr(150mhz,cdcl3)δ170.2,166.0,165.8,159.1,150.0,138.2,137.0,133.4,133.3,132.8,130.4,130.3,130.2,130.1,129.8,129.6,129.3,128.6,128.5,128.3,128.2,128.0,125.3,113.8,100.5,86.1,79.1,78.0,74.3,72.1,70.8,70.7,69.2,68.9,68.5,68.1,55.0,52.2,34.6,31.5,25.6,20.6,18.5,17.9,-4.2,-5.7;hrms(esi)m/zcalcdforc59h72o13ssina[m+na]+1071.4361,found1071.4363.
9.化合物12的制备步骤
将87.6mg(0.084mmol)化合物11溶于1.2ml的干燥四氢呋喃中,0℃下加入324μl(2.52mmol)70%氟化氢吡啶溶液,恢复至室温搅拌反应,室温搅拌2d后,tlc(石油醚:乙酸乙酯=2:1)显示反应完全,饱和碳酸氢钠淬灭反应,二氯甲烷萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=4:1→2:1),得到12(73.1mg,93%)。1hnmr(600mhz,cdcl3)δ8.05(m,2h),7.92(dd,j=0.6,7.8hz,2h),7.59–7.56(m,3h),7.46(t,j=7.8hz,2h),7.43–7.39(m,6h),7.33–7.30(m,1h),7.24(dd,j=1.8,7.8hz,1h),7.17(d,j=7.8hz,1h),7.08(d,j=8.4hz,2h),6.50(d,j=9.0hz,2h),5.87(dd,j=1.8,3.0hz,1h),5.65(s,1h),5.47(d,j=1.2hz,1h),5.28(m,1h),5.00(d,j=1.2hz,1h),4.84(d-like,j=11.4hz,1h),4.70(d-like,j=11.4hz,1h),4.63(d-like,j=10.8hz,1h),4.39–4.34(m,2h),4.09(d,j=12.0hz,1h),4.03(dd,j=3.0,9.0hz,1h),3.97(t,j=9.6hz,1h),3.89(t,j=2.4hz,1h),3.79(s,3h),3.46(s,3h),2.70(d,j=12.0hz,1h),2.46(s,3h),1.37(d,j=6.0hz,3h),1.31(s,9h);13cnmr(150mhz,cdcl3)δ170.1,165.9,164.9,159.2,150.0,137.9,137.1,133.7,133.5,132.6,130.5,130.3,130.1,129.9,129.8,129.7,129.2,129.1,128.7,128.6,128.1,125.5,113.8,100.3,86.2,78.9,78.0,74.1,72.2,70.7,70.6,68.7,68.4,68.2,67.5,55.0,52.6,34.6,31.5,20.6,18.5;hrms(esi)m/zcalcdforc53h58o13sna[m+na]+957.3496,found957.3495.
10.化合物13的制备步骤
将244mg(0.23mmol)化合物11与69.3mg(0.35mmol)的(z)-3-碘代丙烯酸溶于5.5ml的干燥二氯甲烷中,加入350.0mg的ms分子筛,氩气保护下,室温搅拌30min,加入103.5mg(0.46mmol)的n-碘代丁二酰亚胺和3.0μl(0.035mmol)三氟甲磺酸,室温下搅拌反应。反应5h后,tlc(石油醚:乙酸乙酯=6:1)显示反应完全,加入三乙胺淬灭反应,过滤收集滤液,饱和硫代硫酸钠洗涤滤液,收集有机相,无水硫酸钠干燥,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=15:1→10:1),得到(z)-3-碘代丙烯酸酯(204.8mg,84%)。将上述204.8mg(0.19mmol)(z)-3-碘代丙烯酸酯溶于12.9ml的乙腈-四氢呋喃的混合溶剂(乙腈:四氢呋喃=2:1)中,加入36.1mg(0.19mmol)碘化亚铜和7.0mg(0.01mmol)三苯基膦氯化钯搅拌溶解,氩气保护下置换空气3次,依次加入53μl(0.38mmol)三乙胺和43μl(0.38mmol)1-己炔,室温下搅拌反应过夜。tlc(石油醚:乙酸乙酯=4:1)显示反应完全,饱和氯化铵溶液淬灭反应,二氯甲烷萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并旋干,硅胶柱层析(石油醚:乙酸乙酯=15:1→8:1),得到13(179.4mg,93%)。1hnmr(600mhz,cdcl3)δ8.07(m,2h),7.94(m,2h),7.59(t,j=7.8hz,1h),7.51(t,j=7.8hz,1h),7.47(t,j=7.8hz,2h),7.39(d,j=7.2hz,2h),7.35–7.32(m,4h),7.28(t,j=7.2hz,1h),6.99(d,j=8.4hz,2h),6.41(d,j=9.0hz,2h),6.30(dt,j=2.4,11.4hz,1h),6.27(d,j=1.8hz,1h),6.06(d,j=11.4hz,1h),5.72(s,1h),5.60(m,1h),5.08(s,1h),4.85(d-like,j=12.0hz,1h),4.83(d,j=2.4hz,1h),4.71(d-like,j=12.0hz,1h),4.59(d-like,j=10.8hz,1h),4.30(d-like,j=10.8hz,1h),4.06(t-like,j=1.8hz,1h),4.04(dd,j=3.0,9.0hz,1h),4.00–3.94(m,2h),3.76(s,3h),3.72(t,j=2.4hz,1h),3.47(s,3h),2.45–2.41(m,2h),1.57–1.52(m,2h),1.47–1.41(m,2h),1.37(d,j=5.4hz,3h),0.91(t,j=7.8hz,3h),0.61(s,9h),-0.15(s,3h),-0.40(s,3h);13cnmr(150mhz,cdcl3)δ170.1,165.8,165.7,162.4,159.0,138.0,133.5,133.3,130.2,129.7,129.6,129.4,128.6,128.5,128.3,128.2,128.1,126.2,126.1,113.7,106.3,100.2(1jc1,h1=175.2hz),91.5(1jc1,h1=175.2hz),78.2,77.6,74.5,72.2,70.8,69.7,69.4,68.7,67.8,55.0,52.2,30.5,25.6,22.2,20.1,18.6,17.8,13.8,-4.3,-5.8;hrms(esi)m/zcalcdforc57h68o15sina[m+na]+1043.4225,found1043.4224.
11.化合物14的制备步骤
将605.5mg(0.59mmol)化合物13和334.8mg(0.36mmol)化合物12溶于14ml干燥甲苯中,加入1.2g的ms分子筛,氩气保护下搅拌30min,加入2.2ml三苯基膦金三氟甲磺酸盐的二氯甲烷溶液(0.05mmol/ml)和25.6μl三氟甲磺酸的二氯甲烷溶液(1.40mmol/ml),室温下搅拌反应。tlc(甲苯:乙酸乙酯=12:1)显示反应完全,加入三乙胺淬灭反应,过滤除去ms分子筛,滤液直接旋干,硅胶柱层析(甲苯:乙酸乙酯=30:1→20:1),得到14(578.1mg,89%)。1hnmr(600mhz,cdcl3)δ8.05(m,2h),8.01(m,2h),7.96(m,2h),7.93(m,2h),7.58–7.55(m,4h),7.51(t,j=7.2hz,1h),7.47–7.32(m,16h),7.30–7.27(m,2h),7.23(dd,j=1.8,7.8hz,1h),7.16(d,j=7.8hz,1h),7.03(d,j=8.4hz,2h),6.88(d,j=8.4hz,2h),6.43(d,j=8.4hz,2h),6.34(d,j=8.4hz,2h),5.85(dd,j=1.8,2.4hz,1h),5.76(s,1h),5.54(s,1h),5.47(d,j=1.2hz,1h),5.33(dd,j=1.8,3.0hz,1h),5.23(s,1h),4.99(d,j=2.4hz,1h),4.89(d-like,j=12.0hz,1h),4.86(d-like,j=9.6hz,2h),4.76(t,j=12.6hz,2h),4.63–4.59(m,3h),4.39–4.31(m,3h),4.18(brs,1h),4.05–3.98(m,5h),3.87(s,3h),3.76(t,j=9.6hz,1h),3.75(s,3h),3.68(dd,j=3.6,9.6hz,1h),3.64(brs,1h),3.60–3.55(m,1h),3.45(s,3h),3.42(s,3h),2.46(s,3h),1.37(d,j=6.6hz,3h),1.30(s,9h),0.89(d,j=6.0hz,3h),0.58(s,9h),-0.18(s,3h),-0.44(s,3h);13cnmr(150mhz,cdcl3)δ170.1,169.8,166.0,165.8,165.7,165.5,159.1,158.9,150.0,137.9,137.0,133.8,133.5,133.3,133.2,132.7,130.4,130.3,130.2,130.1,129.8,129.7,129.6,129.5,129.3,129.1,128.7,128.6,128.5,128.4,128.3,128.2,128.1,128.0,125.4,113.8,113.6,100.2,99.8,86.1,78.5,78.2,78.1,76.9,75.2,74.3,73.8,72.5,72.1,70.8,70.7,69.2,68.9,68.7,68.6,68.4,68.3,67.7,67.6,55.1,55.0,52.8,52.2,34.6,31.5,31.4,25.6,20.6,18.6,18.0,17.8,-4.3,-5.8;hrms(esi)m/zcalcdforc101h114o26ssina[m+na]+1825.6986,found1825.6962.
12.化合物16的制备步骤
将578.1mg(0.32mmol)化合物14与209.4mg(0.64mmol)五碳连接臂15溶于9ml
无水二氯甲烷中,加入900mg的ms分子筛,氩气保护下搅拌30min,加入144mg(0.64mmol)n-碘代丁二酰亚胺与4.2μl(0.048mmol)三氟甲磺酸,室温下搅拌反应4h,tlc(甲苯:乙酸乙酯=12:1;石油醚:乙酸乙酯=2:1)显示反应完全,加入三乙胺淬灭反应,过滤除去ms分子筛,饱和硫代硫酸钠洗涤有机相,无水硫酸钠干燥有机相,过滤收集滤液,减压浓缩,硅胶柱层析(石油醚:乙酸乙酯=6:1→3:1),得到16(531.4mg,85%)。1hnmr(600mhz,cdcl3)δ8.05(m,2h),8.00(m,2h),7.93–7.91(m,4h),7.58–7.54(m,3h),7.52–7.50(m,1h),7.47–7.43(m,4h),7.38–7.18(m,24h),6.96(d,j=8.4hz,2h),6.87(d,j=9.0hz,2h),6.36(d,j=9.0hz,2h),6.33(d,j=9.0hz,2h),5.76(s,1h),5.54(brs,2h),5.32(dd,j=1.8,3.0hz,1h),5.19(t,j=10.2hz,3h),4.96(d,j=2.4hz,1h),4.85–4.81(m,4h),4.75(d-like,j=11.4hz,1h),4.72(d-like,j=12.0hz,1h),4.62–4.60(m,2h),4.57–4.51(m,3h),4.32(d,j=10.2hz,1h),4.28(d,j=10.2hz,1h),4.16(brs,1h),4.00–3.96(m,4h),3.91(t,j=9.6hz,1h),3.87(s,3h),3.80–3.74(m,5h),3.68–3.53(m,4h),3.43(s,3h),3.41(s,3h),3.39–3.23(m,3h),1.61–1.55(m,4h),1.34(d,j=6.6hz,3h),1.28–1.26(m,2h),0.86(d,j=6.6hz,3h),0.58(s,9h),-0.18(s,3h),-0.45(s,3h);13cnmr(150mhz,cdcl3)δ170.1,169.8,166.1,165.8,165.7,165.5,158.9,158.8,138.1,137.9,137.8,133.7,133.4,133.3,133.2,130.3,130.1,129.9,129.8,129.7,129.6,129.4,129.3,129.1,128.7,128.6,128.5,128.4,128.3,128.2,128.1,128.0,127.9,127.5,127.4,113.6,100.1,100.0,99.8,97.8,78.1,78.0,75.1,74.3,73.9,73.8,72.5,72.1,70.8,70.7,69.2,69.0,68.9,68.7,68.6,68.3,68.0,67.9,67.8,67.4,67.0,55.0,54.9,52.8,52.1,50.8,50.5,47.3,46.3,29.3,28.1,27.7,25.6,23.5,18.6,18.0,17.8,-4.3,-5.8;hrms(esi)m/zcalcdforc110h123o29nsina[m+na]+1973.7881,found1973.7882.
13.化合物17的制备步骤
将531.4mg(0.27mmol)化合物16溶于29ml的干燥四氢呋喃中,0℃下加入7.9ml70%的氟化氢吡啶溶液,恢复至室温搅拌反应,室温反应2d后,tlc(石油醚:乙酸乙酯=2:1)显示反应完全,饱和碳酸氢钠淬灭反应,乙酸乙酯萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并减压浓缩,硅胶柱层析(石油醚:乙酸乙酯=4:1→2:1),得到4位羟基裸露的醇(418mg,84%)。1hnmr(600mhz,cdcl3)δ8.05(m,2h),7.98(m,2h),7.90(m,2h),7.87(m,2h),7.60–7.54(m,4h),7.47–7.19(m,28h),6.96(d,j=8.4hz,2h),6.89(d,j=8.4hz,2h),6.37(d,j=8.4hz,2h),6.35(d,j=8.4hz,2h),5.76(s,1h),5.54(brs,1h),5.52(s,1h),5.38(dd,j=1.8,3.0hz,1h),5.20–5.17(m,3h),4.98(m,2h),4.87–4.82(m,3h),4.73(d-like,j=12.0hz,1h),4.69(d,j=1.2hz,1h),4.62(d-like,j=11.4hz,1h),4.56(d,j=10.2hz,1h),4.54–4.52(m,3h),4.35(d,j=10.2hz,1h),4.28(d,j=10.2hz,1h),4.17(brs,1h),4.00–3.95(m,4h),3.92(t,j=9.6hz,1h),3.89(s,3h),3.80(m,1h),3.77(s,3h),3.76–3.54(m,5h),3.43(s,3h),3.41(s,3h),3.36–3.23(m,3h),2.58(d,j=11.4hz,1h),1.62–1.54(m,4h),1.34(d,j=6.0hz,3h),1.29(m,2h),0.87(d,j=6.0hz,3h);13cnmr(150mhz,cdcl3)δ169.9,169.8,166.1,165.7,165.4,164.8,159.0,158.9,138.1,137.9,137.5,133.7,133.6,133.4,130.3,130.1,130.0,129.9,129.8,129.7,129.5,129.4,129.3,129.2,128.8,128.7,128.6,128.5,128.2,128.1,128.0,127.9,127.5,127.4,113.7,113.6,100.1,100.0,99.5,97.8,78.3,78.1,78.0,76.1,75.0,74.0,73.8,73.7,72.4,72.2,70.8,70.7,69.0,68.8,68.3,68.2,68.0,67.9,67.7,67.6,67.4,67.3,67.0,55.0,52.9,52.5,50.8,50.5,47.3,46.3,29.4,28.1,27.7,23.6,18.6,18.0;hrms(esi)m/zcalcdforc104h109o29nna[m+na]+1859.7017,found1859.7021.
将上述418mg(0.23mmol)4位羟基裸露的醇溶于25ml的无水二氯甲烷,加入56.2mg(0.46mmol)的dmap搅拌溶解,氩气保护下,加入217μl(2.3mmol)乙酸酐,室温下搅拌反应。室温反应5h后,tlc(石油醚:乙酸乙酯=2:1)显示反应完全,饱和碳酸氢钠淬灭反应,二氯甲烷萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并减压浓缩,硅胶柱层析(石油醚:乙酸乙酯=4:1→2:1),得到17(416.2mg,96%)。1hnmr(600mhz,cdcl3)δ8.06(m,2h),7.99–7.97(m,4h),7.90(d-like,j=7.2hz,2h),7.60–7.53(m,4h),7.47–7.18(m,28h),6.97(d,j=8.4hz,2h),6.88(d,j=8.4hz,2h),6.36–6.34(m,4h),5.76(s,1h),5.56(brs,2h),5.35(dd,j=1.8,3.0hz,1h),5.21–5.16(m,4h),4.97(d,j=1.8hz,1h),4.94(s,1h),4.86–4.82(m,3h),4.75–4.73(m,2h),4.67(d-like,j=11.4hz,1h),4.62(d-like,j=11.4hz,1h),4.57(d-like,j=10.2hz,1h),4.53–4.51(m,2h),4.33(d,j=10.2hz,1h),4.28(d,j=10.2hz,1h),4.17(brs,1h),4.00(m,1h),3.97–3.91(m,3h),3.89(s,3h),3.79(m,2h),3.76–3.73(m,4h),3.68–3.51(m,3h),3.42(s,3h),3.39(s,3h),3.35–3.23(m,3h),1.78(s,3h),1.63–1.56(m,4h),1.35(d,j=6.0hz,3h),1.29(m,2h),0.86(d,j=6.0hz,3h);13cnmr(150mhz,cdcl3)δ170.0,169.8,169.0,166.1,165.7,165.5,164.9,159.0,158.9,138.1,137.9,137.4,137.0,133.7,133.6,133.4,133.3,130.3,130.1,130.0,129.9,129.8,129.6,129.5,129.4,129.3,128.7,128.6,128.5,128.4,128.2,128.0,127.9,127.5,127.4,127.3,113.7,113.6,100.2(1jc1,h1=171.6hz),100.0(1jc1,h1=174.0hz),99.3(1jc1,h1=175.2hz),97.8(1jc1,h1=172.2hz),78.2,78.1,78.0,76.0,75.0,73.5,72.4,72.3,72.0,70.8,70.7,69.0,68.9,68.1,67.9,67.7,67.4,67.3,67.1,67.0,66.2,55.0,52.9,52.6,50.8,50.5,47.3,46.3,29.3,28.1,27.7,23.5,20.7,18.6,17.9;hrms(esi)m/zcalcdforc106h111o30nna[m+na]+1901.7122,found1901.7124.
14.化合物18的制备步骤
将197.1mg(0.11mmol)化合物17溶于6.2ml混合溶剂(二氯甲烷/ph=7.2磷酸盐缓冲液=10/1)中,0℃下加入119.2mg(0.53mmol)ddq,并搅拌反应1h。温度逐渐升至室温,在室温下继续搅拌反应,tlc(石油醚:乙酸乙酯=2:1)显示反应完全,饱和碳酸氢钠淬灭反应,二氯甲烷萃取合并有机相,无水硫酸钠干燥,过滤收集滤液并减压浓缩,硅胶柱层析(石油醚:乙酸乙酯=4:1→2:1),得到18(170.4mg,95%)。1hnmr(600mhz,cdcl3)δ8.11–8.08(m,4h),8.02–8.00(m,4h),7.60–7.56(m,3h),7.51(t,j=7.2hz,1h),7.48–7.45(m,4h),7.42(t,j=7.8hz,2h),7.36–7.17(m,22h),5.67(d,j=2.4hz,1h),5.41(s,1h),5.28–5.24(m,3h),5.19(dd,j=1.2,3.0hz,2h),5.16(s,1h),5.07(s,1h),4.97(d,j=2.4hz,1h),4.93(s,1h),4.82(d-like,j=11.4hz,2h),4.74(d-like,j=12.0hz,1h),4.71(d,j=1.8hz,1h),4.64(s,2h),4.50(d-like,j=11.4hz,2h),4.20(t-like,j=3.0hz,2h),4.07–4.04(m,1h),3.96(s,3h),3.90(t,j=3.0hz,1h),3.88–3.86(m,2h),3.80(s,3h),3.75(t,j=9.6hz,2h),3.67–3.58(m,2h),3.39–3.20(m,3h),2.99(d,j=5.4hz,1h),2.80(d-like,j=9.0hz,1h),2.00(s,3h),1.58–1.51(m,4h),1.34(d,j=6.0hz,3h),1.26(m,2h),0.93(d,j=6.0hz,3h);13cnmr(150mhz,cdcl3)δ170.0,169.8,168.8,166.5,166.0,165.8,165.4,138.1,137.3,137.0,136.9,136.7,133.8,133.7,133.5,130.2,130.1,130.0,129.8,129.7,129.4,129.3,128.7,128.6,128.5,128.4,128.3,128.2,128.0,127.5,127.4,99.9,99.3,99.0,97.4,80.1,78.6,75.1,74.9,74.8,73.8,73.2,73.0,72.8,72.7,70.5,69.9,69.2,69.1,69.0,68.1,67.9,67.8,67.5,67.4,67.3,67.0,66.8,53.0,52.7,50.7,50.4,47.3,46.3,29.3,28.1,27.7,23.5,20.8,18.2,17.4;hrms(esi)m/zcalcdforc90h95o28nna[m+na]+1660.5938,found1660.5930.
15.化合物19的制备步骤
将56mg(0.034mmol)化合物18溶于3.4ml无水吡啶中,加入370mg(2.04mmol)三氧化硫三乙胺复合物,55℃下搅拌回流。反应6h后,tlc(石油醚:乙酸乙酯=2:1;二氯甲烷:甲醇=15:1)显示反应完全,加入124ml(3.06mmol)甲醇搅拌15分钟淬灭反应,加入三乙胺调节ph至7~8,直接减压浓缩,硅胶柱1%三乙胺润柱,硅胶柱层析(二氯甲烷:甲醇=50:1→30:1,+1%et3n),浓缩产物通过dowex50wx8na+树脂柱(甲醇),得到19(60.3mg,99%)。1hnmr(600mhz,cd3od)δ8.12(m,2h),8.09(m,2h),8.05(m,2h),7.98(m,2h),7.62–7.60(m,2h),7.57(t,j=7.8hz,1h),7.53–7.44(m,7h),7.42–7.15(m,22h),5.79(s,1h),5.61(brs,2h),5.55(s,1h),5.53(t,j=3.0hz,1h),5.23(s,1h),5.18–5.14(m,2h),5.12(s,1h),5.00(d,j=2.4hz,1h),4.93(d,j=8.4hz,1h),4.89–4.82(m,4h),4.71(t,j=10.2hz,2h),4.63(d,j=1.8hz,1h),4.55(d-like,j=10.8hz,1h),4.51(s,2h),4.10(brs,1h),4.04(t,j=9.0hz,1h),4.00(t,j=3.0hz,1h),3.94(s,3h),3.90(t,j=2.4hz,1h),3.84–3.81(m,2h),3.76(s,3h),3.67–3.54(m,2h),3.44–3.24(m,3h),1.75(s,3h),1.61–1.52(m,4h),1.30(m,5h),0.61(d,j=6.0hz,3h);13cnmr(150mhz,cd3od)δ171.3,171.2,170.4,167.3,167.1,167.0,166.5,139.2,138.8,138.1,134.4,134.3,131.3,131.2,131.1,131.0,130.9,129.8,129.7,129.6,129.5,129.4,129.3,129.2,129.1,129.0,128.8,128.7,128.4,101.6,100.9,100.5,98.5,78.7,78.2,77.5,77.1,74.7,73.4,73.3,73.1,72.8,70.0,69.2,69.0,68.9,68.5,68.4,67.8,53.6,52.9,51.7,51.5,47.7,29.0,28.5,24.3,20.5,18.8,18.4;hrms(esi)m/zcalcdforc90h94no34s2[m–h]-1796.5104,found1796.5125.
16.目标四糖化合物1
将59.2mg(0.033mmol)化合物19溶于1.65ml四氢呋喃中,然后将30%双氧水(674μl,6.6mmol)和氢氧化锂水溶液(3.3ml,3.3mmol,1m)预先混合,在0℃下加入到19的四氢呋喃溶液中,恢复至室温搅拌反应。反应24h后,加入3m氢氧化钾水溶液调节ph至14,继续室温搅拌反应24h。tlc(rp-18silicagel,甲醇:水=2:1)显示反应完全,加入h+树脂调节ph至8,过滤且滤液直接减压浓缩,rp-18反相硅胶柱层析(甲醇:水=1:3→2:1),得到多醇(37.9mg,88%)。1hnmr(600mhz,d2o)δ7.45–7.18(m,20h),5.21(s,1h),5.13(brs,2h),5.09(s,1h),4.87(s,1h),4.77–4.74(m,2h),4.68–4.64(m,3h),4.56(dd,j=3.0,9.6hz,1h),4.54(d,j=1.8hz,1h),4.49–4.45(m,4h),4.29(m,1h),4.25(s,1h),4.15(s,2h),4.05(dd,j=2.4,4.2hz,1h),3.99(m,1h),3.78–3.70(m,5h),3.66(brs,1h),3.60–3.37(m,2h),3.24–3.21(m,2h),1.53–1.44(m,4h),1.30–1.20(m,5h),1.03(brs,3h);13cnmr(150mhz,d2o)δ176.0,175.3,158.1,157.7,137.6,137.5,137.2,136.3,128.7,128.6,128.5,128.2,128.1,127.9,127.8,127.5,127.3,127.1,102.4,102.2,101.0,99.3,79.2,78.9,76.9,76.8,76.3,75.9,74.5,71.7,71.5,70.1,69.2,68.9,68.7,68.1,67.7,67.5,67.3,66.7,66.5,50.5,50.4,47.6,46.8,28.3,28.1,27.1,26.9,22.8,22.6,17.1,17.0;hrms(esi)m/zcalcdforc58h72o29ns2[m–h]–1310.3631,found1310.3637.
将上述77.9mg(0.059mmol)多醇溶于14.4ml甲醇-水(体积比1/3)的混合溶剂中,加入10%氢氧化钯/碳(623mg),氢气置换5次,室温反应24h后,过滤,减压浓缩,粗产物通过dowex50wx8na+树脂柱(水),减压浓缩后经lh-20凝胶柱层析(水)纯化得到目标四糖化合物1(52.2mg,98%)。1hnmr(600mhz,cdcl3)δ5.12(d,j=4.2hz,1h),5.08(d,j=3.6hz,1h),4.87(d,j=1.2hz,1h),4.81(d,j=1.8hz,1h),4.61–4.59(m,2h),4.55(d,j=3.6hz,1h),4.51(d,j=3.6hz,1h),4.29(t,j=2.4hz,1h),4.25(t,j=3.0hz,1h),4.10–4.05(m,1h),4.00(t,j=3.6hz,1h),3.95(t-like,j=4.8hz,1h),3.88–3.83(m,3h),3.82–3.78(m,2h),3.75–3.69(m,3h),3.57–3.53(m,1h),3.02(t,j=7.2hz,2h),1.74–1.62(m,2h),1.55–1.42(m,2h),1.27(d,j=6.0hz,3h),1.26(d,j=6.0hz,3h);13cnmr(150mhz,d2o)δ175.7,174.6,103.0,102.7,101.2,99.3,79.0,78.8,76.5,76.1,71.4,71.3,71.2,70.9,70.7,70.3,69.9,68.8,68.7,67.8,67.6,67.4,39.4,28.0,26.6,22.6,16.9,16.8;hrms(esi)m/zcalcdforc29h48o27ns2[m–h]-906.1855,found906.1810.
实施例2.石莼b3s型硫酸寡糖化合物基于raw264.7细胞的免疫增强功能评价
在本发明实施例中,提供实施例1获得的石莼b3s型硫酸四糖化合物调节鼠源巨噬细胞raw264.7活性研究结果。
在一些实施例中,在所述应用中,所述石莼b3s型硫酸四糖化合物的使用浓度为0-500μg/ml。
在一些实施例中,石莼b3s型硫酸四糖化合物对鼠源巨噬细胞raw264.7的增殖能力无影响。
在一些实施例中,石莼b3s型硫酸四糖化合物能提高鼠源巨噬细胞raw264.7的吞噬能力。
在本实施例中,石莼b3s型硫酸四糖化合物基于raw264.7细胞的免疫增强测试具体包括以下几个具体步骤。
1.石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7增殖能力的影响。
本实施例中,采用mtt法检测石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7增殖能力的影响。将raw264.7细胞接种于96孔板中,使用不同浓度的石莼b3s型硫酸四糖化合物(0、18.75、37.5、75、150、300μg/ml)处理raw264.7细胞24h,并检测raw264.7细胞的存活率。实验重复三次及以上,实验数据用三次实验的平均值±sd表示。石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7的细胞增殖抑制影响的实验结果如图1所示。
结果:石莼b3s型硫酸四糖化合物处理组和对照组之间的差异显著性通过studentt检验进行分析。*p<0.05,**p<0.01,***p<0.001。
由实验结果可知石莼b3s型硫酸四糖化合物浓度为18.75、37.5、75、150μg/ml时,对raw264.7细胞增殖无影响,与空白对照组相比无统计学差异(p>0.05)。石莼b3s型硫酸四糖化合物浓度高达300μg/ml时,对巨噬细胞raw264.7无细胞毒性。
2.石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7吞噬能力的影响
本实施例中,采用中性红摄取实验检测石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7吞噬能力的影响。将raw264.7细胞接种在96孔板中,在37℃、5%co2的条件下培养24h。24h后,在96孔板中分别加入1μg/mllps和浓度分别为0、37.5、75、150、300μg/ml的石莼b3s型硫酸四糖化合物,孵育24h后,弃去培养液并加入100μl/孔的0.075%中性红并温育4min。用pbs洗涤3次后,将100μl细胞裂解液(乙醇:冰醋酸=1:1)添加到每个孔中,裂解液作用2h后在酶标仪上测定od值。每个实验重复三次及以上,结果如图2所示。
结果:石莼b3s型硫酸四糖化合物处理组和阴性对照组之间差异的显著性通过studentt检验进行可视化分析。*p<0.05,**p<0.01,***p<0.001。
由实验结果可知石莼b3s型硫酸四糖化合物浓度为37.5、75、150、300μg/ml时均可显著增强raw264.7细胞的吞噬活性(p<0.001)。
上述测试结果表明,本发明所述的石莼b3s型硫酸四糖化合物对巨噬细胞raw264.7的细胞增殖无明显影响,对巨噬细胞raw264.7吞噬活性有明显提高。本发明提出一种石莼b3s型硫酸寡糖化合物及其制备方法,并从巨噬细胞入手,对石莼b3s型硫酸聚糖在体外水平的免疫调节活性进行测试分析,可应用于免疫调节药物的开发。
本发明已由上述相关实施例加以描述,然而上述实施例仅为实施本发明的范例。必需指出的是,已公开的实施例并未限制本发明的范围。相反地,包含于权利要求书的精神及范围的修改及均等设置均包括于本发明的范围内。
