一种具有分子标签序列的磁性微球及其制备方法与流程
[0001]
本发明属于分子生物学领域,具体涉及一种具有分子标签序列的磁性微球及其制备方法。
背景技术:
[0002]
单细胞转录组测序(single-cell rna-sequencing,scrna-seq)是近几年兴起的新技术,能够从单个细胞水平获得全转录组表达谱、扩增后进行高通量测序,从而高效地检测单个细胞内的基因表达水平,在干细胞的发育与分化、肿瘤的诊断与治疗、靶向药物的设计等领域具有重要的应用价值。
[0003]
单细胞转录组测序之所以可以同时对成百数千个细胞进行测序,是因为每个细胞都贴有不同的标签,为了区别每个细胞中的每条mrna,每条mrna同样被赋予一个唯一的分子标签。目前单细胞测序的微流控平台,主要是将单个细胞与带有分子标签的单个微珠或者磁珠置于一个微孔环境,细胞裂解后,不同的细胞可携带特异的细胞标签,经反转录同一个细胞的不同mrna又被不同分子标签所标记。这种方法可追踪每个基因的细胞来源,而且可以对mrna进行定量,显著提高了测序通量、降低测序成本并且减轻扩增偏好的影响。但是目前带有分子标签的微珠或者磁珠均存在制作成本高、制备困难、制备成功率低、以及不同批次效果不稳定等诸多问题,严重影响单细胞测序结果的稳定性和精确性,同时这也是的单细胞测序费用昂贵,不能广泛应用的原因之一。
技术实现要素:
[0004]
有鉴于此,本发明的目的是提供了一种具有分子标签序列的磁性微球及其制备方法。所述的磁性微球上装配有固定的分子标签序列,其制备工艺简单、批间差异小,错误率低、成本低廉。
[0005]
为了解决上述技术问题,本发明采用的技术方案为:本发明提供了一种具有分子标签序列的磁性微球,所述的磁性微球表面依次修饰链接有三段寡核苷酸序列r1、 r2和r3;利用化学键和dna连接酶相连接的方法将三段寡核苷酸连接到磁珠上,合成为带有oligo序列的磁性微球;所述r1为tccctacacgacgctcttccgatctb~bl
1
~l
1
,r2为l
2
~l
2
b~bl
3
~l
3
,r3为l
4
~l
4
b~bcn~n【ttt】;其中b、l、n均为a、t、c、g任一碱基,“~
”ꢀ
为6-16个任意序列,【ttt】为8-38个t。
[0006]
所述的辅助序列a2为l
1
~l
1
l
2
~l
2
的互补序列,a3为l
3
~l
3
l
4
~l
4
的互补序列。
[0007]
进一步的,上述序列中的b~b为相同序列。
[0008]
本发明还提供了一种具有分子标签序列的磁性微球的合成方法,所述方法包括如下步骤:(1)分别合成三段寡核苷酸序列r1、 r2、r3和对应的辅助序列a2、a3;(2)将寡核苷酸序列r1加入到微孔板中,加入磁珠与r1相连,得到磁珠混合物a,其中微孔板上每个微孔中刚好容纳一个寡核苷酸序列r1和一个磁珠;
(3)在步骤(2)所得的磁珠混合物a中加入dna 连接酶连接得到混合体系a;将寡核苷酸序列r2加入到新的微孔板中,加入辅助序列a2,得到盛有r2的微孔板;将混合体系a加入到盛有r2的微孔板中,酶变性失活后收集得到磁珠混合物b;(4)在步骤(3)所得的磁珠混合物b中加入dna 连接酶连接得到混合体系b,将寡核苷酸序列r3加入到新的微孔板中,加入辅助序列a3,得到盛有r3的微孔板;将混合体系b加入到盛有r3的微孔板中,混合后使酶变性失活,收集磁珠,naoh重悬磁珠后静置后获得具有分子标签序列的磁性微球。
[0009]
步骤(1)中,所述的r1为tccctacacgacgctcttccgatctb~bl
1
~l
1
,r2为l
2
~l
2
b~bl
3
~l
3
,r3为l
4
~l
4
b~bcn~n【ttt】;其中b、l、n均为a、t、c、g任一碱基,“~”为6-16个任意序列,【ttt】为8-38个t。
[0010]
步骤(1)中,所述辅助序列a2为l
1
~l
1
l
2
~l
2
的互补序列。
[0011]
步骤(1)中,所述a3为l
3
~l
3
l
4
~l
4
的互补序列。
[0012]
与现有技术相比,本发明的有益效果是:本发明以磁珠为分子标签基底,利用化学键和酶连接的方法将三段寡核苷酸(oligo)按顺序连接到磁珠上,合成为带有独特oligo序列的磁性微球。本发明制备的磁性微球稳定性和精确性均较高。同时,本发明制备工艺简单、耗时短,全程12个小时可以完成;所需仪器均是常见的生化与分子实验的仪器、且原料来源方便,成本低,使单细胞测序费用大幅降低。相较于现有的dropseq微珠标签,更方便于后期生物信息学分析纠错。本发明所用oligo均是已知序列,三段oligo可以组合形成百万种分子标签,批次差异较小,明显提高单细胞测序结果的稳定性和精确性,且分子标签种类数量可达百万,可实现高通量的单细胞转录组测序,可以广泛的应用于医学、生物等研究。
附图说明
[0013]
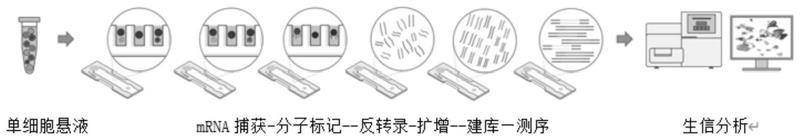
图1是单细胞mrna测序流程图;图2是单细胞cdna产物获得率对比图;图3是单细胞文库产物获得率对比图。
具体实施方式
[0014]
本发明公开了一种具有分子标签序列的磁性微球及其制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。以下实施案例中的方法、设备、材料,如果未进行特别说明,均为本领域常规方法、设备和材料,均可由市场购得。
[0015]
试剂:10
×
annealing buffer(退火缓冲液)的配比为500mm tris盐酸缓冲液、100mm 氯化镁溶液和余量的无核酸酶水。
[0016]
mes(2-(n-吗啡啉)乙磺酸)、edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)、tween 20(吐温20)均购买于sigma公司,t4 ligase(t4连接酶)、10
×
ligation buffer均购
买于qiagen公司,pbs(磷酸盐缓冲液)、te(te缓冲液)均购买于生工生物工程(上海)股份有限公司,dnase/rnase-free water(无核酸酶水)购买于赛默飞。海量单细胞mrna测序前处理试剂盒来自于新格元生物科技有限公司,磁珠(货号mp26ca-3)来自于苏州为度生物技术有限公司。
[0017]
仪器:四维旋转混合仪be-1100购买于其林贝尔仪器制造有限公司,singleron matrix自动化单细胞测序文库构建系统来自于新格元生物科技有限公司。
[0018]
需要说明的是:本发明制备磁性微球所需的三段寡核苷酸的序列和辅助序列如下所示:第一段oligo(r1):tccctacacgacgctcttccgatctb~bl
1
~l
1
,其中b,l为a、t、c、g任一碱基,“~
”ꢀ
为6-16个任意序列。
[0019]
第二段oligo(r2):l2~l2b~bl3~l3,其中b,l为a、t、c、g任一碱基,“~”为6-16个任意序列。
[0020]
第三段oligo(r3):l4~l4b~bcn~n【ttt】,其中b,l,n均为a、t、c、g任一碱基,且“~”为6-16个任意序列,【ttt】为8-38个t。
[0021]
辅助第二段酶连接(a2):l
1
~l
1
l
2
~l
2
的互补序列;辅助第三段酶连接(a3):l
3
~l
3
l
4
~l
4
的互补序列。
[0022]
上述序列中r1、r2、r3三段中的b~b是相同序列,所有oligo均购买于生工生物工程(上海)股份有限公司。需要说明的是,通过上述说明已阐述了所有寡核苷酸序列的设计规律,因三段oligo序列均有成百上千种,在本发明的具体实施方案中,各选取96种举例说明。
[0023]
实施例1:磁性微球的制备(1)oligo溶解第一段oligo溶解:取96条r1置于离心机中,12000rpm离心2min使r1沉降到底部,加入适量的0.1m mes缓冲液溶解至终浓度为50μm;室温静置10min,将上述溶解的r1漩涡震荡20s,掌上离心机顺时针离心使r1沉降在底部,r1置于4℃保存备用,如使用频率不高,可置于-20℃保存备用。
[0024]
其它oligo(r2、r3)溶解:将 r2或r3置于离心机中,12000rpm离心2min使其沉降到底部,加入适量1
×
te缓冲液溶解至终浓度为50 μm。室温静置10min后漩涡震荡20s,掌上离心机顺甩使其沉降在底部后置于4℃保存备用,如使用频率不高,可置于-20℃保存。
[0025]
(2)第一步连接反应将溶解后的第一段oligo分装在96空孔板中,每孔2.5 μl,每孔对应一种r1;离心机顺时针离心10s使得r1聚集在96孔板底部,备用;取磁珠100万颗用pbst(pbs+0.1%tween 20)缓冲液清洗2遍,0.1m的mes缓冲液清洗3遍后加入0.1m的mes缓冲液至终体积为450 μl,加入300μl 100mg/ml 的edc后快速分装在上述装有第一段oligo的96孔板中;贴上封口膜密封,离心机中顺时针离心10s,将96孔板固定在四维旋转混合仪上25℃混匀反应2h;结束后,将96孔板从四维旋转混合仪上取下,收集磁珠于1.5ml的离心管中。加入1ml的1
×
te轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,重复一次;取下磁珠加入1ml的1
×
ligation buffer(由10
×
ligation buffer稀释),轻柔吹吸混匀磁珠,再将磁珠置于磁力架上,静置20s,弃上清;加入350μl的dnase/rnase-free water得到磁珠混合物a,备用,以备第二段连接。
[0026]
(3)第二步连接反应将96条第二段oligo分装在新的96孔板底部,每种加入2μl,每孔对应一种r2;每孔中再加入3μl的a2混合物(50μm a2 200 μl,10
×
annealing buffer 100 μl);放在pcr仪中进行反应,结束后置于冰上待用;反应程序为105℃热盖,95℃5min,0.1℃/s降至20℃,20℃∞,反应结束后将盛有第二段oligo反应物的96孔板置于冰上,待用。
[0027]
向步骤(2)中得到的磁珠混合物a中加入10
×
t4 dna ligase buffer 100μl和t4 dna ligase 50μl,终体积为500 μl的混合体系a;用12道移液器将其分装在上述盛有第二段oligo反应物的96孔板中,每个孔中加入5μl,将96孔板置于四维旋转混合仪上25℃反应1h。反应结束后置于pcr仪上65℃处理10min使酶变性失活,收集磁珠于1.5ml的离心管中加入1ml的te-tween(1
×
te+0.01%tween 20)轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,重复1次。将磁珠从磁力架上取下,加入1ml的1
×
te 缓冲液,轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,重复1次。将磁珠将从磁力架上取下,加入1ml的1
×
ligation buffer(由10
×
ligation buffer稀释),轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,加入350μl的dnase/rnase-free water得到磁珠混合物b,以备第三段连接。
[0028]
(4)第三步连接反应将96条第三段oligo分装在新的96孔板底部,每种加入2μl,每孔对应一种oligo;每孔中再加入3μl的a3混合物(50μm a3 200 μl,10
×
annealing buffer 100 μl);放在pcr仪中进行反应,结束后置于冰上待用;反应程序为105℃热盖,95℃5min,0.1℃/s降至20℃,20℃∞,反应结束后将盛有反应物的96孔板置于冰上待用。
[0029]
向步骤(3)中得到的磁珠混合物b中加入10
×
t4 dna ligase buffer 100μl和t4 dna ligase 50μl,得到终体积为500 μl的混合体系b;用12道移液器将配置好的混合体系b分装在上述盛有第三段oligo反应物的96孔板中,每个孔中加入5μl,将96孔板置于四维旋转混合仪上25℃反应1h。反应结束后置于pcr仪上65℃处理10min使酶变性失活,收集磁珠于1.5ml的离心管中加入1ml的te-tween轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,重复1次。将磁珠从磁力架上取下,加入1ml的1
×
te缓冲液,轻柔吹吸混匀磁珠,将磁珠置于磁力架上,静置20s,弃上清,重复1次。
[0030]
将磁珠从磁力架上取下后加入400μl 100mm naoh重悬磁珠,室温静置1分钟,将磁珠置于磁力架上,静置20s,弃上清,重复一次。将磁珠从磁力架上取下,加入 pbst,轻柔吹吸混匀,置于磁力架上。弃上清;重复两次后加入1ml的pbst,获得具有分子标签序列的磁性微球a。
[0031]
为了验证不同批次的磁性微球的稳定性能,本实施例采用上述相同制备方法,同等条件下制备了不同批次的磁性微球b。
[0032]
实施例2:本发明制备的磁性微球的性能分析在本实施例中分为三组进行单细胞mrna测序来验证所制备的磁性微球的有益性能,具体单细胞mrna测序程序参照附图1所示。其中d1组采用市场上常用的dropseq微珠,c1、c2组分别为实施例1所制备的磁性微球a、磁性微球b。本实施例采用同一批次单细胞测序试剂盒进行测试,整个测试中除了微球不同,其他条件均保持一致。具体步骤如下:(1)准备细胞、海量单细胞mrna测序前处理试剂盒;
(2)配合singleron matrix自动化单细胞测序文库构建系统,获得单细胞测序文库;(3)测序和生物信息学分析。
[0033]
分别对获得的单细胞cdna产物获得率进行分析,图2是单细胞cdna产物获得率对比图;由图2可见,d1组中cdna产物浓度为6.3ng/μl,而c1组及c2组中获得的cdna产物浓度分别为15.8ng/μl、19.2ng/μl。可见,本发明制备的磁性微球进行单细胞mrna测序获得的cdna产物浓度均比dropseq微珠高;且从产物峰图来看,磁性微球的目的片段主要是600bp以上,磁性微球小片段数量明显比dropseq微珠少。同时,c1组和c2组两个批次间差异不明显。
[0034]
图3是单细胞文库产物获得率对比图,由图3可见,d1组dropseq微珠获得的单细胞文库产物浓度为15.1ng/μl。本发明制备磁性微球c1组获得的单细胞文库产物浓度为22.4ng/μl。c2组获得的单细胞文库产物浓度为27.2ng/μl。可见,本发明制备磁性微球应用于单细胞mrna测序后获得的单细胞文库产物浓度均比dropseq微珠高,可以很好的增加单细胞文库产物浓度。而且不同批次之间的差异不明显。
[0035]
经过对不同实验组的测序和生物信息学进行分析,结果发现d1组的有效数据量(valid reads)为81%,c1组、c2组分别为82.27%、83.92%,本发明制备磁性微球的valid reads数值略高,c1和c2两个批次间差异不明显。
[0036]
通过比较参考序列上唯一比对位置的数据比例(uniquely mapping)后发现,d1组的uniquely mapping 为78.05%,c1组为80.66%,c2组为82.37%;本发明制备磁性微球在uniquely mapping上磁性微球数值略高,且c1和c2两个批次间差异不明显。
[0037]
通过比较定位到基因上数据比例(assigned)后发现,d1组为82.64%,c1组为85.38%,c2组为87.71%;可见,本发明制备的磁性微球在assigned上磁性微球数值略高,且c1和c2两个批次间差异不明显。比较各组的细胞数(cell number),d1为2375个,c1组为3268个,c2组为3505个,可见,本发明制备的磁性微球在cell number上磁性微球数值明显高于dropseq微珠,且c1和c2两个批次间差异不明显。
[0038]
综上,可以验证本发明所制备的磁性微球性能稳定,应用于单细胞转录组测序可捕获的细胞精确度上优于现有的dropseq微珠,获得到的细胞数较多;同时不同批次间差异较小。所提供的磁性微球在性能上具有显著的优势。以上所述仅为本发明的实施方式,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1