氟硼二吡咯类蛋白质错误折叠探针Halo-BODIPY及其制备方法与应用与流程
氟硼二吡咯类蛋白质错误折叠探针halo-bodipy及其制备方法与应用
技术领域
[0001]
本发明属于荧光探针技术领域,具体涉及一种氟硼二吡咯类蛋白质错误折叠探针halo-bodipy及其制备方法与应用。
背景技术:
[0002]
氟硼二吡咯(bodipy)是荧光染料中用途最广、最受欢迎的一类,具有荧光量子产率高、摩尔吸收系数大、荧光谱峰窄,灵敏度高、光稳定性好等优异性能。bodipy在荧光成像、及传感、光动力治疗、及光学器件等领域的应用越来越受到人们的关注。典型的bodipy染料一般在470-530nm区域发出荧光。长波长染料对于基础研究和应用研究,如生物应用和光电子材料,都具有极高的重要性。
[0003]
蛋白质是生物体的组成部分之一,在物质代谢、机体防御、血液凝固、肌肉收缩、细胞信息传递、个体生长发育、组织修复等方面均有不可替代的重复作用。具有完整以及结构的蛋白质,只有当其折叠形成正确的三维空间结构才可能具有正常的生物功能。一旦蛋白质形成了错误的空间结构,将丧失其生物学功能,还会引发相关疾病,帕金森症,亨廷舞蹈病,朊蛋白病,家族性肌萎缩侧索硬化症等均与蛋白质聚集和错误折叠有关。细胞内微环境粘度的改变可能会诱发各种疾病或导致生理功能紊乱,例如细胞质内液体的粘度关系着心肌细胞和肺巨噬细胞的活性。近年来在细胞水平上检测微环境内液体的粘度称为一个研究热点,这对人们认知很多疾病具有重大意义。所以,设计能够检测蛋白质错误折叠和检测粘度变化的探针具有重要意义。
技术实现要素:
[0004]
发明目的:针对现有技术存在的问题,本发明提供了一种氟硼二吡咯类蛋白质错误折叠探针halo-bodipy,其是一种基于氟硼二吡咯母核的小分子荧光探针halo-bodipy,该探针不仅可以对错误折叠及聚集的蛋白质进行检测,还可以检测细胞内环境的粘度变化,具有极大的生物利用价值,有效解决了细胞内可溶及不可溶的错误折叠蛋白难以检测的难题。
[0005]
本发明还提供了氟硼二吡咯类蛋白质错误折叠探针halo-bodipy的制备方法和应用。
[0006]
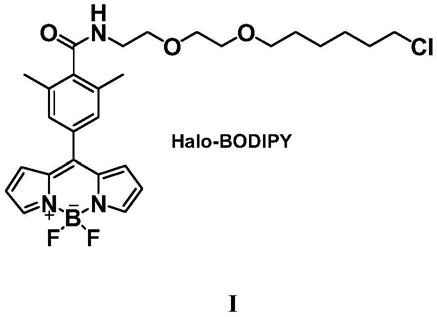
技术方案:为实现上述发明目的,本发明所述一种氟硼二吡咯类蛋白质错误折叠探针halo-bodipy,所述荧光探针halo-bodipy含有错误折叠及聚集蛋白质识别基团halo-linker,其结构式如下式-所示:
[0007][0008]
其中,linker是由氯代烷和peg两部分拼接而成,氯代烷是可以与蛋白相连接,使得探针分子可以选择性地与蛋白发生作用;peg可以提高整个分子的水溶性,以便于探针进入细胞内,检测胞内蛋白。
[0009]
所述基团halo-linker其结构式为:
[0010][0011]
本发明所述的基于氟硼二吡咯母核的小分子荧光探针halo-bodipy的制备方法,包括如下步骤:
[0012]
将羧酸基取代的bodipy,halo-linker加入dmf中,加入hobt
·
h
2
o,三乙胺,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,反应混合物搅拌过夜,反应结束淬灭,萃取,收集有机部分,干燥,然后真空干燥除去溶剂,纯化产物,得到荧光探针halo-bodipy。
[0013]
其反应路线如下所示:
[0014][0015]
所述反应结束用水淬灭,用dcm萃取,收集有机部分,用无水na
2
so
4
进行干燥,然后真空干燥除去溶剂,用薄层色谱法进一步纯化化合物,得到荧光探针halo-bodipy。
[0016]
其中,所述羧酸基取代的bodipy的制备过程为:将thf和化合物1(4-溴-2,6-二甲基苯甲酸冷却),缓慢滴加正丁基锂,混合搅拌然后再冷却,再添加dmf混合加热搅拌,反应结束后淬灭,旋蒸除去thf,萃取,调节水层ph析出产物,经过过滤和干燥得到白色固体,即化合物2直接将化合物2用bodipy法合成红色固体化合物3即为羧酸基取代的bodipy。
[0017]
化合物3的通过bodipy法制备,按文献方法制备(yuan zhang,rong-fang ma,hai-juan lv,hong-mei fang,chen-yu xue,gui-jun zhang,xue-ying wang,guo-wen xing,3-aminobodipy dyes:unexpected synthesis from 2-borate derivatives and application as fluorescent probe for alkaline ph range,tetrahedron letters,2016,57,4624-4628)
[0018]
其反应路线如下所示:
[0019][0020]
其中,所述halo-linker的制备过程为:
[0021]
化合物5的合成:在吡啶中加入化合物4,6-氯-1-己醇,对甲苯磺酰氯,4-二甲基氨基吡啶,混合搅拌,萃取,收集有机相,减压蒸发,得到粗产物无色晶体化合物5;
[0022]
用碳酸正丁酯基对氨基醇进行保护,进行化合物7的合成:室温下,2-(2-氨基乙氧基)乙醇,二叔丁基二碳酸在甲醇中搅拌3小时。用二氯甲烷和pbs对混合物进行萃取,收集有机相并进行真空干燥,产物通过硅胶层析柱纯化(乙酸乙酯:正己烷=1:1),最后得到无色油状物化合物7;
[0023]
化合物8的合成:在dmf中加入化合物5,化合物7和叔丁醇钾,搅拌过夜,淬灭反应,萃取,对产物进行进一步纯化,得到了无色油化合物8;
[0024]
化合物9的合成:将化合物8和hcl混合搅拌,反应结束后,抽滤并真空干燥,得到白色固体;化合物9即为halo-linker。
[0025]
其反应路线如下所示:
[0026][0027]
本发明所述的氟硼二吡咯类蛋白质错误折叠探针halo-bodipy在检测细胞内微环境粘度变化中的应用,所述的基于氟硼二吡咯母核的小分子荧光探针halo-bodipy的荧光响应与细胞内微环境粘度呈正相关,可以对粘度进行检测。
[0028]
本发明所述的氟硼二吡咯类蛋白质错误折叠探针halo-bodipy在检测蛋白错误折叠和聚集中的应用。
[0029]
所述的氟硼二吡咯类蛋白质错误折叠探针halo-bodipy在体外检神经退行性蛋白sod1-v31a-halo蛋白质的错误折叠及聚集中的应用。
[0030]
所述的氟硼二吡咯类蛋白质错误折叠探针halo-bodipy在细胞内检测可溶性和不可溶性sod-g93a-halo蛋白质中的应用。
[0031]
本发明基于氟硼二吡咯(bodipy)的荧光发光母核设计合成了能够对神经退行性蛋白质错误折叠和聚集识别的荧光探针。由于bodipy荧光团丰富的功能化修饰,通过结构修饰,它们的吸收和发射可红移至红色/近红外(nir)区域。此外,在bodipy的8位引入halo-linker,不仅可以对错误折叠及聚集的蛋白质进行检测,还可以检测细胞内环境的粘度变化,具有极大的生物利用价值。
[0032]
本发明的小分子荧光探针是利用halo linker和氟硼二吡咯,通过有机合成反应制备得到。探针小分子halo-bodipy是荧光打开型探针,在合成的过程中引入了halo-linker基团,能够实现对错误折叠和聚集的蛋白质的有效识别。由于探针halo-bodipy是基于氟硼二吡咯的发光母核设计而成,因此具有较低的细胞毒性,较好的生物相容性,稳定的荧光性质;摩尔吸收系数较大,抗背景干扰能力强,荧光量子产率高,可作为优异的探针设计平台,在活细胞成像、生物成像、荧光标记、生物传感器、荧光传感器、药物研发等领域有着极为重要的应用。
[0033]
有益效果:与现有技术相比,本发明具有如下优点:
[0034]
本发明的新探针包含halo-linker基团和氟硼二吡咯基团,具有较低的细胞毒性,较好的生物相容性,具有荧光量子产率高、摩尔吸收系数大、荧光谱峰窄,灵敏度高、光稳定性好等优异性能;在bodipy的8位引入halo-linker,使得探针具有对错误折叠和聚集蛋白的识别能力,对细胞内微环境的粘度变化敏感,具有极大的生物利用价值。在活细胞成像、荧光传感器、生物荧光分析、荧光标记、药物高通量筛选等领域具有极为重要的应用。本发明的氟硼二吡咯类蛋白质错误折叠探针halo-bodipy制备方法,制备工艺简单、原料易得、成本低,易于规模化生产。
附图说明
[0035]
图1为氟硼二吡咯类蛋白质错误折叠探针halo-bodipy的合成路线;
[0036]
图2为探针halo-bodipy(5μm)在不同meoh/glycerol梯度溶液中探针的荧光响应;
[0037]
图3为温度诱导体外纯化的sod1-v31a-halo蛋白和与探针halo-bodipy偶联的halo-tag蛋白实验;
[0038]
图4为探针halo-bodipy检测hela细胞内sod-g93a-halo蛋白质的可溶性和不可溶性实验。
具体实施方式
[0039]
下面结合附图和实施例对本发明作进一步说明。
[0040]
本发明中使用的实验方法如无特殊说明,均为常规方法。实验所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0041]
实施例1
[0042]
探针分子halo-bodipy的制备
[0043]
其具体制备合成路线如图1所示:
[0044]
中间体化合物3的合成
[0045]
在-70℃下,加入10ml thf和1g 4-溴-2,6-二甲基苯甲酸,待温度冷却至-80℃,缓慢滴加3.52ml正丁基锂,混合搅拌15min,然后再冷却到-80℃,再添加817.6μl dmf,混合搅
拌30min,温度上升至-20℃。反应结束后,加入2.5ml水淬灭反应,旋蒸除去thf。分别用2.5ml乙醚萃取两次,调节水层ph值至4-5,析出产物。经过过滤和干燥得到白色固体,即化合物2。考虑到化合物2的稳定性,直接将其用于下一步反应。用bodipy法合成红色固体化合物3。
[0046]
中间体化合物5的合成
[0047]
0℃下,在7ml吡啶中加入1当量的6-氯-1-己醇,1.1当量的对甲苯磺酰氯,0.1当量的4-二甲基氨基吡啶,混合搅拌1.5h。用乙醚萃取,收集有机相,减压蒸发,得到粗产物无色晶体化合物5。
[0048]
中间体化合物7的合成
[0049]
用碳酸丁酯对氨基进行保护,室温下在甲醇中加入1当量的2-(2-氨基乙氧基)乙醇和1当量的二叔丁基碳酸二酯,混合搅拌3h。用pbs溶液(ph7.4)和dcm对溶液进行萃取,收集有机相,并且进行真空干燥。用薄层色谱(乙酸乙酯:己烷=1:1)进一步纯化化合物,得到无色油化合物7。
[0050]
中间体化合物8的合成
[0051]
室温条件下在10ml dmf中加入1当量的化合物5,1当量的化合物7和1.5当量的叔丁醇钾(1m in thf),搅拌过夜。用水淬灭反应,用乙醚萃取。用薄层色谱法(乙酸乙酯:己烷=1:2)对产物进行进一步纯化,最后真空干燥得到了无色油化合物8。
[0052]
中间体化合物9的合成
[0053]
在室温下加入1当量的化合物8,6当量的hcl(4m in dioxane),混合搅拌1h。反应结束后,抽滤并真空干燥,得到白色固体,即化合物9。
[0054]
目标化合物探针halo-bodipy的合成
[0055]
在10ml dmf中,加入1当量的化合物3,1.2当量的化合物9,1.2当量的hobt
·
h
2
o,4当量的三乙胺和1.5当量的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐。混合搅拌过夜,然后用水淬灭,用dcm萃取,收集有机部分,用无水na
2
so
4
干燥,减压蒸发除去溶剂。产物用薄层色谱法(乙酸乙酯:己烷=1:2)进一步纯化化合物,得到探针halo-bodipy。
[0056]
化合物9的分析与表征:
[0057]
核磁共振氢谱
1
h nmr(500mhz,dmso)δ8.26(s,3h),3.65
–
3.58(m,4h),3.56
–
3.52(m,2h),3.51
–
3.46(m,2h),3.36(t,j=6.6hz,2h),2.94
–
2.87(m,2h),1.73
–
1.65(m,2h),1.51
–
1.44(m,2h),1.41
–
1.33(m,2h),1.33
–
1.25(m,2h)。
[0058]
核磁共振碳谱
13
c nmr(126mhz,dmso)δ70.23,69.70,69.34,66.58,45.39,38.37,32.03,29.06,26.13,24.93。
[0059]
高分辨质谱hrms:calculated:[m+h]
+
=260.1417,found:260.1411。
[0060]
探针halo-bodipy的分析与表征:
[0061]
核磁共振氢谱
1
h nmr(500mhz,cdcl
3
)δ7.94(s,2h),7.23(s,2h),6.92(d,j=4.1hz,2h),6.55(dd,j=4.1,1.6hz,2h),6.43(s,1h),3.73(s,4h),3.69
–
3.65(m,2h),3.60
–
3.56(m,2h),3.49(t,j=6.6hz,2h),3.42(t,j=6.7hz,2h),2.42(s,6h),1.76
–
1.70(m,2h),1.55
–
1.48(m,2h),1.45
–
1.37(m,2h),1.35
–
1.29(m,2h)。
[0062]
核磁共振碳谱
13
c nmr(126mhz,cdcl
3
)δ169.73,146.67,144.31,139.53,134.88,134.25,131.44,129.53,118.60,71.27,70.33,70.06,69.67,44.99,39.48,32.46,29.31,
26.62,25.36,19.22,0.01。
[0063]
高分辨质谱hrms:calculated:[m+h]
+
=545.2506,found:545.2512。
[0064]
其具体合成路线如图1所示。
[0065]
实施例2
[0066]
探针在不同meoh/glycerol梯度溶液中的相对荧光强度
[0067]
测定了探针halo-bodipy在不同粘度的meoh/glycerol溶液中的荧光响应。以0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%等不同体积分数的甘油梯度制备甲醇和甘油混合物。将探针halo-bodipy溶于各甘油梯度混合溶液中,探针halo-bodipy的浓度保持在5μm,在tecan infinite m1000pro荧光微平板阅读器上记录荧光。以纯dioxane作为溶剂效应的对照,以证明探针的荧光强度与溶剂极性无关。使用荧光探针在纯甘油中的荧光强度,进行归一化计算。所有荧光强度除以纯甘油的荧光强度。结果如图2所示,从数据特征可以明显看出来,随着丙三醇的含量增大,溶液粘度增大,探针分子的相对荧光强度也逐渐增大,这表明探针分子halo-bodipy对溶液粘度具有检测功能。
[0068]
实施例3
[0069]
温度诱导体外纯化的sod1-v31a-halo蛋白和与探针halo-bodipy偶联的halo-tag蛋白实验
[0070]
本实施例利用25~59℃的温度梯度(25、37、38.9、41.8、45.6、50.7、54.5、57.2、59℃)诱导蛋白错误折叠和聚集。每个样品溶液都含有42μm蛋白质、50mm tris,100mm nacl,ph=8,最后加入5μm探针(dmso)。edta浓度为83mm,用于金属离子在sod1蛋白中的螯合。每个样品在不同温度下孵育10分钟。在dioxane中加入5μm的探针,其荧光强度作为对照。用激发波长506nm记录荧光强度。所有的荧光强度均由25℃下halo-tag-(halo-bodipy)的荧光强度归一化。用紫外透照仪观察蛋白质偶联物的荧光。结果如图3所示,这些数据表明,随着温度增加,蛋白质聚集程度增加,sod1(v31a)-halo-(halo-bodipy)的荧光增强。上述实验结果表明探针halo-bodipy可以作为良好的蛋白质聚集探针)。
[0071]
实施例4
[0072]
探针halo-bodipy检测hela细胞内sod-g93a-halo蛋白质的可溶性和不可溶性实验
[0073]
本实施例对探针halo-bodipy进行了细胞成像实验检测蛋白聚集,实验中使用的细胞为hek293t细胞。将10μm探针与细胞核染料hoechst在细胞内共同孵育,将hek293t细胞置于含有胎牛血清10%(v/v)、青霉素(100μg/ml)和链霉素(100μg/ml)的dmem中,然后置于37℃,5%的co
2
的培养箱中孵育。成像实验前将细胞分散到直径35mm共聚焦培养皿中,每个培养皿细胞密度保持在3
×
10
5
个左右,然后在dmem培养基中孵卵24h。将实验组加入诱导剂10μl mg132,诱导细胞内蛋白质发生聚集,然后实验组和对照组(不加诱导剂)分别用10μm探针halo-bodipy在fbs-free dmem溶液中37℃孵育30min。成像之前用pbs缓冲溶液(ph7.4)冲洗3次,然后用共聚焦激光扫描显微镜获得细胞成像图。实验结果如图4所示,与用hoechst染料处理过的细胞相比,hoechst处理过的细胞是显现弥散性荧光,实验组细胞成像图中只有明显的荧光点表明探针,表明探针与聚集的蛋白质结合,并且荧光打开,这表明探针halo-bodipy可以有效地检测hela细胞内可溶及不可溶性蛋白质sod-g93a-halo。
[0074]
综上,本发明的实例化合物探针halo-bodipy荧光性质优良,能够检测蛋白质错误
折叠,能够检测细胞内微环境粘度变化,在荧光传感器、生物荧光分析、荧光标记等领域具有极为重要的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1